Introducción
Las interacciones entre especies determinan el flujo de energía en un ecosistema, este flujo se ve afectado por especies invasoras. Dentro de un ecosistema las especies naturalmente raras pueden verse amenazadas por la presencia de especies invasoras que influyen negativamente en el mantenimiento o crecimiento de la población nativa. Además, la introducción de especies exóticas se considera un factor importante en la reducción de la biodiversidad mundial (Hoagland y Din 2006). Documentamos la interacción del bivalvo invasor Geukensia demissa (Dillwyn 1817, mejillón rayado) con el rálido Rallus obsoletus levipes (Bangs 1899, rascón picudo), una especie considerada rara. Estimamos prioritario evaluar si G. demissa contribuye a la disminución de la biodiversidad del Estero Punta Banda, Ensenada, Baja California (EPB), y nos concentramos en el caso de R. o. levipes. Encontramos muertos dos polluelos de R. o. levipes en las valvas de G. demissa durante las mareas altas en el EPB, lo cual nos llevó a investigar las posibles causas de la interacción entre las dos especies. Esta interacción quizá esté limitando la población de R. o. levipes en el estero.
El Estero de Punta Banda (EPB) es un sitio prioritario para la conservación; fue designado el sitio Ramsar No. 1604 en 2006 (Martínez Del Río 2005). Este ecosistema se identifica como un eslabón importante en la ruta migratoria del Pacífico, en particular para especies de aves que lo habitan en forma permanente o durante su migración y residencia invernal (Palacios-Castro et al. 1991, Jiménez et al. 2009). Algunas de las especies de aves que residen en el EPB están bajo algún tipo de protección especial en México y en Estados Unidos de América (Massey y Palacios 1994). Una de estas aves protegidas es una subespecie del rascón picudo del Pacífico (en inglés, Ridgway’s rail) Rallus obsoletus levipes. Para la determinación taxonómica y clasificación de Rallus obsoletus levipes (Bangs 1899) seguimos la nomenclatura y taxonomía de la subespecie de acuerdo con la Unión Ornitológica Americana (Chesser et al. 2018) y el nombre común acorde a Berlanga et al. (2017). R. o. levipes es de cuerpo compacto, de cola y alas cortas y redondeadas, color café-grisáceo acanelado, con barras blancas verticales hacia los flancos bajos del cuerpo y tiene una longitud promedio total de 38 a 48 cm. En esta ave no se aprecian variaciones entre sexos (González-Guzmán 2007). Es endémica y residente permanente de las zonas de marismas del sur de California y del norte de Baja California (Howell et al. 2001), en donde realiza la totalidad de su ciclo biológico. La especie y sus subespecies han sido enlistadas como en peligro de extinción y protegidas por la NOM-059-SEMARNAT-2010 (Semarnat 2010) y por el Acta de especies en peligro de Estados Unidos de América (USFWS 1973). Se desconocen muchas características de su biología como es la dinámica y tendencia de la población, éxito reproductivo, dispersión o amenazas (Eddleman y Conway 2018).
Rallus obsoletus levipes es de hábitos crepusculares y críptica (González-Guzmán 2007), altamente dependiente de la presencia y cobertura vegetal que le ofrecen el biotopo caracterizado por Spartina foliosa-Salicornia spp., descrito por Delgadillo et al. (1992). R. o. levipes es precocial (nidífuga), con variabilidad genética baja, propiciada principalmente por la fragmentación histórica de los humedales costeros donde habita, lo que ha dado lugar a un aislamiento entre sus poblaciones (Nusser et al. 1996, Powell 2006).
Eddleman et al. (1988) estimaron una población de 64 parejas en el EPB. Posteriormente González-Guzmán (2007) estimó, para el año 2003, una población de 63 parejas y 380 individuos de R. o. levipes. En este sitio, la población de R. o. levipes enfrenta problemas de conservación comunes a la especie en toda su distribución. Tiene depredadores aéreos importantes: Buteo regalis, Falco peregrinus y Falco mexicanus, éstos influyen en los esfuerzos de conservación (De Groot 1927). Además, enfrenta retos locales como la pérdida del hábitat por el uso residencial y la invasión de especies exóticas (Eddleman et al. 1988).
El mejillón rayado, Geukensia demissa, es nativo del Atlántico norte, su distribución natural se da en la costa este de los Estados Unidos de América (Abbott 1974). Fue introducido en el siglo XX a la bahía de San Francisco, California (Carlton 1979, 1992, Cohen y Carlton 1995) desde donde se ha distribuido a lo largo de la costa del Pacífico. De Groot (1927) identificó a G. demissa como un factor de riesgo para el rascón picudo, ya que puede llegar a amputar dedos a pollos, juveniles y adultos, así como ahogar a los pollos durante la subida de marea cuando éstos quedan atrapados en las valvas del molusco, por lo tanto su presencia en el EPB podría aumentar los riesgos de la población de R. o. levipes.
Torchin et al. (2005) encontraron una población de Geukensia demissa en las zonas de marismas del EPB asociada al pasto nativo Spartina foliosa, registraron de 24-35 individuos/m2. En ese estudio reportaron hábitats traslapados para G. demissa y R. o. levipes sin descubrir interacciones entre las especies. Dada la presencia de G. demissa en el EPB se le puede suponer una amenaza más para la supervivencia y permanencia de la población de R. o. levipes. Por lo tanto, consideramos prioritario evaluar la interacción de estas dos especies y su efecto en la población de R. o. levipes para determinar el riesgo que pudiera presentar G. demissa. Como un estudio preliminar determinamos la distribución de nidos, el tamaño de la nidada, el éxito de eclosión de R. o. levipes y la densidad de G. demissa en tres zonas de marisma del estero.
Métodos
El Estero de Punta Banda es un humedal subestuarino (Dugan 1992), localizado en la vertiente oriental del Pacífico bajacaliforniano, N 31°40’-31°48’ y W 116°40’-116°34’, 13 km al sur de la ciudad de Ensenada, Baja California, México (Figura 1). El área de total del estero es de 2,393,266 ha y presenta una barra arenosa con una longitud aproximada de 8 km que forma una laguna costera en forma de L, la cual protege al área de marismas. El EPB tiene la afluencia ocasional de agua dulce durante eventos pluviales de invierno, los cuales oscilan de 200 a 400 mm anuales promedio (Ibarra-Obando y Poumian-Tapia 1991), que vierte en dos cuencas hidrológicas: los arroyos San Carlos y Las Ánimas (Pritchard et al. 1978) y brinda un hábitat ripario temporal (Martínez Del Río 2005). En el área de marismas existen canales y charcas de marea, que se extienden en un espacio aproximado de 326 ha. El área de estudio se encuentra en el tercio norte de las marismas, con una extensión de 107 ha (Jiménez-Pérez et al. 2009).
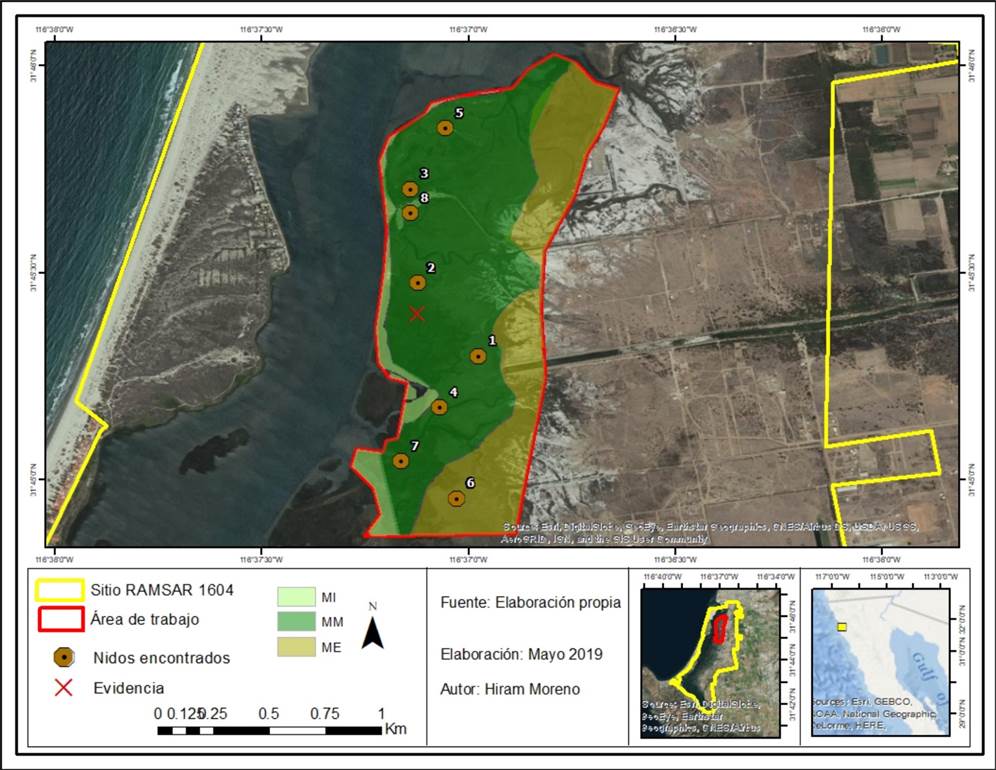
Figura 1 Ubicación geográfica del Estero de Punta Banda (EPB), Ensenada, Baja California, México. Zonación de las áreas de marismas: Marisma Interna (MI), Marisma Media (MM) y Marisma Externa (ME). Localización de nidos y punto donde se encontró evidencia de muerte de pollos de rascón picudo (Rallus obsoletus levipes) por interacción con el mejillón (Geukensia demissa).
Las mareas en la costa del Pacífico de Norteamérica son semidiurnas. Hay un efecto notable de éstas en el interior del estero de Punta Banda, ya que hasta el 60% del agua puede ser evacuada en un ciclo de mareas; el volumen total de agua en el estero varía de 5,280,000 m3 en bajamar media inferior, a 17,180,000 m3 en pleamar media superior. El tiempo de residencia del agua afecta directamente las condiciones ambientales (Martínez Del Río 2005), por lo que durante mareas vivas la altura de marea puede variar 2 o más metros en pocas horas (PredMar 2017).
Por su alta diversidad de hábitats se le considera óptimo para el descanso y alimentación de diversos organismos (Martínez Del Río 2005), en particular para especies de aves que lo habitan en forma permanente o durante la migración y residencia invernal (Jiménez et al. 2009).
De acuerdo con las descripciones de Delgadillo et al. (1992) y González-Guzmán (2007) se delimitaron tres zonas en el área de estudio de la marisma: Marisma Interna (MI), delimitada por el nivel más bajo de marea hasta donde inicia la presencia de Spartina foliosa; Marisma Media (MM), delimitada por el límite de la MI hasta los niveles más altos de presencia de S. Foliosa, y la Marisma Externa (ME), que está establecida desde arriba de la presencia de S. foliosa hasta donde termina la vegetación de Salicornia spp.
La selección de fechas de búsqueda de nidos fue durante las épocas reproductivas de mayo a julio de 2016, 2017 y 2018 (De Groot 1927). Durante mayo y junio de 2016 y 2017 realizamos prospecciones diarias de nidos de R. o. levipes en el EPB conforme al protocolo para especies de marisma de Conway (2009) y las prospecciones preliminares de ocurrencia de nidos las realizó el primer autor en 2014. Un nido lo encontramos de manera fortuita en 2018. Durante la temporada reproductiva realizamos recorridos diarios matutinos (6:30-10:30 h) y vespertinos (17:00-19:00 h), en cada una de las zonas MI, MM y ME, buscando pequeñas elevaciones de terreno. Una vez localizadas en las zonas, realizamos recorridos de búsqueda intensiva de nidos. Cada nido que encontramos fue georreferenciado (Figura 1) y monitoreado continuamente hasta la eclosión de huevos. La Figura 2 muestra el nido típico de R. o. levipes en el EPB.

Figura 2 Nido 4 de Rallus obsoletus levipes (rascón picudo) con 7 huevos, la puesta total fue de 8. Localizado a 15 m de un canal de marea y perdido por una marea alta. Véase Figura 1 y Cuadro 1 para localización. El nido se encontró a la sombra de Salicornia bigelovi y con pasto (Spartina foliosa) como sustrato de sustentación. Diámetro 29 cm, altura 17 cm (foto: HM-H del 6/05/2017).
En julio de 2018 en cada zona, MI, MM y ME, se establecieron 33 cuadrantes paralelos a la línea de costa para medir la densidad poblacional por m2 de G. demissa. Cada cuadrante fue de 1 x 1 m, y se establecieron cada 20 m, comenzamos desde el nido 6 de posición más sureña en nuestra área de estudio, hasta el nido 5 de posición más norteña para cada área de marisma para un total de 99 cuadrantes, 33 para cada zona (Figura 1). Para determinar la densidad de G. demissa en el hábitat de R. o. levipes contamos el número de individuos por cuadrante sin discriminar tallas. No sabemos si la talla del G. demisa influye en las interacciones con R. o. levipes. También identificamos las especies vegetales más comunes. Obtuvimos las alturas de marea en el EPB con el programa de predicción de mareas del CICESE (PredMar 2017).
Para decidir si la presencia de G. demissa estaba determinada por la zona de marisma, probamos por medio de una tabla de contingencia de X2 la independencia del número de individuos de G. demissa y el área de muestreo. Para el análisis estadístico utilizamos el programa PAST 3.22 (Hammer et al. 2001).
Resultados
Durante este estudio encontramos ocho nidos, dos en 2016, cinco en 2017 y uno de manera fortuita en 2018 (Figura 1, Cuadro 1). En 2017 solamente dos nidos fracasaron a media temporada debido a las mareas altas en los sitios 4 y 6. En el Cuadro 1 reportamos año de anidación, ubicación geográfica, número de huevos y éxito de eclosión de los nidos. La media de eclosión fue de 7.0 huevos, DE = 1.20.
Cuadro 1 Registro y monitoreo de los nidos localizados de rascón picudo (Rallus obsoletus levipes), en el Estero de Punta Banda (EPB), durante las épocas reproductivas de mayo a julio de 2016, 2017 y 2018.
| Núm. nido | Año | Coordenadas | Núm. huevos | Días seguimiento | Éxito eclosión |
|---|---|---|---|---|---|
| 1 | 2016 | N 31°45’17.94” W 116°36’58.66” | 8 | 18 | 100% |
| 2 | 2016 | N 31°45’28.53” W 116°37’7.44” | 6 | 3 | 100% |
| 3 | 2017 | N 31°45’42.13” W 116°37’8.47” | 8 | 9 | 75% |
| 4 | 2017 | N 31°45’10.51” W 116°37’4.23” | 8 | 6 | 0% |
| 5 | 2017 | N 31°45’50.97” W 116°37’3.36” | 8 | 11 | 100% |
| 6 | 2017 | N 31°44’57.26” W 116°37’1.76” | 7 | 13 | 0% |
| 7 | 2017 | N 31°45’2.72” W 116°37’9.82” | 6 | 8 | 100% |
| 8 | 2018 | N 31°45’38.70” W 116°37’8.42” | 5 | 0 | 100% |
El material de construcción y forma de los nidos fueron muy similares. Todos ellos construidos mayormente con material vegetal seco del pasto Spartina foliosa. Notamos que las plataformas que forman los nidos estaban entreveradas a la vegetación más cercana a ellas, lo cual les brindaba un área de sustento. Los nidos fueron construidos a la sombra de la vegetación emergente característica para cada zona de marisma (Figura 2). De una temporada a otra las aves no utilizaron el sitio previo para anidar.
Encontramos dos pollos de R. o. levipes muertos en las valvas de G. demissa. El primero durante el mes de junio de 2015, antes del inicio de este estudio, de manera fortuita sin que se pudiera determinar la fecha exacta de muerte. El segundo el 19 de junio durante la búsqueda de nidos de 2017 dentro de la MM en el punto: N 31°45’24.11” W 116°37’7.57” a las 9:30 h (Figura 3). La noche anterior la marea más alta superó los 1.50 m promedio máximo de una marea viva para esa fecha (PredMar 2017 y com. pers. Alfonso Higareda, Depto. Oceanografía Física, CICESE).

Figura 3 (1) Pollo muerto de rascón picudo (Rallus obsoletus levipes), atrapado en las valvas del mejillón (Geukensia demissa). (2) Mejillón expuesto para contrastar su tamaño con el del pollo. Eventualidad en la Marisma Media (MM) registrada el 19 de junio de 2017 (foto: HM-H).
La mayor densidad que registramos del bivalvo G. demissa fue en la Marisma Media (MM) 6.94 ind/m2 y la menor en la Marisma Externa (ME) 3.52 ind/m2) (Cuadro 2), las densidades fueron diferentes entre las tres zonas (X2 = 36.77, gl = 2, p < 0.001).
Cuadro 2 Estimaciones de la densidad (ind/m2) de Geukensia demissa en la marisma del Estero Punta Banda (EPB), Baja California en tres zonas: Marisma interna (MI), Marisma media (MM) y Marisma Externa (ME). En todas las zonas se obtuvo un valor mínimo de cero (0). DE = Desviación Estándar.
| Zona | Valor máximo (ind/m2) | Total individuos en transecto | Media (ind/m2) | DE (ind/m2) |
|---|---|---|---|---|
| MI | 11 | 177 | 5.36 | 2.84 |
| MM | 12 | 229 | 6.94 | 2.81 |
| ME | 9 | 116 | 3.52 | 2.49 |
Dentro de la MI la presencia y densidad G. demissa no se asoció a alguna característica física del ambiente o especie vegetal, aunque en esta zona se hallan dispersas Zoostera marina y S. foliosa. En la MM es predominante S. foliosa, con elementos de Salicornia pacífica y S. bigelovi. Para la ME encontramos al molusco presente en esta área acompañado por S. pacifica, S. bigelovi, Batis maritima y el pasto salado Distichlis spicata. La dominancia vegetal en esta área está representada por S. pacífica y S. bigelovi.
Discusión
En el EPB se desconocía el éxito de eclosión de R. o. levipes, pero aquí reportamos que es alto, aunque se sabe que el porcentaje anual de éxito reproductivo de la especie en otros sitios en general es bajo (Eddelman y Conway 2018). El promedio de eclosión por nido reportado por Eddelman y Conway (2018) para el Sur de California y norte de Baja California es de 7.3, DE = 1.2, no existe una diferencia significativa con la media reportada aquí (7.0, DE = 1.2). Todos los nidos exitosos se encontraban en lugares con una elevación mayor al nivel promedio, según PredMar (2017), de 1.3 m. En el sitio 3, dos de los huevos de una puesta de ocho, no lograron eclosionar y posteriormente se extraviaron con la marea alta del día 22 de junio de 2017 (PredMar 2017), la pleamar durante la temporada de reproducción fue de 2.2 m (PredMar 2017).
No atestiguamos la muerte de los pollos, pero anotamos la evidencia de cómo pudo haber sucedido. Como no observamos un estado de descomposición ni daño físico aparente en los pollos muertos, consideramos que posiblemente se ahogaron al quedar atrapados en las valvas de G. demissa durante el ascenso de la marea hasta una pleamar de 2.2 m. La evidencia circunstancial: los encontramos en planicies lodosas y no en canales de marea a donde los pollos que se ahogaron hubieran sido arrastrados por la corriente; en otras ocasiones hemos observado a pollos muertos flotando y en ambos casos los pollos estaban atrapados por los pies. DeGroot (1927) también atribuye muertes, la falta de dedos o patas a especímenes de colección de R. o. levipes con evidencia circunstancial a depredación por G. demissa.
Considerando que R. o. levipes es un especie naturalmente rara y que se encuentra enlistada como en peligro de extinción en la NOM-059-SEMARNAT-2010 (Semarnat 2010) y por el Acta de especies en peligro de Estados Unidos de América (USFWS 1973) se debe conocer su biología y los ambientes en los que se distribuye la especie, incluidas las amenazas y ventajas particulares para la conservación en cada sitio. La presencia de G. demissa puede representar un factor de riesgo para la población de R. o. levipes en la disminución del éxito reproductivo a través de la muerte de pollos. Esta ave es una especie con múltiples amenazas en el EPB, como el desarrollo habitacional, plantas invasoras, actividades recreativas no reguladas, contaminación agrícola de suelo y subsuelo, abatimiento de acuíferos y la presencia de perros y gatos ferales (Martínez del Río 2005).
Torchin et al. (2005) reportaron hábitats traslapados para G. demissa y R. o. levipes, pero no advirtieron las interacciones que observamos en este estudio. Ya De Groot (1927) notó, sin cuantificar, que en California R. o. levipes se encontraba amenazada por G. demissa y sugería la importancia de esfuerzos de conservación para R. o. levipes con respecto a G. demissa.
Encontramos a G. demissa en diferentes densidades en las tres zonas de estudio en la marisma donde habita y forrajea R. o. levipes (Cuadro 2), sus lugares de forrajeo y refugio están determinados por el nivel de marea. Nuestras notas de campo indican que el forrajeo se lleva a cabo principalmente en orden de prioridad en las zonas MI y MM. Estas observaciones requieren de mayores estudios para su cuantificación. Las densidades del bivalvo fueron mayores en la marisma media, lo cual aumenta la probabilidad de ocurrencia por muerte si las aves hubiesen sido atrapadas en las valvas de G. demissa. Nuestros resultados de la presencia y densidad de G. demissa coinciden con estudios previos en las mismas zonas realizados entre 2013 y 2018, donde para un área total de estudio de 1,200 m2 se reportó una densidad de 3.5 a 7.5 individuos/m2, E. Campos (com. pers.).
Zembal y Fancher (1988) observaron a dos especímenes de R. o. levipes depredando sobre G. demissa en Newport Bay, California. Se desconoce la frecuencia o volumen de G. demissa en la dieta del rascón en el EPB. Sin embargo, Moffitt (1941) encontró, después de haber analizado 18 estómagos del R. o. levipes, que el mejillón rayado fue el alimento más abundante. No es claro para Zembal y Fancher (1988) si R. o. levipes puede romper las valvas de mejillones grandes o traga mejillones chicos enteros. Se desconoce el impacto de R. o. levipes sobre el control de la población de G. demissa, pero debe cuantificarse para saber si es un factor de control de la especie invasora.
Las observaciones en las zonas de marismas revelan que no existe una asociación fácilmente discernible entre la cobertura vegetal de las especies dominantes, Spartia foliosa y Salicornia spp. con respecto a la distribución y densidad de G. demissa. Por lo que parece que la presencia de G. demissa es independiente de la presencia de vegetación.
Nuestros resultados de la distribución y composición de nidos así como la presencia generalizada de G. demissa nos lleva a sugerir que R. o. levipes persiste en el EPB y que es necesario desarrollar más investigaciones sobre la población de la especie y sus interacciones con G. demissa. La investigación debe ajustarse a las recomendaciones generales de Eddelman et al. (1988) y Eddelman y Conway (2018) de trabajar en horarios crepusculares, poniendo atención a la aparición ya sea auditiva o visual de esta especie críptica. Las observaciones deben ajustarse a la presencia de desarrollo humano cercano, el control y manejo de especies exóticas como G. demissa o plantas como el ngaio (Myoporum laetum) y la conservación general de las zonas habitadas por R. o. levipes. Nuestros resultados indican que se debe elaborar una propuesta técnica y planes de acción y manejo adaptativos para asegurar que los sitios con una elevación mayor al nivel medio de marea dentro de la zona de marismas en los que hemos encontrado nidos sean considerados como críticos para la anidación y persistencia del ave. Estas pequeñas elevaciones son de gran importancia para asegurar el éxito de eclosión de los huevos de R. o. levipes ante las mareas altas y extraordinarias. Estas mareas ya han sido identificadas como un riesgo natural por Rush et al. (2010). Además del riesgo de pérdida de nidos por inundación la propuesta debe contemplar la presencia de G. demissa y otras perturbaciones del hábitat inducidos por el desarrollo en zonas costeras, la presencia de otras especies invasoras y ferales y el aumento del nivel y la temperatura del mar como amenazas a la persistencia de R. o. levipes en el EPB.











 nueva página del texto (beta)
nueva página del texto (beta)



