Introducción
La familia Cathartidae es una familia exclusiva de América y consta de especies grandes y parecidas a los buitres del viejo mundo (Subfamilia: Aegypiinae), con cuello desnudo; su alimentación consiste principalmente de cadáveres (Del Hoyo et al. 1994, Howell y Webb 1995). A excepción del cóndor andino (Vultur gryphus) y el cóndor californiano (Gymnogyps californianus), ninguna de las especies de la familia Cathartidae se incluyen en las listas de especies de rapaces diurnas amenazadas en la región. Sin embargo, éstas enfrentan amenazas como persecución directa, envenenamiento primario y secundario, pérdida del hábitat y sitios de nidificación (Kiff 2000, Desmarchelier et al. 2010, Sarasola et al. 2018).
En El Salvador se han registrado cuatro especies de esta familia: el zopilote común (Coragyps atratus), el zopilote aura (Cathartes aura), el zopilote rey (Sarcoramphus papa) y el zopilote sabanero (Cathartes burrovianus) (Ibarra-Portillo 2013). A pesar de que el zopilote aura es común en todo El Salvador (Dickey y van Rossem 1938, Campbell 2014) y está catalogado como una especie residente y migratoria (Ibarra-Portillo 2013), estudios de rapaces diurnas a largo plazo en el país (West 1988, Pérez 2002, 2007) no han registrado actividades de reproducción o de anidación para esta especie (Komar 2001).
Del mismo modo, aunque esta ave se reproduce desde el sur de Canadá hasta el sur de Sudamérica (Kirk y Mossman 1998), se conoce muy poco sobre su biología reproductiva. Así, por ejemplo, la nidificación de esta especie no fue documentada en La Española (isla que comprende Haití y República Dominicana) sino hasta el año 2014, cuando se realizó un hallazgo de nidos en República Dominicana (Curti et al. 2014). Asimismo, la época reproductiva es asincrónica a través del continente americano; en La Española el inicio de ésta ha sido registrado en febrero (Curti et al. 2014), a finales de mayo en Estados Unidos (Rollack et al. 2013), en junio en Canadá (Houston et al. 2011) y en noviembre en Costa Rica (Stiles y Skutch 1995) y Argentina (Moroni y Salvador 2014).
En esta publicación detallamos el desarrollo de un polluelo de C. aura, desde el hallazgo del huevo hasta el abandono del nido, en el departamento de Usulután, El Salvador. Según la revisión bibliográfica, no existen detalles de la biología reproductiva de esta especie en la literatura ornitológica del país (West 1988, Komar 2001, Pérez 2002, 2007), siendo éste un vacío importante en la historia natural para esta especie, restringida al hemisferio occidental (Del Hoyo et al. 1994, Sarasola et al. 2018).
Métodos
Las observaciones de la anidación de C. aura las realizamos en el recinto de venados cola blanca (Odocoileus virginianus) del Centro de Rescate de Fauna Silvestre El Tronador (CERFAS), ubicado en el Campo Geotérmico de Berlín, departamento de Usulután, El Salvador (Figura 1). Dicho recinto tiene a más de 25 individuos de O. virginianus, posee un área total de 7.94 ha y forma parte de las aproximadamente 100 manzanas de bosque protegido destinadas por LaGeo como refugio natural de vida silvestre (Arévalo 2016). Esta localidad se encuentra catalogada en la zona de vida bosque húmedo subtropical (bh-S) según el Visualizador de Información Geográfico de Evaluación Ambiental [(VIGEA: http://mapas.marn.gob.sv/vigea/login.aspx; basado en Holdridge (1975) ] y dentro del Área de Conservación Tecapa-San Miguel con prioridad media de restauración (MARN 2018). En el sector donde se encontró el nido, existe predominancia de especies como “tecomasuche” (Coclospermum vitifolium), “jocotes” (Spondias sp.), pastos y bejucos, y en algunas partes la ausencia de vegetación ocurre por la actividad geotermal del suelo (obs. personal). La estructura geológica del recinto, evidencia la actividad volcánica de la zona (Volcán Tecapa, municipio de Alegría, Usulután) con la presencia de lavas, escorias intracaldéricas (andesitas, andesitas basálticas y basaltos), fumarolas, hervideros y suelos humeantes (Alvarenga et al. 2004).
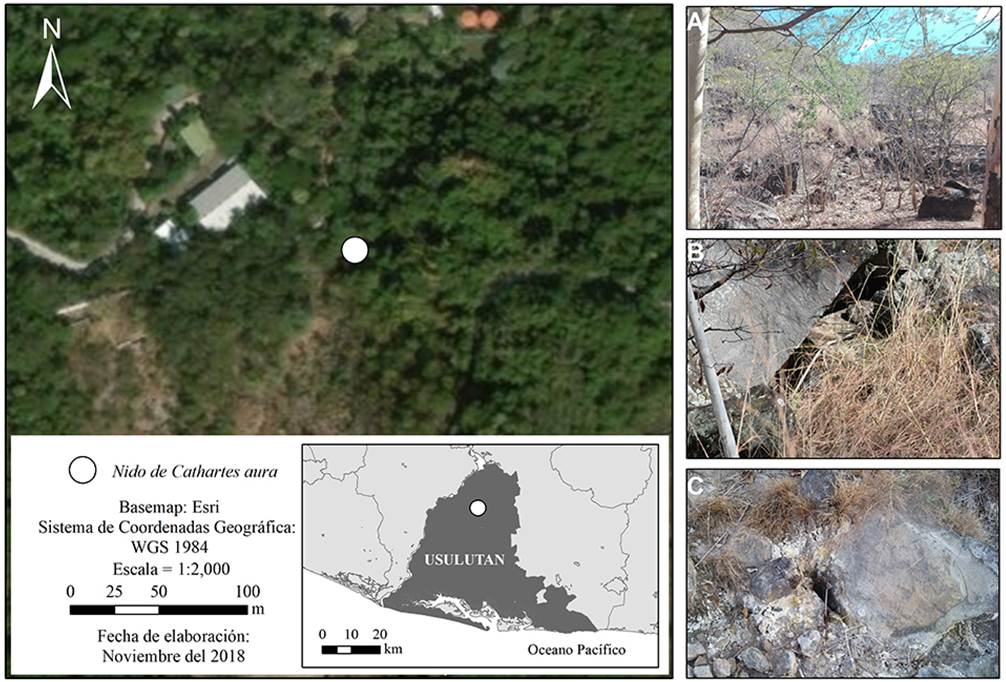
Figura 1 Sitio de nidificación del zopilote aura (Cathartes aura) en el departamento de Usulután, El Salvador. A) Vegetación caducifolia característica del sitio de nidificación, marzo de 2018. B) Superposición de rocas basálticas que conformaron la cavidad del nido. C) Suelo humeante por la actividad geotermal del sitio (fotos: DA-A).
El nido lo encontramos en las coordenadas 13°31’10.40” N, 88°30’42.31” O y a 615 msnm. El monitoreo del nido lo realizamos desde febrero a mayo de 2018, aproximadamente cada siete días en horas matutinas y vespertinas. Hicimos un registro fotográfico para cada día de monitoreo con el objetivo de captar los cambios del plumaje. El registro de datos de la conducta y estadío del plumaje de los polluelos fue de observación ad libitum (Gaibani y Csermely 2007), con una duración entre 5-15 min y en ningún momento manipulamos a los individuos. A partir del 24 de abril, fecha en que nos percatamos de la ausencia de uno de los polluelos, la estimación de la edad del polluelo restante la presentamos en el texto y en el Anexo 1 como el promedio de ambos. La medición de dimensiones de la cavidad del nido las realizamos el 12 de julio de 2018, mediante el uso de una cinta métrica de 30 m (Stanley) y se hizo cuando el nido fue abandonado para evitar provocar estrés en los individuos. Realizamos una medición perpendicular desde donde estuvieron los huevos hasta el techo de la cavidad, nueve medidas por lado (alto y ancho) en la primera abertura (principal), tres medidas por lado en la segunda (trasera) y seis medidas por lado en la tercera (escotilla). Finalmente calculamos el promedio y desviación estándar (media ± DE) y mostramos los valores máximos y mínimos (mínimo, máximo) para describir el tamaño de la cavidad.
Resultados
El 12 febrero de 2018, a las 09:52 h y a 88.5 m de la entrada principal del recinto, encontramos dos huevos blancos con manchas cafés en una cavidad natural formada por la superposición de varias rocas, al nivel del suelo, con sustrato de tierra y material orgánico vegetal, diversas raíces de árboles establecidos sobre las rocas y sin una aparente preparación del área para nidificación por parte de los padres (Figura 2A). Observamos en los alrededores a un individuo adulto de C. aura que sobrevolaba a baja altura la zona donde nos encontrábamos. Días posteriores, notamos al menos a uno de los padres cuidando el nido, posado sobre la entrada de la cavidad o dentro de ésta.

Figura 2 Desarrollo de la anidación del zopilote aura (Cathartes aura) encontrado en el recinto de venados cola blanca (Odocoileus virginianus) del CERFAS. A) Nidada de dos huevos dentro de cavidad rocosa y sobre material vegetal seco (12 de febrero de 2018). B) Polluelos de siete y cinco días de edad con apertura ocular (26 de marzo de 2018). C) Polluelo de 46 días de edad realizando extensión alar como amenaza (4 de mayo de 2018). D) Polluelo de 58 días de edad encontrado a aproximadamente 2 m de distancia de la cavidad rocosa (16 de mayo de 2018) (fotos: DA-A).
La cavidad natural está compuesta por la superposición de rocas basálticas que conforman al menos tres aperturas. 1) Cavidad principal: en ésta observamos a los padres ingresar para empollar los huevos y realizar cuidados parentales. Está orientado hacia el suroeste y posee una forma trapezoide, con 54.5±9.4 (46, 71) cm de ancho, 45.2±33.9 (0, 84) cm de alto y se encuentra a 185 cm de donde ocurrió la puesta de huevos. 2) Cavidad trasera: los padres utilizaron esta cavidad para huir cuando fueron perturbados. Está orientada hacia el noreste, posee una forma rectangular y se encuentra al lado opuesto de la cavidad principal, con 29.3±4.5 (25, 34) cm de ancho, 26.5±4.4 (21, 31) cm de alto y a 47 cm de distancia con respecto a donde estuvieron ubicados los huevos dentro de la cavidad. 3) Cavidad escotilla: en esta cavidad observamos a los polluelos durante su crecimiento. Está orientada hacia el noreste, posee una forma trapezoide y se encuentra ubicada en el techo de la estructura de rocas, a 105 cm de la segunda apertura, posee 26.1±11.9 (13, 42) cm de ancho, 28.6±14.5 (12, 49) cm de largo y está situado a 127 cm de donde ocurrió la puesta de huevos. La altura desde el suelo al techo donde estuvieron ubicados los huevos fue de 31 cm. Dentro de la cavidad se encontraron dos zonas con suelos alterados termalmente, la primera se encuentra en la apertura principal, a 178 cm de donde ocurrió la puesta de huevos y la segunda a 30 cm.
El día el 19 de marzo, a las 13:47 h, observamos a uno de los huevos eclosionado. El polluelo tenía los ojos cerrados y el plumón blanco y seco, lo que indicó que probablemente nació unas pocas horas antes. La parte frontal, lores, mentón y zona circundante a los ojos estaban desprovistos de plumón y eran de color negro. El vientre se observó desnudo, de color rosado y la zona del buche de color grisáceo. Los tarsos y dedos eran de color blanco con pequeñas manchas de color gris oscuro a negro, predominantemente en las puntas de las falanges. El pico y narinas eran de gris oscuro. Dos días después, el 21 de marzo a las 09:23 h, observamos al otro polluelo. Uno de los padres se encontraba con ellos dentro de la cavidad y al momento de acercarnos huyó del sitio; sin embargo, se mantuvo sobrevolando en las cercanías del nido.
El 26 de marzo, con siete y cinco días de edad, respectivamente, observamos que ambos polluelos tenían los ojos abiertos. La pupila de los ojos era de color negro y el iris de color grisáceo oscuro (Figura 2B). Ambos presentaron una conducta de alerta sin siseo de amenaza. Al día siguiente, al acercarnos a la entrada de la cavidad, ambos polluelos mostraron una conducta de alerta, sin embargo sólo uno de ellos bajó la cabeza, siseó y extendió las alas en señal de amenaza, el otro únicamente bajó la cabeza.
El 11 de abril, con 24 y 22 días de edad, observamos en ambos polluelos el inicio del crecimiento de las plumas primarias con aproximadamente 0.5 cm de largo a partir del folículo. A esta edad, los polluelos poseían más del doble de tamaño desde el momento en que nacieron. Fue notable la diferencia de conductas que presentaron al momento de acercarnos, uno de ellos huyó inmediatamente hacia otra sección de la cavidad y el otro mostró amenazas mediante el siseo y extensión de alas durante unos cuantos segundos hasta que huyó hacia la misma sección que el otro. En días posteriores, observamos casi el mismo patrón conductual de ambos; sin embargo, el único polluelo que mostraba amenazas prefería huir hacia la otra sección de la cavidad con mayor rapidez.
El 19 de abril, con 32 y 30 días edad, uno de los polluelos presentó el inicio del crecimiento de las plumas secundarias y algunas coberteras mayores. Ambos polluelos presentaron la misma conducta amenazante mediante siseo y extensión de alas, con un inmediato escape hacia una sección de la cavidad que nos imposibilitaba observarlos.
El 24 de abril, con 36 días de edad, observamos a un solo polluelo en la cavidad. Éste presentó inicio de crecimiento de las plumas rectrices con aproximadamente 0.5 cm de largo a partir del folículo. La conducta que presentó el individuo al momento de acercarnos fue la misma a la observación anterior. Tres días después revisamos nuevamente la cavidad para buscar al otro polluelo pero sólo observamos uno.
El 4 de mayo, con 46 días de edad, el polluelo presentó inicio de crecimiento de plumas en la parte dorsal y frontal del cuerpo y coberteras de las rectrices, apenas visibles. Las oscuras plumas secundarias y primarias de las alas y rectrices contrastaban a simple vista con el plumón blanco que predominaba en cabeza, cuello, parte frontal y dorsal del cuerpo (Figura 2C). Esta vez la conducta presentada fue de extensión de alas y amenaza mediante siseo.
El 16 de mayo, con 58 días de edad, el polluelo lo encontramos fuera de la cavidad del nido, utilizando otras cavidades cercanas. El plumaje de las alas estaba casi completo, con reminiscencias de plumón visibles entre las plumas coberteras secundarias, primarias y mayor proporción de plumón entre las coberteras menores. Las plumas rectrices y coberteras estaban completas. Las plumas de la parte dorsal y frontal del cuerpo aún presentaban reminiscentes de plumón (Figura 2D). La conducta presentada por el individuo fue de huida.
El 23 de mayo, con 65 días de edad, el polluelo presentó el plumaje de juvenil casi completo, los bordes de las alas presentaron algunos plumones reminiscentes en la zona de coberteras menores y cerca de las álulas, así como también la parte dorsal del cuerpo. Se observaron manchas de heces en el plumaje de la parte dorsal del cuerpo y en las alas. La parte frontal y muslos presentaron mayor proporción de plumón que pluma. La zona del buche presentó pluma en su totalidad. El cuello aún mantuvo plumón; sin embargo, en la garganta se observó crecimiento de plumas oscuras (Figura 3A). La conducta del individuo fue la extensión de las alas y siseo de amenaza, con fuertes aleteos al momento de acercarnos a la cavidad.

Figura 3 Desarrollo del juvenil de zopilote aura (Cathartes aura). A) Juvenil encontrado a aproximadamente 5 m de distancia de la cavidad rocosa (23 de mayo de 2018). B) Agrupación interespecífica de zopilote común (Coragyps atratus; primer plano), juvenil de C. aura (segundo plano) y garrobo (Ctenosaura similis; tercer plano) alimentándose de carroña (19 de junio de 2018). C) Juvenil forrajeando sobre el recinto de venados cola blanca (Odocoileus virginianus) (12 de julio de 2018). D) Progenitor (derecha) y juvenil (izquierda) perchados en un árbol de Simarouba glauca (4 de septiembre de 2018) (fotos: DA-A).
El 19 de junio, con 92 días de edad, aproximadamente a 50 metros del nido, encontramos al pichón alimentándose de carroña junto a sus padres y otros dos C. aura, un individuo de Ctenosaura similis y con al menos 14 individuos de Coragyps atratus. El ahora juvenil presentó el plumaje completo, con ciertas manchas de heces sobre las plumas coberteras medias y menores. La cabeza, nuca y mentón estaban desprovistos de plumas, la piel de color rosado grisáceo con ciertos tonos grises oscuros, predominantemente en la parte de los lores. El pico presentó una coloración predominante negra con una lista color blanco en el culmen y laterales de la mandíbula superior que se extendían en dirección a la cera. En la parte del cuello colindante al mentón y nuca aún tenía plumones (Figura 3B). Al enterarse de nuestra presencia, el juvenil, junto a sus padres, volaron hacia dirección noreste.
El 12 de julio, con 115 días de edad, lo observamos junto a sus padres forrajeando sobre el área del recinto de venados cola blanca. El plumaje del cuello presentó aún reminiscencias de plumón y el color de la cabeza fue el mismo (Figura 3C). El último avistamiento que realizamos ocurrió el 4 de septiembre. Con 169 días de edad, lo observamos aproximadamente a 700 metros del sitio de anidación, junto a uno de los padres. El plumaje del cuello carecía de plumón y el color de la cabeza fue el mismo (Figura 3D).
Discusión
Si bien C. aura se considera como una especie residente en El Salvador (Ibarra-Portillo 2013), hasta la fecha únicamente se deducía su reproducción en el territorio salvadoreño por el registro de un huevo encontrado en el útero de un espécimen durante su preparación taxidérmica. Dicho espécimen fue colectado el 15 de enero de 2002, a 950 msnm en la cooperativa Concepción Miramar en San Pedro Puxtla, departamento de Ahuachapán y depositado posteriormente en University of Kansas Natural History Museum con código KU93743 (N. Herrera y O. Komar, comunicación personal). Esta publicación es por lo tanto el primer registro fotográfico y descripción de la nidificación de la especie en El Salvador.
La fecha de puesta del nido de C. aura que reportamos concuerda con la actividad reproductiva descrita para Cuba (Denis et al. 2013, Vilató 2002) y La Española (Curti et al. 2014), la cual ocurre principalmente en el mes de febrero. Al comparar con las fechas de anidación de Estados Unidos (Coleman y Fraser 1989) y Canadá (Nelson et al. 2009, Houston et al. 2011, Rollack et al. 2013), encontramos diferencias principalmente con este último, quienes indican que la ovoposición ocurre aproximadamente a inicios de mayo. En contraste con Argentina (Moroni y Salvador 2014, Sarasola et al. 2000, De Lucca et al. 2012), también observamos diferencias ya que los autores indican que la fecha de puesta de nido ocurre aproximadamente en el mes de noviembre, al igual que en Costa Rica (Stiles y Skutch 1995). De manera general, la variación en la sincronización de la temporada reproductiva para esta especie podría estar sujeta a la latitud y a factores ambientales locales, así como ha sido reportado para otras especies de aves (Sutherland 1989, Sanz 1998, Carrillo y González-Dávila 2009).
Las características de la anidación que detallamos en el presente escrito concuerdan con la literatura. El tamaño de nidada corresponde al promedio reportado en vida libre (Coles 1944, Del Hoyo et al. 1994, Sarasola et al. 2000, Vilató 2002, Nelson et al. 2009, Denis et al. 2013, Curti et al. 2014). Si bien no manipulamos a los individuos para obtener datos biométricos en un gradiente temporal para determinar la tasa de desarrollo de los polluelos, el tiempo de crecimiento que reportamos parece concordar con Coleman y Fraser (1989), Del Hoyo et al. (1994) y Nelson et al. (2009), y el desarrollo del plumaje con la guía fotográfica de Nelson et al. (2009). Asimismo, la depredación de polluelos de esta especie también ha sido reportada y parece ser que polluelos de algunas semanas de nacido son vulnerables a la depredación por zorros, reptiles o felinos (Sarasola et al. 2000). Dentro y alrededor del recinto de venados cola blanca del CERFAS hemos observado y encontrado rastros de mamíferos como zorros grises (Urocyon cinereargenteus), perros ferales (Canis lupus familiaris), gato zonto (Herpailurus yagouaroundi), reptiles de gran tamaño como garrobos (Ctenosaura similis) y mazacuatas (Boa constrictor), de los cuales alguna de estas especies podría haber depredado al polluelo.
La conducta que presentan los padres durante el período de empolle y al momento de detectar la presencia de una persona al sitio de anidación, es por lo general el escape por una apertura específica de la cavidad o cueva, y si no escapan, pueden hacer extensión de alas, sisear y lanzar vómito como método de defensa del nido (Coles 1944). En el caso de la pareja que observamos, únicamente registramos la conducta de escape cada vez que nos acercábamos a 10 metros de la cavidad, manteniendo cierta vigilancia del nido mediante sobrevuelos en el sitio. En cuanto al cuidado del nido por parte de los padres, a pesar de que no cuantificamos el tiempo, la mayoría de veces observamos al menos a uno de ellos dentro de la cavidad empollando los huevos durante los monitoreos. Posterior a la eclosión, observamos a los padres pocas veces con los polluelos y más tiempo forrajeando por la zona. Rollack et al. (2013), mencionan que ambos padres toman parte del empolle y cuidado parental con turnos de hasta 24 horas; sin embargo, pueden ocurrir lapsos de ausencia de ambos de hasta 5.5 horas y llegar a realizar una sola visita por día para alimentar a los polluelos, lo cual depende principalmente de la disponibilidad de alimento en la zona (DeVault et al. 2004). En cuanto a la conducta de los polluelos, la extensión alar como amenaza que observamos cada vez que nos acercábamos a la cavidad, ha sido reportada con anterioridad en individuos de hasta 13 días de edad (Work y Wool 1942) y con siseo gutural en polluelos de 6 días de edad (Nelson et al. 2009).
Cathartes aura anida en una gran diversidad de ambientes. Esta especie puede anidar en repisas rocosas (Harrison y Greensmith 1993), cuevas (Curti et al. 2014), troncos huecos de árboles (Giusti et al. 2015), en el suelo debajo de matorrales densos (Sarasola et al. 2000, De Lucca et al. 2012, Moroni y Salvador 2014) y cercano a cuerpos de agua (Vilató 2002) e incluso dentro de infraestructuras humanas (Houston et al. 2011, Rollack et al. 2013). El presente hallazgo, además de haberlo hecho en una cavidad formada por la superposición de rocas basálticas, la presencia de tierras calientes y zonas alteradas, no ha sido descrito previamente en la literatura de la especie. Asimismo, a pesar de que las reducidas dimensiones de la cavidad que reportamos contrastan con las dimensiones descritas por Curti et al. (2014), parece ser que este tipo de morfología es frecuentemente utilizado en zonas con mayor cantidad de cuevas disponibles (Coles 1944), así como las condiciones que presenta actualmente el recinto.
Por último, parece ser que existe una recurrencia anual de nidificar en el mismo sitio desde hace al menos tres años. Según Filadelfo Mejía (comunicación personal), guardarrecursos del CERFAS, es el tercer año que ha observado la anidación de esta especie precisamente en la misma cavidad. En enero de 2015 observó dos huevos color blanco con manchas cafés y un individuo adulto dentro de la cavidad. Durante el mes de marzo observó dos polluelos con plumón blanco, con cara y pico de color negro. Posterior a esta fecha no continuó monitoreando el nido. Un año después, en el mes de febrero, nuevamente observó dos huevos con las mismas características que los del año anterior y un individuo adulto posado en la punta de la roca que forma la cavidad para el nido. Semanas después no se observaron polluelos y se sospecha que fueron depredados. Estas observaciones podrían reafirmar la teoría de la conducta filopátrica de la especie, la cual se refiere a la tendencia de retornar anualmente al mismo territorio a reproducirse o nidificar (Curti et al. 2014); sin embargo, esta filopatría puede no ocurrir en todos los individuos de la especie (Rollack et al. 2013), por lo que no podemos inferir con certeza que la misma pareja esté anidando cada año en la misma cavidad sin realizar un debido marcaje de cada individuo. Con este estudio se aporta información valiosa sobre la biología reproductiva de C. aura, que a pesar de ser común en el continente americano y con tendencias poblacionales estables (BirdLife International 2018), pocas descripciones de su nidificación han sido reportadas; por lo tanto, el presente manuscrito es de fundamental importancia para aunar al actual conocimiento de la historia de vida de esta especie y para el planteamiento de estrategias de conservación adecuadas.











 text new page (beta)
text new page (beta)



