Introducción
Una población de aves se ve limitada por factores intrínsecos como la migración y la inmigración, y por factores externos tales como la competencia por alimento con otras especies (Newton 1998). El gavilán caracolero (Rostrhamus sociabilis) y la correa (Aramus guarauna) son dos especies de aves de los humedales de agua dulce en las regiones tropicales y subtropicales del continente americano. Ambas especies comparten el mismo hábitat debido a que su alimentación se compone casi exclusivamente de caracoles del género Pomacea (Estela y Naranjo 2005).
En México, el gavilán caracolero se encuentra permanentemente en los humedales del sureste del país, en la península de Yucatán, istmo de Tehuantepec, Tabasco y el sur de Veracruz. Ocasionalmente ha sido reportado en el Pacífico Tropical Mexicano, en las costas de Chiapas y Guerrero (Navarro y Peterson 2007). En Colima, observadores de aves lo reportan a partir de 1998 y en Jalisco a partir de 2004 (Pineda et al. 2012). Hernández-Vásquez (2013) y colaboradores indicaron que el gavilán caracolero se encontró de manera constante en Jalisco y Colima y, aunque no observaron su reproducción, sugieren que puede reproducirse en la región. La correa es la única especie de la familia Aramidae; en México su distribución como residente se encuentra en el Golfo de México desde Veracruz y en el Pacífico desde el occidente de Colima y el sureste de Oaxaca, hacia el sur por ambas vertientes incluyendo la península de Yucatán (AOU 1983). Fue registrada en Jalisco por vez primera en 1999 (Hernández-Vázquez et al. 1999) y desde entonces hay varios registros adicionales (Palomera-García et al. 2006). Adicionalmente, desde 2012 a 2016 se le registró reproduciéndose en Nayarit (Molina et al. 2017), por lo que podemos considerarla actualmente como residente. Tanto el gavilán caracolero como la correa han incrementado su área de distribución hacia el noroeste de México y ahora se les encuentra regularmente en la Reserva de la Biosfera de Marismas Nacionales entre los estados de Nayarit y Sinaloa (Carmona et al. 2012).
Ambas especies se encuentran en la Norma Oficial Mexicana NOM-059-SEMARNAT-2010 (Semarnat 2010), donde el gavilán caracolero se considera como especie sujeta a protección especial debido en particular a su estrecha asociación con los ambientes de humedales, los cuales han disminuido a causa del crecimiento urbano e industrial; en tanto la correa es considerada amenazada, y podrían encontrarse en peligro si las modificaciones de su hábitat continúan (Semarnat 2010). En la lista de la UICN el gavilán caracolero y la correa se consideran especies de preocupación menor (BirdLife International 2016a, 2016b).
Los hábitos alimentarios de estas especies son bien conocidos (Snyder y Snyder 1969, Sykes 1987, Magalhães 1990, Sykes et al. 1995, Bryan 2002, Estela y Naranjo 2005, Pineda et al. 2012). El 95% de su alimentación es exclusivamente de caracoles de agua dulce del género Pomacea, generalmente de los que flotan en el espejo de agua, aunque también estas aves se alimentan de otras especies de caracoles abundantes en sus ambientes (Estela y Naranjo 2005). Cuando los gavilanes buscan alimento vuelan a baja altura, a unos 5 u 8 m, sobre el área de caza en forma lenta y con las patas toman los caracoles. Sin embargo permanecen gran parte del tiempo en perchas observando el cuerpo de agua.
En las riberas de las lagunas y de otras zonas bajas es frecuente observar conchas vacías de caracoles, principalmente del género Pomacea. Cuando estas conchas presentan perforación en su voluta más grande y generalmente se encuentran dispersas en las orillas de las lagunas, se sugiere que han sido depredadas por la correa (Estela y Naranjo 2005). En consecuencia, cuando las conchas están amontonadas y no presentan ningún tipo de perforación, indican depredación del gavilán caracolero, sin embargo Bryan (2002) menciona que las correas raramente dañan la concha.
La “chivita”, como se conoce en el sur de Quintana Roo al caracol Pomacea flagellata, se distribuye en el sistema lagunar de Bacalar en Quintana Roo y es colectada por pobladores de la comunidad para su consumo en los hogares y restaurantes. La especie es además capturada por los pescadores locales como una fuente de ingreso. El uso no regulado de la chivita por parte de los pescadores no sólo puede repercutir drásticamente en la población de chivitas en sí; sino también puede originar un desbalance ecológico con implicaciones graves en las poblaciones de sus depredadores como gavilanes y correas que dependen del recurso para su alimentación. Este problema puede ocasionar la pérdida de las poblaciones de ambas especies de aves en la Laguna de Bacalar en el largo plazo.
En este documento reportamos la distribución y abundancia del gavilán caracolero y la correa, así como el tamaño de presa consumido por ambas especies en la Laguna de Bacalar. Esta investigación aporta información para la gestión de cada una de las especies involucradas y la futura propuesta de un plan de protección inscrito en el programa de ordenamiento municipal.
Área de estudio
La Laguna de Bacalar se ubica al sur del estado de Quintana Roo, México (18°40’37” N, 88°23’43” O) a una altura media de 10 msnm (Figura 1). La forma de la laguna es estrecha y larga, con tan sólo 2 o 3 km en su punto más ancho, tiene una longitud aproximada de 50 km (Herrera-Sansores y Heredia-Escobedo 2011).
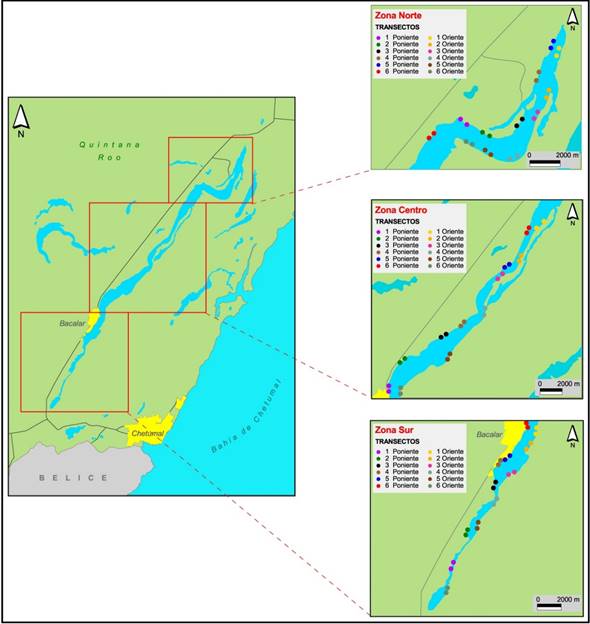
Figura 1 Laguna de Bacalar, Quintana Roo y ubicación de los transectos en las zonas de muestreo (norte, centro y sur). Cada par de puntos del mismo color representa inicio y fin del muestreo (mapa base tomado de Google Earth 2012 y modificado por H. Weissenberger).
El clima del lugar es húmedo intermedio, la temperatura media anual es de 25.5ºC, con diferencias de media mensual de 5 y 7ºC entre el mes más caliente y el más frío; la precipitación promedio es de 1224.70 mm anuales (Herrera-Sansores 2011). La vegetación predominante difiere en ambas riberas; en el este dominan el mangle rojo (Rizophora mangle) y mangle de botoncillo (Conocarpus erectus), en tanto en el oeste hay vegetación de selva mediana con árboles de zapote (Manilkara zapota) y palma ch’it (Thrinax radiata). A lo largo de ambas riberas de la laguna se puede observar tasiste (Acoelorraphe wrightii), chechen (Metopium brownei), chacá (Bursera simaruba) y pucté (Bucida buceras) entre otras. En zonas someras hay vegetación emergente como la ninfa acuática (Ninphae sp.) y el carrizo (Phragmites australis). Existen varios poblados ubicados cerca de la Laguna de Bacalar por lo que gran parte de la selva y humedales del lado oeste se encuentran perturbados.
Métodos
Para identificar a las especies de aves involucradas, las características particulares son: el gavilán caracolero se distingue por su pico delgado, ampliamente curvado y de punta afilada. Los individuos presentan una longitud de 43 cm y una envergadura de 117 cm (Dunn y Alderfer 2011). El macho es de color negro, sus patas y la base del pico son de color naranja fuerte (Figura 7). La hembra es de color café con rayas blancas en el pecho y en la zona gular, malar y superciliar, blanco en las cobertoras inferiores de la cola, en tanto sus patas y la base del pico son de color naranja claro (Figura 8). El juvenil es similar a las hembras adultas, pero con más rayas en la espalda y patas de color amarillo pálido y la cara blanca (Figura 6).
La correa es un ave de tamaño mediano, 66 cm de la punta del pico hasta el final de la cola (Dunn y Alderfer 2011). Es de color café chocolate todo el cuerpo, salvo las líneas blancas alrededor de todo el cuello: desde la cabeza hasta el pecho. El dorso y las cobertoras terciarias también tienen plumas blancas. Las patas son largas, vadeadoras, los dedos no son palmeados. El pico es largo con la parte inferior amarilla y oscura en la superior y la punta. Los ojos son café oscuro (Figura 9).
Para determinar la distribución de ambas especies en la laguna, ésta se fraccionó en tres zonas: sur (Xul-Ha-Bacalar), centro (Bacalar-Buenavista) y norte (Buenavista-Pedro Antonio de los Santos). Esta división se hizo para tener recorridos aproximadamente iguales en cada día de muestreo porque es prácticamente imposible recorrer toda la Laguna de Bacalar en un solo día al realizar el muestreo; de manera adicional, las zonas sur y centro tienen mayor actividad turística. De junio de 2012 a agosto 2013 realizamos nueve salidas de campo, cada una de tres días consecutivos; hicimos el conteo de los gavilanes caracoleros y las correas a lo largo de ambas riberas de la laguna. Se iniciaba siempre por el oeste (W) y terminábamos en el este (E), para tener mejor iluminación y disminuir el contraluz que dificulta la identificación de juveniles y hembras de gavilán. Para evitar el sesgo en los transectos, descritos a continuación, comenzábamos a navegar una vez hacia el norte y la siguiente hacia el sur y de esta forma la hora en que se pasaba por cada transecto era diferente. De manera similar, la primer salida de campo comenzó en la zona sur y al día siguiente el centro y después el norte; en la siguiente salida comenzamos en el centro y así sucesivamente. En cada una de las tres zonas, con ayuda de un GPS Garmin, ubicamos aleatoriamente 12 transectos de 500 m de longitud de los cuales la mitad (seis) estuvieron en cada ribera, de esta manera son 36 transectos de 500 m en toda la Laguna de Bacalar para un total de 18,000 m de transecto por muestreo (Figura 1). Recorrimos los transectos en lancha a una velocidad constante de 10 km/h (3 min por transecto), con dos observadores, anotando el número de gavilanes caracoleros (incluyendo sexo y edad) y la cantidad de correas, esto es, 72 min de observación en cada muestreo. Realizamos una salida de campo adicional en enero de 2013 en la cual no pudimos hacer los transectos y sólo obtuvimos información de número, sexo y edad de los individuos de gavilanes avistados, y el número de correas. Agrupamos por temporadas climáticas locales (secas correspondiente a marzo y mayo 2013), lluvias junio, julio 2012 y agosto 2013 y nortes a octubre, noviembre 2012 y enero 2013.
Realizamos las observaciones entre las 08:00 y las 15:00 h (comenzábamos 1.5 h-2.0 h después de la salida del sol), utilizamos binoculares (10 x 50). Para el caso de los gavilanes registramos la edad y sexo (en los adultos), de acuerdo con las guías de Howell y Webb (1995) y Sibley (2003), siguiendo sus características morfológicas externas. En las correas no es posible hacer esta diferencia entre edades y sexos porque los individuos son similares (Howell y Webb 1995).
Se ha reportado que los gavilanes desechan las conchas sin dañarlas en el exterior y generalmente al pie de un árbol o poste, esto se conoce como percha de alimentación (Estela y Naranjo 2005). Mientras que las correas dejan un orificio en la voluta mayor de la concha (Snyder y Snyder 1969, Estela y Naranjo 2005). Identificamos 16 sitios de acumulación de conchas y su posición fue registrada con GPS. No encontramos evidencia de que esos sitios de acumulación correspondieran de manera exclusiva, ya sea a gavilanes o a correas pues había tanto conchas intactas como con orificio, por ello consideramos que todas las conchas colectadas y medidas (longitud sifonal en milímetros) correspondieron a la dieta en general de conjunto de ambas especies. En cada salida de campo se colectaron todas las conchas vacías que se encontraban en esos sitios.
Las abundancias fueron los promedios de los conteos de los gavilanes y de las correas observadas en los transectos por la longitud total de la orilla de la Laguna de Bacalar (abundancia extrapolada). De manera complementaria, realizamos comparaciones de las abundancias estimadas entre zonas de la laguna (norte, centro y sur) y entre temporadas (secas, lluvias y nortes), así como entre lados de la laguna (W y E). Las conchas colectadas se lavaron y secaron. Medimos la longitud sifonal (mm) utilizando un vernier digital. Los caracoles vivos, disponibles en los sitios, se capturaron y los medimos de su longitud sifonal (mm), los liberamos en el mismo sitio. Para la comparación estadística utilizamos la prueba de t pareada con un nivel de significancia del 95%. Aplicamos la prueba de Chi cuadrada (χ²) para determinar diferencias entre las abundancias de adultos y de juveniles, y para machos y hembras, usamos la corrección de Yates (
Resultados
Ambas especies se distribuyen a lo largo de la Laguna de Bacalar. Las abundancias mayores de gavilanes las registramos en agosto de ambos años (2012-2013), en tanto para las correas fueron en septiembre y octubre de 2012.
Rostrhamus sociabilis
Registramos un total de 319 gavilanes caracoleros en los muestreos con transectos. La abundancia extrapolada promedio mensual fue de 63.3 ± 46.2 individuos (Figura 2). Los separamos por edades y correspondieron a 181 adultos, 87 juveniles y 66 individuos indeterminados. Para analizar las proporciones entre juveniles y adultos excluimos a los indeterminados, de esta manera registramos un mayor número de adultos con 68% y 32% de juveniles (

Figura 2 Abundancia extrapolada de gavilanes caracoleros (Rostrhamus sociabilis) en la Laguna de Bacalar, Quintana Roo.
De acuerdo con la proporción entre machos y hembras por temporada; el mayor número de machos fue en secas con 67% y 33% hembras. Sin embargo hubo una proporción muy alta de individuos a los cuales no pudimos asignar sexo o edad, la diferencia no fue significativa (
Encontramos que los gavilanes siempre estuvieron presentes en las tres zonas (norte, centro y sur) en la Laguna de Bacalar. La abundancia de los gavilanes no varió entre los meses. Las medias de las abundancias de gavilanes registrados en cada temporada climática (secas, lluvias y nortes) no fueron diferentes (H = 2,9; P = 0.327) (Figura 4). Asimismo, comparamos las abundancias extrapoladas mensuales en cada lado de la Laguna (W y E), pero no hubo diferencias significativas (t10 = 0.138, P = 0.893) para ambas riberas.
Aramus guarauna
Registramos un total de 339 correas en los transectos. La abundancia extrapolada promedio mensual fue de 73.3 ± 82.8 individuos (Figura 3). Separamos las abundancias mensuales por zonas y las correas siempre estuvieron presentes en toda la Laguna de Bacalar. Sólo en noviembre de 2012 (H = 2,36; P = 0.01) encontramos que la “zona centro” fue significativamente diferente de la zona norte y sur. Las medianas de las abundancias de correas no variaron entre temporadas climática (secas, lluvias y nortes) (H = 2,9; P = 0.29) (Figura 5). Y tampoco las abundancias variaron en ambos lados de la laguna (t10 = -0.13, P = 0.89).

Figura 4 Abundancias de gavilanes caracoleros (Rostrhamus sociabilis) en la Laguna de Bacalar, Quintana Roo por temporada climática 2012-2013. Se indica la mediana y las líneas muestran las abundancias máximas y mínimas.
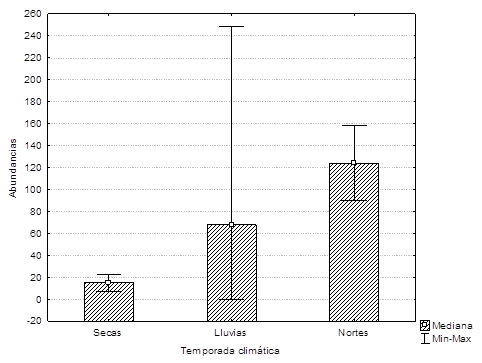
Figura 5 Abundancia de correas (Aramus guarauna) en la Laguna de Bacalar por temporada climática 2012-2013. Se indica la mediana y las líneas muestran las abundancias máximas y mínimas.

Figura 6 Juvenil (Rostrhamus sociabilis) perchado. Laguna de Bacalar, Quintana Roo (foto: J. Correa Sandoval 7/6/2012).

Figura 7 Macho (Rostrhamus sociabilis) perchado. Laguna de Bacalar, Quintana Roo (foto: J. Correa Sandoval 11/7/2012).

Figura 8 Hembra (Rostrhamus sociabilis) perchada. Laguna de Bacalar, Quintana Roo (foto: J. Correa Sandoval 31/8/2012).
Alimentación
En total colectamos 4,312 conchas de caracoles durante todo el muestreo y se obtuvieron 17,419 caracoles vivos. La longitud sifonal promedio de los caracoles consumidos fue de 37 ± 0.56 (n = 4312), el rango estuvo entre 17 mm y 55 mm. De los caracoles capturados vivos, la longitud sifonal promedio fue 33 ± 2.82 mm (Cuadro 1). El tamaño de los caracoles vivos y disponibles en el ambiente no fue diferente de los caracoles seleccionados y ya consumidos por los gavilanes y correas (t7 = -2.08; P= 0.08).
Cuadro 1 Tamaño promedio mensual en mm y su desviación estándar de los caracoles (Pomacea flagellata) depredados y disponibles en el ambiente capturados vivos en la Laguna de Bacalar, Quintana Roo. Los valores entre paréntesis representa el número total de caracoles obtenidos en cada mes.
| Meses | Depredados | Vivos |
|---|---|---|
| Jun 2012 | 35 ± 5.68 (1142) | 35 ± 6.55 (474) |
| Jul 2012 | 40 ± 4.24 (571) | 35 ± 7.20 (1081) |
| Ago 2012 | 39 ± 4.26 (324) | 36 ± 5.46 (4507) |
| Sep 2012 | 37 ± 4.53 (272) | 36 ± 4.89 (4144) |
| Oct 2012 | 36 ± 4.47 (360) | 37 ± 4.84 (5086) |
| Nov 2012 | 35 ± 4.38 (623) | * |
| Dic 2012 | * | 35 ± 4.89 (833) |
| Ene 2013 | * | 33 ± 8.63 (557) |
| Feb 2013 | * | 28 ± 11.56 (276) |
| Mar 2013 | 38 ± 3.84 (388) | 25 ± 12.57 (139) |
| Abr 2013 | * | 32 ± 10.80 (122) |
| May 2013 | 37 ± 5.01 (197) | 32 ± 7.68 (200) |
| Ago 2013 | 41 ± 5.18 (435) | * |
| Total | 37 ± 0.56 (4312) | 33 ± 2.82 (17419) |
* Sin datos de conchas.
Discusión
Se ha reportado que el gavilán y la correa se alimentan casi exclusivamente de los gasterópodos del género Pomacea (Magalhães 1990, Estela y Naranjo 2005, Corrales-Gómez 2006, Palomera et al. 2009, Pineda et al. 2012, Carmona et al. 2012). Sin embargo, Magalhães (1990) observó que los gavilanes consumían cangrejos grandes (Dilocarcinus pagei) debido al mayor aporte energético. Por otro lado Veiga y colaboradores (2009) confirman que el gavilán se alimenta de cangrejos (Chasmagnathus granulata) en condiciones especiales (abundantes lluvias o sequías extremas), y plantean la posibilidad de consumo ocasional de tortuga de Laguna (Phrynops hilarii). En este estudio sólo observamos a los gavilanes y correas capturando caracoles, no los vimos alimentándose de otro recurso.
Estela y Naranjo (2005) plantean que las correas hacen una perforación en la voluta más grande de la concha y, una vez consumido el caracol dejan las conchas vacías dispersas en la orilla; este comportamiento no se pudo observar en este estudio. Sin embargo, documentamos que, en algunos casos, no perforan la concha. Asimismo, detectamos que los gavilanes no tienen perchas habituales y utilizan cualquier rama o poste cercano para alimentarse una vez capturado el caracol. Estela y Naranjo (2005) reportaron que las perchas son utilizadas por todos los gavilanes y que no son defendidas por algunos de ellos. En el caso de las correas, los mismos autores plantean que éstas no defienden los sitios donde comen, después de que capturan el caracol vuelan hacia la orilla a consumirlo; en la Laguna de Bacalar durante este estudio observamos este mismo comportamiento. Magalhães (1990) encontró que los gavilanes consumen principalmente caracoles grandes (≥ 25.1 mm) y de tamaño medio (15.1 - 25.0 mm). Nuestros resultados concuerdan con Estela y Naranjo (2005) donde mencionan que los gavilanes y correas no presentan selección de presa sino cada uno consume caracoles de los tamaños más frecuentes del ambiente donde se alimenta. Sería necesario realizar un monitoreo a largo plazo para tener datos de consumo por separado y poder estimar las tallas preferidas de cada especie.
A pesar de que el gavilán caracolero es un ave residente, y durante este estudio recorrimos en su totalidad la Laguna de Bacalar, no localizamos nido alguno. Sin embargo, en agosto del 2016 hubo un reporte de anidación en un islote (Baier 2016). Cuando hay nidos de gavilanes caracoleros es relativamente fácil observarlos y forman colonias laxas en donde puede haber nidos de diferentes parejas de manera simultánea y los adultos sobrevuelan de manera constante la zona. En Florida, la anidación de los gavilanes es durante la estación seca (Sykes 1987), con el máximo de puestas en promedio 81 días antes del inicio de las lluvias. Rodgers y Schwikert (2003), reportan para Florida el 27 de abril ± 36 días como el promedio para la puesta de huevos de gavilán caracolero. Entonces es posible encontrar actividad de anidación desde fines de marzo hasta principios de mayo. En el estudio realizado en la costa del Pacífico central de México Hernández et al. (2013) observaron a algunos individuos adultos llevando ramas pequeñas en sus patas, pero no se registraron nidos. En Quintana Roo la temporada de seca es en los meses de febrero, marzo, abril y parte de mayo; hicimos los muestreos correspondientes sin observar actividades de anidación, aunque sí se registraron juveniles en esos meses, pero probablemente de la temporada anterior.
Por otra parte, la correa se encuentra como residente en el estado de Quintana Roo. En agosto de 2012 observamos a la correa con tres polluelos en la zona sur con coordenadas geográficas (18°39’35.3” N, 88°23’53.0” O). El hecho de no haber encontrado físicamente los nidos de correas se debe a que la mayoría de nuestros recorridos los hicimos en lancha y no caminando en los humedales. Corrales-Gómez (2006), encontró un aumento de número de correas en febrero (seca) y la menor densidad en enero y abril, debido a que el nivel del agua disminuye y por tanto hay mayor cantidad de alimento disponible. Lo anterior no concuerda con los resultados obtenidos en este estudio, dado que la mayor abundancia de correas la registramos en septiembre y octubre de 2012 (temporada de lluvias).
Aunque ambas especies de aves se reproducen en la región, es probable que el pico de abundancia observado durante el otoño boreal sea causado por individuos migratorios o de paso. Correa-Sandoval y MacKinnon (2011) reportan para Quintana Roo varias especies de aves (en su mayoría acuáticas) que tienen poblaciones residentes, pero cuyas poblaciones se incrementan con individuos que llegan durante su estancia migratoria o van de paso hacia Centroamérica o Sudamérica. Las abundancias de algunas de estas especies pueden incrementarse durante la primavera boreal, la cual corresponde a las secas (febrero, marzo, abril) por ejemplo playeros (Correa-Sandoval y Contreras-Balderas 2008). Desafortunadamente, por problemas logísticos no obtuvimos datos de censos de gavilanes ni correas de estos meses.
El gavilán caracolero se ha reportado como especie especialista en su alimentación y nómada por sus movimientos regionales (Sykes 1983, Bennetts y Kitchens 1997). Sin embargo, tales movimientos pueden tener varios disparadores u objetivos, por ejemplo la sequía del humedal o la baja abundancia de alimento. Sin embargo Bennetts y Kitchens (2000) describen movimientos de dispersión que podrían estar favorecidos por la abundancia de alimento. De acuerdo con Weller (1999) el movimiento durante ese periodo podría ayudar a las aves de humedal a reconocer la región y prepararles para responder rápido cuando ocurra un cambio catastrófico. El mismo autor menciona que hay varias especies de aves de humedal que recurren a esta estrategia de movimiento en donde al mismo tiempo pueden ser nómadas pero todavía pueden ser migratorios de larga distancia. Esto correspondería a lo observado en este estudio en donde llegan aves de otros humedales de la región e incrementan temporalmente las abundancias locales.
Los pobladores de las comunidades cercanas a la Laguna de Bacalar capturan grandes cantidades de caracoles chivitas para su consumo. Sin embargo, no hay una cuantificación de la extracción de esta especie porque es una actividad dispersa a lo largo de la laguna y tampoco se reporta. Solamente hay información de antes de 2009 que indica que se recolectaban 120 kg diarios equivalentes a 200 caracoles (Oliva-Rivera et al. 2016). Sin embargo, no se conoce el impacto que esta actividad tiene sobre las poblaciones de gavilanes caracoleros y correas. Recomendamos realizar estudios detallados sobre la ecología reproductiva y alimenticia de estas dos especies de aves para obtener información que pueda ser contrastada con estudios de consumo humano de los caracoles chivita en la Laguna de Bacalar y proponer medidas de manejo y conservación.











 nueva página del texto (beta)
nueva página del texto (beta)





