Introducción
La urbanización puede definirse como el proceso demográfico en el que las ciudades en todo el mundo se están expandiendo (McDonald et al. 2008). Este proceso se ha acelerado en el último siglo y se estima que crece en 1.1% cada año, lo cual causa que las áreas urbanas sean cada vez más comunes (ONU 2017). Las áreas urbanas presentan una serie de retos para las plantas y animales que se encuentran dentro de ellas. En comparación a los ecosistemas naturales, tienen mayores niveles de dióxido de carbono, mayores promedios de temperatura al año y mayores niveles de contaminación (Breza 2015). A pesar de esto, las áreas urbanas pueden representar hábitats efímeros o permanentes para algunas especies, servir como corredores para el paso de animales o funcionar como sitios de descanso para especies migratorias (Gaston et al. 2005).
En las áreas urbanas, los parches de vegetación remanente nativa o exótica, son importantes, y representan un sitio donde las aves pueden obtener refugio y beneficiarse del volumen de vegetación. Además, obtienen alimento que proviene principalmente de árboles frutales introducidos, lo cual beneficia tanto a especies residentes como a migratorias (Martin 1985, Savard et al. 2000, Nielsen et al. 2013). De esta manera, los espacios que no sean propiamente un área verde, pero que tienen suficiente cobertura arbórea son útiles para la avifauna, ya que ofrecen un hábitat potencial para ella, y además proveen un espacio de fácil acceso para estudiar sus interacciones y adaptaciones a las áreas urbanas (Gavareski 1976, Beissinger y Osborne 1982).
En El Salvador, la alta densidad poblacional ha provocado la destrucción de hábitats naturales, en consecuencia ha cambiado la zoogeografía nacional, de tal manera que las especies son desplazadas de sus hábitats naturales hacia áreas semiurbanas y urbanas (Daugherty 1972, Cortez de Galán et al. 1994). Dentro del área urbana de San Salvador, la Universidad de El Salvador (UES) representa un área importante, ya que cuenta con espacios ocupados por árboles y arbustos de tamaño suficiente para proveer de refugio y alimento a las aves. En la UES se han realizado investigaciones sobre la avifauna (Cortez de Galán et al. 1994, Perla y Salazar 2007, Vides-Hernández et al. 2017), pero todas tienen como principal limitante el poco tiempo destinado a realizar los muestreos. El objetivo de este estudio fue actualizar el conocimiento de las especies de aves en la Universidad de El Salvador e identificar qué especies hacen uso del sitio para alimentación, nidificación o descanso.
Métodos
Ubicación del sitio de estudio
La UES se encuentra ubicada en el municipio de San Salvador, departamento de San Salvador, en las coordenadas: 13°43’ N y 89°12’ O, a una altura de 710 msnm (Google Earth 2018, Figura 1). Se trata de la única universidad estatal del país, con un promedio aproximado de 55,000 estudiantes al año (periodo 2008-2017) y representa el centro de educación superior con mayor afluencia estudiantil en El Salvador (Macal 1976, UES 2018). Posee un área total de 41.97 ha, de las cuales un 36.38% (15.27 ha) está cubierto por vegetación arbórea, según datos calculados a partir de la imagen satelital de Google Earth.
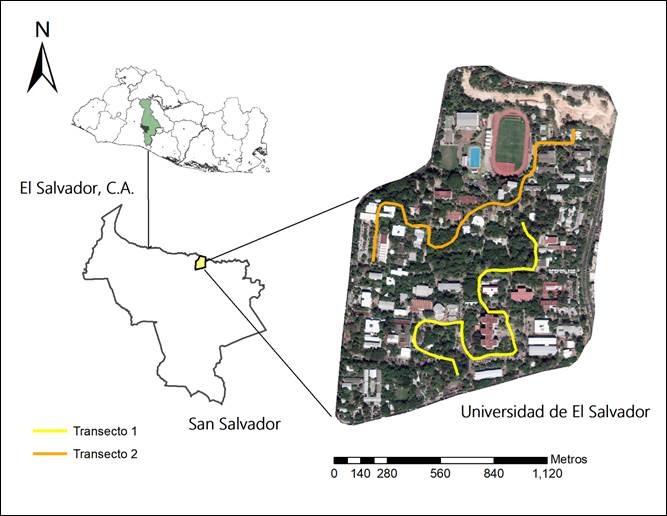
Figura 1 Ubicación de la Universidad de El Salvador y de los dos transectos establecidos, municipio de San Salvador, departamento de San Salvador.
De acuerdo con la clasificación de las formas de la vegetación de El Salvador (Lauer 1954) el campus universitario (altura<1000 msnm) comprende las formaciones de tierra cálida y caliente, con vegetación de sabanas húmedas y bosques semihúmedos caducifolios. En la actualidad se encuentran algunas especies remanentes de esa vegetación como: madrecacao (Gliricida sepium), laurel (Cordia alliodora), cortez blanco (Tabebuia chrysantha), aceituno (Simarauba glacua), ceiba (Ceiba pentandra), conacaste (Enterolobium cyclocarpum) y carreto (Samanea saman). Así mismo especies frutales introducidas, como mango (Mangifera indica), guayaba (Psidium guajava) y marañón (Anacardium occidentale). Y otras especies introducidas, como: llama del bosque (Spathodea campanulata), eucalipto (Eucalyptus spp.), y calistemo (Callistemon citrinus), entre otras.
Muestreos
Establecimos dos transectos de 1 km de longitud cada uno, distribuidos de tal forma que cubrieran la mayor cantidad de zonas arbóreas disponibles dentro de la UES, evitando que se traslaparan entre sí. Lo anterior para disminuir la probabilidad de reconteo de individuos (Figura 1). Realizamos un muestreo mensual durante un año, desde febrero de 2017 a enero de 2018. Cada muestreo se realizó por una hora y media (06:30 am a 08:00 am). Utilizamos la metodología de búsqueda intensiva, la cual consiste en recorrer el sitio de estudio a través de transectos en busca de aves. Esta metodología facilita la detección de especies silenciosas y permite su identificación a través de inspección visual, de cantos o llamados, además, permite la cuantificación de individuos por especie (Ralph et al. 1996). Para la observación de las aves utilizamos binoculares Eagle OpticS 10 x 42, Kahles 10 x 42 y Canon 8 x 40. Para corroborar la identificación utilizamos la guía de campo Field Guide to Birds of Northern Central America (Fagan y Komar 2016). Además, registramos el comportamiento de alimentación de cada individuo y si se encontraba en actividades de anidación (construcción de nido u observación directa del ave en el nido).
Análisis de resultados
Para la realización de los análisis sumamos los registros de abundancia para cada especie en los dos transectos definidos. Promediamos las observaciones realizadas durante los 12 muestreos y los presentamos en el Cuadro 1 de composición de especies para el sitio. Además graficamos de acuerdo con su estacionalidad las especies registradas y presentamos los valores mensuales de la abundancia de especies utilizando el paquete estadístico R (R Core Team 2017). Para conocer la estructura del ensamblaje de aves en el sitio de estudio realizamos una curva de rango-abundancia.
Cuadro 1 Número de registros de especies durante el periodo de muestreo (febrero 2017 a enero 2018). Las columnas de abundancia han sido ordenadas desde febrero (F) hasta enero (E) sin interrupción. EST: Estacionalidad. R: Residente; RM: Residente y Migratorio; M: Migratorio; T: Transeúnte; VR: Visitante Reproductor.
Categoría de Conservación; SC: Sin Categoría; A: Amenazada; EP: En Peligro; PM: Preocupación Menor; NE: No evaluado. CAT: Categoría de Conservación. MARN: Ministerio de Medio Ambiente y Recursos Naturales.
UICN: Unión Internacional para la Conservación de la Naturaleza.
|
ORDEN
Familia Especie |
CAT. MARN/ UICN | EST | MESES |
( |
|||||||||||
| F | M | A | M | J | J | A | S | O | N | D | E | ||||
| COLUMBIFORMES | |||||||||||||||
| Columbidae | |||||||||||||||
| Columba livia 1,2 | SC/PM | R | 6 | 3 | 5 | 4 | 0 | 6 | 3 | 2 | 13 | 6 | 9 | 1 | 4.83±3.59 |
| Patagioenas flavirostris 2 | SC/PM | R | 7 | 7 | 7 | 6 | 1 | 1 | 3 | 0 | 0 | 1 | 2 | 6 | 3.42±2.94 |
| Columbina talpacoti 1,2 | SC/PM | R | 4 | 3 | 16 | 6 | 7 | 15 | 31 | 32 | 4 | 1 | 13 | 2 | 11.17±10.74 |
| Zenaida asiatica 1,2 | SC/PM | RM | 25 | 37 | 16 | 37 | 32 | 48 | 10 | 18 | 29 | 14 | 39 | 21 | 27.17±11.73 |
| CUCULIFORMES | |||||||||||||||
| Cuculidae | |||||||||||||||
| Piaya cayana | SC/PM | R | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.08±0.29 |
| APODIFORMES | |||||||||||||||
| Apodidae | |||||||||||||||
| Chaetura vauxi | SC/PM | R | 3 | 2 | 7 | 6 | 2 | 3 | 13 | 2 | 1 | 0 | 0 | 0 | 3.25±3.79 |
| Trochilidae | |||||||||||||||
| Archilocus colubris 1 | SC/PM | M | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 2 | 1 | 0.58±0.99 |
| Amazilia rutila 1 | SC/PM | R | 2 | 6 | 3 | 3 | 0 | 7 | 5 | 4 | 4 | 6 | 7 | 3 | 4.17±2.12 |
| CATHARTIFORMES | |||||||||||||||
| Cathartidae | |||||||||||||||
| Coragyps atratus | SC/PM | RM | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 5 | 0.58±1.44 |
| Cathartes aura | SC/PM | RM | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 2 | 0.50±1.00 |
| ACCIPITRIFORMES | |||||||||||||||
| Accipitridae | |||||||||||||||
| Rupornis magnirostris | SC/PM | R | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0.08±0.29 |
| Buteo plagiatus | SC/PM | R | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 2 | 0.58±0.67 |
| CORACIFORMES | |||||||||||||||
| Momotidae | |||||||||||||||
| Momotus lessonii 1 | SC/PM | R | 2 | 0 | 4 | 3 | 4 | 2 | 5 | 2 | 4 | 1 | 2 | 3 | 2.67±1.43 |
| Eumomota superciliosa 1,2 | SC/PM | R | 5 | 0 | 5 | 2 | 3 | 7 | 5 | 2 | 3 | 4 | 4 | 6 | 3.83±1.95 |
| PICIFORMES | |||||||||||||||
| Ramphastidae | |||||||||||||||
| Pteroglossus torquatus 1 | SC/PM | R | 1 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0.33±0.49 |
| Picidae | |||||||||||||||
| Melanerpes aurifrons 1,2 | SC/PM | R | 4 | 6 | 3 | 5 | 6 | 5 | 3 | 5 | 6 | 5 | 13 | 7 | 5.67±2.60 |
| Sphyrapicus varius 1 | SC/PM | M | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.17±0.39 |
| Colaptes rubiginosus 1,2 | SC/PM | R | 3 | 0 | 2 | 2 | 2 | 1 | 3 | 2 | 2 | 0 | 1 | 0 | 1.50±1.09 |
| FALCONIFORMES | |||||||||||||||
| Falconidae | |||||||||||||||
| Falco peregrinus | SC/PM | M | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.08±0.29 |
| PSITTACIFORMES | |||||||||||||||
| Psittacidae | |||||||||||||||
| Eupsittula canicularis | A/PM | R | 0 | 0 | 0 | 0 | 12 | 2 | 2 | 0 | 6 | 2 | 0 | 2 | 2.17±3.56 |
| Psittacara strenuus | A /NE | R | 5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.42±1.44 |
| Brotogeris jugularis 1 | A /PM | R | 17 | 21 | 20 | 43 | 18 | 65 | 38 | 30 | 39 | 19 | 7 | 28 | 28.75±15.57 |
| Amazona auropalliata 1 | EP/EP | R | 4 | 0 | 2 | 0 | 3 | 2 | 3 | 2 | 1 | 0 | 2 | 4 | 1.92±1.44 |
| PASSERIFORMES | |||||||||||||||
| Tyrannidae | |||||||||||||||
| Contopus cooperi 1 | SC/PM | T | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0.17±0.39 |
| Contopus cinereus 1 | SC/PM | R | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.08±0.29 |
| Empidonax flaviventris 1 | SC/PM | M | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0.08±0.29 |
| Pitangus sulphuratus 1 | SC/PM | R | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0.33±0.49 |
| Megarynchus pitangua 1 | SC/PM | R | 1 | 0 | 5 | 1 | 0 | 1 | 1 | 2 | 1 | 1 | 0 | 2 | 1.25±1.36 |
| Myiozetetes similis 1,2 | SC/PM | R | 4 | 5 | 2 | 5 | 8 | 8 | 4 | 11 | 5 | 4 | 3 | 7 | 5.50±2.54 |
| Myiodinastes luteiventris 1 | SC/PM | VR | 0 | 1 | 1 | 0 | 0 | 3 | 0 | 2 | 0 | 0 | 0 | 0 | 0.58±0.99 |
| Tyrannus melancholicus 1,2 | SC/PM | R | 10 | 8 | 13 | 1 | 2 | 10 | 6 | 10 | 8 | 10 | 3 | 8 | 7.42±3.70 |
| Tyrannus verticalis 1 | SC/PM | M | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.08±0.29 |
| Tyrannus forficatus 1 | SC/PM | M | 1 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 9 | 1.33±2.67 |
| Vireonidae | |||||||||||||||
| Vireo gilvus 1 | SC/PM | M | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.17±0.58 |
| Hirundinidae | |||||||||||||||
| Progne chalybea | SC/PM | R | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 10 | 0 | 0 | 1.00±2.86 |
| Stelgidopteryx serripennis 2 | SC/PM | R | 1 | 4 | 2 | 5 | 0 | 2 | 0 | 2 | 2 | 4 | 2 | 1 | 2.08±1.56 |
| Hirundo rustica | SC/PM | M | 1 | 1 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 4 | 1 | 1.25±1.71 |
| Troglodytidae | |||||||||||||||
| Troglodytes aedon | SC/PM | R | 0 | 8 | 1 | 1 | 1 | 2 | 1 | 1 | 0 | 0 | 0 | 0 | 1.25±2.22 |
| Campylorhynchus rufinucha 1,2 | SC/PM | R | 14 | 3 | 11 | 13 | 12 | 12 | 15 | 6 | 13 | 7 | 11 | 10 | 10.58±3.55 |
| Cantorchilus modestus | SC/PM | R | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0.33±0.49 |
| Turdidae | |||||||||||||||
| Catharus ustulatus 1 | SC/PM | M | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.17±0.58 |
| Turdus grayi 1,2 | SC/PM | R | 7 | 26 | 6 | 29 | 37 | 21 | 29 | 23 | 9 | 13 | 12 | 14 | 18.83±10.07 |
| Fringillidae | |||||||||||||||
| Euphonia affinis 1 | SC/PM | R | 4 | 2 | 3 | 2 | 5 | 3 | 7 | 6 | 6 | 2 | 1 | 2 | 3.58±1.97 |
| Spinus psaltria 1 | SC/PM | R | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 2 | 1 | 0 | 3 | 0 | 0.67±1.07 |
| Icteridae | |||||||||||||||
| Icterus spurius 1 | SC/PM | M | 0 | 18 | 0 | 0 | 0 | 0 | 2 | 1 | 3 | 8 | 14 | 7 | 4.42±6.13 |
| Icterus pustulatus 1,2 | SC/PM | R | 0 | 5 | 0 | 0 | 0 | 0 | 1 | 0 | 3 | 1 | 8 | 3 | 1.75±2.56 |
| Icterus pectoralis 1 | SC/PM | R | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0.17±0.58 |
| Icterus gularis 1 | SC/PM | R | 3 | 2 | 3 | 2 | 1 | 6 | 6 | 0 | 1 | 0 | 1 | 3 | 2.33±2.02 |
| Icterus galbula 1 | SC/PM | M | 3 | 13 | 3 | 0 | 0 | 0 | 0 | 1 | 6 | 3 | 8 | 3 | 3.33±3.96 |
| Molothrus aeneus 1 | SC/PM | R | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0.17±0.39 |
| Dives dives 1,2 | SC/PM | R | 18 | 18 | 9 | 10 | 11 | 15 | 15 | 12 | 14 | 8 | 8 | 11 | 12.42±3.55 |
| Quiscalus mexicanus 1,2 | SC/PM | R | 14 | 10 | 13 | 18 | 36 | 37 | 27 | 28 | 44 | 24 | 28 | 13 | 24.33±10.98 |
| Parulidae | |||||||||||||||
| Oreothlypis peregrina 1 | SC/PM | M | 0 | 24 | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 9 | 28 | 9 | 6.17±9.92 |
| Setophaga ruticilla 1 | SC/PM | M | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 2 | 0.42±0.67 |
| Setophaga petechia 1 | SC/PM | M | 3 | 7 | 2 | 0 | 0 | 0 | 0 | 13 | 8 | 8 | 6 | 6 | 4.42±4.23 |
| Cardinalidae | |||||||||||||||
| Piranga rubra 1 | SC/PM | M | 1 | 5 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 4 | 7 | 1 | 1.58±2.39 |
| Piranga ludoviciana 1 | SC/PM | M | 0 | 2 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 4 | 0.75±1.29 |
| Pheucticus ludovicianus | SC/PM | M | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.08±0.29 |
| Spiza americana | SC/PM | M | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0.08±0.29 |
| Thraupidae | |||||||||||||||
| Thraupis episcopus 1 | SC/PM | R | 2 | 2 | 4 | 6 | 2 | 3 | 4 | 0 | 0 | 0 | 5 | 6 | 2.83±2.21 |
| Thraupis abbas 1 | SC/PM | R | 3 | 5 | 1 | 2 | 0 | 4 | 3 | 6 | 1 | 0 | 8 | 3 | 3.00±2.45 |
| Sporophila torqueola 1 | SC/PM | R | 0 | 1 | 1 | 2 | 0 | 2 | 2 | 1 | 0 | 0 | 0 | 0 | 0.75±0.87 |
| Saltator atriceps | SC/PM | R | 7 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.58±2.02 |
| Saltator coerulescens 1 | SC/PM | R | 3 | 4 | 7 | 10 | 10 | 6 | 5 | 7 | 5 | 6 | 9 | 3 | 6.25±2.45 |
1 Se alimenta en la Universidad.
2 Nidifica en la Universidad.
Determinamos la estacionalidad de las aves, de acuerdo con lo propuesto por Ibarra (2013), donde una especie se considera Residente (R) cuando su anidación y reproducción está confirmada en El Salvador; Residente y Migratoria (RM) cuando existe una población reproductora pero también una población migratoria; Migratoria (M) cuando viaja a los trópicos durante la estación seca y periodos de transición; Transeúnte (T) cuando viaja de paso y utiliza el país solamente para llegar a sus territorios de estancia neotropical; Visitante Reproductor (VR) cuando migra desde Sudamérica para reproducirse en América Central.
Utilizamos la taxonomía propuesta por la American Ornithological Society (AOS 2018), e incluimos los últimos cambios realizados en 2017 (Chesser et al. 2017). Para las categorías de conservación nacional utilizamos la del Ministerio de Medio Ambiente y Recursos Naturales de El Salvador (MARN 2015) y para nivel mundial la de Unión Internacional para la Conservación de la Naturaleza (UICN) (BirdLife 2017).
Realizamos una búsqueda de artículos publicados y documentos no publicados relacionados con la riqueza de aves de la UES (Cortez de Galán et al. 1994, Perla y Salazar 2007, Vides-Hernández et al. 2017). Además, revisamos la colección de referencia del Museo de la Escuela de Biología de la UES. Por último, consultamos las observaciones registradas en la plataforma virtual eBird para el sitio de estudio (eBird 2018), consideramos sólo los registros anteriores al periodo de estudio. Del listado de esta plataforma excluimos: (1) especies que se han registrado en el campus, cuya distribución natural no corresponde al país (como Amazona autumnalis), ya que probablemente se trate de individuos que escaparon de casas aledañas; (2) especies cuya distribución natural no es el área de estudio y no se cuenta con evidencia de su presencia (como Patagioenas fasciata); y (3) especies que fueron observadas desde el campus, pero no dentro de éste, es decir, a varios kilómetros de distancia (como Buteo swainsonii).
Resultados
Registramos 64 especies de aves distribuidas en 21 familias. Las especies con mayor número de observaciones fueron Brotogeris jugularis (28.75/mes), Zenaida asiatica (27.17/mes) y Quiscalus mexicanus (24.33/mes), las cuales registramos durante todos los muestreos. Por el contrario, ocho especies, entre ellas Piaya cayana, Falco peregrinus, Empidonax flaviventris y Tyrannus verticalis, sólo las registramos en una ocasión, siendo septiembre el mes en el que registramos más especies poco comunes (Cuadro 1).
Las familias Tyrannidae (10) e Icteridae (8) fueron las que estuvieron representadas por el mayor número de especies. Por el contrario, cinco familias fueron representadas sólo por una especie: Cuculidae, Falconidae, Apodidae, Ramphastidae y Vireonidae.
Al analizar la estructura del ensamblaje de aves (utilizando la curva de rango abundancia), encontramos dominancia de siete especies: B. jugularis, Z. asiatica, Q. mexicanus, Turdus grayi, Dives dives, Columbina talpacoti y Campylorhynchus rufinucha (Figura 2) por sobre el resto de especies que se distribuyen de manera más equitativa. El 75% de las especies registradas (48) las observamos alimentándose o nidificando; y de estas, el 68.75% (33) solamente se alimentan, el 27.08% (13) realizan ambas actividades y el 4.17% (2) las registramos únicamente nidificando.
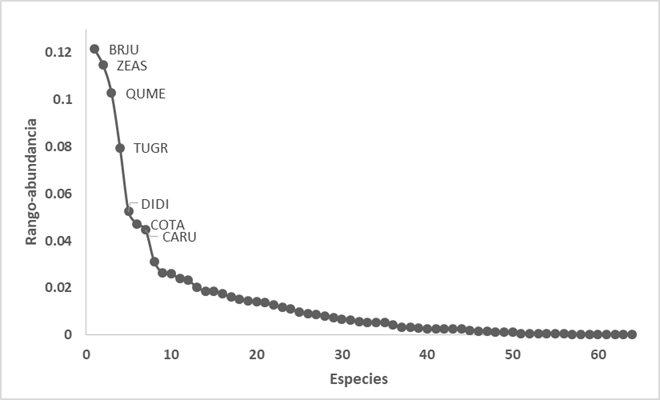
Figura 2 Curva de rango-abundancia de las especies registradas en la Universidad de El Salvador. BRJU: Brotogeris jugularis; ZEAS: Zenaida asiatica; QUME: Quiscalus mexicanus; TUGR: Turdus grayi; DIDI: Dives dives; COTA: Columbina talpacoti; CARU: Campylorhynchus rufinucha.
Con respecto a la estacionalidad de las especies registradas, la mayor riqueza corresponde a las especies residentes con 41, de éstas se destacan cuatro psitácidos: Eupsittula canicularis, Psittacara strenuus, B. jugularis y Amazona autopalliata. Las aves con estacionalidad migratoria estuvieron representadas por 18 especies, todas sin categoría especial de conservación local e internacional; entre ellas las especies con mayor número de observaciones en todo el estudio fueron Oreothlypis peregrina (6.17/mes), Icterus spuris (4.42/mes) y Setophaga petechia (4.42/mes). Cinco de las especies migratorias únicamente presentaron un individuo; dos las registramos en abril (Tyrannus verticalis y Pheucticus ludovicianus), dos en septiembre (Empidonax flaviventris y Spiza americana) y una en enero (Falco peregrinus).
En cuanto a las aves residentes/migratorias únicamente registramos tres especies (Z. asiatica, Cathartes aura y Coragyps atratus). Asimismo, registramos una especie con estacionalidad de visitante reproductor (Myiodinastes luteiventris) en marzo, abril, julio y septiembre. Sólo registramos una especie con estacionalidad transeúnte (Contopus cooperi) durante septiembre y octubre. De acuerdo con la asociación de las especies con el periodo de muestreo, la mayoría de las migratorias coinciden con el periodo de época seca en el país; ausentándose durante los meses de época lluviosa (Figura 3). Los meses en los que registramos mayor número de especies fueron enero (40) y abril (38), mientras que en julio registramos la menor riqueza (33). En relación al número de registros, julio fue el mes con más avistamientos (n = 304), mientras que febrero, abril (n = 192) y noviembre (n = 197) fueron los meses en que menos registros obtuvimos (Figura 4).
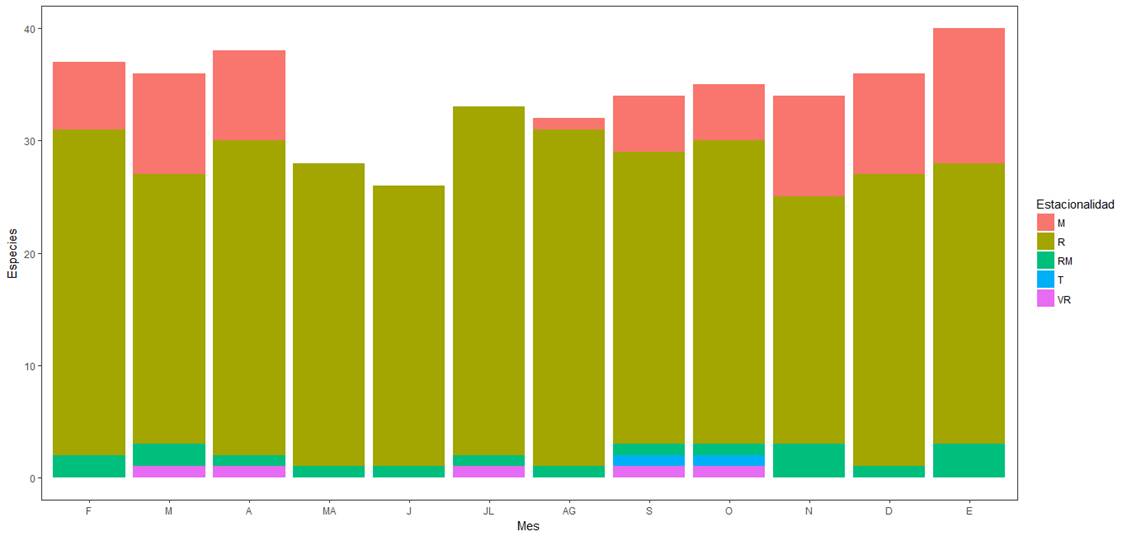
Figura 3 Distribución de las especies de acuerdo con su estacionalidad durante el periodo de estudio, desde febrero (F) 2017 hasta enero (E) 2018. R, Residente; RM, Residente y Migratorio; M, Migratorio; T, Transeúnte; VR, Visitante Reproductor.
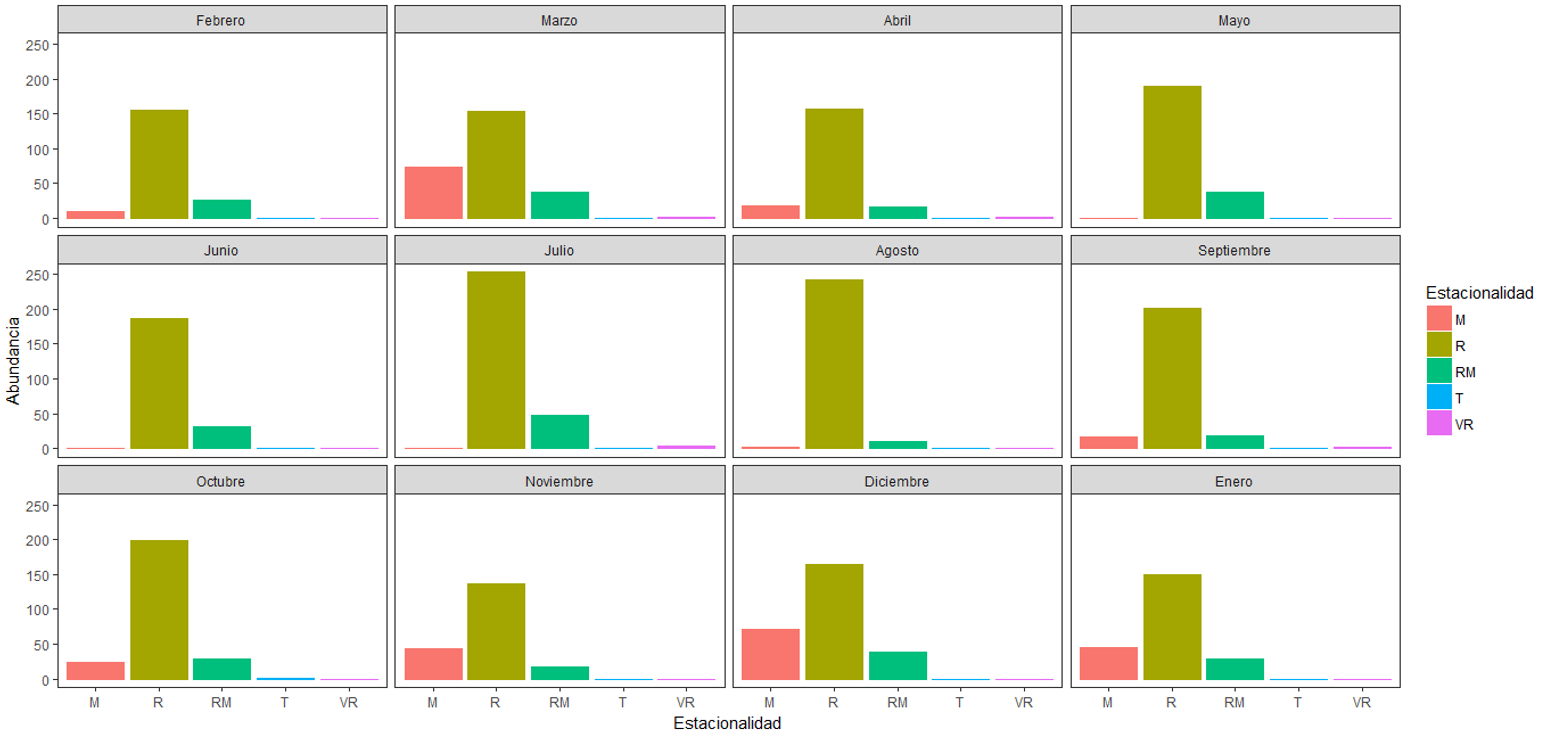
Figura 4 Abundancia de especies de acuerdo con su estacionalidad durante los 12 meses de muestreo. R, Residente; RM, Residente y Migratorio; M, Migratorio; T, Transeúnte; VR, Visitante Reproductor.
De acuerdo con los estudios y bases de datos consultados, revisamos cuatro fuentes de información, donde Cortez de Galán et al. (1994) registraron un total de 44 especies en tres meses de muestreo, Perla y Salazar (2007) registraron 49 especies en un tiempo no definido de muestreo; en el museo de la Escuela de Biología existen especímenes de 14 especies colectados desde 1980 a 2016, Vides-Hernández et al. 2017 en una semana de muestreo reportan 15 y en la plataforma eBird se reportan 86. Si incluimos estas especies registradas con nuestras observaciones, la riqueza de aves del campus universitario asciende a 100 especies (Cuadro 2).
Cuadro 2 Avifauna registrada en la Universidad de El Salvador.
| ORDEN Familia Especie |
Presente estudio 2017 | Cortez de Galán et al. 1994 | Perla y Salazar 2007 | Colección Museo Escuela de Biología (1980-2016) | Vides et al. 2017 | eBird |
|---|---|---|---|---|---|---|
| GALLIFORMES | ||||||
| Odontophoridae | ||||||
| Colinus cristatus | x | x | ||||
| COLUMBIFORMES | ||||||
| Columbidae | ||||||
| Columba livia | x | x | x | x | x | |
| Patagioenas flavirostris | x | x | x | x | ||
| Columbina inca | x | x | ||||
| Columbina talpacoti | x | x | x | x | x | |
| Zenaida asiatica | x | x | x | x | x | x |
| CUCULIFORMES | ||||||
| Cuculidae | ||||||
| Piaya cayana | x | x | ||||
| Crotophaga sulcirostris | x | |||||
| APODIFORMES | ||||||
| Apodidae | ||||||
| Streptoprocne zonaris | x | |||||
| Chaetura vauxi | x | x | x | |||
| Panyptila cayennensis | x | |||||
| Trochilidae | ||||||
| Archilocus colubris | x | x | x | |||
| Amazilia beryllina | x | |||||
| Amazilia rutila | x | x | x | x | x | x |
| PELECANIFORMES | ||||||
| Ardeidae | ||||||
| Butorides virescens | x | |||||
| CATHARTIFORMES | ||||||
| Cathartidae | ||||||
| Coragyps atratus | x | x | x | x | x | |
| Cathartes aura | x | x | x | |||
| ACCIPITRIFORMES | ||||||
| Accipitridae | ||||||
| Rupornis magnirostris | x | x | x | |||
| Buteo plagiatus | x | x | x | x | ||
| Buteo platypterus | x | |||||
| Buteo brachyurus | x | |||||
| Buteo albonotatus | x | |||||
| STRIGIFORMES | ||||||
| Strigidae | ||||||
| Glaucidium brasilianum | x | x | x | x | ||
| Ciccaba virgata | x | x | ||||
| CORACIFORMES | ||||||
| Momotidae | ||||||
| Momotus lessonii | x | x | x | x | x | x |
| Eumomota superciliosa | x | x | x | x | x | x |
| PICIFORMES | ||||||
| Ramphastidae | ||||||
| Pteroglossus torquatus | x | x | x | |||
| Picidae | ||||||
| Melanerpes aurifrons | x | x | x | x | x | |
| Sphyrapicus varius | x | x | x | |||
| Colaptes rubiginosus | x | x | ||||
| FALCONIFORMES | ||||||
| Falconidae | ||||||
| Falco sparverius | x | |||||
| Falco peregrinus | x | x | ||||
| PSITTACIFORMES | ||||||
| Psittacidae | ||||||
| Eupsittula canicularis | x | x | ||||
| Psittacara strenuus | x | x | x | x | ||
| Brotogeris jugularis | x | x | x | x | ||
| Amazona auropalliata | x | x | ||||
| PASSERIFORMES | ||||||
| Tyrannidae | ||||||
| Contopus cooperi | x | |||||
| Contopus sordidulus | x | |||||
| Contopus virens | x | |||||
| Contopus cinereus | x | x | ||||
| Empidonax flaviventris | x | x | ||||
| Empidonax minimus | x | |||||
| Pitangus sulphuratus | x | x | x | x | ||
| Megarynchus pitangua | x | x | x | |||
| Myiozetetes similis | x | x | x | x | ||
| Myiodinastes luteiventris | x | x | x | |||
| Tyrannus melancholicus | x | x | x | x | ||
| Tyrannus verticalis | x | x | x | |||
| Tyrannus tyrannus | x | |||||
| Tyrannus forficatus | x | x | x | x | ||
| Tityridae | ||||||
| Pachyramphus aglaiae | x | |||||
| Vireonidae | ||||||
| Cyclarhis gujanensis | x | |||||
| Vireo flavifrons | x | |||||
| Vireo solitarius | x | |||||
| Vireo gilvus | x | x | ||||
| Vireo flavoviridis | x | |||||
| Corvidae | ||||||
| Calocitta formosa | x | x | ||||
| Hirundinidae | ||||||
| Progne chalybea | x | x | x | |||
| Stelgidopteryx serripennis | x | x | x | x | ||
| Hirundo rustica | x | x | ||||
| Troglodytidae | ||||||
| Troglodytes aedon | x | x | x | |||
| Campylorhynchus rufinucha | x | x | x | x | x | x |
| Cantorchilus modestus | x | x | x | |||
| Polioptilidae | ||||||
| Polioptila caerulea | x | |||||
| Turdidae | ||||||
| Catharus ustulatus | x | |||||
| Turdus grayi | x | x | x | x | x | |
| Mimidae | ||||||
| Dumetella carolinensis | x | |||||
| Bombycillidae | ||||||
| Bombycilla cedrorum | x | |||||
| Passeridae | ||||||
| Passer domesticus | x | |||||
| Fringillidae | ||||||
| Euphonia affinis | x | x | x | x | ||
| Spinus psaltria | x | x | x | x | ||
| Icteridae | ||||||
| Icterus spurius | x | x | x | |||
| Icterus pustulatus | x | x | x | |||
| Icterus pectoralis | x | x | ||||
| Icterus gularis | x | x | x | x | x | |
| Icterus galbula | x | x | x | |||
| Molothrus aeneus | x | x | x | x | ||
| Dives dives | x | x | x | x | ||
| Quiscalus mexicanus | x | x | x | x | x | x |
| Parulidae | ||||||
| Parkesia noveboracensis | x | |||||
| Mniotilta varia | x | |||||
| Oreothlypis peregrina | x | x | x | x | ||
| Geothlypis poliocephala | x | |||||
| Setophaga citrina | x | |||||
| Setophaga ruticilla | x | x | x | |||
| Setophaga petechia | x | x | x | x | ||
| Setophaga virens | x | |||||
| Cardellina pusilla | x | |||||
| Cardinalidae | ||||||
| Piranga rubra | x | x | x | x | ||
| Piranga ludoviciana | x | x | x | |||
| Pheucticus ludovicianus | x | x | x | |||
| Passerina caerulea | x | |||||
| Passerina ciris | x | |||||
| Spiza americana | x | |||||
| Thraupidae | ||||||
| Thraupis episcopus | x | x | x | x | ||
| Thraupis abbas | x | x | x | x | x | |
| Volatinia jacarina | x | |||||
| Sporophila torqueola | x | x | x | x | ||
| Saltator atriceps | x | x | x | x | ||
| Saltator coerulescens | x | x | x | x | ||
Discusión
Con base en la riqueza que encontramos y considerando los estudios previos como el de Cortez de Galán et al. (1994) y Perla y Salazar (2007), registramos 14 nuevas especies para el campus universitario: Piaya cayana, Colaptes rubiginosus, F. peregrinus, E. canicularis, A. auropalliata, C. cooperi, C. cinereus, E. flaviventris, Megarynchus pitangua, Vireo gilvus, Hirundo rustica, Catharus ustulatus, Icterus pectoralis y S. americana, de las cuales tres especies: C. cooperi, C. ustulatus y S. americana no habían sido registradas en eBird.
Al analizar la estructura del ensamblaje, en relación con Cortez de Galán et al. (1994), encontramos un menor número de individuos de Patagioneas flavirostris (3.42/mes). Dicho estudio (Cortez de Galán et al. 1994) se realizó entre mayo y junio de 1991, y esta especie fue la sexta más común, con un total de 45 individuos; mientras que nosotros sólo registramos siete individuos en mayo y junio. Esta especie suele congregarse en grandes números (Howell y Webb 1995) y usa áreas abiertas con árboles dispersos (Stiles y Skutch 1995); es posible que en 1991 se congregara a alimentarse en las áreas abiertas del campus, los cuales se han reducido en los últimos años, por la construcción de edificios.
Cortez de Galán et al. (1994), registraron 12 especies anidando. En nuestro estudio observamos 15 especies en esta actividad, de las cuales siete son nuevos registros de anidación en el sitio: C. talpacoti, C. rubiginosus, Myiozetetes similis, Tyrannus melancholicus, D. dives y Q. mexicanus. Registramos sólo dos especies en actividades de anidación que perforan cavidades para anidar (C. rubiginosus y Melanerpes aurifrons). Las áreas urbanas tienden a favorecer a especies que construyen su nido con material vegetal, y no a aquellas que perforan cavidades en árboles muertos (Sandström et al. 2006). Sin embargo, observamos individuos de Eumomota superciliosa y Stelgidopteryx serripennis aprovechando cavidades artificiales, como desagües en muros de la universidad, para anidar.
De acuerdo con Allen y O’Connor (2000) y Emlen (1974), tiende a existir un gradiente en las áreas boscosas-urbanas, en el cual se evidencia una tendencia en áreas urbanas a favorecer especies omnívoras, granívoras e insectívoros aéreos. A excepción de C. rubiginosus, todas las aves que registramos anidando por primera vez en el campus pertenecen a uno de estos gremios alimentarios, siendo C. talpacoti una especie granívora, M. similis, D. dives y T. melancholicus insectívoros aéreos y Q. mexicanus una especie omnívora (Stiles y Skutch 1995).
La marcada estacionalidad de aves del país se evidencia con la ausencia de aves migratorias durante la época lluviosa (mayo a octubre) en la UES. Algunas especies migratorias son reconocidas como migratorios tempranos, tal es el caso de I. spurius, que en agosto ya está en sus territorios de estancia neotropical; y algunos miembros de la familia Parulidae que llegan en septiembre a dichos territorios (Fagan y Komar 2016). Las observaciones durante 2017 coinciden con este patrón, ya que registramos aves migratorias (I. spurius e I. gálbula) en agosto, y S. petechia (Parulidae) en septiembre.
El número de registros de las aves residentes incrementó de mayo a octubre, cuando la mayoría de aves migratorias están ausentes. Uno de los factores que pudiesen explicar este incremento, es que, aunque algunas especies de aves residentes no cambian sus hábitos de forrajeo en función de la presencia o ausencia de aves migratorias (Randler 2013), algunas sí tienden a modificarlos (Jedlicka et al. 2006), probablemente volviéndolas más conspicuas.
El incremento de infraestructura del campus universitario en los últimos 18 años es evidente y se ve reflejado en el ensamblaje actual de las aves. El estudio de Cortez de Galán et al. (1994) fue llevado a cabo en 1991, cuando el campus tenía más zonas verdes y áreas abiertas. En dicho estudio se registraron Colinus cristatus y Geothlypis poliocephala, especies generalistas de hábitat abiertos (Komar y Domínguez 2001) que no volvieron a registrarse nuevamente en el campus. La ausencia de estas especies en la actualidad se debe, entre otros factores, a la modificación del hábitat donde fueron registradas. Lo anterior, debido a la construcción de nueva infraestructura en el campus universitario en 2001 (Salinas et al. 2002).
Las nuevas estructuras, el crecimiento de la población estudiantil y la presencia de desperdicios de alimentos han dado lugar el aumento de especies oportunistas, como Q. mexicanus. Sin embargo, otras especies que se encuentran en declive en el país por pérdida del hábitat y saqueo de nidos han encontrado en el campus un refugio, como A. auropalliata, que habita principalmente en tierras bajas, áreas costeras y manglares (Thurber et al. 1987, Fagan y Komar 2016). Por otro lado, las arboledas y áreas sucesionales del lugar son áreas clave para las aves migratorias (Martin, 1985), ya que muchas mantienen una dieta alta en frutas y néctar como I. galbula, I. spurius, Piranga rubra y O. peregrina (Kricher 2006), todas registradas en este estudio.
Destacamos que en el campus de la UES se han registrado dos especies con categoría de conservación internacional: Passerina ciris y A. auropalliata. Esta última especie está catalogada en peligro por la UICN, dado que sus poblaciones han declinado principalmente por el saqueo de nidos (BirdLife 2017). Esta especie la registramos en 10 de los 12 meses muestreados, y refleja que el campus universitario es un hábitat de importancia para ésta; y para E. canicularis, P. strenuus y B. jugularis que se encuentran amenazadas en el país (MARN 2015).
La riqueza de especies que se distribuye en la ciudad universitaria asciende a 100, lo cual resalta la importancia del sitio y de las áreas verdes en general ubicadas dentro del paisaje urbano de San Salvador. Estas áreas se constituyen actualmente como sitios de alimentación, descanso y nidificación para las aves. De acuerdo con la literatura consultada, éste es el primer inventario de aves sistemático en un área verde urbana en El Salvador, que ha considerado aspectos de alimentación, anidación de especies y sus registros históricos. Esta investigación puede ayudar a sentar las bases para el desarrollo de estudios de la diversidad de aves que utilizan los ecosistemas urbanos del país. Investigaciones como ésta contribuyen a entender las adaptaciones de las aves y tomar las mejores decisiones para su conservación en este tipo de ambiente, cada vez más común en El Salvador.











 nueva página del texto (beta)
nueva página del texto (beta)



