Introducción
Las aves son un grupo ecológicamente importante ya que desempeñan diversos y complejas funciones en la dinámica natural de los ecosistemas (Whelan et al. 2018). Algunas aves, como los colibríes, son eficientes polinizadores (Torres y Navarro-Sigüenza 2000); también se consideran los mejores dispersores de semillas en términos de cantidad y distancia debido a su gran movilidad y tiempo de retención en su tracto intestinal (Arteaga y Moya 2002). Otras especies contribuyen al control de plagas, principalmente de roedores e insectos (Berlanga et al. 2010); las aves carroñeras son importantes en la salud del ambiente pues consumen los restos animales y humanos (Green et al. 2004), lo cual evita la dispersión de enfermedades ya que el vuelo maximiza la detección rápida y a gran escala de carroña (Whelan et al. 2018). Además, las aves han sido consideradas como un grupo indicador de biodiversidad por sus características biológicas y ecológicas (Gregory et al. 2003, Peck et al. 2014), esto incluye la presencia de grupos taxonómicos que responden de manera específica a cambios ambientales (Navarro-Alberto et al. 2016). Sin embargo, debido a su capacidad de vuelo se ha reportado que presentan una baja diversidad beta en relación con otros grupos de vertebrados (Qian 2009, Ochoa-Ochoa et al. 2014).
En México se encuentra el 11% de todas las especies de aves del planeta, es decir, alrededor de 1,107 especies de un total de 10,699 (Berlanga et al., 2015, Gill y Donsker 2018). Lo anterior lo coloca en el onceavo lugar entre los países megadiversos y en el cuarto lugar en cuanto a la proporción de especies endémicas. Además, cerca del 30% de la riqueza de aves en México son migratorias; se desplazan estacionalmente realizando movimientos desde Norteamérica hasta Centro y Sudamérica (Navarro-Sigüenza et al. 2014). De la riqueza total de aves que existe en México, 393 especies se enlistan en alguna categoría de protección en la NOM-059-SEMARNAT-2010 (Semarnat 2010).
A nivel estatal, Veracruz es el segundo lugar en cuanto a riqueza de especies de aves, con 719, sólo después de Oaxaca, que cuenta con 736 especies (Navarro-Sigüenza et al. 2014). En Veracruz se han realizado diversos estudios recientes sobre ornitofauna: ecología de comunidades (Rueda-Hernandez et al. 2015), diversidad (Bojorges-Baños y López-Mata 2005, González-García et al. 2014), ecología de poblaciones (Ruelas et al. 2010), distribución de algunos grupos en particular (Ortiz-Pulido y Díaz 2001), nuevos registros de especies (Fuentes-Moreno et al. 2016, García-Domínguez y Velarde 2015), dispersión de semillas (Hernández-Ladrón de Guevara et al. 2012) y métodos de colecta (Hernández-Dávila et al. 2015), entre otros; sin embargo, la mayoría de estos estudios han sido realizados tanto en el centro como en el sur del estado.
Para la zona norte de Veracruz hay estudios ornitológicos en los municipios de Tamiahua, Cazones y Tuxpan. De estos estudios siete de ellos están relacionados con el municipio de Tuxpan (Ramos-Ramos 2008, Hernández-Hernández 2009, Hernández-Sánchez 2010, Serrano et al. 2013, Cipriano 2014, Macías-Hernández 2014, Mendoza-Mar 2015). Sin embargo, dichos estudios se han enfocado principalmente a la zona costera y humedales sin incluir otros tipos de ambientes y zonas del municipio. El objetivo de este estudio fue analizar la estructura de la comunidad de aves en seis diferentes sitios del municipio de Tuxpan, Veracruz, incluidos los distintos tipos de vegetación, desde playa, manglar, bosque de encino, tular, acahual, cultivos hasta selva mediana subperennifolia. Además, realizar un análisis de priorización, incluido el presente estudio y otros estudios realizados previamente en el municipio de Tuxpan, basado en un enfoque de complementariedad, mediante el cual se pueden identificar los estudios más importantes para la representación de la avifauna regionalmente (Ceballos 1999).
En este artículo describimos la importancia de realizar muestreos de aves en diferentes hábitats para tener una mejor representatividad a nivel de paisaje. También comparamos la riqueza de aves registrada en estos hábitats en relación con los estudios llevados a cabo previamente en el municipio de Tuxpan, Veracruz, para analizar la complementariedad de aves regionalmente.
Métodos
Área de estudio
El municipio de Tuxpan pertenece al estado de Veracruz. Se encuentra ubicado en las coordenadas 20°57’ N y 97°24’ W, a una altura de 10 metros sobre el nivel del mar. Limita al norte con Tamiahua y Naranjos, al este con el Golfo de México, al oeste con Álamo Temapache, al sur Tihuatlán y Poza Rica. Tiene una superficie de 1,051.89 km2, y posee un clima tropical con una temperatura media anual de 21.1ºC con lluvias en verano y a principios de otoño, presenta una precipitación media anual de 1,241 mm (INEGI 2001).
Entre la vegetación del municipio se encuentran hábitats variados, como bosque de encino, manglar, selva alta subperennifolia, selva mediana subperennifolia, tular, playa y vegetación halófila (Aguilar-Pérez 2014). Para realizar el trabajo de campo seleccionamos seis localidades dentro del municipio de Tuxpan: 1) “Tumilco” (20°56’38’’ N y 97°21’16.67” O), localizado dentro del sitio Ramsar 1602 “Manglares y humedales de Tuxpan”, en el que realizamos el monitoreo en vegetación de manglar, acahual y tular; 2) “Playa” (21°5’45.06” N y 97°21’55.49” O), que se encuentra frente a la localidad de Galindo, en el cual las especies vegetales predominantes son Casuarina equisetifolia, Cocos nucifera y Coccoloba uvifera; 3) “La Ceiba” (20°58’39.5” N y 97°21’28.01” O), localizada en el km 6 por la carretera hacia la playa, presenta una vegetación de bosque de encino, acahual y manglar, con un cuerpo de agua semipermanente; 4) “El Edén” (21°55’22.27” N y 97°33’47.93” O), que se encuentra en el km 20 sobre la carretera Tuxpan-Tampico, cuenta con vegetación de acahual, cultivos de maíz (Zea mays) y mandarina (Citrus reticulata) y selva mediana subperennifolia; 5) “Juana Moza” (20°55’04.51” N y 97°26’02.26” O), por el que tiene paso de un brazo el río Tuxpan y también sobre él, además de cultivos, zonas inundadas y acahual; 6) rancho “Salman” (21°00’44.08”N y 97°25’07.90” O), ubicado en la carretera hacia Tamiahua, presenta selva mediana subperennifolia, acahual y áreas de ganadería (Figura 1).
Métodos de observación
Realizamos el presente estudio entre agosto de 2014 y marzo de 2015, con cuatro días de muestreo por sitio al mes, tanto en horario matutino (de 7:00 a 11:00 h) como vespertino (de 16:00 a 19:00 h). Utilizamos la metodología de transectos en combinación con puntos de conteo, donde registramos las especies observadas. Los transectos tuvieron una longitud de 2 km, tuvimos dos transectos por cada sitio de muestreo y por cada transecto se establecieron 10 puntos de conteo. Estimamos un radio fijo de 30 m en cada punto e identificamos las aves observadas por 10 minutos (Gallina y López-González 2011); la distancia entre cada punto de conteo fue de 200 m.
Análisis de datos
Para estimar la representatividad de los inventarios, calculamos el porcentaje que representa la riqueza de especies registrada en cada sitio con relación al promedio de los estimadores de riqueza Chao 2, ICE y Jacknife de primer orden, los cuales están basados en datos de presencia-ausencia (Hortal et al. 2006). Para determinar diferencias en la riqueza de especies entre los sitios, se realizó una curva de acumulación de especies, considerando como sitios diferentes aquellos en los cuales no se traslapen sus intervalos de confianza al 95%. Tanto los estimadores de riqueza como la curva de acumulación los calculamos con el programa EstimateS versión 9.1 (Colwell 2013), aleatorizando 1,000 veces las muestras para evitar un efecto en el orden de las mismas.
Para evaluar el grado de riesgo de cada especie, las clasificamos con base en la NOM-059-SEMARNAT-2010 (Semarnat 2010). Para analizar diferencias en la proporción de gremios alimenticios por sitio, las especies se clasificaron con base en su tipo de alimentación en el que la mayoría de los individuos de cada especie se encontraron alimentándose basados en la propuesta de Lopes et al. (2016), que considera los siguientes gremios divididos en material vegetal: folívoros, aquellos que se alimentan de las hojas, tallos, helechos y musgos; frugívoro, que se alimentan de fruta carnosa, bayas y drupas; granívoro, que se alimentan de semillas, granos nueces y frutos secos; nectarívoro, que se alimentan del néctar de las flores. Material animal: carnívoro, aquellos que se alimentan de anfibios, reptiles, aves y mamíferos; crustáceovoro, que se alimentan de crustáceos no zooplanctónicos; insectívoro, que se alimentan de hexápodos; moluscívoro, que se alimentan de moluscos como caracoles, babosas, lapas; carroñero, que se alimentan de cadáveres de vertebrados; piscívoro, que se alimentan de todo tipo de peces; vermívoro, que se alimentan de gusanos. Comida antrópica: purgamenívoro, aquellos que se alimentan de todo tipo de alimentos producidos por humanos.
Para analizar diferencias en el uso de hábitat, las aves se clasificaron en tres categorías: marinas, costeras o acuáticas y terrestres (Peterson y Chalif 1989, Howell y Webb 1995). Las diferencias estadísticas en la proporción de especies por gremios alimenticios y la proporción de especies por tipo de hábitat las determinamos mediante la prueba no paramétrica de G de tablas de contingencia (Zar 2010).
Para evaluar el recambio de especies entre los sitios de muestreo utilizamos el índice de complementariedad de Colwell y Coddington (1994), el cual expresa el grado de disimilitud en la composición de especies entre diferentes sitios. Así, la complementariedad varía desde 0 (cero), cuando ambos sitios son idénticos en composición de especies, hasta 100, cuando las especies de ambos sitios son completamente distintas, es decir, complementarias entre sí.
Para evaluar el aporte puntual de los diferentes estudios realizados en Tuxpan a la riqueza regional (municipio) (Anexo 1), llevamos a cabo un análisis de complementariedad regional por medio de un algoritmo que selecciona los sitios con base en su importancia en el aporte de especies nuevas, esto a manera de representar todas las poblaciones de las especies de una forma más eficiente. Este análisis permite identificar al sitio con mayor riqueza ya que es el que se encontrará en primer lugar, posterior a éste se añaden los lugares que aporten nuevas especies a los sitios previos independientemente de su riqueza de especies particular, es decir, los más complementarios a nivel paisaje (Ceballos 1999).
Resultados
En total, en los seis sitios de muestreo registramos 155 especies de aves pertenecientes a 118 géneros, 41 familias y 20 órdenes. La familia Parulidae fue la mejor representada, con 16 especies, y el orden Passeriformes el más numeroso, con 16 familias (Anexo 2). Tumilco fue el sitio con la mayor riqueza de especies (72 especies), mientras que la menor riqueza (53 especies) la registramos en La Playa (Figura 2). El porcentaje de representatividad de los sitios fue entre el 70 y 80% con base en los estimadores empleados, se infiere que aún podrían albergar una mayor cantidad de especies (Cuadro 1).
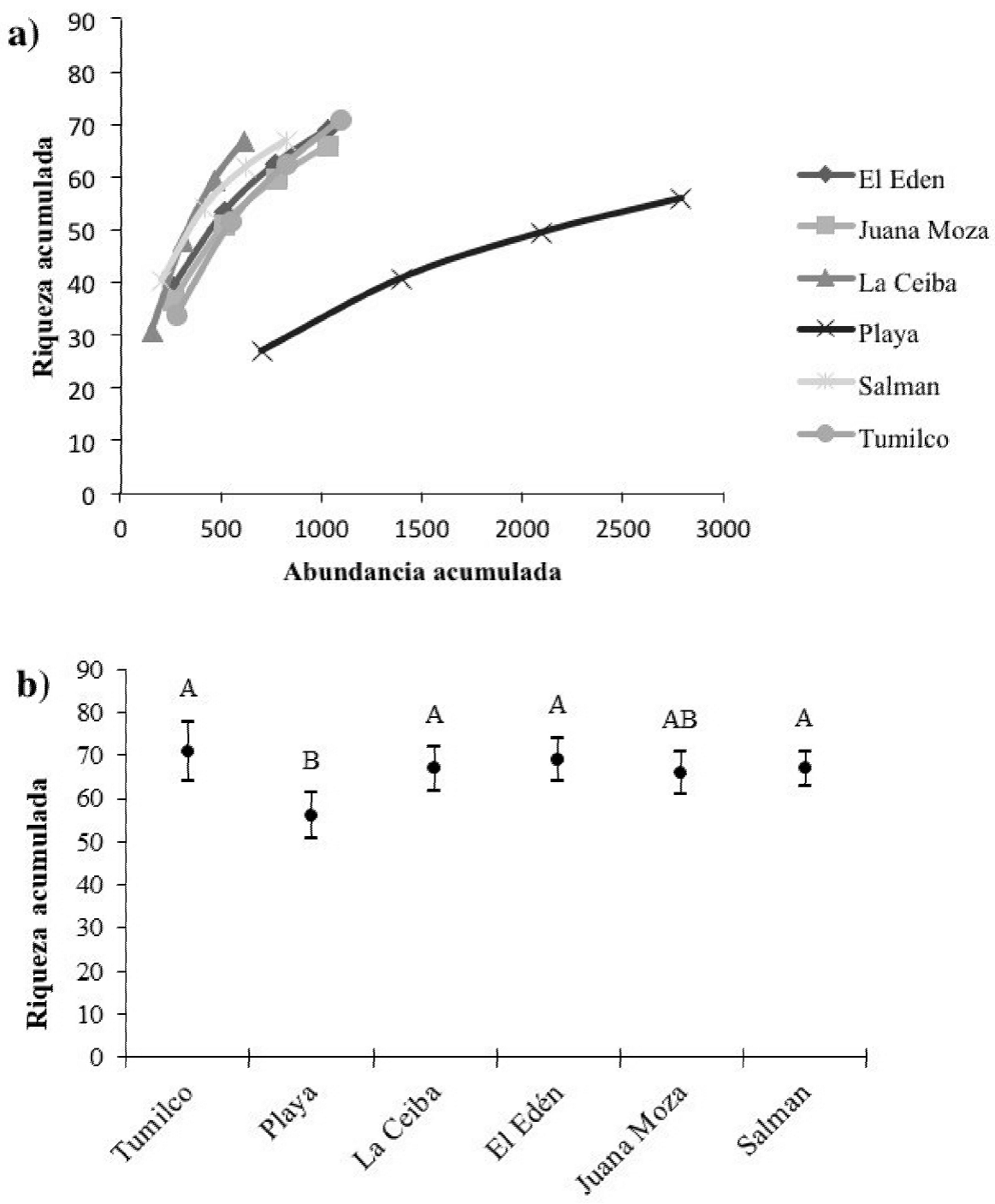
Figura 2 a) Curva de rarefacción y b) riqueza de especies (intervalo de confianza ±95%) por sitio de muestreo durante el periodo agosto 2014-marzo 2015 (las letras denotan diferencias significativas entre sitios).
Cuadro 1 Parámetros de diversidad de aves en seis sitios de muestreo durante el periodo agosto 2014-marzo 2015.
| Parámetros | El Edén | Juana Moza | La Ceiba | Playa | Salman | Tumilco | Total |
|---|---|---|---|---|---|---|---|
| Riqueza | 68 | 64 | 65 | 53 | 63 | 72 | 155 |
| Sp. NOM-059 | 6 | 5 | 7 | 3 | 5 | 5 | 15 |
| Chao 2 | 83.34 | 80.06 | 82.16 | 73.41 | 76.84 | 97.3 | |
| ICE | 93.63 | 89.31 | 101.79 | 85.13 | 83.34 | 110.04 | |
| Jacknife de primer orden | 88.5 | 92.25 | 90.25 | 75.5 | 82.75 | 96.5 | |
| Porcentaje de representatividad | 93.29 | 92.24 | 89.51 | 92.79 | 93.95 | 91.65 |
En este estudio registramos 19 especies no reportadas con anterioridad para el municipio de Tuxpan, 14 especies están listadas en la NOM-059-SEMARNAT-2010, tres catalogadas “En peligro de extinción” (P): Geothlypis flaveolata, Amazona oratrix, Amazona viridigenalis; cuatro “Amenazadas” (A): Geranospiza caerulescens, Falco femoralis, Vireo griseus perquisitor, Ramphastos sulfuratus, y siete “En protección especial” (Pr): Egretta rufescens, Tigrisoma mexicanum, Mycteria americana, Buteogallus anthracinus, Passerina ciris, Psarocolius montezuma, Eupsitula nana.
Las especies registradas se agruparon en 12 gremios tróficos (folívoros, frugívoros, insectívoros, nectarívoros, molluscívoros, crustáceovoros, piscívoros, carnívoros, granívoros, carroñeros, purgamenívoros y vermívoros). Encontramos diferencias significativas en la proporción de estos gremios entre los sitios de estudio (G2 = 38.36; P = 0.002). El gremio con la mayor riqueza de especies fueron los insectívoros (68 especies), el cual siempre dominó en todos los sitios con excepción de La Playa, en la cual dominaron las especies piscívoras. El gremio con menor número de especies fue el vermívoro (una especie) (Figura 3).

Figura 3 Proporción de especies de aves por gremios tróficos en Tuxpan, Veracruz en seis sitios durante el periodo agosto 2014-marzo 2015.
Con relación al uso de hábitat, las especies se agruparon en dos categorías; encontramos diferencias significativas en su proporción entre los sitios de estudio (G2 = 43.2; P < 0.001). Las especies terrestres tuvieron la mayor riqueza en cinco sitios con excepción de La Playa, en donde las aves costeras o acuáticas fueron las de mayor riqueza (Figura 4).
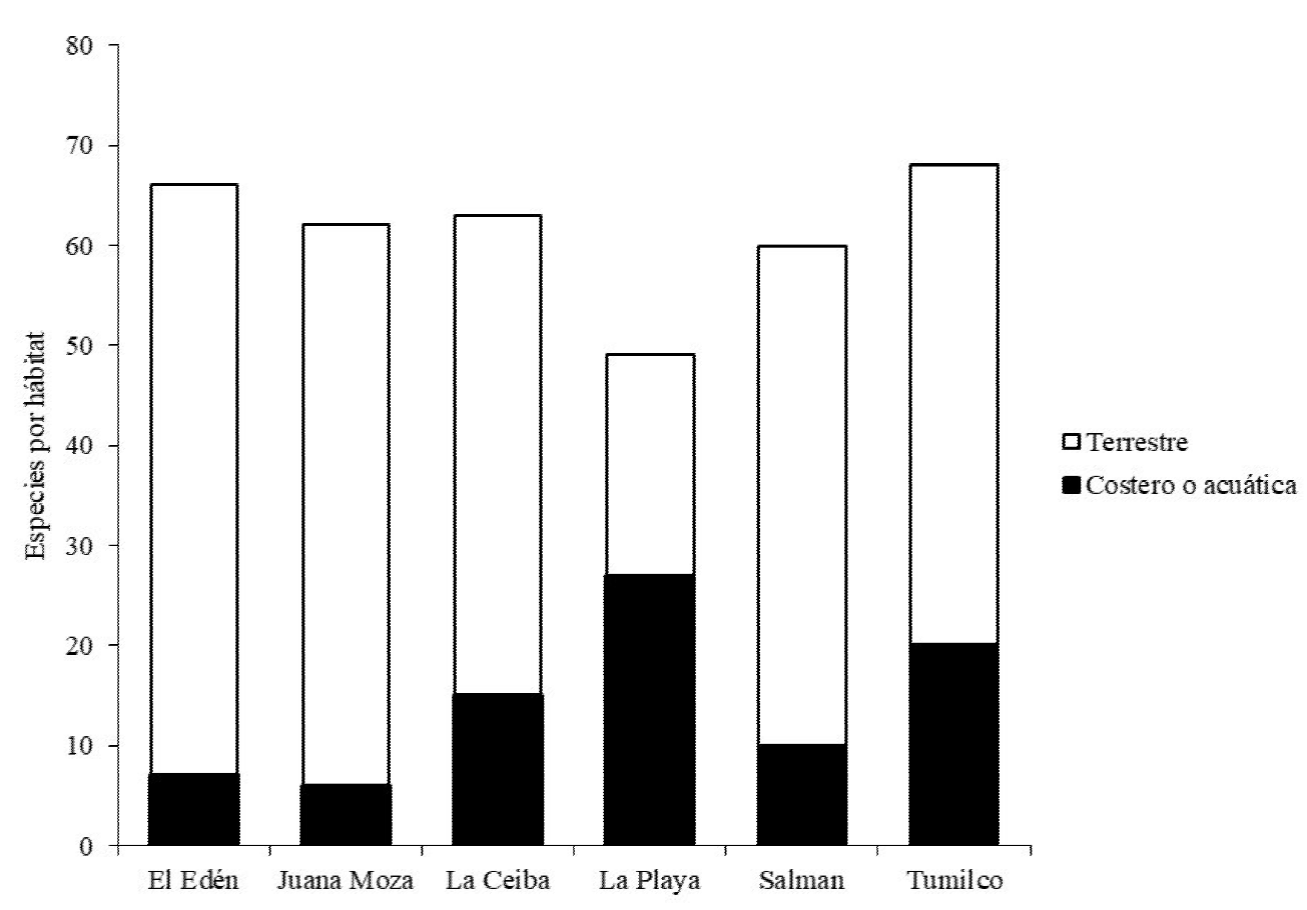
Figura 4 Número de especies de aves por uso de hábitat en seis sitios en Tuxpan, Veracruz durante el periodo agosto 2014-marzo 2015.
Analizando el recambio de especies, encontramos que La Ceiba y La Playa fueron los más complementarios entre sí (78%) compartiendo 22 especies, mientras que los sitios con menor complementariedad fueron Tumilco y Juana Moza (34%), los cuales comparten 44 especies entre sí (Cuadro 2).
Cuadro 2 Complementariedad entre los seis sitios del municipio de Tuxpan, Veracruz, durante el periodo agosto 2014-marzo 2015. En la diagonal superior muestra las especies compartidas y en la diagonal inferior muestra el porcentaje de complementariedad.
| Sitios | El Edén | Juana Moza | La Ceiba | Playa | Salman | Tumilco |
|---|---|---|---|---|---|---|
| El Edén | 44 | 38 | 24 | 44 | 24 | |
| Juana Moza | 51 | 35 | 27 | 44 | 43 | |
| La Ceiba | 61 | 64 | 22 | 36 | 38 | |
| Playa | 76 | 71 | 78 | 26 | 30 | |
| Salman | 52 | 50 | 63 | 73 | 41 | |
| Tumilco | 67 | 34 | 62 | 69 | 57 |
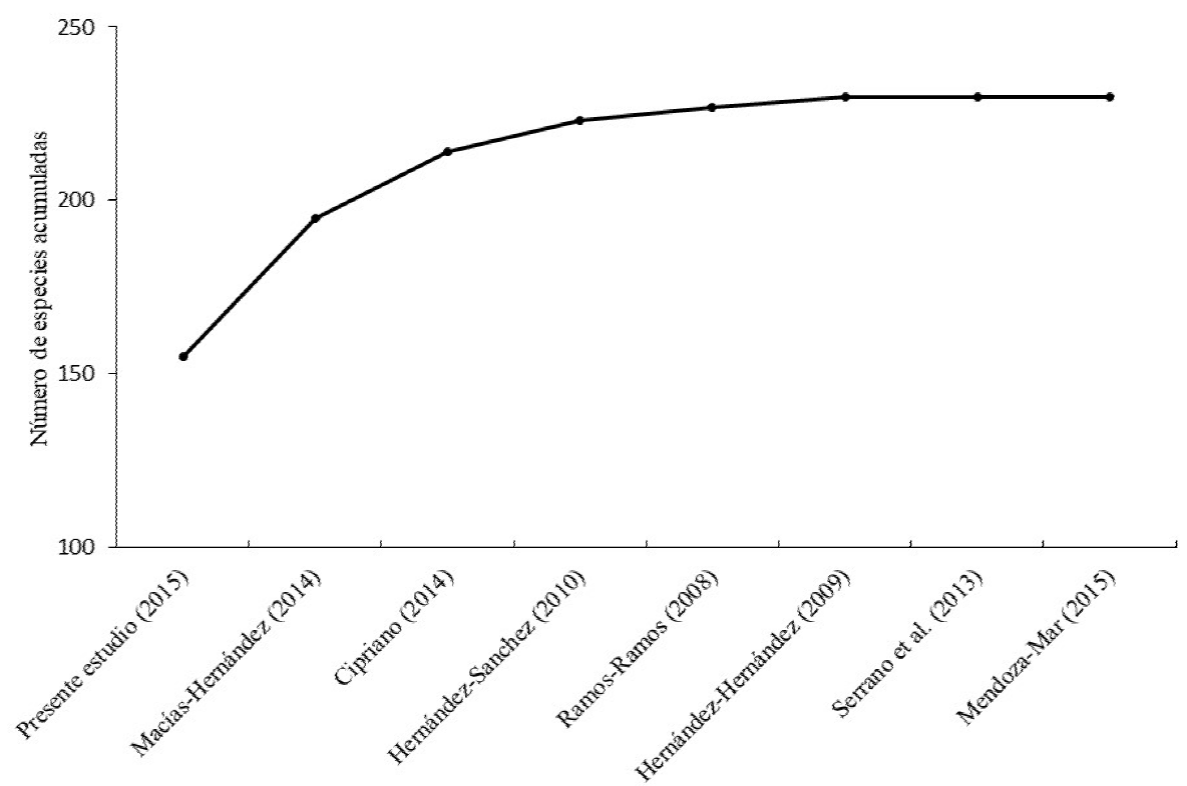
De acuerdo al análisis de complementariedad regional, que integra ocho estudios en el municipio de Tuxpan (Figura 5), el presente estudio es el que aporta la mayor riqueza de especies para este municipio (155 especies), seguido del trabajo de Macías-Hernández (2014) que aportó 40 especies diferentes, después el de Cipriano (2014), con 19 especies nuevas, el de Hernández-Sánchez (2010) que aportó nueve especies, seguido de Ramos-Ramos (2008) con cuatro especies y Hernández-Hernández (2009) aportando tres especies. Así, tenemos un total de 230 especies acumuladas para el municipio; de los ocho estudios que se utilizaron para este análisis, dos de ellos no aportaron regionalmente ninguna especie (Serrano et al. 2013, Mendoza-Mar 2015).
Discusión
Diversidad de aves en los sitios de estudio
Los resultados en los sitios, muestran que el recambio de especies (diversidad beta) es más importante que la diversidad puntual (alfa) para estimar la diversidad a nivel de paisaje (diversidad gamma). Esto ha sido un patrón descrito previamente en otros estudios con aves en México (Ramírez-Albores et al. 2014). El sitio con mayor riqueza de especies (72 especies) representa menos de la mitad de las especies registradas de manera general (155 especies), lo que muestra el gran recambio de especies entre los sitios que puede asociarse a que cada uno presenta características únicas y diferentes entre sí.
La mayor riqueza registrada en Tumilco (72 especies) es quizás porque este sitio está inmerso en un paisaje con una gran heterogeneidad de hábitats, que incluye manglar, espartal, tular, acahual y bosque de encino. Este sitio se encuentra en el sitio Ramsar 1602 “Manglares y humedales de Tuxpan”, uno de los más grandes en el norte de Veracruz (Basáñez-Muñoz 2005). Esto favorece la presencia de una gran cantidad de especies, principalmente insectívoras y carnívoras, que fueron los gremios alimenticios con la mayor riqueza. Además, los humedales son un hábitat importante para las aves migratorias de América del Norte durante la época de invierno ya que son usados para alimentación, descanso y reproducción (Gallardo et al. 2004), tal como ha sido reportado en estudios previos en este sitio (Serrano et al. 2013).
La menor riqueza de especies registrada en La Playa puede deberse a que se trata de un sitio ubicado en un paisaje más homogéneo espacialmente, lo que se traduce en una simplificación de los gremios tróficos, incluida la ausencia de especies nectarívoras. Sin embargo, fue el sitio donde se observó la mayor riqueza de especies marinas y costeras, entre ellas dos especies, P. occidentalis y Eudocimus albus, que fueron observadas volando en grupos grandes (más de 200 individuos por grupo). Esto se debe a que las familias Pelecanidae y Threskiornithidae son grupos muy sociables entre poblaciones de la misma especie y se reúnen en grupos grandes para alimentarse y anidar (Perrins 2011).
El análisis de complementariedad entre sitios muestra que la riqueza de especies per se puede subestimar la importancia de un sitio a nivel de paisaje, ya que a pesar de que en La Playa se registró la menor riqueza de especies, los mayores porcentajes de complementariedad se encontraron entre éste con los otros sitios; lo anterior se debe a que en La Playa se registraron de manera exclusiva a las especies marinas, las cuales estuvieron ausentes en prácticamente todos los otro sitios. La menor complementariedad registrada entre Salman y Juana Moza puede deberse a que ambos sitios comparten composiciones vegetales y especies similares, como Bursera simaruba, Psidium guajava y Leucaena leucocephala.
La mayor riqueza de aves insectívoras registradas en este estudio es consistente con lo reportado en otras regiones de México (Almazán-Núñez et al. 2009, Ramírez-Albores 2006, Ramírez-Albores 2010), y puede deberse a que la mayoría de los sitios están asociados a algún cuerpo de agua o sistema productivo que permite mantener una constante oferta de invertebrados (Castaño-Villa 2001, Ramírez-Albores 2006). Los carnívoros fueron el segundo gremio con mayor riqueza de especies, lo que puede atribuirse a la variedad de recursos alimenticios que pueden consumir, ya que dentro de este gremio están consideradas las aves que se alimentan de anfibios, mamíferos medianos y pequeños, reptiles, y de otras aves e incluso de los huevos de estos dos últimos (González-Salazar et al. 2014). El gremio que tuvo menor riqueza de especies fue el vermívoro, es decir, que se alimenta de todo tipo de gusanos, siendo Turdus grayi la única especie presente de este gremio, esto puede deberse a que los zorzales (Turdus) son especies que se han registrado alimentándose generalmente de larvas de insectos y de lombrices siendo mayor en época de primavera (Gruar et al. 2003).
La gran cantidad de especies protegidas sugiere que en la zona deben realizarse diversas acciones para la conservación, como el mantenimiento de los humedales debido a la presencia en este hábitat de Geothlypis flavevolata, especie endémica de las tierras bajas del noreste de México (BirdLife 2009). La conservación de los remanentes de vegetación debido a la presencia de algunas especies grandes, como el tucán pico canoa (Ramphastos sulphuratus), requiere de grandes fragmentos para su forrajeo, además de cavidades de árboles grandes para su reproducción (Silveira et al. 2003). También se requieren estrategias de manejo y educación ambiental, ya que diversas especies de psitácidos, como el perico pechisucio (Eupsittula nana), así como varias especies de aves canoras, son capturadas ilegalmente para ser comercializadas como mascotas por los pobladores locales (obs. pers.).
Complementariedad regional
Las 155 especies de aves registradas en los sitios de muestreo del presente estudio representan el 13.4% y 21.5% de la riqueza nacional y estatal, respectivamente (Navarro-Sigüenza et al. 2014). Sin embargo, incluido el análisis de complementariedad regional, en el municipio de Tuxpan se han registrado un total de 230 especies de aves, lo cual representa el 2.1% de la riqueza de aves mundial (Gill y Donsker, 2018), el 20.7% de la riqueza nacional (Navarro-Sigüenza et al. 2014) y el 31.9 % de la riqueza para el estado de Veracruz. Esta riqueza acumulada es mayor a la encontrada por Alducin (2013) en un cultivo de maíz asociado a un bosque secundario en el centro de Veracruz y a la reportada por Bojorges-Baños y López-Mata (2005) en una selva mediana. Esta riqueza es menor a la reportada para la ciudad de Xalapa (329 especies), en el centro del estado de Veracruz (González-García et al. 2014). Este último estudio es importante porque muestra la capacidad de una ciudad mediana para retener una elevada diversidad de aves en sus áreas verdes remanentes. Además, también demuestra la importancia de realizar estudios que integren información municipal para la obtención de un inventario de especies a nivel de paisaje, enfoque empleado en el presente trabajo.
El incremento en la riqueza de especies considerando los trabajos realizados de manera regional puede asociarse a la inclusión de sitios con hábitats diferentes, no solamente entre los sitios muestreados en el presente estudio sino también en relación con los estudios hechos previamente. Esto demuestra que, para lograr un adecuado inventario a nivel de paisaje, es importante incluir muestreos en escalas grandes y con hábitats heterogéneos más allá de realizar estudios en escalas pequeñas o en un solo hábitat, ya que esto incrementa la probabilidad de tener un mayor recambio de especies. Este patrón se ha demostrado en otros estudios que reportan una alta complementariedad de especies de aves entre hábitats contrastantes (bosque y pastizal), lo que se asocia a que cada hábitat posee especies propias en función de los recursos particulares que ofrece (Fandiño et al. 2017). Por lo anterior, para lograr un adecuado nivel de inventario es importante considerar a las especies con hábitos especialistas que puedan encontrarse en bajas densidades (Moura et al. 2013).
En el análisis de complementariedad regional, se identificó que se requieren seis estudios para lograr la eficiencia máxima, esto es, para tener representadas a todas las especies de aves del municipio de Tuxpan. Esto demuestra que prácticamente en todos los estudios se han registrado especies de manera exclusiva y refuerza la importancia de la diversidad beta en las aves, a pesar de que comparativamente ésta suele ser menor en relación con otros vertebrados, principalmente anfibios y reptiles (Qian 2009).
Con base en la priorización de los estudios, se registró que el presente estudio fue el que aportó la mayor riqueza de especies, esto puede atribuirse al esfuerzo de muestreo y el horario en el que se realizaron los muestreos en relación con los estudios previos. En esta investigación realizamos muestreos en horario vespertino donde encontramos especies que no habían sido registradas previamente en la zona, como Nyctidromus albicollis, Glaucidium brasilianum y Chordeiles minor. El segundo estudio que aportó regionalmente nuevas especies (40), tanto migratorias como playeras fue el de Macías-Hernández (2014), quien incluyó una variada representación espacial al incluir varios sitios de muestreo, pero también fue el estudio con mayor tiempo de muestreo (15 meses).
Incluir la diversidad beta temporal es un factor de gran relevancia para entender los procesos que determinan la diversidad (Halffter y Moreno 2005). Para esto, es importante considerar los diferentes aspectos en la que la diversidad avifaunística puede cambiar en escalas grandes de tiempo, como taxonómico, funcional y filogenético (Jarzyna y Jetz 2017), así como también los impactos que pueden tener los cambios temporales finos en especies de aves migratorias, tanto por la posible reducción de los tamaños poblacionales de algunas especies (Saino et al. 2011), como sobre la red de interacciones planta-animal (Ramos-Robles et al. 2016).











 nueva página del texto (beta)
nueva página del texto (beta)