Introducción
Las aves rapaces desempeñan un papel ecológico importante al regular las poblaciones de las cuales se alimenta (Garza-Herrera 1999). Tytonidae y Strigidae son las familias presentes en México; la familia Tytonidae está representada por la lechuza de campanario (Tyto alba) y Strigidae con 42 especies (AOU, 2017). Dentro de la familia Strigidae se encuentra el búho manchado (Strix occidentalis), de la cual se reconocen tres subespecies; el búho manchado norteño (S. o. caurina), el búho manchado californiano (S. o. occidentalis) y el búho manchado (BM) (S. o. lucida). Estas subespecies se distribuyen en Norteamérica desde el sur de Columbia Británica, Canadá, hasta el centro-sur de México (USDI Fish and Wildlife Service 1995, Tarango et al. 2001, Márquez et al. 2002, Palma-Cancino et al. 2014). Sin embargo, el BM es la única subespecie que se distribuye en los Estados Unidos y México, y su distribución es la más amplia de las tres subespecies. En los Estados Unidos, el BM ocurre desde Utah, Colorado, Arizona, Nuevo México y Texas (Dawson et al. 1987) y en México se le encuentra en la Sierra Madre Occidental, Sierra Madre Oriental y el Eje Neovolcánico Transversal (U.S. Fish and Wildlife Service 2012). Su distribución es discontinua, selecciona sistemas montañosos aislados y cañones (Gutiérrez et al. 1995, Ward et al. 1995), en bosques de coníferas, bosques mixtos y bosques caducifolios de climas templados y fríos (Tarango et al. 1997, Young et al. 1998, Navarro y Tarango 2000, Tarango et al. 2001, Márquez et al. 2002, Palma-Cancino et al. 2014). Sin embargo, debido a actividades antropogénicas como la tala de bosques e incendios forestales el BM se encuentra en la categoría de amenazada en los Estados Unidos (U.S. Fish and Wildlife Service 2012) y en México (Semarnat 2010). Por ello, los bosques deberían aprovecharse con una intensidad tal que les permita mantener su diversidad biológica, su productividad y capacidad para regenerarse, y de esta manera cumplir con su papel ecológico (Aguirre-Calderón 2015).
En los Estados Unidos se ha estudiado la biología del BM, sus amenazas, requerimientos de hábitat (U.S. Fish and Wildlife Service 2012), así como sobre su comportamiento, selección de hábitat, movimientos, índices de supervivencia, ámbito hogareño, distribución (Ganey 1990, Ganey y Balda 1994, Ganey et al. 1998, Ganey et al. 2000, Ganey et al. 2003), tasas de supervivencia (Ganey et al. 2005) y estudios genéticos (Barrowclough y Gutiérrez 1990, Barrowclough et al. 1999, Barrowclough et al. 2006, Haig et al. 2004, Gutiérrez et al. 2007). En contraste, en México son pocos los estudios realizados para esta subespecie (S. o. lucida), éstos han sido sobre las características de su hábitat en Chihuahua, México (Tarango et al. 1997, Young et al. 1998) en ecosistemas con una asociación de pino-encino; en Aguascalientes (Tarango et al. 2001, Márquez et al. 2002) ubicando a los búhos en ecosistemas donde predominan los encinos; así como sobre la composición de su dieta en Chihuahua, Aguascalientes y Zacatecas (Young et al. 1997, Márquez 2002, Bravo-Vinaja et al. 2005). El estudio más reciente sobre la caracterización de su hábitat en Tlachichila, municipio de Nochistlán de Mejía, Zacatecas, indicó que el BM ocupó el bosque de matorral latifoliado con encino (Palma-Cancino et al. 2014). Este estudio incluye el reporte más sureño de la distribución del BM en la Sierra Madre Occidental, muy próximo con los límites del estado de Jalisco.
Los estudios sobre las características del hábitat en sitios de descanso del BM en Aguascalientes se realizaron hace aproximadamente 15 años (Tarango et al. 2001; Márquez et al. 2002). En estos estudios sólo se evaluaron los sitios de descanso y sitios no aleatorios. Adicionalmente, estos estudios y el de Zacatecas (Palma-Cancino et al. 2014) no describieron las características del hábitat de sitios seleccionados por parejas reproductivas. Y como los bosques han sufrido cambios en su estructura por el aprovechamiento forestal, incendios forestales y contaminación, son necesarios más estudios sobre S. o. lucida.
Los objetivos del presente estudio fueron: 1) Caracterizar el hábitat del búho manchado (Strix occidentalis lucida) en sitios de descanso (reproductivos y no reproductivos) y aleatorios y 2) Identificar las variables físicas y biológicas (hábitat) que mejor se relacionan con los búhos registrados en los municipios de Súchil, Durango; San José de Gracia, Aguascalientes; Nochistlán de Mejía y Chalchihuites, Zacatecas. Los resultados de este estudio complementan la información sobre el uso de hábitat por el búho manchado en México y sirven de base para la elaboración de planes de manejo y conservación para S. o. lucida en los bosques de la Sierra Madre Occidental, México.
Métodos
Área de estudio
El presente estudio lo realizamos de julio de 2015 a julio de 2016 en cuatro municipios de la Sierra Madre Occidental, México (Figura 1):
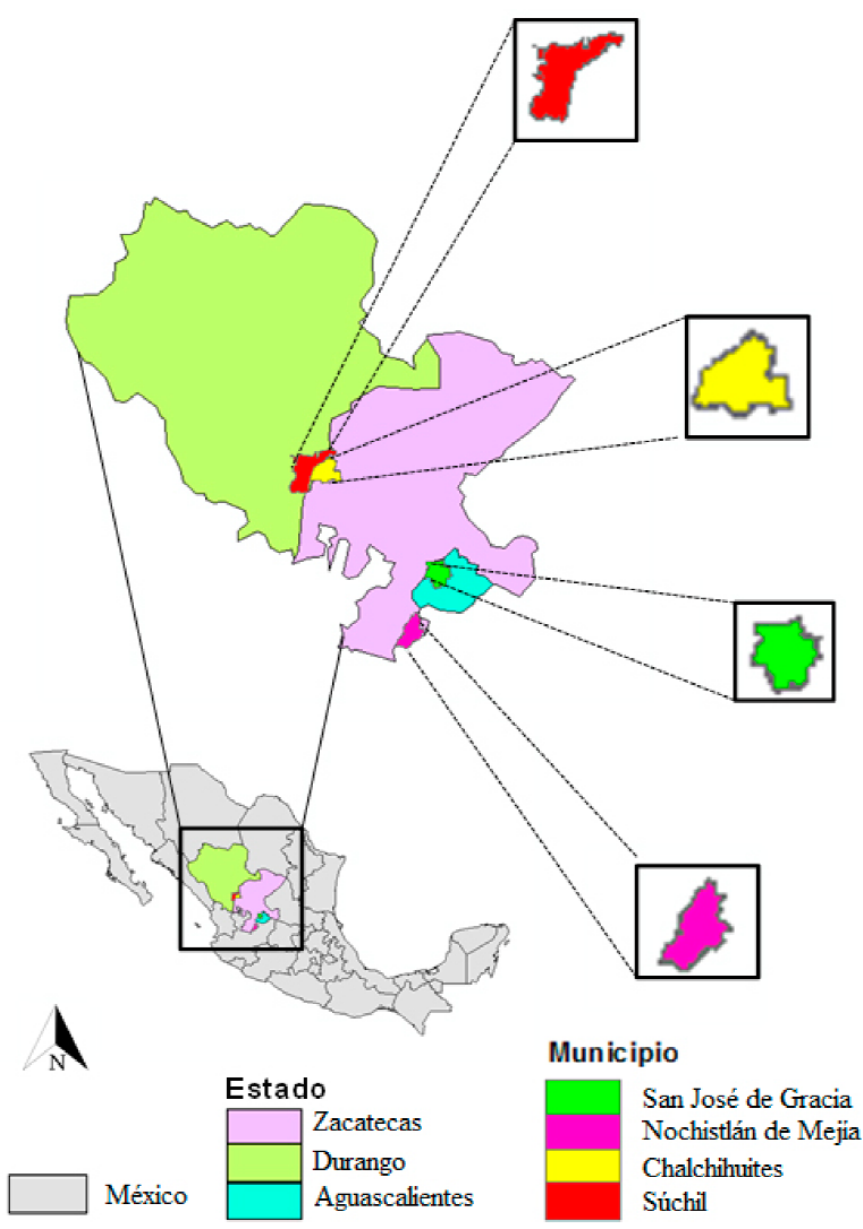
Figura 1 Estados y municipios donde estudiamos el hábitat de los sitios de descanso del búho manchado (Strix occidentalis lucida) en la Sierra Madre Occidental, México (2015-2016).
1) Súchil, Durango (23°07’ y 23°43’ N y 103°47’ y 104°22’ O) particularmente en la Reserva de la Biosfera La Michilía (RBLM) y áreas aledañas, con una elevación entre 1400 y 3100 m, la RBLM es una región Terrestre Prioritaria de México (RTP), además se encuentra en el sistema de Áreas de Importancia para la Conservación de las Aves (AICA) (RBLM 2004). Este municipio posee bosques templados (González-Elizondo et al. 1993), las especies de pinos más comunes son el pino amarillo (Pinus cooperi), pino piñonero (P. cembroides), pino real (P. engelmanni), pino blanco (P. arizonica) y el pino chino (P. chihuahuana). Las especies de encinos más comunes son el encino blanco (Quercus hartwegii), el palo rojo (Q. eduardii), el encino laurillo (Q. durifolia) y el encino colorado (Q. sideroxyla) (INEGI 2010a).
2) Nochistlán de Mejía, Zacatecas (21°12’ y 21°40’ N; 102°41’ y 103°03 ’O) en un rango de elevación de 1900-2700 m, la vegetación se conforma de bosques de pino, encino, pino-encino, bosque tropical caducifolio, así como matorral xerófilo, vegetación secundaria y pastizal inducido (Inafed 2010a; INEGI 2010b).
3) Chalchihuites, Zacatecas (23°16’ y 23°37’ N y 103°43’ y 104°07’ O) con elevaciones desde 1900-3000 m, las especies arbóreas más comunes son encino roble (Quercus sp.), cedro (Juniperus sp.), pino piñonero (P. cembroides), pino real (P. engelmanni), palo colorado (Q. eduardii) y mezquite (Prosopis sp.), madroño (Arbutus sp.), manzanita (Arctostaphylos pungens) (Inafed 2010b, INEGI 2010c).
4) El municipio de San José de Gracia, Aguascalientes, específicamente en el Área Natural Protegida Sierra Fría (ANPSF) (21°58’ y 22°20’ N; 102°21’ y 102°43’ O) es una región montañosa con elevaciones desde 1900 a 2400 m (INEGI 2010d). Esta área se caracteriza por tener una diversidad de zonas ecológicas y diferentes tipos de vegetación como bosque templado y está dominada por comunidades de encino (Quercus spp.), pino (Pinus spp.), cedro (Juniperus sp.) y arbustos como la manzanita (Arctostaphylos pungens y A. Polifolia), madroño (Arbutus glandulosa y A. Arizonica), chaparral, matorral xérofilo, pastizal, bosque tropical seco y matorral subtropical (Sosa et al. 2014). Esta investigación la realizamos en la Unidad de Recuperación del búho manchado denominada Sierra Madre Occidental Sur (USDI Fish y Wildlife Service 1995).
Localización de los búhos
Los búhos los localizamos mediante recorridos nocturnos y diurnos. Los recorridos diurnos los concentramos en aquellas áreas forestales en donde ya existían reportes de la presencia del BM. En particular, en Durango recorrimos las áreas con reporte de avistamientos llevados a cabo por Garza-Herrera (1999), en Zacatecas en las áreas reportadas por Palma-Cancino et al. (2014) y en Aguascalientes en los sitios reportados por Tarango et al. (2001) y Márquez et al. (2002). Esta especie de búho es muy territorial; por ello, para su localización utilizamos grabaciones con cantos de la especie (https://www.xeno-canto.org/), para su registro.
Para incrementar el número de sitios de descanso del BM, en las áreas donde no se tenían registros de la especie, pero que reunían las condiciones de hábitat adecuadas para ello, reportadas en la literatura, realizamos recorridos diurnos y nocturnos. En estas áreas, durante el día, seleccionamos sitios potenciales de distribución de la especie y establecimos estaciones de llamado para visitarlos y muestrearlos durante la noche (20:00-01:00 h) (Forsman 1983). Las distancias entre las estaciones de llamado variaron entre 0.5 y 3.0 km, dependiendo de la topografía del terreno y de las condiciones del hábitat potencial. En cada estación asignamos 5 min para reproducir los cantos y 10 min para escuchar posibles respuestas del BM; una vez que obtuvimos respuesta, registramos la hora, las coordenadas de la estación, la dirección y distancia del punto de respuesta a la estación de llamado. Esta información la utilizamos para localizar los sitios de descanso de los búhos durante el día recorriendo las áreas con mayor probabilidad de presencia del BM, reproduciendo las grabaciones continuamente en arroyos, cañadas, veredas y brechas y buscándolos árbol por árbol y en acantilados. Una vez que obtuvimos respuesta de los búhos, cada sitio de descanso lo identificamos por localidad (nombre del sitio), por estado, los contamos, identificamos el tipo de percha (árbol o cueva), y cuando fue posible, determinamos el sexo de los BM. Todos los tecolotes registrados en este estudio fueron diferentes, pues se trata de una especie extremadamente territorial y cada sitio durante el estudio lo monitoreamos por lo menos en ocho ocasiones, incluyendo la fase final de la etapa reproductiva, lo que nos permitió clasificar los sitios de descanso como sitios reproductivos, cuando en ellos identificamos una pareja y polluelos; por el contrario, como sitios no reproductivos, cuando en ellos reconocimos sólo individuos o parejas solitarias. La época reproductiva de esta subespecie ocurre de marzo a septiembre.
Caracterización del hábitat
Una vez localizados los búhos y determinado sus sitios de descanso, procedimos a evaluar variables del hábitat en parcelas circulares de 20 m (314.2 m2) de diámetro (Solis y Gutiérrez 1990), una por sitio de descanso y considerando el árbol de percha como su centro. En los casos en que el sitio de descanso fue una cueva, la parcela de evaluación la establecimos tomando como centro el árbol más cercano que tuviera un diámetro a la altura del pecho (DAP) ≥ 20 cm, en éstas parcelas evaluamos las variables físicas y biológicas (hábitat) (Cuadro 1). Asimismo, a cada parcela evaluada le asignamos una clave de identificación, así como el nombre de la localidad, registramos la fecha y hora de evaluación, su altitud (msnm) y las coordenadas geográficas (latitud y longitud). Para definir una posible selección de algunos atributos del hábitat por esta especie, evaluamos tres parcelas seleccionadas aleatoriamente por cada sitio de descanso (sitio reproductivo o sitio no reproductivo), excepto para un sitio donde sólo evaluamos una parcela aleatoria debido al difícil acceso a la zona. Estas parcelas las establecimos a distancias de 50, 100 o 150 m del centro del sitio de descanso, seleccionamos una dirección aleatoria (N, S, E, O, NE, NO, SE, SO) y cuantificamos las mismas variables que en los sitios de descanso (Cuadro 1).
Cuadro 1 Variables físicas y biológicas registradas en sitios de descanso y aleatorios del búho manchado (Strix occidentalis lucida), en la Sierra Madre Occidental, México (2015-2016).
| Característica | Variable | Forma de medición |
|---|---|---|
| Físicas | Elevación | GPS GARMIN |
| Inclinación de la pendiente | Clinómetro SUUNTO PM-5/360PC | |
| Dirección de la pendiente | Brújula Brunton Eclipse 5889 | |
| Dimensiones de cuevas y características | Cinta métrica y clinómetro SUUNTO PM-5/360PC | |
| Biológicas | Especie de percha | Claves dicotómicas (Romero et al. 2015; Zavala 1989; González 1986) |
| Altura (árbol de percha, rama de percha, árboles vivos, árboles muertos en pie) | Clinómetro SUUNTO PM-5/360PC | |
| DAP (árbol de percha, árboles muertos en pie, árboles muertos caídos) y largo de árboles muertos caídos | Cinta métrica Truper 20 m-66’ | |
| Orientación de la rama de percha (Azimut) | Brújula Brunton Eclipse 5889 | |
| Tipo de vegetación, número de estratos vegetales, nivel de descomposición de árboles (muertos en pie y caídos) | Visualmente | |
| Cobertura del dosel (%) | Densiómetro (Young et al. 1998) | |
| Cobertura del suelo (%) | ||
| Hierba, pasto, hojarasca, arbusto, suelo desnudo, roca y material leñoso | Línea de Canfield (Canfield, 1941) dos líneas de 20 m de largo por parcela (dirección norte-sur y este-oeste) |
Para las perchas localizadas en cuevas consideramos las siguientes medidas: a) largo de la cueva, b) ancho de la cueva, c) profundidad de la cueva, d) altura de la superficie del suelo a la base de la cueva, e) altura de la parte superior de la cueva hacia la parte final del macizo rocoso y f) altura total del macizo rocoso (Palma-Cancino et al. 2014). En el presente estudio, aunque cuatro de las 11 áreas con presencia del búho (una en Aguascalientes y tres en Zacatecas) se relacionaron con las ya reportadas por Tarango et al. (2001), Márquez et al. (2002) y Palma-Cancino et al. (2014), en ninguno de los casos, la caracterización del hábitat se realizó en los mismos sitios reportados.
Colecta e identificación de especies arbóreas
Para complementar la caracterización del hábitat de los sitios de descanso del BM, colectamos muestras de plantas arbóreas, las etiquetamos con una clave, nombre, coordenadas del sitio, las colocamos y mantuvimos en una prensa botánica hasta su identificación en el herbario de la Universidad Autónoma de Aguascalientes (UAA). Las plantas las identificamos utilizando un estereoscopio, claves dicotómicas y referencias bibliográficas.
Análisis estadísticos
Con la información de las variables del hábitat medidas en los sitios de descanso y aleatorios, obtuvimos la estadística descriptiva, medias y desviaciones estándar (DE), y realizamos un análisis de Kruskal-Wallis (α = 0.05). Esta información la agrupamos por sitios de descanso y sitios aleatorios. Asimismo, obtuvimos un IVI (Índice de Valor de Importancia) de las especies arbóreas, el cual se refiere a las especies de plantas que más contribuyen a la estructura del ecosistema (Cottam y Curtis 1956) mediante la siguiente formula:
Dónde:
Domr = área basal relativa o dominancia relativa.
Dr = densidad relativa.
Fr = frecuencia relativa.
El área basal utilizada para estimar el área basal relativa la calculamos con la siguiente fórmula:
Dónde:
π = 3.1416
DN = Diámetro normal.
Para determinar que variables del hábitat tuvieron un efecto (coeficientes estadísticamente significativos) sobre las frecuencias de búhos en el área de estudio (considerando los sitios de descanso y aleatorios) realizamos un análisis de Regresión Poisson (ARP). Asimismo, para incluir en el ARP la información de las variables evaluadas a los árboles de percha del BM, en los sitios aleatorios, simulamos árboles de percha (el árbol ubicado en el centro de la parcela). En este análisis utilizamos un Modelo Lineal Generalizado (Generalized Linear Model GLM) y seleccionamos las variables por pasos (Stepwise), con un criterio de clasificación del mínimo Akaike (AIC; Akaike 1969) en donde la variable dependiente (y) fue el número de búhos registrados por sitio de descanso y las independientes (xi) las variables físicas y biológicas. Estos análisis los realizamos con el Software estadístico R-versión 3.3.1 (2016).
Realizamos un análisis de correspondencia simple (ACS) con un α = 0.5 para asociar el número de búhos por sitio de descanso y las variables biológicas que fueron significativas en el ARP, estos análisis los obtuvimos con el software (StatSoft 2016). Para ello, las variables biológicas las categorizamos mediante histogramas (Excel 2016) (Cuadro 2). Y para determinar posibles diferencias entre las variables biológicas estadísticamente significativas en el ARP de los sitios de descanso y aleatorios, realizamos una prueba no paramétrica de Kruskal-Wallis (debido a que no se cumplieron los supuestos de normalidad y homogeneidad en las varianzas de los datos colectados) con un nivel de significancia de α = 0.05. Estos análisis los realizamos con el software JMP IN 8.0 (Academic SAS Institute INC 2013).
Cuadro 2 Categorías de las variables del hábitat que resultaron significativas en el ARP en los sitios de descanso y aleatorios del búho manchado (Strix occidentalis lucida), en la Sierra Madre Occidental, México (2015-2016).
| Variable | Clave | Rango (Mín.-Máx.) |
|---|---|---|
| Altura de árbol de percha (m) | ||
| Baja | (AapB) | 5 - 8.84 |
| Media | (AapM) | 8.85 - 11.24 |
| Alta | (AapA) | 11.25 - 17.00 |
| Arbusto (%) | ||
| Nulo | (ArbN) | 0 - 1.20 |
| Muy bajo | (ArbMb) | 1.21 - 4.80 |
| Bajo | (ArbB) | 4.81 - 20.00 |
| DAP del árbol de percha (cm) | ||
| Bajo | (DapapB) | 9.23 - 29.32 |
| Medio | (DapapM) | 29.33 - 39.36 |
| Alto | (DapapA) | 39.37 - 92.94 |
| Altura de árboles (m) | ||
| Baja | (AaB) | 4.9 - 7.40 |
| Media | (AaM) | 7.41 a 9.34 |
| Alta | (AaA) | 9.35 - 18.80 |
| Altura de percha (m) | ||
| Baja | (ApB) | 2 - 3.92 |
| Media | (ApM) | 3.93 - 6.64 |
| Alta | (ApA ) | 6.65 - 10.00 |
| Material leñoso (%) | ||
| Muy bajo | (MlMb) | 0 - 4.35 |
| Bajo | (MlB) | 4.36 - 12.32 |
| Medio | (MlM) | 12.33 - 36.25 |
AapB = Altura de árbol de percha baja; AapM = Altura de árbol de percha media; AapA = Altura de árbol de percha alta; ArbN = Arbusto nulo; ArbMb = Arbusto muy bajo; ArbB = Arbusto bajo; DapapB= Diámetro a la altura del pecho del árbol de percha baja; DapapM = Diámetro a la altura del pecho del árbol de percha media; DapapA = Diámetro a la altura del pecho del árbol de percha alta; AaB = Altura de árboles baja; AaM = Altura de árboles media; AaA = Altura de árboles alta; ApB = Altura de percha baja; ApM = Altura de percha media; ApA= Altura de percha alta; MlMb = Material leñoso muy bajo; MlB=Material leñoso bajo; MlM=Material leñoso medio.
Resultados
Durante julio de 2015 a julio de 2016 localizamos 29 búhos (12 adultos, ocho subadultos y nueve polluelos) en 11 sitios de descanso (5 reproductivos y 6 no reproductivos). Encontramos 11 búhos en Durango, nueve en Zacatecas y nueve en Aguascalientes (Figura 2; Cuadro 3), con una relación de 2.6 búhos por sitio de descanso y un esfuerzo de muestreo de 123 (n = 133 estaciones de llamado), 72 (n = 55 estaciones) y 60 horas (n = 87 estaciones de llamado), respectivamente. El número de estaciones de llamado varió por estado y éste dependió de las características topográficas de los sitios muestreados.
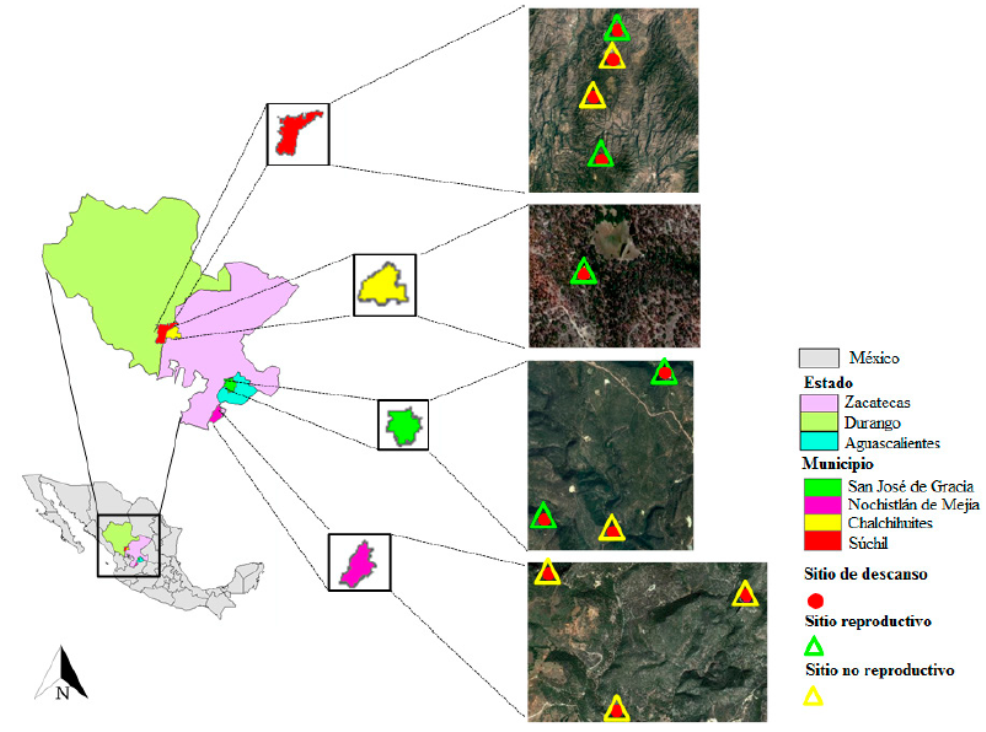
Figura 2 Sitios de descanso reproductivos y no reproductivos del búho manchado (Strix occidentalis lucida) por estado y municipio en la Sierra Madre Occidental, México (2015-2016).
Cuadro 3 Características del búho manchado (Strix occidentalis lucida) por estado y sitio de descanso en la Sierra Madre Occidental, México (2015-2016).
| Sitio de descanso | Número | Nivel de desarrollo | Sexo |
|---|---|---|---|
| Durango | |||
| Arroyo el Toribio | 1 | Subadulto | Desconocido |
| Mesa del burro* | 2 | Adultos | Hembra y macho |
| 3 | Polluelos | Desconocido | |
| Las Margaritas | 1 | Subadulto | Desconocido |
| Los Corralitos* | 2 | Adultos | Hembra y macho |
| 2 | Polluelos | Desconocido | |
| Zacatecas | |||
| Peña Parda | 2 | Subadultos | Hembra y macho |
| Barranca Angosta | 2 | Subadultos | Hembra y macho |
| Rincón Verde | 2 | Subadultos | Hembra y macho |
| El Purgatorio* | 2 | Adultos | Hembra y macho |
| 1 | Polluelo | Desconocido | |
| Aguascalientes | |||
| Cueva Prieta | 2 | Adultos | Hembra y macho |
| Antrialgo* | 2 | Adultos | Hembra y macho |
| 2 | Polluelos | Desconocido | |
| Laguna Seca* | 2 | Adultos | Hembra y macho |
| 1 | Polluelo | Desconocido |
*Sitio reproductivo.
Caracterizamos el hábitat del BM en 42 sitios (11 sitios de descanso y 31 sitios aleatorios), en Durango (n = 14), Zacatecas (n = 16) y Aguascalientes (n = 12) con un esfuerzo de muestreo y medición de 97 horas. Los sitios de descanso (sitios reproductivos y sitios no reproductivos), en su mayoría (90.9%) los encontramos en bosques de encino-pino y encino, y los búhos percharon preferentemente (90.9%) en encinos de Quercus rugosa Née, Quercus obtusata Bonpl., Quercus sideroxyla Bonpl. y Quercus potosina Trel. Esta especie se encontró principalmente en laderas con exposición noreste y norte (81.8%) y en ramas con orientación noreste, norte y noroeste (81.9%) (Cuadro 4). Los arboles de percha tuvieron una altura de 10.5 ± 2.4 m, un diámetro de 37.6 ± 20.5 cm y los búhos percharon a 6.2 ± 1.4 m de alto.
Cuadro 4 Frecuencia de uso de variables de vegetación en sitios de descanso (n = 11) del búho manchado (Strix occidentalis lucida) en la Sierra Madre Occidental, México (2015-2016).
| Variable | Frecuencia | Porcentaje |
|---|---|---|
| Tipo de vegetación | ||
| Bosque de pino-encino | 1 | 9.1 |
| Bosque de encino-pino | 7 | 63.6 |
| Bosque de encino | 3 | 27.3 |
| Especie del árbol de percha | ||
| Quercus sideroxyla Bonpl. | 2 | 18.2 |
| Quercus obtusata Bonpl. | 2 | 18.2 |
| Quercus rugosa Née. | 5 | 45.4 |
| Prunus rhamnoides Koehn. | 1 | 9.1 |
| Quercus potosina Trel. | 1 | 9.1 |
| Exposición de la pendiente | ||
| Noreste | 5 | 45.4 |
| Este | 1 | 9.1 |
| Norte | 4 | 36.4 |
| Oeste | 1 | 9.1 |
| Orientación de la rama de percha | ||
| Noreste | 4 | 36.4 |
| Noroeste | 2 | 18.2 |
| Norte | 3 | 27.3 |
| Suroeste | 1 | 9.1 |
| Este | 1 | 9.1 |
Aunque los valores de densidad de árboles vivos y muertos, la cobertura de dosel, y la cobertura del suelo (componentes hojarasca y rocas) fueron relativamente mayores en los sitios de descanso que en los aleatorios, éstos no difirieron estadísticamente (P > 0.05). Asimismo, estos sitios los ubicamos en áreas con exposición noreste y más inclinadas que los sitios aleatorios; sin embargo, los valores de esta última variable tampoco difirieron estadísticamente entre sitios (P > 0.05). Todos los sitios de descanso y el 84% (n = 26) de los sitios aleatorios, los localizamos en bosques con tres estratos de vegetación (Cuadro 5).
Cuadro 5 Medias y DE de las variables evaluadas en sitios de descanso y aleatorios en el hábitat del búho manchado (Strix occidentalis lucida) de la Sierra Madre Occidental, México (2015-2016).
| Variable | Sitio de descanso (n = 11) | Sitio aleatorio (n = 31) |
|---|---|---|
| Elevación (msnm) | 2558.3 ± 127.4 | 2563.3 ± 125.4 |
| Inclinación de la pendiente (%) | 28.2 ± 16.5 | 24.5 ± 18.2 |
| Exposición de la pendiente | *NE (45.5%) | *NE (35%) |
| Tipo de vegetación | *BEP (63.6%) | *BEP (52%) |
| Núm. de estratos | *3 (100 %) | *3 (84 %) |
| Cobertura de dosel (%) | 41.2 ± 24.7 | 37.7 ± 20.9 |
| Número de árboles (ha) | 426.7 ± 238.8 | 393.3 ± 168.7 |
| Altura de árboles (m) | 9.3 ± 3.1 | 8.0 ± 3.0 |
| Área basal (m2 ha-1) | 21.3 ± 0.08 | 17.6 ± 0.06 |
| Árboles muertos en pie | ||
| Número de árboles (ha) | 47.7 ± 44.5 | 27.7 ± 33.4 |
| Altura (m) | 7.5 ± 2.9 | 7.1 ± 3.6 |
| Diámetro a la altura del pecho (cm) | 21.8 ± 12.8 | 17.6 ± 0.05 |
| Nivel de descomposición | 3.9 ± 1.6 | 3.5 ± 1.1 |
| Árboles muertos caídos | ||
| Número | 1.5 ± 1.3 | 0.87 ± 1.52 |
| Largo (m) | 5.8 ± 2.3 | 7.8 ± 3.8 |
| Diámetro (cm) | 21.7 ± 11.7 | 23.8 ± 12.5 |
| Nivel de descomposición | 3.3 ± 1.5 | 2.7 ± 0.9 |
| Cobertura de suelo (%) | ||
| Hierba | 6.3 ± 8.8 | 4.1 ± 5.7 |
| Pasto | 15.1 ± 15.0 | 20.6 ± 13.6 |
| Hojarasca | 45.6 ± 16.5 | 43.7 ± 13.3 |
| Arbusto | 1.4 ± 1.7 | 3.3 ± 5.0 |
| Suelo desnudo | 3.9 ± 3.0 | 5.2 ± 6.5 |
| Roca | 21.8 ± 17.3 | 12.7 ± 13.1 |
| Material leñoso | 6.0 ± 5.9 | 10.4 ± 7.5 |
* El porcentaje se refiere al número de sitios. NE = Noreste, BEP = Bosque de encino-pino.
En los sitios de descanso reproductivos (SDR = 5), la densidad de árboles, fue mayor estadísticamente que la de los sitios de descanso no reproductivos (SDNR = 6) y sitios aleatorios (SA = 31) (P < 0.05). Aunque la elevación en los SDR fue mayor (2627.6) que la de los SDNR (2500.5) y SA (2563.3 msnm) y los árboles de percha y los árboles muertos sobre la superficie del suelo de los SDR presentaron un mayor diámetro, comparados con los sitios de descanso no reproductivos y aleatorios (Cuadro 6), estos valores no fueron diferentes estadísticamente (P > 0.05).
Cuadro 6 Medias y DE de las variables evaluadas por sitio en el hábitat del búho manchado (Strix occidentalis lucida) de la Sierra Madre Occidental, México (2015-2016).
| Variable | Sitios reproductivos (n = 5) | Sitios no reproductivos (n = 6) | Sitios aleatorios (n = 31) |
|---|---|---|---|
| Elevación (msnm) | 2627.6±182.7 | 2500.5± 101.9 | 2563.3±125.4 |
| DAP de los árboles de percha (cm) | 43.6±27.8 | 32.5±12.3 | 35.7±12.2* |
| Densidad de árboles ha-1 | 557.3±9.4 | 324.8±3.9 | 391.7±5.3 |
| DAP de los árboles muertos caídos (cm) | 25±8 | 19.8±13.1 | 23.8±12.5 |
* Diámetro a la altura del pecho de percha simulada. DAP = Diámetro a la altura del pecho.
En los sitios de descanso y aleatorios identificamos 27 especies de plantas arbóreas. Sin embargo, las más sobresalientes con un IVI acumulado de 59.7% en los sitios de descanso fueron Quercus rugosa Née, Quercus sideroxyla Bonpl., Quercus obtusata Bonpl., Arbutus sp. Pinus chihuahuana Engelmann, Pinus cembroides Zucc (Cuadro 7). En los sitios aleatorios, las especies con un IVI acumulado de 69.7% fueron Quercus sideroxyla Bonpl., Pinus chihuahuana Engelmann, Quercus rugosa Née., Juniperus sp, Quercus resinosa Liebm., Arbutus sp. y Quercus potosina Trel. (Cuadro 8).
Cuadro 7 Índice de valor de importancia de especies arbóreas registradas en sitios de descanso del búho manchado (Strix occidentalis lucida) de la Sierra Madre Occidental, México (2015-2016).
| Familia | Especie | IVI | % |
|---|---|---|---|
| Fagaceae | Quercus rugosa Née. | 44.5 | 14.8 |
| Quercus sideroxyla Bonpl. | 39.5 | 13.2 | |
| Quercus obtusata Bonpl. | 28.1 | 9.4 | |
| Ericaceae | Arbutus sp. | 22.6 | 7.5 |
| Pinaceae | Pinus chihuahuana Engelmann. | 22.2 | 7.4 |
| Pinus cembroides Zucc. | 22.1 | 7.4 | |
| Fagaceae | Quercus potosina Trel. | 18 | 6 |
| Rosaceae | Prunus rhamnoides Koehn.* | 16.5 | 5.5 |
| Cupressaceae | Juniperus sp. | 14.9 | 5 |
| Pinaceae | Pinus devoniana Lindl. | 12.6 | 4.2 |
| Fagaceae | Quercus eduardi Trel. | 12.4 | 4.1 |
| Clethraceae | Clethra hartwegii Briton.* | 10.5 | 3.5 |
| Betulaceae | Alnus acuminata subs. Arguta (Schltdl.) Furlow.* | 5.4 | 1.8 |
| Fagaceae | Quercus viminea Trel. | 5.3 | 1.8 |
| Pinaceae | Pinus ayacahuite C. Ehrenb. ex Schltdl.* | 4.8 | 1.6 |
| Pinus sp. | 4.3 | 1.4 | |
| Scrophulariaceae | Buddleia cordata Kunth.* | 4.2 | 1.4 |
| Salicaceae | Salix bonplandiana Kunth. | 4.1 | 1.3 |
| Fagaceae | Quercus laeta Liebm.* | 3.9 | 1.3 |
| Ericaceae | Arbutus bicolor S. S. González, M. González, M. González & P.D Sorenson. | 3.8 | 1.3 |
| 300 | 100 |
* Especies no encontradas en sitios aleatorios del búho manchado (Strix occidentalis lucida).
Cuadro 8 Índice de valor de importancia de las especies arbóreas registradas en sitios aleatorios del hábitat del búho manchado (Strix occidentalis lucida) en la Sierra Madre Occidental, México (2015-2016).
| Familia | Especie | IVI | % |
|---|---|---|---|
| Fagaceae | Quercus sideroxyla Bonpl. | 53.0 | 17.6 |
| Pinaceae | Pinus chihuahuana Engelmann | 37.5 | 12.5 |
| Fagaceae | Quercus rugosa Née | 30.7 | 10.2 |
| Cupressaceae | Juniperus sp. | 24.1 | 8.0 |
| Fagaceae | Quercus resinosa Liebm.* | 22.7 | 7.5 |
| Ericaceae | Arbutus sp. | 21.0 | 7.0 |
| Fagaceae | Quercus potosina Trel. | 20.9 | 6.9 |
| Quercus eduardi Trel. | 16.1 | 5.3 | |
| Quercus candicans Née.* | 15.6 | 5.2 | |
| Quercus obtusata Bonpl. | 9.3 | 3.1 | |
| Pinaceae | Pinus devoniana Lindl. | 7.8 | 2.6 |
| Ericaceae | Arbutus bicolor S. S. González, M. González, M. González & P.D Sorenson. | 6.1 | 2.0 |
| Pinaceae | Pinus sp. | 5.9 | 1.9 |
| Meliaceae | Cedrela dugesii S. Wats.* | 5.8 | 1.9 |
| Salicaceae | Salix bonplandiana Kunth | 4.5 | 1.5 |
| Pinaceae | Pinus cembroides Zucc. | 4.2 | 1.4 |
| Fagaceae | Quercus viminea Trel. | 2.9 | 0.9 |
| Quercus praeco Trel.* | 2.8 | 0.9 | |
| Quercus durifolia Seemen.* | 2.8 | 0.9 | |
| Pinaceae | Pinus lumholtzii B.L. Rob. & Fernald.* | 2.6 | 0.8 |
| Fagaceae | Quercus scytophylla Liebm.* | 2.6 | 0.8 |
| 300 | 100 |
* Especies no encontradas en sitios de descanso del búho manchado (Strix occidentalis lucida).
El mejor modelo de regresión Poisson presentó un AIC = 87.5 y sus resultados sugieren que seis variables del hábitat presentaron el mayor efecto sobre las frecuencias de S. o. lucida, sobresaliendo las variables diámetro a la altura del pecho del árbol de percha, cobertura arbustiva del suelo y la altura del árbol de percha (Cuadro 9). El ACS mostró una asociación entre las frecuencias de S. o. lucida y las variables categóricas del hábitat, identificadas como variables significativas en el ARP. Las dimensiones consideraron el 36.1% de la inercia total e identificaron una asociación de los búhos en tres conjuntos de variables biológicas categóricas (Figura 3). Los conjuntos 1 y 3 definen la selección de los búhos por la altura de árboles de percha, la altura de percha y la altura de árboles de media a alta, así como el DAP del árbol de percha media, sobresaliendo la variable categórica de arbustos nula.
Cuadro 9 Resultados del análisis de Regresión Poisson entre las variables del hábitat (sitios de descanso y aleatorios) y los búhos manchados (Strix occidentalis lucida) registrados en la Sierra Madre Occidental, México (2015-2016).
| Variable | Error estándar | Probabilidad |
|---|---|---|
| Altura de árboles | 0.138 | 0.0197 |
| Altura del árbol de percha | 0.142 | 0.0008 |
| Altura de la rama de percha | 0.194 | 0.0139 |
| Cobertura del suelo arbustiva | 0.202 | 0.0006 |
| DAP del árbol de percha | 0.014 | 0.0001 |
| Cobertura del suelo material leñoso | 0.049 | 0.0121 |

Figura 3 Representación dimensional del ACS entre las frecuencias de búho manchado (Strix occidentalis lucida) y las variables biológicas categóricas del hábitat en la Sierra Madre Occidental, México (2015-2016).
Los análisis de Kruskal-Wallis no mostraron diferencias significativas (P > 0.05) en ninguna de las variables del hábitat, identificadas con coeficientes estadísticamente significativos por el ARP entre sitios de descanso y aleatorios (Cuadro 10), lo que sugiere que las condiciones generales del hábitat utilizado por el BM para descansar y forrajear son muy similares.
Cuadro 10 Resultados de los análisis Kruskal-Wallis para las variables del hábitat derivadas del ARP para los sitios de descanso y aleatorios del búho manchado (Strix occidentalis lucida) en la Sierra Madre Occidental, México (2015-2016).
| Variable | Valor H | Grados de libertad | Probabilidad |
|---|---|---|---|
| Altura de árboles | 33.761 | 36 | 0.575 |
| Cobertura del suelo arbustiva | 9.571 | 9 | 0.386 |
| Cobertura del suelo material leñoso | 17.137 | 15 | 0.310 |
| Altura del árbol de percha | 27.326 | 23 | 0.242 |
| DAP árbol de percha | 38.660 | 36 | 0.350 |
| Altura de la rama de percha | 21.388 | 18 | 0.260 |
En cuatro sitios de descanso (n = 3 en Aguascalientes, y n = 1 en Durango), los búhos también hicieron uso de cuevas para perchar. Estas cuevas tuvieron las siguientes características: a) largo de la cueva (1.8 ± 1.3 m), b) ancho de la cueva (0.7 ± 0.2 m), c) profundidad de la cueva (1.3 ± 0.5 m), d) altura de la superficie del suelo a la base de la cueva (4.7 ± 1.8 m), e) altura de la parte superior de la cueva hacia la parte final del macizo rocoso (3.2 ± 1.4 m) y f) altura total del macizo rocoso (10.2 ± 1.5 m).
Discusión
Localizamos 29 búhos en 11 sitios de descanso, con una relación de 2.6 búhos por sitio de descanso. El hábitat lo caracterizamos en 42 sitios. Los sitios de descanso los encontramos en bosques de encino-pino y encino, e identificamos 27 especies en donde los encinos fueron los más comunes. La regresión Poisson sugirió que seis variables del hábitat presentaron la mayor asociación con la presencia de S. o. Lucida, sobresaliendo en los árboles de percha las variables de diámetro a la altura del pecho, cobertura arbustiva del suelo y la altura del árbol, lo cual se confirmó con el ACS. Sin embargo, el análisis Kruskal-Wallis no mostró diferencias significativas (P > 0.05) entre éstas variables registradas en los sitios de descanso y aleatorios. En cuatros sitios de descanso (n = 3 en Aguascalientes, y n = 1 en Durango), los búhos también hicieron uso de cuevas para perchar.
El número de búhos registrados por sitio de descanso en este estudio fue superior (n = 2.6) a lo reportado para Chihuahua por Tarango et al. (1997) (n = 1.9), pero menor al registrado por Young et al. (1998) (n = 2.9) para el mismo estado; también fue superior al reportado para Aguascalientes por Tarango et al. (2001) y Márquez et al. (2002) con n = 1.3 y n = 1.6, respectivamente y para el de Zacatecas (n = 1.6) por Palma-Cancino et al. (2014). El número de búhos encontrados por sitio de descanso depende de las condiciones estructurales del hábitat, de la disponibilidad de sitios para descanso y anidación y de la disponibilidad de presas para el BM.
En este estudio encontramos a los búhos en su mayoría en bosques de encino-pino y encino y percharon preferentemente en encinos Quercus rugosa Née, Quercus obtusata Bonpl., Quercus sideroxyla Bonpl. y Quercus potosina Trel. La selección de hábitats de encino-pino por el BM se reportó para Aguascalientes (Tarango et al. 2001, Márquez et al. 2002) y para Nuevo México por Seamans et al. (1995). En Chihuahua, los sitios de descanso se relacionaron con Quercus spp., Pinus arizonica, Pinus ayacahuite y Pseudotsuga menziesii (Tarango et al. 1997). El BM utiliza también áreas dominadas por pinos piñoneros y cedros (Pinus edulis-Juniperus monosperma) para anidar (Bowden et al. 2015). En Nuevo México, Ganey et al. (2013) reportaron que el BM anida en bosques mixtos de coníferas (Abies concolor o Pseudotsuga menziesii) y la mayoría lo hace en cavidades de árboles muertos o en el muérdago (Arceuthobium spp.). Sin embargo, Young et al. (1998) reportaron que en Chihuahua el BM utiliza principalmente pinos (49%), encinos (36%) y abetos (7%). En Utah, Estados Unidos, Willey y Van-Riper III (2015) identificaron que los sitios de descanso (n = 189) se ubicaron preferentemente en rodales pequeños de bosques mixtos de coníferas, en matorral desértico, en pino piñonero, cedro y en zonas ribereñas.
En México, los encinos son un componente muy común e importante en el hábitat del búho manchado (Tarango et al. 1997, Young et al. 1998, Tarango et al. 2001, Márquez et al. 2002 y Palma-Cancino et al. 2014), ya que éstos proporcionan condiciones de temperatura adecuadas para descansar, anidar, criar a sus polluelos y sitios de alimentación (Márquez et al. 2002). Nosotros encontramos que el número de especies arbóreas en los sitios de descanso fue superior (20 vs. 7 especies) al encontrado en Chihuahua (Tarango et al. 1997) y en Zacatecas (20 vs. 4) (Palma-Cancino et al. 2014). Aunque se ha demostrado que los encinos son importantes para proveer condiciones microclimáticas requeridas para S. o. lucida, sin duda la estructura, cobertura y densidad del dosel son factores también ecológicamente importantes para esta especie.
Aunque los valores de la densidad de árboles vivos y muertos, el porcentaje de la cobertura de dosel, el porcentaje de cobertura del suelo de los componentes hojarasca y rocas, fueron mayores en los sitios de descanso que en los aleatorios, no fueron diferentes estadísticamente (P > 0.05). Hathcock y Haarmann (2008) identificaron que en Nuevo México el BM selecciona áreas con mayor diversidad, densidad, altura de árboles, mayor cobertura del dosel y más arbustos. Asimismo, Ganey et al. (2014) reportaron que, en Sacramento, Nuevo México, los sitios de anidación del BM se caracterizaron por tener una cobertura del dosel y área basal mayor que los sitios aleatorios. Si bien el BM presenta preferencias específicas de hábitat para desarrollarse y sobrevivir, sin duda la variable más sobresaliente es la cobertura del dosel.
El promedio de la elevación registrada está en los rangos reportados en México (Tarango et al. 1997, Young et al. 1998, Tarango et al. 2001, Márquez et al. 2002, Bravo-Vinaja et al. 2005, Palma-Cancino et al. 2014). Sin embargo, la elevación (2821 m) del sitio de descanso de Chalchihuites, Zacatecas, es la más alta registrada para México. En contraste, el sitio de descanso con la menor elevación (2072 m) se registró en Chihuahua (Young et al. 1998).
Los búhos utilizaron laderas con exposición noreste y norte. Estas laderas con exposición norte ofrecen condiciones más frescas y húmedas requeridas por el BM (Barrows 1981, Ganey et al. 1993). Se han reportado resultados similares por Young et al. (1998) y Tarango et al. (1997) para el norte y por Tarango et al. (2001), Márquez et al. (2002) y Palma-Cancino et al. (2014) para el centro de México, y para los Estados Unidos por Barrows (1981) y Willey y Van-Riper III (2015).
Los arboles de percha tuvieron una altura promedio de 10.5 ± 2.4 m, esta altura fue menor a la reportada por Tarango et al. (1997) en Chihuahua, la cual fue de 13.0 ± 2.8m, pero muy similar a la de Aguascalientes (10.4 ± 1.1 m) (Tarango et al. 2001). La altura promedio de percha para Aguascalientes fue de 7.0 ± 0.7 m (Tarango et al. 2001) y de 5.8 m (Márquez et al. 2002); mientras que en Zacatecas fue de 7 ± 2.1 m (Palma-Cancino et al. 2014). Asimismo, en Utah la altura promedio de los árboles de percha fue de 9.5 m y la de percha de 3.7 m; sin embargo, cuando el BM descansó en acantilados, su altura de percha fue mayor (17.2 m) (Willey y Van-Riper III 2015). Al respecto, Tarango et al. (1997) encontraron que en Chihuahua la densidad de árboles donde el BM utilizó árboles para perchar (643 árboles ha-1) fue mayor que donde utilizó acantilados (610 árboles ha-1). Estos resultados indican que la estructura y condición del ecosistema son importantes para proveer microambientes requeridos por el BM, al igual que para cualquier especie, pero parece ser que ésta tolera diversas condiciones forestales.
Aunque no hubo diferencias estadísticas (P > 0.05) en los valores de la cobertura del dosel entre sitios, el valor de esta variable fue mayor en los sitios de descanso que en los sitios aleatorios. Al respecto, Barrows (1981) y Willey y Van-Riper III (2015) enfatizan la importancia de esta variable, específicamente en las laderas con orientación norte. Se ha establecido que el uso de ambientes más frescos por el BM es por su falta de capacidad para disipar el calor corporal (Barrows 1981, Ganey et al. 1993) y que su plumaje lo protege de las temperaturas frías. Al respecto, Ganey et al. (1993) observó el aleteo gular del BM a una temperatura de 30oC, el aleteo gular es un mecanismo para disipar calor corporal.
En Nuevo México, los sitios de anidación presentaron mayor cobertura de dosel y más área basal (Ganey et al. 2013). Asimismo, Young et al. (1998) en Chihuahua, México, reportaron que los sitios de descanso se ubicaron en áreas más inclinadas, con más capas de vegetación, mayor cobertura del dosel y de área basal que los sitios aleatorios. Resultados similares se reportaron por Bond et al. (2004) quienes identificaron una asociación del búho manchado californiano (S. o. occidentalis) con árboles grandes, una cobertura del dosel alta y una estructura vertical diversa; sin embargo, los árboles grandes y la cobertura del dosel fueron los componentes que más explicaron el hábitat de anidación del búho. En Nuevo México, Seamans et al. (1995) reportaron que los árboles de anidación del BM tuvieron una edad promedio de 163.7 años y un diámetro de 60.6 cm. Timm y McGarigal (2016) identificaron que la cobertura del dosel y la inclinación de la pendiente fueron más importantes en la selección del hábitat por el BM. Asimismo, Hathcock y Haarmann (2008) en Jemez, Nuevo México, identificaron que el BM se ubicó en hábitats con mayor diversidad, densidad y altura de árboles, cobertura del dosel y densidad de arbustos. Willey y Van-Riper III (2014) encontraron diferencias significativas entre sitios de descanso y sitios aleatorios en las variables cobertura del dosel, número de árboles, número de capas de vegetación, altura y diámetro de los árboles y área basal. Adicionalmente, en Utah Willey y Zambon (2014) encontraron que la inclinación de la ladera y la elevación fueron las variables que mejor predicen la ocurrencia del BM en ambientes rocosos.
Aunque en este estudio no detectamos diferencias estadísticas (P > 0.05) entre los valores de la cobertura del suelo componentes hojarasca y rocas, los sitios de descanso presentaron mayores valores de ambas variables que los sitios aleatorios, resultados similares se reportaron por Young et al. (1998) y por Palma-Cancino et al. (2014). Presumiblemente el arreglo de la cobertura del suelo tiene una influencia en la presencia, cantidad y disponibilidad de presas. Al respecto, Carey et al. (1992) y Ward et al. (1998) sugieren que S. o. caurina selecciona hábitats con base en la distribución de sus presas. Es muy probable que este comportamiento también lo presente el BM, pues Ganey et al. (2014) estimaron que la biomasa de presas en áreas con ocurrencia de incendios forestales fue mayor a la de las áreas de anidación. Block et al. (2005) recomiendan que las acciones de conservación para el BM deben enfocarse al incremento de presas y en proveer condiciones ambientales para descanso y anidación; asimismo, enfatizaron la importancia de las especies arbustivas y herbáceas en el hábitat del BM, así como la aplicación de fuego prescrito y del manejo de la capacidad de carga. Asimismo, Bond et al. (2009) reportaron que S. o. occidentalis se asoció con áreas incendiadas, las cuales presentan mayor cobertura de arbustivas y herbáceas que favorecen la presencia de presas.
El BM ha demostrado su habilidad para utilizar una diversidad de microambientes para descansar, anidar, migrar o forrajear (Block et al. 2005, Willey y Van-Riper III 2014, Willey y Van-Riper III 2015). Sin duda, las condiciones estructurales de los ecosistemas en los que reside son importantes; sin embargo, otros componentes de su hábitat como el espacio y fuentes alimenticias son también importantes para su supervivencia al igual que la cobertura arbustiva y herbáceas que favorecen la presencia de presas (Young et al. 1998, Block et al. 2005). Por ello, es importante el manejo del bosque para proveer condiciones de descanso, anidación y de alimento. Una herramienta de manejo es el fuego prescrito pues éste incrementa la diversidad de presas preferidas por el búho al generar hábitats de orilla (Ganey et al. 2014).
Seis variables del hábitat presentaron coeficientes estadísticamente significativos sobre los individuos de S. o. lucida registrados, y sobresalieron el DAP del árbol de percha, cobertura arbustiva del suelo y la altura del árbol de percha. Esta información es congruente con los resultados obtenidos para esta especie (Seamans et al. 1995, Hathcock y Haarmann 2008, Willey y Van-Riper III 2014).
El BM usó cuevas para perchar, en México el uso de acantilados rocosos es común en el norte y centro de México (Tarango et al. 1997, Márquez et al. 2002, Palma-Cancino et al. 2014). Dependiendo de las características del paisaje, esta especie selecciona componentes específicos de su hábitat; por ejemplo, en Utah utiliza cuevas en cañones rocosos (Willey y Van-Riper III 2015) y alturas promedio de las perchas en cuevas de 4.7 m. Adicionalmente, Mullet et al. (2010) reportan el uso de cañones angostos de Nuevo México y Texas donde la cobertura del dosel, el porcentaje de árboles jóvenes y la cobertura de roca en los sitios de descanso y anidación fueron mayores que las de los sitios aleatorios.
Los estudios para esta especie en México y en los Estados Unidos demuestran que el búho manchado selecciona preferentemente ambientes forestales templados (Ganey y Balda 1994, Tarango et al. 1997, Young et al. 1998, Peery et al. 1999, Tarango et al. 2001, Márquez et al. 2002, Palma-Cancino et al. 2014, Willey y Van-Riper III 2015) con asociaciones de encino-pino y pino encino. Por ello las estrategias de manejo para el hábitat del BM en México deben considerar la conservación de espacios de aproximadamente 235 ha (124.2 ha de coníferas mixtas y 11.6 ha de pino) alrededor de los sitios de descanso (Peery et al. 1999). Sin duda, México representa una gran oportunidad para estudiar las capacidades adaptativas del BM a ambientes forestales alterados y degradados. En este proceso será importante determinar sus áreas de actividad y se vislumbra que sus necesidades de espacio podrían ser mayores a lo reportado por Willey y Van-Riper III (2014) en los Estados Unidos, los cuales varían entre 70 y 1160 has.
Este estudio mostró la relación del búho manchado con los bosques de encino-pino y encino. Los sitios de descanso reproductivos tuvieron una densidad de árboles mayor que la de los sitios de descanso no reproductivos y sitios aleatorios. Identificamos 27 especies arbóreas en donde los encinos fueron las especies más comunes. La regresión Poisson identificó que seis variables del hábitat presentaron la mayor relación con los S. o. lucida registrados y que en cuatro sitios de descanso los búhos utilizaron cuevas para perchar. Esta información detallada sobre las preferencias de hábitat del búho manchado para descansar es útil para establecer planes de manejo forestal para la conservación de la especie en México. Sin embargo, es necesario realizar estudios manipulativos y observacionales a largo plazo como lo proponen Noon y Franklin (2002). En México, en específico, se requiere emprender estudios sobre el efecto de los tratamientos silvícolas en las poblaciones del BM, sobre el impacto del fuego, la disponibilidad de presas y conocer el ámbito hogareño del BM ante diferentes escenarios de conservación del bosque. Asimismo, en el área de estudio se debe realizar un aprovechamiento forestal selectivo que permita la permanencia de árboles más grandes requeridos por Strix occidentalis lucida y cuantificar la relación entre calidad de hábitat, la sobrevivencia y reproducción de esta subespecie como lo recomienda Peery et al. (1999).











 nueva página del texto (beta)
nueva página del texto (beta)


