Editor asociado: Jorge Vega Rivera
Introducción
Las aves terrestres son indicadoras de la salud de los ecosistemas, ya que los cambios en sus poblaciones reflejan cambios en los hábitats. Además, proporcionan servicios ambientales como la dispersión de semillas, la polinización y el control de plagas. También son un recurso económico pues atraen a miles de ecoturistas de observación de aves (Berlanga et al. 2010). Por ello, es importante estudiar sus poblaciones y las características de la historia natural de las aves para determinar aspectos demográficos poblacionales (sexo, edades, longevidad) que ayudan a su conservación. En las zonas tropicales y especialmente en la península de Yucatán (Navarro-Sigüenza et al. 2014) encontramos elevada diversidad avifaunística, pero muy poca información de las poblaciones de aves y especialmente de aquellas aves endémicas. Según la Evaluación Trinacional realizada por Compañeros en Vuelo, las aves neotropicales de México enfrentan fuertes amenazas y disminuciones en sus poblaciones (Berlanga et al. 2010). Las aves endémicas presentan además una mayor vulnerabilidad para su conservación debido a su distribución restringida (González-García y Gómez de Silva 2003). Por lo tanto, estas especies representan el grupo de aves de mayor importancia para la conservación en los tres países (Canadá, Estados Unidos y México) (Berlanga et al. 2010).
Melanoptila glabrirostris, localmente llamada dzibabán, es una especie del orden Passeriformes y de la familia Mimidae (Howell y Webb 1995), endémica de la península de Yucatán y cuasiendémica de México (González-García y Gómez de Silva 2003). La población de Isla Cozumel es considerada una subespecie endémica de esta isla, Melanoptila glabrirostis cozumelana (Paynter 1954). La especie está catalogada como casi amenazada en la lista roja de la IUCN (Bird Life International 2008). Además, en México está considerada en la NOM-059-ECOL-2010 como una especie en Protección Especial (SEMARNAT 2010).
La familia Mimidae está formada de por lo menos 34 especies distribuidas por casi toda América (Cody 2005). Esta familia forma un clado con dos subclados. Uno es más diverso, que incluye Toxostoma, Oreoscoptes, Mimus, Nesomimus y Mimodes. El otro subclado incluye tres géneros de “maulladores” (Dumetella, Melanoptila y Melanotis), además de cuatro géneros endémicos de las Antillas (Ramphocinclus, Margarops, Allenia y Cinclocerthia) (Lovette y Rubenstein 2007). Melanoptila, Dumetella, Ramphocinclus, Margarops, Allenia y Cinclocerthia forman un grupo monofilético (Hunt et al. 2001, Lovette y Rubenstein 2007). Melanoptila está cercanamente relacionada con los mímidos de las Antillas. La migratoria Dumetella carolinensis, morfológicamente muy similar al dzibabán, es también una de las especies filogenéticamente más cercana, junto a Ramphocinclus brachyurus.
Es importante determinar la edad y el sexo de las aves ya que condiciona parámetros biométricos, fisiológicos y demográficos (Swanson et al. 1999, Clarabuch 2000). Para individuos vivos, los caracteres que cambian de manera temporal pueden utilizarse como criterio para la determinación de su edad. Éste es el caso de las características externas que puedan ser examinadas a simple vista, como el plumaje, la osificación craneal o la coloración de las partes no emplumadas (patas, pico, iris, anillo ocular, interior de la mandíbula, lengua) (Clarabuch 2000). Por ejemplo, en el caso de Dumetella carolinensis, la coloración ocular varía con la edad (Pyle 1997).
Por otro lado, la diferenciación del sexo se puede realizar a través de características morfológicas cuando no existe dimorfismo sexual, que varían en la temporada de reproducción. Así, en los machos la cloaca se agranda, formando la protuberancia cloacal (PC) y en las hembras se genera el parche de incubación de los huevos (PI, Pyle 1997). Además, la utilización de la cuerda alar para sexar individuos puede ser muy útil cuando no se presentan características reproductivas. En la familia Mimidae, el dimorfismo sexual es nulo o muy ligero, aunque los machos a veces presentan cuerda alar mayor al de las hembras (Cody 2005). Para el dzibabán se ha sugerido que podrían haber diferencias entre adultos y subadultos (Howell y Webb 1995) y entre machos y hembras (Ridgway 1907).
En realidad, la información biológica publicada del dzibabán es muy escasa que sólo existe en guías de campo (e.g.Jones 2003, Perlo 2006) y muy pocas publicaciones. Por ejemplo, hay una publicación en el cayo Caulker, Belice, en temporada no reproductiva (Miller y Miller 1991) donde encontraron que el dzibabán era abundante: 15.5% y 22.4% de las especies reportadas en sus conteos por puntos y redes de niebla. Otro estudio describió características de su reproducción a través de una muestra de 23 nidos y sugiere que los hábitats reproductivos del dzibabán son el bosque litoral (littoral forest), la zona arbustiva-manglar y los bordes de bosque litoral (Morgenthaler 2003). A pesar de este último estudio, no existe información detallada sobre características reproductivas de la especie; por ejemplo, la duración del ciclo del nido.
La conservación de las especies depende del conocimiento que se tenga sobre su biología reproductiva y las características del hábitat que influyen en la reproducción (Martin 1992). La costa en la Reserva de la Biosfera de Sian Ka’an y en general en toda la costa de Quintana Roo ha estado sometida a un acelerado cambio de uso de suelo debido principalmente a la inversión inmobiliaria para el turismo (Castillo-Beltrán 1997, Figueroa-Zavala et al. 2015). Lo anterior ha ocasionado que la costa de Quintana Roo esté fuertemente fragmentada por lo que la generación de información básica de historia natural y particularmente sobre la reproducción del dzibabán será mucho más difícil. Además, el estudio de poblaciones donde la urbanización aún es baja podrá encontrar medidas de mitigación de los daños que ocasionarán los desarrollos urbanos masivos. Por todo ello, en este estudio reportamos características morfológicas y aspectos reproductivos e historia natural del dzibabán durante la temporada reproductiva 2008.
Área de estudio
El trabajo de campo lo realizamos en la costa norte de la Reserva de la Biosfera de Sian Ka’an, entre los 20º04’ N, 87º29’ O y los 19º52’ N, 87º26’ O. Ésta se localiza en la porción centro-oriente de la península de Yucatán, en el estado de Quintana Roo, México. La reserva está ubicada en la costa central de Quintana Roo en el mar Caribe y presenta una superficie de 651 mil ha, con lo cual se clasifica como una de las áreas protegidas más grandes del trópico mexicano (Mazzotti et al. 2005). El clima es cálido subhúmedo con lluvias en verano y una temperatura media anual de 25.7ºC. Sian Ka’an ocupa una planicie calcárea formando un gradiente que va de sitios secos hasta inundables (Olmsted y Duran 1990). Toda la superficie de la reserva es manejada por la Comisión Nacional de Áreas Naturales Protegidas (CONANP) y es propiedad federal, menos el 5.3% (SEMARNAT, Programa de Manejo 2014), de los cuales un 2%, especialmente en la costa, es propiedad privada (Ortiz Moreno 2009, obs. personal).
El área de estudio es una franja de vegetación de duna costera sobre una isla barrera (Clark 1983), también llamada cordón litoral y penilaguna (Miranda 1978) formada por el grupo dominado de Thrinax y Pithecellobium (Olmsted y Duran 1990). Esta franja tiene aproximadamente 45 km de largo y no más de 500 metros de ancho. Se seleccionaron dos sitios de estudio con vegetación similar a una distancia de aproximadamente 15 km el uno del otro.
Métodos
Morfología: morfometría (medidas lineales) y determinación de sexo y edad
Capturamos individuos de dzibabán de febrero a julio de 2008 con redes de niebla de 12 metros de largo y 31 mm de luz de malla; seguimos los protocolos de anillamiento internacionales (Pinilla 2000, The North American Banding Council 2001, DeSante et al. 2005). Se consideraron las siguientes medidas morfométricas: longitud del pico (culmen), longitud del tarsometatarso, cuerda alar y peso. La longitud del pico (culmen) la medimos con un vernier, desde la narina hasta la punta de la mandíbula superior (Pyle 1997). La longitud del tarsometatarso la tomamos también con un vernier, siendo ésta la distancia entre la juntura que conecta el tarsometatarso con el tibiotarso y el final de la última escama antes de que emergen los dedos (Pyle 1997). La cuerda alar la medimos en su posición natural sin ser aplanada, con una regla que dispone de un tope al cero (Pyle 1997). Todas las medidas se consideraron en milímetros. La masa corporal la tomamos con un dinamómetro de la marca Pesola de 60 gramos. Todos los instrumentos los calibramos. Durante la temporada reproductiva (de abril a agosto de 2008), determinamos el sexo de las aves mediante el parche de incubación (PI) o la placa incubadora, que sólo se presenta en las hembras, y la protuberancia cloacal (PC), que sólo se presenta en los machos (Pyle 1997).
Para determinar la edad de las aves en categoría de segundo año (aves nacidas un año anterior a su captura), buscamos rémiges juveniles en las alas. Estas rémiges tienen menos barbas y bárbulas, contienen estructura más ligera y un color más pálido (Pyle 1997, Clarabuch 2000). También observamos la coloración del iris con el fin de determinar si se presentaban diferencias entre individuos adultos e individuos de segundo año. La captura de los datos de campo la realizó la primera autora (BRC).
Para los análisis estadísticos utilizamos la prueba t de Student para encontrar variación en las medidas de la cuerda alar entre machos y hembras, y una prueba de bondad de ajuste (log-likelihood) para determinar diferencias de frecuencias de aparición de los colores de ojo entre individuos adultos y subadultos. Todos los datos los reportamos como media ± desviación estándar. Consideramos una prueba significativa con una P < 0.05.
Características reproductivas y de comportamiento
Realizamos la búsqueda intensiva y monitoreo de nidos de dzibabán en los dos sitios de estudio de 20 hectáreas cada uno (Martin y Geupel 1993). Para localizar los nidos utilizamos dos técnicas: búsqueda sistemática de nidos y detección de adultos que acarrean material de construcción de nidos o alimento para sus pollos, los cuales guían directamente al lugar donde está el nido. Al registrar un nido identificamos la especie de planta soporte y revisamos el nido con un espejo (Parker 1972). A través de los nidos que logramos monitorear durante el ciclo completo o en alguno de sus estadios (construcción, incubación y empollamiento), determinamos la duración del ciclo de nidación de la especie. La incubación correspondió al periodo entre la puesta del primer huevo y la eclosión del primer huevo. El empollamiento correspondió al periodo entre la eclosión del primer huevo y el abandono del nido por el último polluelo. Visitamos los nidos cada cuatro días y realizamos algunas observaciones del comportamiento de adultos previamente marcados con anillos de colores.
Resultados
Morfología y morfometría (medidas lineales)
Durante el estudio capturamos un total de 167 individuos. Los resultados morfológicos fueron: la longitud del culmen del dzibabán: 12.33 ± 0.75 mm (rango: 10.28 - 14.93 mm, n = 91), la longitud del tarsometatarso: 28.53 ± 1.11 mm (rango: 26.16 - 33.33 mm, n = 76) y la masa de 32.6 ± 2.4 g (rango: 26.5 - 42.0 g, n = 158). No incluimos los individuos nacidos el año de su captura (n = 7).
Diferenciación por sexo y edad
De acuerdo con las medidas morfológicas, encontramos diferencias significativas en la cuerda alar entre hembras y machos (t = -5.05, gl = 106, P < 0.001). En las hembras (n = 30) la cuerda alar fue de 87.68 ± 3.04 mm, con un rango de 82.00 a 92.50 mm (IC al 95% 86.50 - 88.80 mm); y en los machos (n = 78) de 90.90 ± 2.93 mm con un rango de 85 a 99 mm, (IC al 95% 90.24 - 91.56 mm) (Figura 1). Por otro lado, encontramos que las hembras fueron más pesadas que los machos durante la temporada de reproducción, entre el 1 mayo y el 31 de julio (♀: 34.8 ± 3.1 g, n = 20, ♂: 32.1 ± 1.9 g, n = 48, t = 4.34, gl = 66, P < 0.001). Las diferencias son probablemente debidas a que en la temporada reproductiva las hembras tienen en su interior huevos y más grasa que los machos.

Figura 1 Medidas de cuerda alar de individuos de dzibabán hembras (n = 30) y machos (n = 78) capturados durante 2008 en la Reserva de la Biosfera Sian Ka’an, México. Las cuerdas alares siguieron distribución normal (Shapiro-Wilk ♀: W = 0.940, P = 0.081, ♂: W = 0.972, P = 0.285). Las líneas continuas representan medianas y las líneas discontinuas medias. Los extremos representan los 25a y 75a percentiles, las líneas verticales representan los 10ª y 90ª percentiles. Los puntos representan datos extremos. Existe diferencia significativa en la cuerda alar de hembras y machos (t = -5.05, gl = 106, P < 0.001).
Las aves de segundo año, las cuales presentaron plumas alares juveniles, poseían los ojos frecuentemente de coloración marrón (G = 8.55, gl = 1, P = 0.003), mientras que las aves que no fueron identificadas de segundo año presentaron los ojos rojizos (G = 13.25, gl = 1, P < 0.001) (Figura 2). Por lo tanto, el color del ojo puede ser un criterio suplementario para determinar la edad, además de la presencia de rémiges juveniles en las alas. Sin embargo, este criterio faltaría evaluarlo con aves de edad conocida.
Temporada reproductiva
El dzibabán inicia su temporada reproductiva a mediados de abril, considerando que el 22 de abril observamos al primer dzibabán llevando material para la construcción del nido, y el 26 de abril capturamos la primera hembra con parche de incubación. Finalizada la temporada de campo el 12 de agosto, aún había individuos con nidos activos. Durante una visita al sitio de estudio a principios de septiembre, ya no registramos nidos activos. Por lo tanto, la temporada de reproducción puede considerarse de por lo menos cuatro meses (de mediados de abril a finales de julio). En toda la temporada 2008 encontramos 117 nidos activos.
Ciclo del nido y tamaño de nidada
Desde el inicio de la construcción del nido hasta la deposición del primer huevo, transcurrieron entre 4 y 12 días (n = 12). La puesta de huevos abarcó por lo menos dos días (n = 6). El número de días de incubación estimado fue de mínimo 11 y máximo 18 días (n = 7); en los tres nidos en que obtuvimos datos exactos (observamos directamente la eclosión de huevos), la incubación duró entre 12 y 17 días. Finalmente, los días de empollamiento fueron de 11 a 15 días (n = 3), el único nido confirmado de 13 días (observamos la salida de los volantones). Con estos datos se determinó que la duración del ciclo del nido fue de 27 a 32 días. Los nidos presentaron en promedio de 2.51 ± 0.51 huevos (rango = 2 - 3, n = 37).
Tareas reproductivas y alimentación
La construcción del nido se llevó a cabo por ambos miembros de la pareja, aunque los machos son los que realizaron la mayor parte de su construcción. Las hembras de dzibabán fueron las que incubaron los huevos, aunque no obtuvimos información durante la incubación nocturna. El alimento más consumido fue el fruto de la palma Thrinax radiata. También observamos a dzibabán consumiendo fruto de chechén (Metopium brownei) y del arbusto Pithecellobium keyense, e incluso cangrejos atropellados en la carretera y restos de alimentos humanos. Durante el pico de temporada de empollamiento (junio-julio), observamos varios individuos buscando y capturando insectos en el suelo, probablemente para la alimentación de los pollos. Observamos que los pollos eran alimentados con artrópodos y a veces con frutos de palma T. radiata y otros frutos. Otra estrategia de alimentación que observamos el 26 de junio de 2008 fue el aprovechamiento de una explosión de hormigas voladoras, las cuales eran capturadas en la carretera de terracería y almacenadas (5-10 hormigas) en el pico.
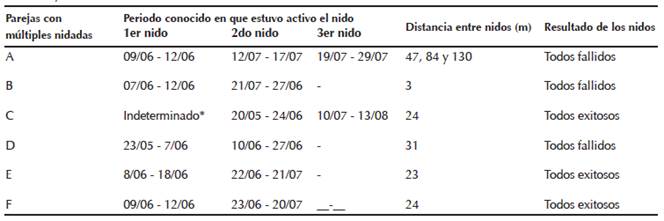
Parejas
Las parejas se mantuvieron juntas toda la temporada de estudio (n = 6 parejas). En varias parejas identificadas observamos reanidación dos veces (n = 4 parejas) y tres veces (n = 2 parejas). El número de días entre las nidadas fue variado, con un promedio de 12 días. En los nidos fallidos (n = 3), transcurrieron de dos a nueve días desde la pérdida del nido hasta el inicio de la construcción del siguiente nido. En los nidos exitosos (n = 3 parejas), transcurrieron de cuatro a 22 días desde que el último volantón salió del nido hasta el inicio de la construcción del siguiente nido. En el caso de las parejas exitosas en su primer intento, todas las nidadas sucesivas fueron exitosas, mientras que lo contrario ocurrió para las parejas que fracasaron en el primer intento, es decir, fallaron en intentos posteriores (Cuadro 1).
Plantas usadas para la construcción del nido
El dzibabán utilizó por lo menos cinco especies de plantas como soporte para sus nidos (n = 64). Las especies más utilizadas fueron la palma Thrinax radiata (60.9% de los nidos), el arbusto Pithecellobium keyense (25.0%) y en menor grado el árbol Metopium brownei (3.1%), el arbusto Coccoloba uvifera (1.6%) y la palma Cocos nucifera (1.6%), así como otras plantas no identificadas (7.8%), e incluso uno de los nidos se registró en un tejado. Los nidos que estuvieron colocados en la palma T. radiata en su mayor parte estaban compuestos de la misma fibra de la palma.
Vocalización
El canto del dzibabán es melódico, varía según la localidad y, como el cenzontle (Mimus sp.), puede imitar sonidos de su entorno. Los machos de dzibabán presentan dos tipos de cantos, uno con intensidad alta y otro con intensidad muy baja. Varias veces durante nuestras visitas a los nidos, al acercarnos, los machos utilizaban el canto de intensidad baja como estrategia de aviso de posible depredador. Las hembras de dzibabán, por otro lado, realizaban sonidos de alarma de alta intensidad.
Discusión
En este estudio reportamos por primera vez datos morfométricos para el dzibabán con un tamaño de muestra mucho mayor a los estudios previos (Ridgway 1907, Paynter 1954, Morgenthaler 2003). Las mediciones que realizamos revelan la existencia de dimorfismo sexual, aunque las medidas de masa corporal tendrían que hacerse fuera de la temporada de reproducción. Ridgway (1907) también detectó dimorfismo sexual, y obtuvo medidas de cuerda alar similares. Encontramos que las hembras fueron más pesadas que los machos durante la temporada reproductiva, al igual que Morgenthaler (2003). Esta autora encontró que las hembras eran 2 g más pesadas que los machos, similar al presente estudio, pero las masas medias que reporta (♀: 36.5 g; ♂: 34.6 g) son superiores en aproximadamente 2 g a las reportadas en el presente estudio. El tamaño de muestra de Morgenthaler (2003) fue pequeño (n = 8). Con respecto a la muda, para aclarar la distinción entre aves de primer año y aves de mayor edad, proponemos realizar estudios de patrones de muda para esta especie y así verificar si las aves que no presentan rémiges juveniles son realmente aves que nacieron después de segundo año durante la temporada reproductiva.
En general, los mímidos tienen una temporada reproductiva de más de cinco meses (Cody 2005). Sin embargo, de acuerdo con los registros de este estudio para el dzibabán, su temporada fue más corta y similar a la del cenzontle tropical, Mimus gilvus, que comparte área de distribución y se extiende de finales de la temporada de secas a principios de la temporada de lluvias (Cody 2005). No encontramos información para la subespecie M. g. leucophaeus que comparte hábitat con el dzibabán.
En este estudio el ciclo del nido del dzibabán es de 27 a 32 días, similar a los 28 días que se designó en el estudio de éxito reproductivo del dzibabán durante las temporadas 2008 y 2009 (Roldán-Clarà et al. 2013). En el estudio de Morgenthaler (2003) el ciclo de nidos fue similar (17 días de incubación, 12-13 días de empollamiento). También semejante es el periodo de incubación y empollamiento de D. carolinensis, de 13 y 12 días, respectivamente (Cody 2005) y el de R. brachyurus, de 14 y 12 días (Temple 2005).
El promedio de huevos por nido fue semejante a lo reportado por Morgenthaler (2003). Lo cual coincide con muchas aves tropicales (Skutch 1985, Martin et al. 2000), donde el tamaño promedio de las nidadas es de dos huevos (Skutch 1985). Por ejemplo, para el mímido tropical Ramphocinclus brachyurus, la nidada es de 1.97 ± 0.02 y oscila entre uno y tres huevos (Temple 2005). Por otro lado, para Dumetella carolinensis, que se reproduce en zonas templadas, el tamaño de nidada es en promedio 3.4 huevos (Cimprich y Moore 2008). La construcción del nido la realiza principalmente, pero no exclusivamente, el macho, a diferencia de D. carolinensis donde es la hembra quien lo construye (Cody 2005).
Consideramos que el dzibabán es generalista en su alimentación y probablemente en la elección de sitios de anidación, ya que las especies más utilizadas como soporte para sus nidos también fueron las más abundantes en los sitios de estudio (Roldá-Clarà 2009), pero más estudios detallados son necesarios. Con respecto a la vocalización, el dzibabán utiliza estrategias de alarma parecidas a D. carolinensis (Cimprich y Moore 2008).
Con respecto al éxito de las nidadas, encontramos parejas con todos sus nidos exitosos o con todos sus nidos fallidos. La edad de los individuos influye de manera notoria en su éxito reproductivo (Weimerskirch 1990, Martin 1995, Ludwigs y Becker 2005), aunque también puede ser un factor importante el tiempo que la pareja ha estado unida (Weimerskirch 1990). Asimismo se ha sugerido que la dominancia social puede influir en el éxito de reproducción de los individuos (Martin 1995). Si las parejas de dzibabán más exitosas son dominantes, estaríamos hablando de jerarquización y por lo tanto indicios de complejidad social y posibilidad de reproducción cooperativa o reproducción plural (plural breeding, Cockburn 2004). Varios mímidos tropicales presentan comportamiento reproductivo complejo (Cody 2005), por lo que aún falta mucho por conocer sobre la reproducción y la socioecología del dzibabán.
El dzibabán comparte características reproductivas y morfométricas con sus especies filogenéticamente relacionadas: Ramphocinclus brachyurus y D. carolinensis. Las diferencias primordiales entre M. glabrirostris y D. carolinensis son precisamente debidas a que una es residente tropical y la otra es migratoria (tamaño de nidada, reanidación, ciclo de incubación, entre otros; Skutch 1985). La información generada en este estudio es un importante avance en el conocimiento biológico del dzibabán. Considerando su distribución restringida y su situación de conservación, es prioritario realizar más investigaciones con especie.











 text new page (beta)
text new page (beta)