Editor asociado: Diego Santiago Alarcón
Introducción
El gorrión altiplanero o de Worthen (Spizella wortheni) es una ave endémica del altiplano mexicano que no realiza movimientos migratorios y habita áreas semi-desérticas, en el ecotono de pastizal y matorral (Rising 1996, Canales-del-Castillo et al. 2010). Históricamente tuvo una distribución más amplia desde el centro al norte de México y sur de EUA (Wege et al. 1993); sin embargo, en los últimos 35 años sólo se han tenido registros en un área restringida dentro de los límites de los estados de Nuevo León, Coahuila, Zacatecas y San Luis Potosí (Wege et al. 1993, Canales-del-Castillo et al. 2010, Canales-Delgadillo et al. 2015). Su tamaño poblacional se estima en al menos 100 individuos (Birdlife 2016), lo cual se debe muy probablemente a los mismos factores que han afectado a otras poblaciones de aves de pastizal en Norteamérica, como la reducción y fragmentación de su hábitat por la conversión a zonas agrícolas y el sobrepastoreo (Dinerstein et al. 2000, Askins et al. 2007, Estrada-Castillón et al. 2010). Dicha restricción distribucional y poblacional ha sustentado su protección como especie en peligro de extinción por las leyes mexicanas (NOM-059-SEMARNAT-2010) (SEMARNAT 2010), y su inclusión bajo la misma categoría en la Lista Roja de Especies Amenazadas por organizaciones internacionales (Birdlife 2016). El conocimiento de su biología es escaso, y se ha centrado en generar información actualizada sobre su distribución, tamaño poblacional, hábitat y éxito reproductivo (e.g.Canales-del-Castillo et al. 2010, Canales-Delgadillo et al. 2015); sin embargo, poco se ha explorado sobre otros aspectos de su historia natural.
Las enfermedades infecciosas en vida silvestre impactan en la salud y limitan el tamaño de las poblaciones, por ejemplo, reduciendo la supervivencia (Martínez-de la Puente et al. 2010); además de ser un factor que actúa negativamente junto con otros fenómenos estocásticos, demográficos y relativos a las actividades humanas, lo cual incrementa el riesgo de extinción en especies vulnerables (Brooke et al. 2008), por lo que el monitoreo de agentes infecciosos debe ser considerado en los planes de manejo (Bertram et al. 2015). Con el objetivo de incrementar el conocimiento en esta especie y realizar una primera aproximación sobre la importancia del parasitismo para la viabilidad de la misma, evaluamos la composición e intensidad de parásitos en heces fecales y sangre, así como la cuantificación diferencial de leucocitos.
Métodos
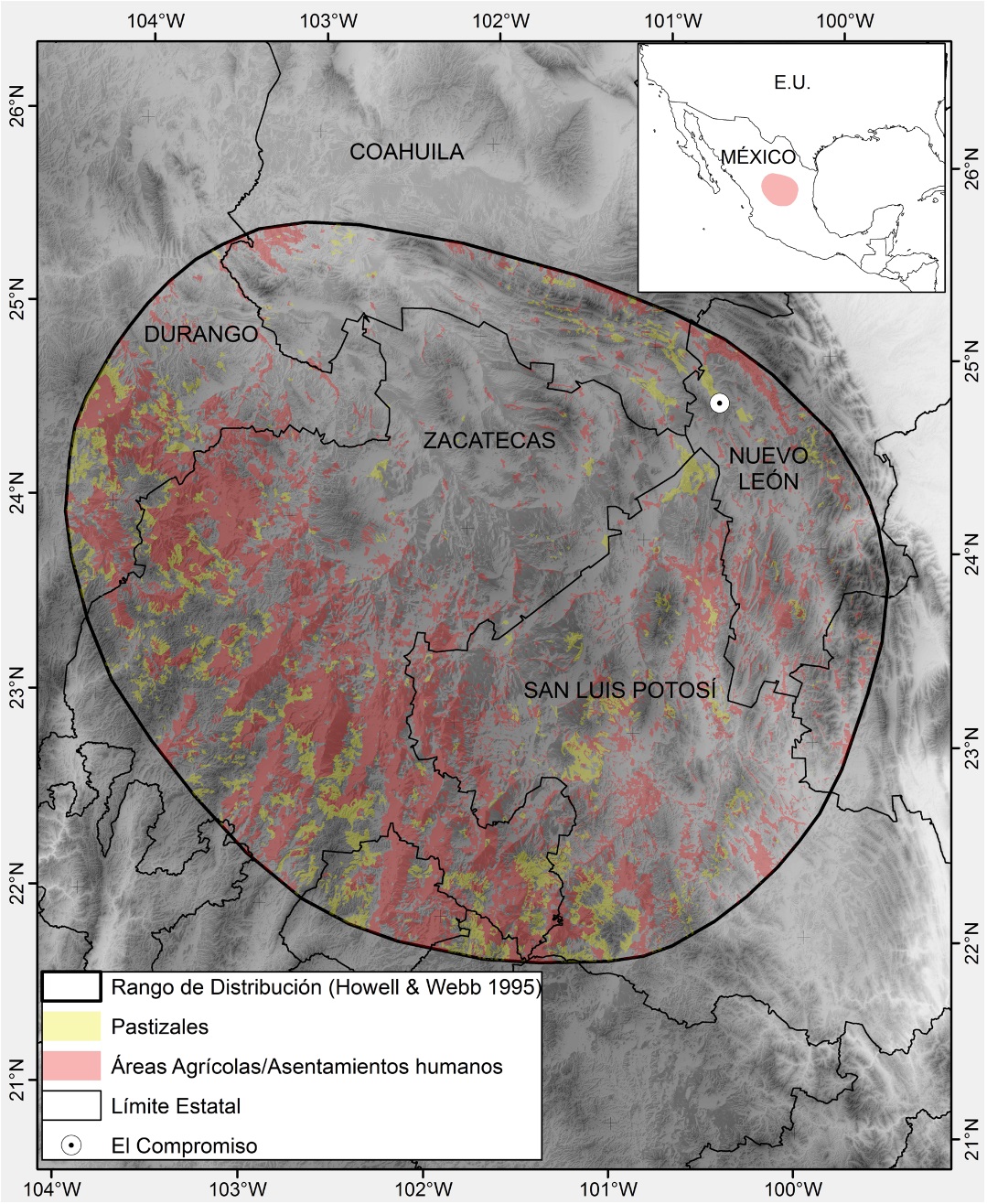
Capturamos 11 individuos, con redes de niebla, en el Rancho El Compromiso, en el límite sureño del valle de La Soledad en el municipio de Galeana, Nuevo León, México (Figura 1). Tomamos una muestra fecal de cada individuo, la cual fue preservada en formol al 10%. En el laboratorio analizamos las muestras fecales mediante la técnica de flotación y recuento directo en solución salina saturada y seguimos los protocolos previamente descritos (Kahn y Scott 2010). Para obtener los oocistos por gramo de heces fecales (o.g.h.) o huevo por gramo de heces fecales (h.g.h.), determinamos la cantidad de parásitos presentes en una submuestra de 50 mg de la muestra fecal, mediante observación al microscopio con objetivos de 40x y 100x. Calculamos la prevalencia mediante el cociente del número de individuos positivos entre el total analizados. A su vez determinamos los intervalos de confianza al 95% (IC95%) con el método Blaker’s, el cual es adecuado para su estimación cuando no se tiene información sobre la prevalencia en la población (Reiczigel et al. 2010). Estimamos la intensidad de la infección como el promedio de los valores o.g.h. y h.g.h. y su intervalo de confianza del 95% con 2000 replicaciones bootstrap. Ambos cálculos los realizamos con el programa Quantitive Parasitology QPweb (Reiczigel y Rózsa 2005). Debido a que la toma de muestras sanguíneas puede tener un efecto negativo sobre la sobrevivencia si no se considera el tamaño del ave (Brown y Brown 2009), únicamente tomamos una muestra sanguínea de 30 µl en un tubo capilar con heparina de un solo individuo. Dicho volumen representa el 0.25% de la masa corporal del ave, considerando un promedio de masa de 11.98±0.68 g para la especie (datos de este estudio). Asimismo, el tiempo en que manipulamos al individuo capturado fue menor a los 30 min para evitar un incremento en los niveles de leucocitos (Cīrule et al. 2012). En campo realizamos los frotis sanguíneos, los cuales dejamos secar a temperatura ambiente, para luego fijarlos con metanol al 100%; posteriormente, en el laboratorio los teñimos con el colorante Giemsa durante 55 min. Realizamos la búsqueda de parásitos sanguíneos examinando entre 100-150 campos a 100x, mientras que el conteo diferencial de leucocitos lo hicimos identificando en el frotis 100 células blancas siguiendo el criterio de identificación de Campbell (1995) y reportamos los valores porcentuales de cada tipo de célula observada (Vleck et al. 2000, Valkiunas 2004).
Resultados y discusión
A partir del análisis coproparasitoscópico de 11 muestras del gorrión altiplanero reportamos dos phylum (Apicomplexa y Nematoda), tres familias (Cryptosporiidae, Eimeriidae y Ascarididae) y tres géneros de parásitos intestinales. Encontramos que 10 de las 11 (93%) muestras presentaban al menos un taxón parasitario. El género Cryptosporidium presentó la mayor prevalencia con 63.6% (IC95% =33.3-86.5%), seguido por Eimeria con un 54.5% (IC 95% =25.6-80.1%), y finalmente por Ascaradia con 9.1% (IC 95% = 0.5-40.1%). La intensidad de la infección fue relativamente baja con rangos que oscilaron de 20-120 o.g.h. en Cryptosporidum (
La prevalencia de Eimeria spp. ya ha sido reportada para Passeriformes silvestres (Yabsley 2008, Berto et al. 2011), incluyendo a dos especies en el continente americano de la familia Tyrannidae: Casiornis rufus y Myiarchus ferox (Berto et al. 2008, 2009); mientras que parásitos del género Cryptosporidium han sido reportados en más de 30 especies de aves (Sréter y Varga 2000), incluyendo al gorrión Zonotrichia capensis (Nakamura et al. 2014).
En este estudio, ambos coccidios presentaron una alta prevalencia, la cual pudiera estar relacionada con tres factores: primero, el gorrión altiplanero es una especie particularmente gregaria fuera de su temporada reproductiva, forrajea en parvadas monoespecíficas o mixtas (Canales-Delgadillo et al. 2008). Este comportamiento social representa un mayor riesgo de infección comparado con aquellas especies que se alimentan en solitario, dado que un solo individuo infectado con coccidios pudiera contaminar con sus heces los sitios de forrajeo (McQuistion et al. 2000, Dolnik et al. 2010). Segundo, las aves gregarias con un forrajeo en suelo presentan una mayor prevalencia e intensidad en las infecciones de coccidios, que aquellas especies forrajeras de follaje o aéreas (Dolnik et al. 2010). Finalmente, esta especie se alimenta principalmente en los pastizales, los cuales se encuentran fragmentados y adyacentes a zonas rurales, y en donde la interacción con aves de corral es frecuente (RCC observación personal). Respecto al impacto que tiene la coccidiosis en las aves silvestres, esta enfermedad se presenta principalmente durante la época reproductiva, cuando puede ocasionar pérdida de peso y reducción del éxito reproductivo (Yabsley 2008), así como una disminución en la calidad de los caracteres sexuales secundarios (Horak et al. 2004, Pap et al. 2011). Sin embargo, en la mayoría de los casos las infecciones no presentan problemas significativos, especialmente cuando la intensidad de la infección es baja (Lindsay y Blagburn 2008, Yabsley 2008).
Por su parte, los nemátodos Ascaridia son comunes en las aves de corral, silvestres en cautiverio, aves de presa y en algunas aves silvestres. Los efectos negativos que tienen sobre las aves son diarrea y deshidratación (para una revisión véase Fedynich 2008). La baja prevalencia del nemátodo del género Ascaridia spp. en nuestro estudio (n=1) es muy similar a la reportada en el pinzón mexicano (Haemorhous mexicanus) con un 4% (Hartup et al. 2004). Uno de los riesgos por infección de nemátodos en Passeriformes es el gremio alimenticio, en donde las aves insectívoras y omnívoras muestran una mayor prevalencia de helmintos (68.8-88.7%) en comparación con aves granívoras (11.1%; Borgsteede et al. 2000). Aunque el gorrión altiplanero es principalmente granívoro, durante la época reproductiva y al igual que otros gorriones (e.g.Best 1977, Maher 1979), se alimenta primordialmente de larvas y adultos de insectos y otros invertebrados (Carmona-Gómez comunicación personal), lo que aunado a la interacción con heces contaminadas de las aves de traspatio puede ser un factor de riesgo (Hernández-Divers et al. 2006).
El conteo diferencial de leucocitos realizado coincidió con el individuo en el que se detectó coccidios (Eimeria spp. 20 o.g.h.) y helmintos (Ascaris spp., 20 h.g.h.) en el cual se observó que los linfocitos son el grupo celular más abundante (L=63%), seguido de heterófilos (H=30%), basófilos (B=5%), monocitos (M=2%) y sin observación de eosinófilos (E). La relación heterófilo/linfocito (H/L) fue de 0.48. A pesar de la infección los valores se encuentran en el rango de media previamente reportado para otras especies de las familias Emberizidae y Passerellidae: Emberiza cirlus (L=56.29, H=37.4, E=5.59, M=0.59, H/L=0.66; Figuerola et al. 1999), Zonotrichia capensis (L=71.4, H=20.2, E=2.3, B=3.1 M=2.9, H/L=0.30; Ruiz et al. 2002), Pipilo aberti (L=39.8, H=51.3, E=7.5, B=0.6, M=1.4, H/L=0.91; Fokidis et al. 2008) y Spizella breweri (L=55, H=37.25, E=2.25, B=1, M=4.5, H/L=0.88, datos obtenidos en un estudio paralelo al presente no publicados). La relación entre el conteo de los eosinófilos en aves con infecciones intestinales es ambigua; a pesar de que se ha se ha mostrado una asociación limitada entre nemátodos y el número de eosinófilos, los estudios experimentales con antígenos parasitarios no indujeron esosinofilia, y en el caso de inoculación de coccidias los niveles de eosinófilos circulantes en sangre se mantuvieron bajos (revisado en Rose et al. 1979 y Mitchell et al. 2008). A su vez, dado que los valores provienen de una sola muestra, deben considerarse como informativos.
A pesar de la alta prevalencia, la baja carga parasitaria encontrada en los individuos de esta especie no muestra indicios de que los parásitos intestinales sean un factor limitante para la viabilidad de la especie. Sin embargo, los resultados obtenidos en este estudio deberían tomarse con precaución, dado que el conteo de parásitos intestinales puede variar dependiendo del método de muestreo (Villanúa et al. 2006). Asimismo, un estudio más extensivo debería realizarse en la mayor parte de su distribución, incluyendo áreas sub-urbanas donde el gorrión coexiste con aves de corral, y podrían representar un mayor riesgo de infección (Deem et al. 2012) y a lo largo de la época reproductiva, cuando, dado el esfuerzo y desgaste energético asociado, las aves son más susceptibles a éstas debido a la inmunosupresión.











 nueva página del texto (beta)
nueva página del texto (beta)