Editor asociado: Carlos Lara Rodríguez
Introducción
Los humedales continentales son áreas de reproducción esenciales para muchas aves acuáticas, principalmente porque proveen zonas de alimentación pre y post-reproducción (Gammonley y Laubhan 2002), suministran el material y soporte para la construcción de sus nidos (Weller 2001, Keddy 2010, Mo y Waterhouse 2015) y proporcionan protección contra depredadores (Neuman et al. 2004). A pesar de su importancia ecológica, estos humedales se encuentran sometidos a fuertes presiones antropogénicas, ya que representan una considerable fuente de recursos para la subsistencia de las poblaciones humanas (EEC 2005, Pearce et al. 2007, Clemente et al. 2014). Entre las principales causas que provocan la pérdida y el deterioro de los humedales se encuentran la extracción excesiva de agua, la desecación, la descarga de contaminantes y los cambios en el uso de suelo (PMAANA 2012, Clemente et al. 2014). Estas modificaciones ocasionan alteraciones en las condiciones físico-químicas del hábitat (Pearce et al. 2007), lo que resulta en la degradación de las zonas de reproducción y alimentación de las aves acuáticas (Dorn et al. 2011), que provoca a su vez una disminución en el éxito de anidación, así como la posible erradicación de sus poblaciones (Brua 2002, Nachuha y Quinn 2012, PMAANA 2012, Wilson et al. 2014).
Los humedales en México representan una porción pequeña de los humedales del mundo (0.6%, Clemente et al. 2014), no obstante son utilizados por una alta proporción de especies, por ejemplo, en ellos se encuentra el 50% de las especies de anátidos (familia Anatidae) que se distribuyen en Norteamérica, que incluyen poblaciones migratorias y residentes (Medina 1996). Los anátidos requieren de ambientes acuáticos para reproducirse y alimentarse, por lo que la salud de estos hábitats repercute en su presencia y éxito reproductivo, de tal manera que han llegado a ser considerados indicadores de la calidad del hábitat (Weller 2001, PMAANA 2012). Durante mucho tiempo diversas especies de patos han tenido una gran importancia para la población humana del país ya sea en el ámbito social, cultural, cinegético o económico (PMAANA 2012, Clemente et al. 2014). Sin embargo, para los humedales de México existen muy pocos estudios enfocados a aspectos reproductivos de los anátidos (e.g., Williams 1975, Woodyard y Bolen 1984, Markum y Baldassarre 1986, Brown 1990, Feekes 2000, Erickson et al. 2002, Fonseca et al. 2012, Hiley 2013). A causa de la inminente pérdida y degradación de los humedales del país (Landgrave y Moreno-Casasola 2012), resulta necesario generar información sobre las poblaciones reproductivas de los anátidos y fomentar estrategias para su conservación y la de sus hábitats (PMAANA 2012).
En el centro de México, la Laguna de Zumpango es uno de los últimos relictos ecológicos de la Cuenca de México, que pese a su relevancia se ha convertido en un humedal urbano con un alto grado de perturbación, lo que ha puesto en riesgo su biodiversidad debido entre otros factores a la mala calidad del agua, la conversión de tierras para uso urbano agrícola (IMTA 2012) y los cambios drásticos en su hidroperiodo. La Laguna de Zumpango alberga una gran riqueza de aves, de las cuales el 50% lo integran especies de hábitos acuáticos (familias: Podicipedidae, Ardeidae, Rallidae Scolopacidae, Laridae), siendo la familia Anatidae una de la más representativas con 16 especies, 5 residentes y 11 visitantes de invierno (de acuerdo con Rodríguez-Casanova 2017). Cabe señalar que mediante estudios previos realizados en este cuerpo de agua se ha registrado la reproducción de especies acuáticas como el pedrete corona negra (Nycticorax nycticorax; Rodríguez-Casanova y Zuria 2016), la gallineta frente roja (Gallinula galeata) y la gallareta americana (Fulica americana; Rodríguez-Casanova y Zuria 2017). En el caso de los patos, Ramírez-Bastida et al. (2011) indicaron la presencia de una colonia reproductiva de la cerceta ala azul (Anas discors) en la laguna, sin embargo los autores no proporcionan más datos sobre la reproducción de esta especie en el humedal. Debido a que existe muy poca evidencia sobre la reproducción de los anátidos en la Laguna de Zumpango, este estudio tiene como objetivo generar información sobre sus parámetros de reproducción con la finalidad de fomentar estrategias de conservación a futuro que permitan mitigar los efectos negativos en las colonias reproductivas de anátidos.
Métodos
Área de estudio
La Laguna de Zumpango se ubica en la zona norte de la Cuenca de México, a los 19°47’25”N y 99°7’’51”O (Figura 1). Se localiza en el Estado de México, abarca el 5.6% del territorio municipal de Zumpango y el 9.5% del territorio de Teoloyucan (IMTA 2012). Este humedal se encuentra a una altitud de 2200 msnm, cuenta con una superficie de 1,860 ha, un perímetro de 18 km, una profundidad máxima de 6 m y una capacidad de almacenamiento de agua de 100 millones de m3 (Navarrete-Salgado et al. 2004). El clima es semiseco con lluvias en verano, la precipitación anual promedio es de 600 a 800 mm (INEGI 2009). Se presenta una temperatura mínima de 2.3°C y una máxima de 31°C (IMTA 2012).
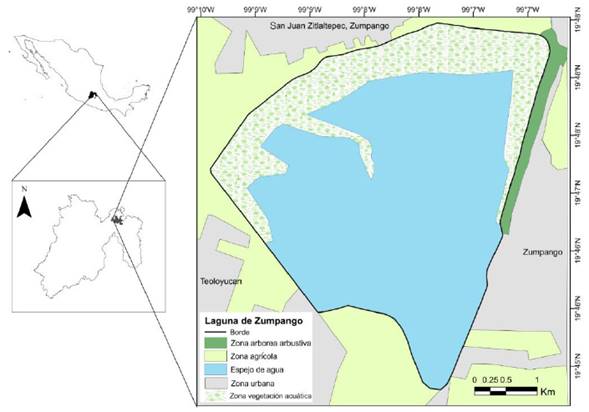
Figura 1 Ubicación geográfica de la Laguna de Zumpango en el Estado de México, con los principales tipos de hábitat presentes en la zona.
La Laguna de Zumpango forma parte de la Región Hidrológica Prioritaria “Remanentes del Complejo Lacustre de la Cuenca de México” (CONABIO 2016). En 2003 fue declarada como Parque Estatal para la Protección y Fomento del “Santuario del Agua Laguna de Zumpango” el cual incluye el cuerpo de agua, sus afluentes, zonas de vegetación de chaparral, matorral y pastizal, así como parte del área urbano-agrícola (POGEM 2003). Durante muchos años las principales actividades de la zona han estado dirigidas a la construcción de viviendas y carreteras en zonas aledañas (Sandre-Osorio 2006), al igual que el aprovechamiento del agua y la tierra para uso agrícola (Maldonado 2005). La Laguna de Zumpango ha sido sometida a varios procesos de desecación, junto con el continuo vertido de aguas residuales, lo cual ha provocado severos problemas de contaminación y eutrofización, que han propiciado la introducción de especies exóticas como el lirio acuático (Eichhornia crassipes, IMTA 2012).
En la periferia de la laguna se encuentra vegetación característica de zonas semiáridas, principalmente matorral xerófilo dominado por especies como Opuntia sp., Cylindropuntia sp., Mimosa biuncifera, Agave sp. y Prosopis juliflora. Al norte del humedal se localizan sitios con pastizal integrado por especies de los géneros Bouteloua, Andropogon, Aristida, Eragrostis (Navarrete-Salgado et al. 2004). La mayor proporción de vegetación acuática se restringe a la zona norte de la laguna, donde anidan varias especies de aves acuáticas (Rodríguez-Casanova 2017), y está constituida por especies como Scirpus validus, Nymphoides fallax, Distichlis spicata, Hilaria cenchroides, Echinochloa crus, E. holciformis y Eichhornia crassipes (Navarrete-Salgado et al. 2004, Mendoza y Rodríguez 2015).
Trabajo de campo
Realizamos visitas semanales, desde febrero hasta septiembre de 2015, con el objetivo de registrar a las especies de anátidos que se reproducen en la Laguna de Zumpango. Establecimos 10 puntos de muestreo a lo largo del borde de la laguna, con una separación de 500 m. En cada punto realizamos observaciones durante 20 minutos, entre las 08:00 y las 13:00 h, con apoyo de binoculares 8 x 42 mm y telescopio de 20 x 60 x 80 mm, con la finalidad de registrar actividades y señales reproductivas como la presencia de plumaje reproductivo, conductas de cortejo, vocalizaciones, acarreo de material para la construcción del nido, periodo de incubación, eclosión y la presencia de crías. Elaboramos el calendario reproductivo con los datos de las fechas, actividad reproductiva y anidación de las especies.
De manera adicional, efectuamos recorridos en lancha para buscar nidos en la zona norte de la laguna. Los recorridos en lancha los llevamos a cabo una vez por semana, a partir de la primera semana de febrero hasta la primera de septiembre de 2015, con un horario establecido desde las 08:00 hasta las 14:00 h. Los nidos encontrados fueron georreferenciados e identificamos la especie de ave a la que pertenecía cada uno (Baicich y Harrison 2005). Al mismo tiempo, observamos si el nido se encontraba activo o no, anotamos el sustrato de anidación utilizado (Baicich y Harrison 2005, Goodfellow 2011) y registramos el tamaño de nidada, que se determinó como el número de huevos encontrados cuando la puesta fue completada (Liljesthrom 2011, Hauber 2014). Obtuvimos el periodo de incubación mediante observación directa a través del seguimiento de la puesta del primero hasta el último huevo, se consideró como el primer día de incubación la fecha cuando la puesta había sido completada y como el final de la incubación el día que se observó la eclosión de los polluelos (Martin y Geupel 1993).
Cuando fue posible, determinamos el porcentaje de éxito de eclosión por nido como el número de huevos que eclosionaron dividido entre el número de huevos de la puesta multiplicado por 100 (Liljesthrom 2011). De igual forma, registramos las características generales de los nidos y los huevos. Para cada nido se tomaron las siguientes medidas en centímetros con un flexómetro: largo (L), ancho (l) y altura del nido. Medimos con un calibrador SPI 2000 (±0.01 mm) el largo (Lh) y ancho (Ah) de los huevos, y el peso (P) de cada huevo con una balanza de 100 g marca Pesola (± 0.1 gr). Obtuvimos la distancia del nido al borde del humedal con ayuda de un Sistema de Información Geográfica (SIG), mediante la herramienta Point Distance con el programa ArcGis 9.1 (ESRI 2011).
Durante los recorridos anotamos las probables causas de fracaso para cada nido fallido mediante la observación de indicios de depredación, como la presencia de pedazos de cascarón, desperfectos del nido o una disminución en el tamaño de la nidada (Martin y Geupel 1993, Ralph et al. 1996).
Seguimos la nomenclatura y taxonomía de las especies de acuerdo con la American Ornithologists’ Union (AOU 2016). Los nombres comunes de las especies se tomaron de Escalante et al. (2014). El estatus de residencia se basó en el propuesto por Howell y Webb (1995), para determinar el área de distribución de las especies se consideraron los mapas de distribución potencial elaborados por Navarro-Sigüenza y Peterson (2007), obtenidos del geoportal de CONABIO (http://www.conabio.gob.mx/informacion/gis/), la información bibliográfica se complementó con las observaciones realizadas en campo. El estatus de conservación de las especies fue el de la NOM-059-SEMARNAT-2010 (SEMARNAT 2010).
Resultados
En este estudio registramos cinco especies de anátidos que se reproducen en la Laguna de Zumpango, una es considerada transitoria: el pijije canelo (Dendrocygna bicolor), tres son consideradas residentes permanentes: el pato mexicano (Anas platyrhynchos diazi), la cerceta canela (Anas cyanoptera) y el pato tepalcate (Oxyura jamaicensis), también incluimos una especie que había sido considerada como visitante de invierno: el pato friso (Anas strepera). De las cinco especies, sólo el pato mexicano (A. platyrhynchos diazi), se encuentra bajo la categoría de amenazada (A) con base en la legislación mexicana. Presentamos datos sobre anidación de A. cyanoptera, A. platyrhynchos diazi y O. jamaicensis. Aunque no encontramos nidos de D. bicolor y A. strepera, registramos parejas reproductivas cortejándose así como crías, por lo que podemos afirmar que estas especies se reproducen en la laguna.
La temporada reproductiva de los anátidos inició a mediados de febrero, con las primeras observaciones de individuos con plumaje reproductivo que realizaban conductas de cortejo, y culminó a mediados de septiembre cuando ya no se observaron hembras con crías ni juveniles (Figura 2). El pato tepalcate (O. jamaicensis) fue la especie que mostró actividad reproductiva durante más tiempo a lo largo del año: desde la tercera semana de febrero cuando se observó la muda, el cambio de coloración del plumaje y del pico de los machos, hasta la segunda semana de septiembre cuando observamos las últimas crías.

Figura 2 Calendario reproductivo de los anátidos reproductivos en la Laguna de Zumpango, las fechas corresponden al periodo de anidación de la temporada del 2015.
Encontramos un total de 16 nidos: 12 de O. jamaicensis, 3 de A. cyanoptera y 1 de A. platyrhynchos diazi. Los patrones generales de anidación para estas tres especies se presentan en el Cuadro 1. Los sustratos de anidación utilizados fueron el tule (Scirpus validus), en la parte noroeste de la laguna, y las zonas no inundadas cubiertas por pastos en la porción noreste del humedal. Debido a que los patos son especies nidífugas, fue difícil registrar el éxito de eclosión, y sólo se pudo determinar para A. cyanoptera, quien tuvo un éxito de eclosión mayor a 60% en los tres nidos encontrados.
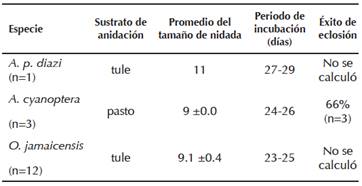
Cuadro 1 Características generales de la biología reproductiva de los anátidos de la Laguna de Zumpango, durante la temporada reproductiva de 2015. (n = nidos con nidadas completas, EE = error estándar)
En general, A. platyrhynchos diazi tuvo el nido más grande y voluminoso con respecto a las otras dos especies, mientras que los nidos más pequeños fueron los de A. cyanoptera, cuyos huevos también fueron los más pequeños de las tres especies (Cuadro 2). Todas las parejas reproductivas colocaron sus nidos al interior de la laguna, ninguna especie colocó sus nidos entre la vegetación cercana al borde (<200 m, Cuadro 2), donde las áreas con tule son menos densas. Oxyura jamaicensis fue la especie que presentó una mayor variación en la distancia a la que colocó sus nidos con respecto al borde.

Cuadro 2 Características generales de los nidos y huevos de los anátidos reproductivos en la Laguna de Zumpango durante la temporada reproductiva de 2015. (nn = número de nidos medidos, nh= número de huevos medidos, EE = error estándar).
A continuación presentamos observaciones particulares sobre la anidación para cada una de las especies de anátidos que se reproducen en la Laguna de Zumpango.
Pijije canelo (Dendrocygna bicolor)
Esta especie se ha considerado como transitoria para el centro del país (Howell y Webb 1995). Sin embargo, obtuvimos registros de esta especie durante todo 2015, con conteos de más de 30 individuos durante febrero. No observamos comportamiento reproductivo, ni cópula y tampoco encontramos nidos. En los recorridos en lancha de abril y mayo registramos al interior del humedal grupos de entre 10 a 20 individuos adultos, y en junio observamos de cuatro a seis parejas dispersas entre el tule. En la primera semana de julio detectamos cerca del borde de la laguna entre la vegetación acuática a una pareja con ocho crías, que presentaron una marca distintiva en forma de “T” en la nuca, característica de los polluelos de esta especie recién eclosionados (Baicich y Harrison 2005), por lo tanto concluimos que esta especie se está reproduciendo en la laguna (Figura 3). Finalmente registramos en julio dos parejas y en agosto una pareja entre el tule.
Pato friso (Anas strepera)
Esta especie se considera como visitante de invierno (Howell y Webb 1995, Leschack et al. 1997) y existen registros aislados de anidación para el norte de México (Erickson et al. 2002). En la Laguna de Zumpango, la especie presentó una gran abundancia en febrero (500 individuos), misma que disminuyó hacia principios de marzo (100 individuos). En los recorridos en lancha de finales de marzo y abril registramos conteos máximos de 15 individuos, la mayoría fueron grupos y parejas alimentándose cerca del borde del humedal. Durante la tercera semana de febrero observamos una pareja con comportamiento reproductivo, el macho realizó el cortejo conocido como head-up-tail-up display (véase descripción abajo, Lorenz 1993, Leschack et al. 1997). En la primera semana de marzo avistamos una pareja cerca del borde del humedal realizando la cópula. No encontramos nidos para esta especie, pero seguramente la selección del sitio de anidación y la construcción del nido se llevaron a cabo en abril, periodo en el que registramos cuatro parejas al interior de la laguna en las zonas no inundables cubiertas por pasto. De acuerdo con lo reportado por otros autores (Leschack et al. 1997) y a las observaciones que realizamos en la laguna, podemos pensar que la puesta de los huevos y la incubación se realizó entre los meses de mayo y junio. En la primera semana de julio encontramos al interior de la laguna en las zonas no inundadas (a 300 m del borde de la laguna) una hembra con 11 crías de entre 2-3 semanas de edad (Figura 4). Observamos a la hembra y las crías durante 10 minutos, tiempo en el cual las crías se alimentaban hasta que salieron del agua y se ocultaron entre la vegetación.
Pato mexicano ( Anas platyrhynchos diazi )
Esta especie es residente en la laguna pero con bajas abundancias; a mediados de marzo observamos a unos 200 m del borde a tres individuos adultos (dos machos y una hembra) que realizaban el cortejo head-up-tail-up display (Figura 5, Lorenz 1993). Este comportamiento consiste en los movimientos alternados de los machos en donde cada uno levanta la cabeza y la cola exhibiendo a la hembra todas las partes del cuerpo y el colorido plumaje, por su parte la hembra realiza la acción de nadar frente a los machos con la cabeza alargada muy cerca del agua como acción de aceptación (Figura 5). Una parte del comportamiento se lleva a cabo entre los machos, que realizan movimientos de cabeza de abajo a arriba y hunden rápidamente el pico en el agua y después lo levantan, durante estos movimientos emiten un silbido (Lorenz 1993), y cuando el pato mueve el pico eleva una columna de agua la cual puede tener un atractivo visual para la hembra (Figura 5).

Figura 5 Comportamiento reproductivo del pato mexicano (Anas platyrhynchos diazi). a) Dos machos realizando el comportamiento conocido como head-up-tail-up display, frente a una hembra que nada con la cabeza alargada cerca del agua en señal de aceptación. b) Dos machos levantando cola y cabeza, se distingue la columna de agua que elevan los machos al realizar movimientos con el pico.
En los recorridos en lancha de abril registramos una pareja en la zona norte del humedal. En la segunda semana de mayo encontramos un nido con tres huevos. La pareja reutilizó un nido que se encontraba entre el tule que había sido construido, utilizado y abandonado por la gallareta americana (Fulica americana) durante el mes de abril de la temporada reproductiva de 2015 (Figura 6). Realizamos el seguimiento del nido, y para la tercera semana de mayo el nido contenía 11 huevos. En la revisión de la segunda semana de junio encontramos el nido desprovisto de vegetación con sólo 8 huevos. Como consecuencia de esta perturbación el nido fue abandonado durante el periodo de incubación, y no pudimos determinar el éxito de eclosión. Ese mismo día, observamos al interior de la laguna en la zona no inundada una pareja que se ocultó entre el pasto. La tercera semana de junio registramos 3 individuos de la especie con comportamiento reproductivo que se ocultaron entre el tule. Por último, en los recorridos de julio y agosto contamos parvadas de entre 30 y 50 individuos adultos sobrevolando la vegetación acuática.
Cerceta canela (Anas cyanoptera)
La especie es residente en la Laguna de Zumpango, presentó una mayor abundancia durante febrero (50 individuos). En la primera semana de marzo observamos 5 parejas alimentándose cerca del borde de la laguna, los machos presentaron plumaje reproductivo. A mediados de marzo avistamos cuatro parejas cerca del borde, dos machos con plumaje reproductivo y los otros dos se encontraban mudando. Registramos comportamiento reproductivo de la especie en la primera semana de abril, sin embargo no observamos cópulas. Localizamos tres nidos, el primero en abril, el segundo en mayo y el tercero en julio. Las parejas anidaron únicamente en zonas no inundables cubiertas con pastos, en sitios donde el pasto no rebasó los 50 cm de altura. Los individuos utilizaron pasto y plumas para la construcción del nido (Figura 7). En los tres casos se registró el mismo tamaño de nidada (9 huevos por nido), y en cada nido determinamos un éxito de eclosión mayor al 60%. Algunos huevos al parecer fueron inviables y no eclosionaron por lo que fueron encontrados en el nido en estado de descomposición. Finalmente, a mediados de julio observamos dos parejas, en la primera el macho exhibió plumaje reproductivo y el segundo macho presentó muda de plumaje no reproductivo.
Pato tepalcate (Oxyura jamaicensis)
Para la Laguna de Zumpango la especie está considerada como residente y también cuenta con poblaciones migratorias, por lo que las mayores abundancias se presentan durante los meses de invierno (>5,000 individuos, Rodríguez-Casanova 2017). A mediados de febrero los machos aún presentaban plumaje no reproductivo, pero a finales del mes avistamos los primeros individuos con plumaje reproductivo. Entre la primera semana de marzo y la segunda de abril observamos machos y hembras realizar baños y limpieza de plumas, este comportamiento está asociado con las actividades pre-reproductivas (Brua 2002). Registramos a mediados de abril los primeros machos que realizaban comportamiento reproductivo (Bubbling display,Brua 2002), pero no observamos cópulas. En la tercera semana de abril encontramos el primer nido, y observamos cerca de 30 individuos entre el tule; los machos exhibieron comportamiento reproductivo. Localizamos 12 nidos activos entre abril y agosto, y el tamaño promedio de nidada fue de 9 huevos por nido (Cuadro 1). Los nidos solamente se encontraron en el área con tule (S. validus). Observamos que O. jamaicensis se internaba entre la vegetación y rasgaba el tule alrededor para utilizarlo en la construcción del nido (Figura 8).

Figura 8 Nido activo de pato tepalcate (Oxyura jamaicensis) en la Laguna de Zumpango. Se observa que el tule es el sustrato de anidación y también el material principal con el que se construyó el nido.
Aunque no se pudo determinar el éxito de eclosión, principalmente por tratarse de una especie nidífuga, en la primera semana de mayo registramos las primeras hembras y parejas con crías en la zona norte del humedal que es menos profunda y mantiene vegetación acuática, aquí observamos a las hembras alimentar a las crías. En algunos casos registramos hembras y parejas con pollos en grupos conformados por entre 3 y 15 crías, lo cual sugiere que algunas parejas pueden llegar a tener un éxito de eclosión elevado (Figura 9). Entre julio y agosto registramos 9 hembras con crías (de 3 a 10 pollos), así como grupos de machos (>30 individuos) y hembras (>35 individuos), algunos machos todavía presentaban comportamiento reproductivo (Bubbling display).

Figura 9 Pareja reproductiva de pato tepalcate (Oxyura jamaicensis) seguidos de 15 crías, de la temporada reproductiva de 2015 en la Laguna de Zumpango.
Reportamos por primera vez cuidado parental cooperativo para O. jamaicensis, ya que registramos “guarderías” conformadas por grupos de más de cinco adultos en su mayoría hembras que protegían entre 10 y 50 crías de diferentes edades. Este comportamiento fue observado por lo menos en cinco ocasiones al final de la temporada reproductiva entre agosto y septiembre (Figura 10).

Figura 10 Cuidado parental cooperativo de pato tepalcate (Oxyura jamaicensis) observado en la Laguna de Zumpango durante la temporada reproductiva (agosto-septiembre) de 2015. a) “Guardería” de pato tepalcate (Oxyura jamaicensis), grupo de crías rodeado por hembras adultas. b) Grupo de crías custodiado por hembras y machos adultos.
La principal causa de fracaso reproductivo fue la pérdida parcial o total de la nidada durante el periodo de incubación, lo que ocasionó el abandono de cinco nidos. A medida que avanzó la temporada reproductiva en la tercera semana de agosto y en la primera de septiembre observamos la muda de plumaje: las hembras perdieron las plumas de la cola, y en los machos se notó principalmente el cambio de color del plumaje y del pico.
Discusión
El estudio de la biología reproductiva de patos y otras especies de importancia económica es fundamental para lograr el manejo adecuado de sus poblaciones (SEMARNAT 2008, Clemente et al. 2014). En este estudio se presentan por primera vez datos sobre la biología reproductiva de cinco especies de la familia Anatidae en la Laguna de Zumpango. Así mismo, aportamos datos de distribución sobre estas especies. Consideramos que D. bicolor se debe re-categorizar de transitoria para el centro de México a residente, ya que existen poblaciones durante todo el año en la Laguna de Zumpango y cuenta con evidencia reproductiva en este humedal, al igual que en otros cuerpos de agua del centro del país como en Querétaro (Hiley 2013). También presentamos evidencia de una población reproductora del pato friso (A. strepera) en el centro de México, aunque se necesitarían más estudios para determinar su estatus de residencia. Además, reportamos por primera vez el cuidado parental cooperativo en O. jamaicensis, comportamiento que ya ha sido reportado para otras aves acuáticas de la familia Anatidae, de los géneros Anser y Branta (Craig y Dzubin 1994, Mowbray et al. 2002), pero no había registros previos para esta especie (Brua 2002).
De manera general, los anátidos anidan en y alrededor de cuerpos de agua, en sitios con vegetación herbácea, arbustiva o acuática emergente que les provee una alta disponibilidad de recursos alimenticios, les permite mantener oculto su nido para protegerse de depredadores y de condiciones climáticas adversas (Gill 1994, Drilling et al. 2002, Neuman et al. 2004, Mercado 2012). En la Laguna de Zumpango todos los nidos fueron encontrados en la zona norte, donde existen manchones de tule (S. validus), pastos (Poaceae) y herbáceas como la hierba de Santa María (Polygonum sp.). Esta zona de la laguna corresponde al área de menor profundidad (<4m) y cuenta con sitios no inundables que forman “islotes” cubiertos por vegetación. Estos microhábitats mantienen la vegetación necesaria que sirve de sustrato para la construcción del nido y provee protección contra depredadores terrestres como perros y gatos ferales o domésticos, que no pueden llegar a los nidos por encontrarse alejados del borde y rodeados de agua. Por lo anterior, se debe evitar una alta variación en los niveles del agua que afecten estas zonas con vegetación, ya que un bajo nivel de agua puede favorecer la entrada de depredadores.
Debido a que existen diferencias en los sustratos de anidación y las áreas de la laguna que utilizan las aves para anidar, debe considerarse la protección de los distintos sitios. Por ejemplo, O. jamaicensis anidó entre el tule, lo que permite corroborar que la especie utiliza sitios con vegetación alta (>90 cm) y densa (Feekes 2000, Brua 2002), mientras que A. cyanopera utilizó exclusivamente zonas con pastos (Gammonley 2012). De manera particular, se deben conservar las áreas de anidación del pato mexicano (A. platyrhynchos diazi), subespecie considerada endémica del país y prioritaria para la conservación bajo la categoría de amenazada (A) con base en la legislación mexicana (SEMARNAT 2010). Históricamente, cerca del 80% de las poblaciones de esta especie se distribuían en el centro del país (SEMARNAT 2008), pero la acelerada transformación de sus hábitats ha ocasionado una disminución de las poblaciones (PMAANA 2012). En la actualidad en la Laguna de Zumpango, A. platyrhynchos diazi es considerada como poco frecuente (Rodríguez-Casanova, 2017), aunque en otros humedales del centro de México ha sido registrada como abundante (Pérez-Arteaga et al. 2005). A pesar de su importancia en el país, el pato mexicano (A. platyrhynchos diazi) ha sido poco estudiado y sólo existen algunos estudios poblacionales (Pérez-Arteaga et al. 2005), de uso de hábitat (Medina et al. 2007) y de dieta (Colón-Quezada 2009), por lo que hace falta generar más información enfocada en su reproducción. Al tratarse de un pato de superficie requiere para su alimentación y descanso zonas poco profundas como los bordes de los cuerpos de agua que cuenten con vegetación acuática (>1 m de profundidad, Howell y Webb 1995, Colón-Quezada 2009), además puede utilizar zonas agrícolas con cultivos inundables (Mercado 2012). Para incrementar las poblaciones de esta subespecie en la Laguna de Zumpango es necesario mantener los manchones densos de tule, así como conservar otras plantas acuáticas como la hierba de Santa María y el zacate de agua (Eragrostis mexicana) que les permita construir y mantener ocultos sus nidos.
El disturbio ocasionado por los habitantes de los asentamientos urbanos es otra causa de fracaso reproductivo para las aves acuáticas en la laguna. Una actividad que realizan los pecadores, es la “siembra de pez” que consiste en introducir alevines en la laguna, la cual realizan al inicio de la temporada de anidación de los anátidos (abril y mayo). En este periodo los pescadores colocan redes sobre los manchones de tule lo que ocasiona que las entradas a los nidos sean obstruidas, además de que algunos nidos quedan expuestos o son saqueados. En el caso de O. jamaicensis observamos que la presencia humana ocasionó que cinco hembras abandonaran sus nidos al inicio de la temporada reproductiva.
Adicionalmente a la presencia humana, el borde de la laguna está siendo modificado como parte de un proyecto de represamiento realizado por la Comisión Nacional del Agua. Por lo que se está eliminando la vegetación arbórea y arbustiva en el borde perimetral, y está siendo reemplazada por una superficie de concreto. Esta vegetación es necesaria para varias especies de aves pues sirve para mitigar los efectos del viento y la lluvia (Weller 2001, Keddy 2010). En el caso de los patos, el borde es utilizado como refugio, sitio de descanso y alimentación, ya que pueden consumir semillas de gramíneas (familia Poaceae; Hohman y Lee 2001, Gammonley 2012) e invertebrados como larvas de quironómidos (familia Chironomidae; Brua 2002) que se encuentran a orillas del humedal.
A partir de los resultados de este estudio proponemos algunas medidas de conservación y manejo que permitan aumentar el número de parejas anidantes de patos, así como su éxito reproductivo: 1) Conservar las zonas con pastos, herbáceas y arbustos en el borde de la laguna, especialmente en la zona norte, en las áreas cercanas al barrio de San Juan Zitlaltepec. 2) Proteger y restringir el acceso a las zonas con tule dentro del cuerpo de agua durante la temporada reproductiva (por lo menos de abril-julio), ya que el paso de lanchas provoca disturbio en las colonias de aves anidantes. 3) Considerar la posibilidad de utilizar estructuras artificiales de anidación (e.g., cajas de anidación o plataformas) para especies como A. platyrhynchos diazi. 4) Restringir la cacería durante la temporada reproductiva, principalmente al interior del cuerpo de agua en las zonas de anidación.
A pesar de las condiciones de transformación y contaminación que tiene este humedal, la Laguna de Zumpango se puede considerar un hábitat importante para la reproducción de anátidos y de diversas especies de aves acuáticas (Rodríguez-Casanova y Zuria 2016, Rodríguez-Casanova y Zuria 2017), por lo que debe incrementarse el nivel de protección. Los estudios sobre la biología reproductiva son fundamentales para poder implementar medidas de restauración y conservación del ecosistema. Consideramos que se requiere un manejo adecuado del cuerpo de agua que garantice su conservación a largo plazo y permita el desarrollo de diversas actividades económicas sustentables.











 nueva página del texto (beta)
nueva página del texto (beta)






