Editor asociado: José Fernando Villaseñor Gómez
Introducción
El estado de Jalisco presenta la mitad de las aves registradas (554 especies) para México, por lo que se considera uno de los cinco estados con mayor riqueza de aves del país (Palomera-García et al. 2007, Navarro-Sigüenza et al. 2014). La elaboración de listados y guías ha permitido tener un amplio conocimiento de la avifauna de diferentes áreas de Jalisco, en particular de humedales y zonas costeras, como el Área Natural Protegida Estero El Salado (Cupúl-Magaña 2000, Molina et al. 2012), la Laguna de Magdalena (Coll-Carabias et al. 2011), la Laguna de Zapotlán (López-Velázquez et al. 2011a) y la Presa de La Vega (López-Velázquez et al. 2012). Los humedales del estado de Jalisco son importantes sitios para la conservación de las aves y los servicios ecosistémicos que éstas proveen, tales como la dispersión de plantas e invertebrados, la estimulación de la productividad primaria y de la descomposición de materia orgánica (Villamagna et al. 2010, 2012; Green y Elmberg 2014).
Sin embargo, existen pocos estudios publicados sobre la ornitofauna del Lago de Chapala (Palomera-García et al. 2007). Para la región de la ribera de Chapala existe un listado elaborado por el grupo de Observadores de Aves de Chapala, quienes reportan 322 especies (Lake Chapala Birders 2012). Para el lago se tiene una guía fotográfica de las aves en donde se reportan 98 especies (López-Velázquez et al. 2011b, Hernández-Morales et al. 2015). Además, se han realizado estudios de los efectos ecológicos del lirio acuático sobre la comunidad de aves del lago (Villamagna et al. 2009, 2010, 2012). Los problemas de gestión de los recursos naturales del Lago de Chapala representan una amenaza para el ecosistema acuático y en particular, las aves (Hansen y Afferden 2001).
En este estudio presentamos el listado de las aves del Puerto Interior Turístico Jocotepec (PITJ), su condición migratoria, endemismo, estatus de conservación, valor de vulnerabilidad y frecuencia de observación; además comparamos la composición de especies de este sitio con otros humedales del estado de Jalisco. Este estudio tiene como objetivo aportar información sobre las aves del Lago de Chapala y servir como referente para futuros estudios realizados en el área.
Métodos
Área de estudio
El Lago de Chapala se encuentra en el occidente de México, entre los estados de Jalisco y Michoacán. Es el cuerpo de agua más grande del país, con una extensión de 114,659 ha. El espejo de agua tiene una longitud máxima de 82.2 km y una anchura promedio de 18.8 km (CEA-Jalisco 2016). El lago se localiza dentro de la Faja Volcánica Transmexicana, y es uno de los principales sistemas lacustres de México, por tener un alto número de especies de peces (Aguilar 2003). Es parte de la Región Terrestre Prioritaria Cerro Viejo-Sierras de Chapala, así como de la Región Hidrográfica Prioritaria Chapala-Cajititlán-Sayula (Arriaga et al. 1998, Arriaga et al. 2000). La cuenca de Chapala es considerada un sitio importante para aves acuáticas y terrestres (Navarro-Sigüenza et al. 2007), es parte de la ruta central de las aves migratorias de Estados Unidos de América y Canadá, y un sitio importante durante la migración de pelícanos blancos (Pelecanus erythrorhynchos) (Lara-Lara et al. 2008, Sovada et al. 2013). Estas características le han conferido al lago reconocimiento como un humedal de importancia nacional e internacional (Pérez-Arteaga et al. 2002), y fue considerado en 1999 como un Área de Importancia para la Conservación de las Aves en México (AICA 58) (Arizmendi y Márquez 2000) y declarado un sitio Ramsar (número 1973) en el 2008 (Ramsar 2009).
El Puerto Interior Turístico Jocotepec (PITJ) se encuentra en el municipio del mismo nombre, Jalisco (20°17’06” N, 103°24’54” O). La elevación promedio es de 1520 msnm con un clima semi-seco, lluvias en verano y otoño e invierno secos. El lugar colinda con los márgenes del Lago de Chapala en su lado noroeste y se encuentra a 1 km del Área Natural Protegida “Cerro Viejo-Chupinaya-Los Sabinos” (ANP CVCS) (Figura 1). El PITJ tiene una superficie de 93,584 m2, cuenta con un estacionamiento, un extenso andador pavimentado, dos canchas de futbol, dos muelles y distintas áreas verdes, que consisten principalmente en jardines con pasto y sauces dispersos, que las personas utilizan para esparcimiento y recreo.
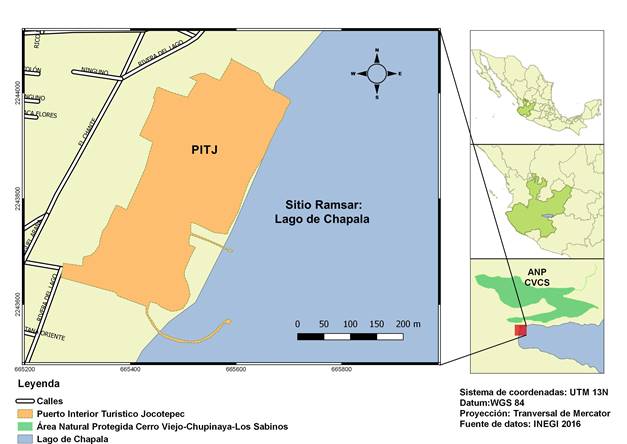
Figura 1 Ubicación del Puerto Interior Turístico Jocotepec (PITJ), cercano al sitio Ramsar Lago de Chapala y al Área Natural Protegida Cerro Viejo-Chupinaya-Los Sabinos (ANP-CVCS) en el estado de Jalisco, México.
La vegetación del sitio está fuertemente modificada, compuesta en su mayoría por árboles nativos de sauce (Salix humboldtiana) y de especies exóticas como eucalipto (Eucalyptus globulus), casuarina (Casuarina cunninghamiana), laurel de la India (Ficus benjamina) y palmera pindó (Syagrus romanzoffiana). En el área colindante con el lago está representada la vegetación emergente: tular (Typha spp), amplias extensiones de lirio acuático (Eichhornia crassipes) y lechuga de agua (Pistia stratiotes), así como algunos árboles de sauce.
Inventario de aves
El muestreo de la avifauna lo efectuamos de abril de 2015 a marzo de 2016, con excepción de mayo de 2015. Realizamos visitas mensuales de dos días, donde hicimos caminatas de búsqueda intensiva de tres horas diarias por el PITJ, tratando de abarcar las diferentes zonas del sitio. Las observaciones las hicimos con binoculares Celestron 8 x 42 mm, y la identificación con el uso de las guías de campo de Dunn y Aldefer (2006) y Van Perlo (2006). Seguimos la nomenclatura taxonómica de American Ornithologists’ Union y suplementos (AOU 1998, Chesser et al. 2015).
Determinamos la estacionalidad siguiendo la propuesta de Palomera-García et al. (2007) para el estado de Jalisco. Definimos la categoría de endemismo (endémico, semiendémico y cuasiendémico) de acuerdo con lo propuesto por González-García y Gómez de Silva (2003). Consideramos el nivel de protección o categoría de riesgo con base en la Norma Oficial Mexicana NOM-059-SEMARNAT-2010 (DOF 2010), el Acta para la Conservación de las Aves Migratorias Neotropicales (NMBCA), la Lista Roja de las Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza (UICN) y los valores de vulnerabilidad de Berlanga et al. (2010), donde los valores van de 4 a 20 (conforme más alto el índice, es mayor la vulnerabilidad). Incluimos la frecuencia de observación de las especies, donde consideramos comunes a aquellas que se observaron en el 50% o más de las visitas, poco comunes entre el 10 y 49% y raras a las menores al 10%, respectivamente.
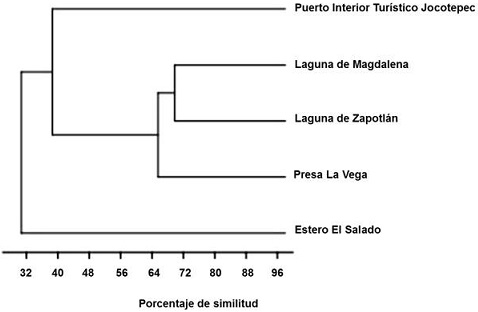
Calculamos la riqueza estimada del parque utilizando el estimador de Chao 2, para el cual construimos una base de datos de incidencia de las especies (tanto acuáticas como terrestres). Utilizamos el programa EstimateS 9.1.0 (Colwell 2013) para obtener el número de especies esperadas. Realizamos un análisis de conglomerados (coeficiente de similitud de Jaccard); para ello construimos una base de datos de presencia-ausencia de especies acuáticas de los humedales del estado de Jalisco: Estero El Salado, Laguna Zapotlán, Laguna de Magdalena y Presa La Vega, que analizamos con el programa PAST (Hammer et al. 2001).
Resultados
Registramos en total 100 especies pertenecientes a 14 órdenes, 34 familias y 82 géneros (Anexo 1). Esto representa el 8.8% de especies presentes en México, el 17.9% para Jalisco y el 30.7% de las observadas en la región de la ribera de Chapala. Las familias con mayor número de especies fueron: Tyrannidae (nueve especies), Icteridae (nueve), Parulidae (ocho), Ardeidae (siete) y Anatidae (seis). Las aves acuáticas representan el 35% del total de las especies registradas. Referente a la estacionalidad de las especies, 69% son residentes, 30% visitantes de invierno, 1% es transitoria y el 3% introducidas. Respecto a la frecuencia de observación, 19 especies son comunes, 38 son poco comunes y 43 son raras.
Sobre la categoría de endemismo, encontramos que cuatro especies son semiendémicas, dos son endémicas y una es cuasiendémica. En cuanto al estatus de conservación, tres especies: Anas platyrhynchos diazi, Botaurus lentiginosus y Geothlypis tolmiei, se encuentran amenazadas según la NOM-059-SEMARNAT-2010; una especie: Rallus tenuirostris, está casi amenazada (NT) según la UICN, y 70 especies se hallan listadas en la NMBCA. En cuanto a los valores de vulnerabilidad, el 78% de las especies se encuentran amenazadas levemente (valores de 4 a 10), 21% se están amenazadas moderadamente (11 a 15) y el 1% severamente (16 a 20); de nuevo es Rallus tenuirostris (Anexo 1).
De acuerdo con el estimador de Chao 2, del total de especies estimadas (155), el porcentaje de completitud total obtenido es del 64%, lo que sugiere que aún existen especies que no fueron observadas durante el estudio. A partir del dendrograma obtenido del análisis de similitud (Figura 2) se observa un conglomerado, representado por los humedales de aguas interiores: Laguna de Zapotlán, Laguna de Magdalena y Presa La Vega, que comparten valores de entre 37 y 40 por ciento de similitud. Estos valores se deben a que son humedales cercanos (<100 km de distancia) y con elementos vegetales y estructurales similares.
Discusión
La riqueza de especies encontradas en el PITJ es mayor a la publicada para el Lago de Chapala de 94 especies (López-Velázquez et al. 2011b, Hernández-Morales et al. 2015), aunque la composición de especies en estos listados fue diferente porque ellos registraron otras especies acuáticas (Anatidae y Scolopacidae) e incluyeron aves nocturnas (Tytonidae y Caprimulgidae). Cerca del 70 por ciento de especies registradas son residentes y corresponde a un patrón observado en el país (Navarro-Sigüenza et al. 2014), donde el 30% de las aves registradas son aves migratorias.
Aunque las aves acuáticas del país representan el 6.7% de la avifauna en lagos y estanques (Navarro-Sigüenza et al. 2014), el PITJ mantiene una riqueza elevada en este componente (35%). La composición de especies del PITJ es similar a otros humedales epicontinentales del estado de Jalisco, como la Laguna de Magdalena, la Laguna de Zapotlán o la Presa de la Vega (Coll-Carabias et al. 2011; López-Velázquez et al. 2011a; López-Velázquez et al. 2012); el Área Natural Protegida Estero El Salado presenta menor afinidad, ya que su composición de aves acuáticas se integra por especies con afinidad por ambientes costeros y de manglar, que no se encuentran en los otros humedales (Cupul-Magaña 2000; Molina et al. 2012).
La heterogeneidad de espacios en el parque, como las zonas de tule, vegetación ribereña leñosa, áreas de arbolado (nativo y exótico) y de césped, así como su cercanía con el Área Natural Protegida Cerro Viejo-Chupinaya-Los Sabinos, las sierras del Lago de Chapala y al sitio Ramsar, son componentes a nivel local y del paisaje importantes que influyen en la riqueza de especies (Savard et al. 2000). Mantener la heterogeneidad de componentes locales en el PITJ es crucial para proveer de hábitat a especies con requerimientos muy específicos, como algunas especies migratorias o que se encuentran dentro de alguna categoría de amenaza. Por ejemplo, las aves de pantano necesitan de tulares altos y densos, las aves playeras dependen de áreas desprovistas de vegetación y con un sustrato húmedo para alimentarse, y los chipes y gorriones están en las áreas arboladas, entre otros. Por ello, es importante mantener las condiciones estructurales y del paisaje que proveen de hábitat a las aves del PITJ.
Los parques son espacios importantes para mantener la biodiversidad tanto en ambientes urbanos y semiurbanos, como en una escala regional (Carbó-Ramírez y Zuria 2011). En Jalisco se han realizado varios estudios sobre avifauna en áreas verdes y parques urbanos, asociados a la ciudad de Guadalajara (MacGregor-Fors 2005; MacGregor-Fors 2010; Santiago-Pérez, 2010; Maya-Elizarrarás 2011). Sin embargo, se ha observado que las avifaunas urbanas son independientes de las comunidades de aves del paisaje adyacente, pues mantienen sus propias dinámicas poblacionales e interacciones ecológicas (Clergeau et al. 2001). Este estudio explora la ecología urbana fuera de una zona metropolitana, donde estos procesos de aislamiento no son tan marcados. La ubicación del parque en el borde de la ciudad de Jocotepec parece no afectar la riqueza y la abundancia de la avifauna, como se ha reportado que ocurre cuando los parques se encuentran cercanos al centro del núcleo urbano (MacGregor-Fors et al. 2010).
De los cuatro registros de especies en riesgo, es importante resaltar al rascón azteca (Rallus tenuirostris), una especie residente y endémica al centro-occidente de México, y que tiene el valor de vulnerabilidad más alto; además, que se encuentra bajo la categoría NT (casi amenazado) de la UICN, pues sus poblaciones están decreciendo (BirdLife International 2014). A nivel mundial, los rálidos presentan un declive poblacional por las presiones existentes a sus hábitats (Wetlands International 2010). Se sugiere la posibilidad de que el PITJ funcione como corredor biológico entre el Área Estatal de Protección Hidrológica Cerro Viejo-Chupinaya-Los Sabinos con el sitio Ramsar Lago de Chapala. Por ello, sugerimos incrementar el número de estudios de la avifauna dentro de los parques del Lago de Chapala. El estudio de las aves del Puerto Interior Turístico Jocotepec aporta al conocimiento del grupo en el mayor humedal del país y ofrece información valiosa para apoyar los planes de manejo y conservación del Lago de Chapala.











 text new page (beta)
text new page (beta)