Editor asociado: Sergio Alvarado
Introducción
La interacción depredador-presa se considera en cualquier situación donde un par de especies o grupos de especies interaccionan entre sí, con un cambio de la población de presas respecto de la población del depredador, y viceversa (Odum 1998). Esta relación se expresa a través de un modelo de retroalimentación (sistema Lotka-Volterra), donde las poblaciones de presas tienen un efecto positivo en el tamaño de la población del depredador, a su vez, la población del depredador ejerce un efecto negativo en el tamaño de las poblaciones de presas (Jaksic y Simonetti 1987, Cano 2011). El modelo depredador-presa en aves rapaces sugiere una relación denso-dependiente de la población depredadora hacia las poblaciones de presas (Aragón et al. 2002). En este sentido, los estudios de los hábitos alimenticios en este gremio han demostrado la preferencia en el consumo de presas dependiendo del grupo animal al que pertenecen, la edad, el tamaño (biomasa) y la composición de sexos (Jaksic y Simonetti 1987).
El orden Strigiformes cuenta con el mayor número de estudios de dieta de aves rapaces a nivel mundial (Bó et al. 2007). En esta rama de la ecología, los estudios tróficos en aves rapaces son realizados comúnmente para la familia Tytonidae, y se destaca a la lechuza de campanario (Tyto alba Strigiformes) por estar entre las especies con mayor número de descripciones de hábitos alimenticios, en gran parte, debido a la facilidad que representa colectar egagrópilas en reposaderos para su análisis y a que su distribución abarca un gran número de ecosistemas (Jaksic et al. 1982, Bruce 1999). Actualmente se sugiere una clasificación taxonómica a nivel mundial que distingue tres especies de lechuza de campanario con base en su grado de variación genética (König y Weick 2008, Enríquez et al. 2015). Las diferencias taxonómicas sugieren denominar a la especie T. alba para la lechuza de campanario distribuida en el Viejo Mundo (Europa y África), T. javanica para la lechuza distribuida en Australasia y T. furcata para la lechuza distribuida en el Nuevo Mundo (América) (Aliabadian et al. 2016). En México los estudios realizados sobre los hábitos alimenticios de la lechuza de campanario (Aragón et al. 2002, Zarza y Cruzado 2004, Santos-Moreno y Alfaro 2009), han permitido estimar la frecuencia de consumo de presas, la distribución potencial de las especies depredadas, así como la disponibilidad y abundancia de presas en regiones puntuales (Martínez y Calvo 2006).
El análisis del contenido de egagrópilas de aves rapaces -consideradas como acumulaciones de porciones no digeridas de presas que son regurgitadas en unidades compactas (Taberlet y Fumagalli 1996, Don et al. 2006)- se considera una herramienta útil para describir la dieta en términos de la estructura de las comunidades de mamíferos pequeños, la disponibilidad de presas de acuerdo con la temporada del año, así como en las estimaciones de las abundancias relativas de las poblaciones de presas en un área y tiempo determinado (Taylor 1994, Bonbicino y Bezerra 2003, Charter et al. 2007, Santos-Moreno y Alfaro 2009, Andrade et al. 2016).
Los aportes realizados por Rodríguez (2002) y Zarza y Cruzado (2004) sobre la dieta de la lechuza de campanario en el Estado de México, representan avances importantes para el entendimiento de las estrategias de alimentación (comportamiento generalista o selectivo de presas) y disponibilidad de presas en ambientes con poco grado de alteración. Lo que conlleva a preguntarse ¿cómo se desarrolla la interacción depredador-presa si las actividades de forrajeo (búsqueda, asecho, captura e ingesta de presas) llevadas a cabo por este depredador ocurren en áreas urbanas del Estado de México?
El enfoque empleado por Trejo y Ojeda (2002) sugiere que el análisis de las dimensiones y características de las egagrópilas (la longitud, el diámetro y el peso) de aves rapaces, representan variables potenciales para determinar la especie de ave rapaz a la que pertenecen; sin embargo, actualmente se ha demostrado la existencia de un nivel de asociación entre las dimensiones de estas regurgitaciones con el número de presas que contienen (Fuentes et al. 2015). No obstante, esta correlación directa tenderá a verse comprometida si consideramos que el contenido y las dimensiones de una egagrópila responden a requerimientos energéticos particulares de la especie depredadora, a su estrategia de alimentación, o bien, a la accesibilidad de sitios de caza y disponibilidad de presas de una región (Marti 1987, Bellocq 2000).
Con el objetivo de describir la dieta de la lechuza de campanario, en esta investigación determiné la diversidad de presas contenidas en egagrópilas pertenecientes a una región urbana del municipio de Ocoyoacac, Estado de México. Por otro lado, para el entendimiento de la relación depredador-presa en este estudio busqué categorizar la frecuencia de consumo de especies presas y analizar cuán generalista o selectiva es la dieta de este depredador, así como el nivel de asociación entre las dimensiones de las egagrópilas con el número de presas contenidas. Por último, con la finalidad de corroborar la determinación de especies presas que componen la dieta de esta especie realicé capturas de mamíferos pequeños en los distintos hábitats de la zona de estudio.
Métodos
Área de estudio
El municipio de Ocoyoacac cuenta con un territorio de 134.71 km2 y comparte junto con los municipios de Lerma, Huixquilucan y la Ciudad de México las 1,760 has que comprenden el Parque Nacional Insurgente Miguel Hidalgo y Costilla (La Marquesa; 19°29’32’’ N, 99°29’32’’ O) (List et al. 2009) (Figura 1). La altura sobre el nivel del mar es de los 2,590 m, según la carta topográfica de la Ciudad de México (SEMARNAT 2012). En el área predomina el clima CWbg (templado sub-húmedo con verano largo) y el C(E)wg (semifrío-subhúmedo) con una temperatura promedio de 13°C (García 2004). La precipitación media anual oscila entre los 1,400 y los 1,800 mm. De acuerdo al Plan Estatal de Desarrollo Urbano (2007), el uso del suelo se caracteriza por asentamientos urbanos, zonas de cultivo, pequeños rodales de pinaceas -Pinus ayacahuite veichii, Pinus herrerae, Pinus leiophylla, Pinus oocarpa, Pinus lumholtzii, Cupressus spp. y Pinus pseudostrobus (Del Carmen 2009)-, y terrenos con pastizal (SEMARNAT 2012).
Colecta de egagrópilas en el campo
El análisis de egagrópilas adquiere ventaja respecto de otros métodos (ejemplo, lavados estomacales) para la descripción de la dieta de aves rapaces. Los motivos para su preferencia suelen provenir de que es i) un método no invasivo y fácil de realizar para la determinación de la dieta, que aporta información valiosa sobre el consumo de presas y la preferencia de especies; ii) permite la determinación de la distribución de especies presas (Don et al. 2006), la composición y abundancia relativa de las comunidades de mamíferos pequeños (Taylor 1994, Bonbicino y Bezerra 2003, Charter et al. 2007, Santos-Moreno y Alfaro 2009, Andrade et al. 2016), y iii) facilita la detección de especies exóticas en una región debido a la conducta de caza de algunas aves rapaces que se ajusta al modelo oportunista (De Santis y Pagnoni 1989, Noriega et al. 1990, Bó et al. 2007).
La ubicación e identificación de perchas o reposaderos (sitios de regurgitación) la realicé durante la noche por medio de la observación directa de individuos en vuelo, así como con la determinación de la presencia de la especie por las plumas presentes en dos reposaderos. El primer reposadero lo localicé en la cabecera municipal de Ocoyoacac (área urbana), mientras que el segundo lo ubiqué en una barranca (área semiurbana) (Figura 1). Realicé dos visitas en cada reposadero entre los meses de marzo y abril (temporada reproductiva, estación de primavera) de 2012, por lo que las muestras sólo representan estos dos meses. La colecta de egagrópilas completas y fragmentos disgregados la efectué en muestras frescas y egagrópilas de meses anteriores con base en las técnicas de manejo y análisis sugeridas por Marti (1987). Al momento de realizar la colecta de egagrópilas no se detectó la presencia de lechuzas de campanario, por lo que se desconoce el número real de individuos o parejas que lo visitan. La preparación de las muestras la adapté a las sugerencias propuestas en el Laboratorio de Ecología y Conservación de Fauna Silvestre (LECFS) de la Universidad Autónoma Metropolitana-Unidad Xochimilco (véase a continuación). Enumeré de forma secuencial el total de muestras (egagrópilas) separando cada unidad de manera individual de acuerdo al número de reposadero y fecha de muestreo.
Preparación de muestras para análisis y descripción de contenidos
Para comprender cómo la disponibilidad local de presas y la estrategia de alimentación de la lechuza de campanario pueden influir en el número de presas que contienen estas regurgitaciones (González et al. 2004), para cada egagrópila obtuve la longitud y diámetro máximo con un calibrador (AutoTectm, precisión ± 0.10 mm) y el peso con una báscula digital (Citizen CT 1202, precisión 1,200g ± 0.01 g). Previo a la descripción de los contenidos de cada muestra, inicié el proceso de limpieza de las egagrópilas tomando en cuenta las indicaciones de Sabo y Laybourne (1994) y Marti et al. (2007). Con ayuda de una tela de malla fina aislé y enumeré sistemáticamente (en forma de cadena) todas las muestras. El uso de tela de malla fina tiene la ventaja de realizar la limpieza de una mayor cantidad de muestras en una sola ocasión, aislando cada egagrópila del resto y haciendo eficiente el uso del agua. De este modo, las egagrópilas aisladas en la tela se sumergieron en agua por tres días con detergente biodegradable (Foca®) poco agresivo con la coloración y estructuras anatómicas de los restos de presas. Cada unidad fue masajeada con la finalidad de disgregar y separar los componentes quitinosos, los cálcicos y aquellos no orgánicos como lo es, el suelo adherido a la egagrópila. Reemplacé el agua cuando fue necesario hasta que presentó la menor turbidez. Por último, sequé las egagrópilas con una estufa de laboratorio (Felisa HORNO) a una temperatura constante de 60ºC. Con ayuda de pinzas entomológicas y caja de Petri procedí a disgregar cada egagrópila separando los materiales quitinosos, los huesos, exoesqueletos y las semillas.
La determinación de especies consumidas la realicé hasta la identificación de nivel taxonómico máximo posible por medio de guías faunísticas de la región (Hall 1981a, 1981b, Howell y Webb 1995, Ceballos y Oliva 2005). Cada taxón presa fue identificado utilizando un microscopio estereoscópico (Nikon SMZ745) por medio de la comparación de las características de cráneos, mandíbulas, pico, dientes, pelos y exoesqueletos encontrados en las muestras, con las guías faunísticas.
Análisis de diversidad trófica
Analicé la diversidad trófica considerando el número total de egagrópilas; es decir, tanto las muestras frescas como aquellas con mayor tiempo de haber sido regurgitadas. Obtuve la riqueza, dominancia y equidad de las presas consumidas por la lechuza de campanario a partir de los valores de los índices de riqueza de Margalef, dominancia de Simpson, y equidad de Shannon-Wiener y Pielou (Moreno 2001). Para conocer cuán generalista o especialista es la dieta de la lechuza de campanario (Marti 1987), estimé la amplitud del nicho trófico del índice de Levins (Marti 1987), así como el índice de Levins estandarizado considerado útil para controlar el efecto potencial que ge nera el cambio estacional sobre la dieta (Colwell y Futuyma 1971). Caractericé el número de especies presa en la dieta por medio de la frecuencia de consumo estableciendo los siguientes criterios arbitrarios: i) individuos de una misma especie que fueron consumidos desde 100 veces o más, lo consideré de consumo dominante; ii) entre 30 y 99 individuos consumidos lo consideré como especies con frecuencia de consumo abundante; iii) si el número de individuos contabilizados se situó entre 10 y 29 ocasiones se consideró como un consumo frecuente; iv) un consumo ocasional lo cuantifiqué de cinco a nueve individuos; v) y como consumo raro consideré aquellas especies registradas con menos de cinco individuos.
Para evitar sobrestimar el número de individuos de cada egagrópila registré: un individuo (mamífero pequeño o ave) cuando se hizo presente un cráneo (o pico), o bien, considerando el mayor número de mandíbulas de un lado (derecho o izquierdo). De la misma manera, para estimar el consumo de artrópodos, distinguí un individuo con base al número de cápsulas craneanas, pares de élitros o mandíbulas. Empleé el coeficiente de correlación de Pearson para evaluar por medio de las medias y la desviación estándar (de) la existencia de una relación significativa (P< 0.05) entre las longitudes, los diáme tros, y los pesos de las egagrópilas, con el número de presas consumidas con ayuda del software InfoStat (Di Rienzo et al. 2008).
Muestreo de mamíferos pequeños
Para confirmar la presencia en el campo de los mamíferos pequeños, que conformaron la dieta de la lechuza de campanario, realicé trampeos estratificados en los hábitats de bosque de coníferas, bosque de encino, pastizal, riberas del Río Ocoyoacac y zonas de cultivo de maíz (cultivo predominante de la región). Los trampeos los efectué simultáneamente entre los meses de colectas de egagrópilas (marzo y abril). A lo largo de 10 transectos lineales dispuestos en los hábitats anteriormente mencionados (Figura 1) instalé 10 trampas Sherman con una separación de 10 m entre ellas. Las trampas las cebé con una mezcla de avena con esencia de vainilla. Los individuos que capturé los liberé una vez que los identifiqué. El esfuerzo de captura (Aragón et al. 2002, Santos-Moreno y Alfaro 2009, González-Romero 2011) tuvo un lapso de tres noches continuas por transecto/mes.
Resultados
Localicé dentro de la zona urbana y semiurbana del municipio de Ocoyoacac dos reposaderos de lechuza de campanario, siendo este primer sitio un área potencial de nidificación (por la presencia de restos de huevos) ubicado en la torre de la iglesia de San Miguel (Figura 1). La distancia lineal entre ambos puntos es de 2.53 km.
Colecté en los dos reposaderos un total de 663 egagrópilas completas, con n = 660 muestras en el primer punto y n = 3 muestras en el segundo. Colecté también las muestras disgregadas y restos óseos que dieron un total de 1,092 individuos depredados y 732 muestras de acuerdo al promedio de presas por egagrópila (n = 1.72 individuos). Las dimensiones promedio de las egagrópilas mostraron una longitud de 3.8 cm (DE = 9.46), un diámetro de 2.5 cm (DE = 5.02) y un peso de 3.8 g (DE = 2.20). Los hábitos tróficos de la lechuza de campanario en el municipio de Ocoyoacac mostraron una dieta basada principalmente en mamíferos pequeños (95.15%), seguida de artrópodos (2.66%) y aves (2.20%).
En cuanto a los mamíferos pequeños (n = 1,039; 95.15%), determiné nueve especies representadas en tres órdenes, cuatro familias y siete géneros (Cuadro 1). En esta categoría, la especie con frecuencia de consumo dominante correspondió a Rattus rattus, seguida por cuatro especies con una frecuencia de consumo abundante (Microtus mexicanus, Reithrodontomys microdon, R. megalotis y Peromyscus maniculatus). Con la frecuencia de consumo frecuente categoricé sólo al género Rattus spp. y a R. norvergicus. La frecuencia de consumo ocasional fue para Sorex saussurei y para el género Reithrodontomys spp. Las menores frecuencias de consumo fueron para dos individuos de Oryzomys couesi, y un lagomorfo del género Sylvilagus spp. Los mamíferos pequeños no determinados repre sentaron 1.56% del total de muestras. Registré un consumo ocasional de artrópodos y aves. El consumo accidental de material vegetal correspondió a semillas (n = 16), gramíneas (n = 12) y musgo (n = 1). En el Cuadro 1 se detallan las frecuencias y proporciones de consumo del total de categorías alimentarias, discriminada por clase, familia, género y especie y categoría de consumo.
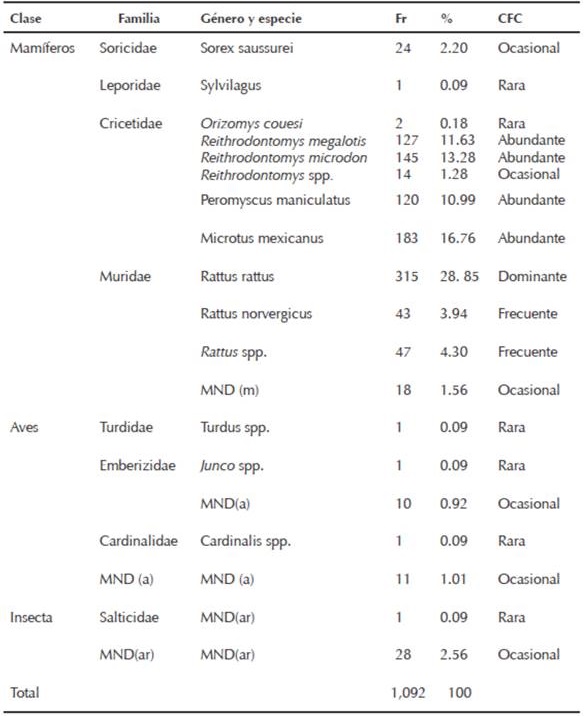
Cuadro 1 Frecuencia de consumo de especies presas determinadas en egagrópilas de Tyto alba, en Ocoyoacac, Estado de México. Fr= frecuencia relativa, %= porcentaje y CFC= categoría respecto a la frecuencia de consumo. MN= muestras no identificadas de (m) mamíferos, (a) de aves y (ar) artrópodos.
De acuerdo al número de muestras colectadas en esta investigación, la riqueza de mamíferos pequeños fue de DMg = 1.60, superior al valor de la riqueza de aves (DMg = 1.25) y artrópodos (DMg = 0.29). La dominancia de mamíferos pequeños y aves fue relativamente baja (λ = 0.20, λ = 0.36, respectivamente) al comparar los valores obtenidos en la categoría de artrópodos (λ = 0.93). La diversidad de mamíferos pequeños de acuerdo al índice de Shannon-Wiener fue de H’ = 1.85. Por otro lado, en artrópodos y aves el valor del índice fue de H’ = 0.14 y H’ = 1.11, respectivamente. En cuanto al valor del índice de Pielou, los mamíferos pequeños y aves superaron el valor de equitatividad media (J’ = 0.74, J’ = 0.69, respectivamente), caso contrario ocurrió para los artrópodos que presentaron baja equitatividad (J’ = 0.20). El valor del índice de amplitud del nicho trófico de Levins para mamíferos pequeños y aves fue de B = 5.25 y B = 2.57, respectivamente. En cuanto al consumo de artrópodos, el índice mostró un valor menor (B = 1.07). Los valores estandarizados del índice de Levins estimaron una amplitud trófica de Bst = 0.42 para mamíferos pequeños, Bst = 0.07 para artrópodos y Bst = 0.39 en aves. De acuerdo con las estimaciones realizadas con el coeficiente de correlación de Pearson, existe una correlación significativa entre la longitud (r = 0.389; P = 0.000), el diámetro (r = 0.297; P = 0.000) y el peso (r = 0.429; P = 0.000) de las egagrópilas con el número de presas contenidas en éstas.
Con un esfuerzo de muestreo de 300 trampas-noche fueron capturados 10 mamíferos pequeños lo que representa un éxito de captura de 3.3 % por transecto/mes. Corroboré la presencia de tres especies de mamíferos pequeños. P. maniculatus (n = 1) fue capturado en hábitats de pastizal. R. megalotis (n = 7) fue capturado en las zonas de cultivo y en fragmentos de bosque de encino. R. rattus (n = 2) fue capturado en las riberas del Río Ocoyoacac.
Discusión
Los hábitos alimenticios de la lechuza de campanario en el municipio de Ocoyoacac resaltaron dos aspectos que permiten comparar posteriormente los valores de diversidad trófica: i) una dieta constituida mayormente por el consumo de mamíferos pequeños, donde la selectividad de presas podría reflejar la abundancia relativa y biomasa disponible de las especies presas registradas, y ii) un consumo oportunista de presas mediado por la disponibilidad de los recursos alimenticios en esta región urbana.
La dieta, desde el punto de vista ecológico, se refiere al margen trófico de todas las categorías alimentarias que son consumidas por un animal (Stephens y Krebs 1986). La información disponible sobre los hábitos alimenticios de la lechuza de campanario en México sugiere que los patrones de consumo de presas se destinan en búsquedas activas de mamíferos pequeños, depredando principalmente roedores (López-Forment y Urbano 1977, Figueroa et al. 2002, Zarza y Cruzado 2004). Los resultados de esta investigación concuerdan con este patrón, ya que la presencia de mamíferos pequeños (95.15%) en las egagrópilas de la lechuza de campanario corrobora esta tendencia, seguida de artrópodos y aves.
En la presente investigación, la riqueza de mamíferos pequeños consumidos por la lechuza de campanario fue semejante al compararla con los resultados obtenidos por Rodríguez (2002) en Xochitla, Tepotzotlan, Estado de México. El número de especies presa que conformaron la dieta de este depredador en Ocoyoacac fue menor de acuerdo con los resultados obtenidos en la dieta de la lechuza de campanario por Zarza y Cruzado (2004) con 10 especies presas consumidas en la Sierra de Guadalupe (norte del Valle de México); 10 especies en el centro de Oaxaca (Lavariega et al. 2016). No obstante, el número de especies determinadas fue mayor respecto de las seis especies registradas en Mapimí, Durango (Aragón et al. 2002) y las ocho especies encontradas en el sureste de Oaxaca (Santos-Moreno y Alfaro 2009). El consumo de otras categorías alimenticias (artrópodos y aves) también ha sido reportado en la dieta de esta rapaz para otras latitudes del país (Aragón et al. 2002, Lavariega et al. 2016), no obstante, las proporciones de estas categorías secundarias son menores respecto a las obtenidas en esta investigación, exceptuando la frecuencia (16.61%, n = 82 de 493 individuos depredados) en el consumo de aves registrada por Rodríguez (2002). Se considera pertinente mencionar que las comparaciones de la riqueza de especies presa en las investigaciones anteriormente citadas cuentan con objetivos de investigación, áreas de estudio y esfuerzos de muestreo que no son los mismos para este estudio. Por lo que se sugiere considerar estas comparaciones en función de ejemplificar las particularidades en la dieta de la lechuza para Ocoyoacac.
De acuerdo con Margalef (1972), el valor del índice de diversidad de Shannon-Wiener, suele hallarse entre los valores 1.5 y 3.5, y sólo raramente sobrepasa 4.5 (Magurran 1988). Bajo este contexto es probable que la baja uniformidad (H’ = 1.85) y la equitatividad media (J = 0.74) de mamíferos pequeños estimadas en este estudio, se explican por la frecuencia de consumo dominante de R. rattus. Si bien se ha remarcado la ambigüedad en el uso e interpretación de los índices de diversidad (Krebs 1989), consideré útil proporcionar con esta investigación un valor de referencia que involucre la composición de la dieta de esta lechuza y los valores estructurales de la comunidad de mamíferos pequeños presentes en el área de estudio (Marti 1987). De esta manera, en futuros acercamientos se contará con un valor comparable para analizar de forma pertinente las variaciones estacionales en la dieta de esta especie. Adicionalmente, se ofrece información de la distribución potencial de mamíferos pequeños de hábitos nocturnos de Ocoyoacac.
Los aportes hechos por Zarza y Cruzado (2004) al describir la dieta de la lechuza de campanario en el norte del Valle de México, sugieren que la uniformidad de especies endémicas consumidas probablemente sea un reflejo de la calidad de los hábitats donde fueron colectadas las muestras de su estudio. No obstante, el poco número de muestras (n = 9) analizadas por los autores previamente citados, implica tomar esta comparación de manera cautelosa. Con base en los resultados de esta investigación se sugiere que la frecuencia de consumo de mamíferos pequeños es respuesta de dos posible escenarios, por un lado, la existencia de un efecto de la urbanización sobre la dieta de un depredador silvestre, y por otro lado, la plasticidad de este depredador al tomar ventaja de la abundancia relativa de roedores comensales exóticos en asentamientos urbanos, particularmente por un consumo dominante de R. rattus. En ambas posturas se manifiesta el grado de perturbación en los distintos hábitats en Ocoyoacac.
La dieta de la lechuza de campanario en Ocoyoacac mostró una tendencia selectiva en el consumo de mamíferos pequeños (Bst = 0.42) al menos en los meses estudiados y con el número de muestras colectadas. Este patrón también se registró en el estudio realizado por Aragón et al. (2002) donde la amplitud de nicho trófico de esta especie en Mapimí, Durango, mostró un patrón selectivo de presas (B = 1.58). En contraposición, los resultados obtenidos en la investigación de Rodríguez (2002) en Xochitla (Estado de México), sugieren que en las temporadas de invierno y primavera (diciembre 2000 y mayo 2001) esta especie presenta una conducta de caza oportunista (B = 5.82) debido al diverso consumo de mamíferos. Ambos resultados que describen cuán generalista o selectiva es la dieta de esta lechuza puede explicarse debido a que la conducta de caza generalista de este depredador puede ajustarse al modelo de caza oportunista (Bellocq 2000, Sahores y Trejo 2004, Bó et al. 2007). Cabe señalar que el valor de la amplitud del nicho trófico tenderá a aumentar dependiendo del grado de alteración de los hábitats de estudio, con aumentos significativos dependiendo el grado de alteración de los ecosistemas (Hernández-Muñoz y Mancina 2011), lo que a su vez determinará la disponibilidad de presas para la especie y su estrategia de caza. Es posible que el valor obtenido de la amplitud de nicho trófico estandarizado en esta investigación, sea un indicador del grado de perturbación territorial ocasionada por la transformación y pérdida de hábitats nativos en Ocoyoacac en respuesta del avance de la frontera urbana y agropecuaria, con beneficios para algunas especies como posiblemente ocurre con la población de R. rattus en el área de estudio.
Entre las causas que pueden asociarse a un marcado consumo de presas por parte de la lechuza de campanario -como el grupo faunístico, la edad, las abundancias relativas y la composición de sexos de las presas (Jaksic y Simonetti 1987, Bozinovic y Canals 2007, Andrade et al. 2016)-, la biomasa de las presas representa un factor que influye potencialmente en la búsqueda, asecho, captura y consumo de ciertas especies (Velarde et al. 2007). En esta investigación es probable que la abundancia relativa y biomasa disponible de R. rattus expliquen el porqué en la dieta de este depredador se concentran sus actividades de forrajeo en este roedor, situándolo como un objetivo de caza más rentable (en términos de compensación energética) respecto de otras especies depredadas como lo sugiere Schluter (1981). A pesar de que las descripciones de la dieta en esta investigación fueron realizadas en un contexto espacial de un área urbana y semiurbana del municipio de Ocoyoacac, también se han reportado estrategias de depredación selectivas por parte de esta especie en zonas con poco grado de transformación, como lo fue en la Reserva de la Biosfera en Mapimí, Estado de Durango (Aragón et al. 2002). En este sentido, se puede inferir que la relación depredador-presa no se encuentra potencialmente determinada si los sitios de forrajeo ocurren en áreas urbanas, como sucedió en Ocoyoacac, o en zonas destinadas a la conservación, en su lugar, se destaca el posible aprovechamiento que lleva a cabo la lechuza de campanario cuando dirige los eventos de caza en presas que recompensan sus requerimientos energéticos. Resultados similares fueron obtenidos por Hernández-Muñoz y Mancina (2011) en Cuba, quienes reportaron en la dieta de esta especie una frecuencia de consumo dominante (80%) de roedores exóticos (Mus musculus y Rattus spp.) que disponen de mayor biomasa. Los resultados de los autores anteriormente citados se asemejaron al comportamiento forrajero de la lechuza de campanario en Ocoyoacac.
En el Estado de México algunas poblaciones de roedores, y en especial aquellas que se encuentran fuertemente asociadas con las poblaciones humanas como lo es la rata negra (R. rattus) con una relación de tipo comensal (Romero-Álvarez y Medellín 2005), son controladas naturalmente por especies endémicas capaces de evitar daños al ecosistema y a la salud humana (Ostfeld y Holt 2004, Weeden et al. 2006, Meyer 2008). Con base en los resultados de esta investigación consideré que la lechuza de campanario representa un agente de control biológico de especies exóticas para el municipio de Ocoyoacac. El planteamiento de que una especie depredadora influye directamente sobre las abundancias de sus presas, tiene más de medio siglo de investigaciones que profundizan la relación del efecto de las aves rapaces sobre las poblaciones de roedores (Ostfeld y Holt 2004). Bajo este contexto, si asumimos que el ámbito hogareño estimado de R. rattus se estima en radios de 3 km2 alrededor de las poblaciones humanas (Romero-Álvarez y Medellín 2005), y que el ámbito hogareño de la lechuza de campanario abarca entre 5 y hasta 7 km2 dependiendo la temporada (Marti 1992, Meyer 2008), es probable que la población de esta especie de roedor exótico tenga cierto grado de control, ya que la selección y depredación de fenotipos particulares por parte de este depredador, como los mencionan Jaksic y Simonetti (1987), repercute directamente en la dinámica poblacional de una especie presa. Si bien Ostfeld y Holt (2004) cuestionan la solidez del efecto potencial que causa un depredador sobre la densidad de presas en términos de transmisión de enfermedades zoonóticas (roedores-seres humanos), en esta investigación se destaca el consumo dominante de R. rattus por parte de la lechuza de campanario como un papel funcional potencial para dirigir una línea de investigación enmarcada en la transmisión y prevalencia de enfermedades zoonóticas del territorio mexiquense.
Aunque los análisis mostraron una correlación significativa entre las dimensiones de las egagrópilas con el número de presas consumidas, considero que estas asociaciones no son lo suficientemente sólidas debido al efecto que puede causar la biomasa de las presas sobre la longitud, el diámetro y peso de estas regurgitaciones. En otras palabras, si las presas disponibles a consumir son pequeñas (en biomasa), se requerirá de una mayor frecuencia en la búsqueda y consumo de éstas; en cambio, si la presa es grande, no sólo la lechuza satisface sus requerimientos metabólicos mediante una única captura (Bozinovic y Medel 1988), sino también aumentará la probabilidad de medir una egagrópila con grandes dimensiones en que se encuentre un solo individuo, como ocurrió con nuestras muestras donde se registró la depredación de R. rattus. Debido a que la colecta de muestras en esta investigación se limitó a dos meses, se considera necesario realizar estas correlaciones entre las distintas temporadas del año para reforzar o desestimar estos valores de asociación. Los estudios realizados por Fuentes et al. (2015) encontraron una correlación significativa entre el peso de las egagrópilas de este depredador con el número de presas consumidas (r = 0.4377; P = 0.000). Los autores previamente citados sugieren que esta correlación puede estimar potencialmente el número de presas de forma rápida cuando el proceso de las muestras no pueda realizarse de manera inmediata. Bajo mis observaciones, se sugiere tomar con precaución una aseveración sólida entre las dimensiones de las egagrópilas y el número de presas contenidas por lo discutido anteriormente. Esto podría ser respaldado con las conjeturas formuladas por Guidali y Pigozzi (1996), donde explican que las dimensiones de las egagrópilas de la lechuza de campanario pueden verse afectadas no sólo por la disponibilidad de presas, también lo hace la estacionalidad y el momento del día, horas de luz o sin luz, en el que fueron regurgitadas (en términos de la pérdida de agua de las muestras al secarse).
En este sentido, Castro y Jaksic (1995) subrayan lo comprometedor que resultaría afirmar que la selección de presas por un depredador se encuentre condicionada sólo por atributos biométricos (ejemplo, clases de edad, tamaño), o la vulnerabilidad en la captura de las presas. En contraposición, Arruda Bueno y Motta-Junior (2008) explican en su estudio que la selección de presas por parte de la lechuza de campanario ocurre selectivamente sobre presas pequeñas y de menor edad. Los resultados de los autores previamente citados muestran la plasticidad que posee la lechuza de campanario en cuanto a sus estrategias de alimentación. Las conjeturas obtenidas en esta investigación sugieren que las dimensiones de las egagrópilas reflejan la particularidad de la estructura de la comunidad de mamíferos pequeños de hábitos nocturnos en Ocoyoacac, a la abundancia relativa de las presas, los sitios donde se realizan los forrajeos y la vulnerabilidad de la presas para ser capturadas (Marti 1987).
Es importante señalar que los análisis hechos en esta investigación podrían representar la dieta de una o dos parejas de lechuzas, por lo que se considera pertinente considerar esto para futuros estudios comparativos. Otra de las limitaciones a considerar fue la comparación del número de muestras de los dos reposaderos, ya que la colecta de egagrópilas en la zona semiurbana (segundo sitio) sólo contabilizó tres muestras.
Con base en los muestreos en campo corroboré la presencia de tres especies de roedores que coincidieron con las especies registradas en la dieta de la lechuza de campanario. En los hábitats de pastizal capturé a las especies P. maniculatus y R. megalotis. En las zonas destinadas al cultivo sólo capturé a R. megalotis. Finalmente en ambientes de ribera capturé R. rattus. Cabe señalar que la distribución potencial de los roedores que capturé no se encuentra limitada a los distintos hábitats donde realicé los transectos lineales.
Se concluye a partir de los muestreos realizados en este estudio que la lechuza de campanario en el municipio de Ocoyoacac muestra una conducta de caza selectiva, valiéndose de la predominancia y diversidad de algunas especies de mamíferos pequeños presentes en un área urbana y semiurbana del Estado de México. Se remarca el papel funcional de esta lechuza como un potencial controlador biológico de roedores exóticos. La presencia de distintas categorías alimenticias subraya la plasticidad trófica de esta rapaz. Se considera necesario realizar estudios a corto y mediano plazo para conocer si las estrategias de caza de esta especie difieren entre las distintas temporadas del año. Este acercamiento en la dieta de la lechuza de campanario promueve la aplicación de medidas de manejo (mediante la instalación de cajas-nido con características para la nidificación y crianza), que permitan ejercer prácticas de conservación en el territorio mexiquense.











 nueva página del texto (beta)
nueva página del texto (beta)



