Editor asociado: Patricia Ramírez Bastida
Introducción
Los humedales proporcionan servicios ambientales, como la conservación de la biodiversidad, que resultan esenciales para mantener la estructura y el funcionamiento de los ecosistemas tal y como los conocemos (Bobbink et al. 2006, Brauman y Daily 2009, Russi et al. 2013). Sin embargo, numerosas actividades humanas provocan la degradación y pérdida de humedales en todo el mundo (Millenium Ecosystem Assessment 2005, Scholes et al. 2005). La información del estado de conservación de los humedales de México y su biodiversidad es deficiente (Pineda López 2011), pero se admite que han sufrido un acelerado deterioro en tiempos recientes (Cervantes 2007, Sarukhán et al. 2009), lo que demanda acciones urgentes para revertir la situación (Ezcurra 2010).
Diversas especies de aves acuáticas migratorias habitan temporalmente en humedales (Boere y Rubec 2002, Wetlands International 2010), lo que aumenta la importancia de conservar estos ecosistemas (Sánchez 2007). La Convención sobre los Humedales de Importancia Internacional (i.e., Convención de Ramsar) busca promover la conservación y el uso sostenible de los humedales y sus recursos (http://www.ramsar.org). Uno de los sitios Ramsar de México es la “Presa Manuel Ávila Camacho (Presa Valsequillo)”, que fue construida en 1946 y que en 2012 fue designada como sitio Ramsar no. 2027 y “Parque Estatal Humedal de Valsequillo” (Rose Burney y Hernández Balzac 2013). Entre las razones seguidas en estas designaciones está su importancia para las aves acuáticas migratorias del Altiplano Mexicano, de donde ha desaparecido una gran parte de los humedales naturales (Pineda López et al. 2013). Según Rose (2012), Valsequillo cuenta con 16 especies de aves en alguna categoría de protección en México, según la NOM-059-SEMARNAT-2010, como el gavilán de pecho rufo (Accipiter striatus), el pato de collar mexicano (Anas platyrhynchos diazi) o el chipe de Tolmie (Oporornis tolmiei); además, se ha registrado la presencia de 33 especies y subespecies de aves cuasiendémicas, semiendémicas y endémicas a México, y se han observado por lo menos 38 especies de aves migratorias, como el pato cucharón norteño (Anas clypeata) o el pato pico anillado (Aythya collaris) (Rose 2012).
Rose (2012) reportó para Valsequillo un total de 169 especies de aves, de las cuales 33% son acuáticas; pero al listado se siguen añadiendo nuevos registros de aves acuáticas (Berumen Solórzano et al. 2016). En realidad, la información disponible sobre la avifauna acuática y migratoria de este sitio Ramsar es escasa (Rose 2012), y no se ha estudiado la diversidad de aves acuáticas, y qué variación temporal presenta. El objetivo de este estudio fue incrementar el conocimiento sobre la diversidad y los cambios temporales de la avifauna acuática de la Presa de Valsequillo. Para ello, (1) describimos los patrones de cambio en la estructura de la comunidad de aves acuáticas de Valsequillo, en términos de su abundancia, riqueza y diversidad, entre febrero de 2014 y enero de 2015, (2) evaluamos las diferencias entre periodos del año (i.e., grupos de meses), definidos en función de la composición y abundancia de la comunidad de aves acuáticas, y (3) identificamos las especies que indican las diferencias entre los periodos del año analizados.
Métodos
Área de estudio
El Parque Estatal “Humedal de Valsequillo” (23,612 ha) se localiza en la Cuenca del Alto Balsas, a unos 10 km al S de la Ciudad de Puebla, México. El límite norte de este sitio Ramsar discurre por el extremo sur de la mancha urbana de la ciudad de Puebla; al este, por la cortina de la Presa de Valsequillo; al sur, por la Sierra del Tentzo, y al oeste por el río Atoyac. Los afluentes principales del humedal son los ríos Atoyac y Alseseca, cuyas aguas recoge la Presa, de perfil dendrítico-irregular (2,800 ha; coordenadas geográficas del centro: 18°54’60”N, 98°10’58”O; altitud: 2 061 m). La temperatura media anual de la región es 17°C y la precipitación total anual 715 mm; el clima varía entre una temporada de lluvias en verano y otra de sequía en invierno. La calidad del agua en Valsequillo ha sido calificada como “mala”, pues recibe los aportes altamente contaminados de los ríos Atoyac y Alseseca (Rodríguez Tapia y Morales Novelo 2010). La vegetación circundante a la Presa está dominada por pastizales y áreas agrícolas (unas 13,000 ha), bosques de encino (2,640 ha) y bosques tropicales caducifolios (1,100 ha); además, hay superficies menores de palmar y mezclas de bosques y pastizales (Rodríguez Tapia y Morales Novelo 2010, Berumen Solórzano 2015).
Trabajo de campo
De febrero de 2014 a enero de 2015 (excepto en abril y junio) realizamos conteos mensuales de las aves acuáticas presentes en la Presa. Realizamos los muestreos una vez al mes, entre las 09:00 y las 12:30 h, desde una embarcación con motor fuera borda (velocidad promedio de 6 km/h). Nos fue imposible realizar conteos desde la embarcación en cerca del 60% del cuerpo de agua, debido a que la elevada densidad de lirio acuático (Eichhornia crassipes) impide la navegación (Mangas Ramírez 2011). Por ello, en cada recorrido desde San Baltazar Tetela hasta la cortina de la Presa contamos todos los individuos observados en una zona de 180° centrada en la proa del itinerario seguido por la embarcación. Para la observación utilizamos binoculares (Bushnell 10×50) y telescopio (Bushnell 20-60×60); y para la identificación, guías de campo (Howell y Webb 1995, Kaufman 2005, Peterson y Chalif 2008). Seguimos a Escalante et al. (2014) para los nombres comunes de las aves. Aunque también muestreamos las orillas de la Presa, la intensidad de estos muestreos no fue suficiente como para determinar con precisión y exactitud la riqueza y abundancia de las especies presentes de Charadriidae, Recurvirostridae y Scolopacidae, por lo que en este estudio no las consideramos.
Estructura de la comunidad
Con las abundancias mensuales de los Anseriformes, Podicipediformes, Gruiformes, Suliformes, Laridae y Pelecaniformes, calculamos los siguientes descriptores de la estructura de la comunidad (Moreno 2001). (1) Abundancia total [NTOT]: Número de individuos observados de todas las especies consideradas. (2) Riqueza [S768]: Número de especies estandarizado a un mismo número de individuos (Gotelli y Colwell 2001). Aunque el itinerario seguido en la Presa durante los muestreos fue siempre el mismo, la abundancia total de la comunidad cambió notablemente a lo largo del tiempo, por lo que no es lícito comparar los valores brutos de riqueza obtenidos con abundancias diferentes (Gotelli y Colwell 2001). Para corregir este inconveniente metodológico, utilizamos técnicas modernas de estimación de la riqueza mediante extrapolación o rarefacción (Colwell et al. 2012, Gotelli y Chao 2013), y calculamos el número de especies esperado con un número de individuos común a todos los meses (Colwell et al. 2012). El mínimo NTOT fue 384 individuos, por lo que obtuvimos por extrapolación la riqueza esperada en 768 individuos (i.e., 384 × 2) para los meses de mayo a septiembre (aquellos con NTOT < 768), pero obtuvimos por rarefacción (Gotelli y Colwell 2001) la riqueza esperada en el mismo número de individuos el resto de los meses (aquellos con NTOT > 768). (3) Diversidad de especies [1D384]: Expresada como el número de especies equiprobables (Jost 2006, Moreno et al. 2011, Jost y González Oreja 2012), estandarizado a 384 individuos (el mínimo NTOT), y calculado con los datos de la abundancia de cada mes: qD = [Σ pi q]1/(1 - q), donde pi es la proporción de individuos de la especie i, y q es el orden de la diversidad. Se utilizó q = 1, el único valor que pondera a todas las especies de modo proporcional a su abundancia (Jost 2006). Aunque la expresión anterior no está definida cuando q = 1, su límite sí y equivale a exp[ - Σ pi × ln(pi)] (Jost 2006). Realizamos todos los cálculos de riqueza y diversidad con EstimateS 9.1.0 (Colwell 2013); el número de repeticiones fue siempre n = 100, sin reemplazo entre individuos.
Análisis multivariantes
Hemos seguido la estrategia de análisis en sucesivas etapas propuesta originalmente por Clarke (1993). Primero realizamos un análisis de aglomeración jerárquica (Legendre y Legendre 2012) para revelar los patrones de dinámica temporal que pudieran estar ocultos en los datos de abundancia; construimos el dendrograma correspondiente mediante el algoritmo UPGMA (Group Average). Posteriormente, evaluamos la significación estadística de los clusters de meses así generados con la rutina SIMPROF (Similarity Profile). El método SIMPROF es una alternativa moderna y objetiva frente a formas más tradicionales de interpretar los resultados de un dendrograma, y evalúa la hipótesis nula de que no hay estructura multivariante en la comunidad (Clarke et al. 2008). Finalmente, aplicamos la prueba simper (Similarity Percentage) para revelar qué especies explican las principales diferencias entre los clusters de meses previamente formados (Clarke 1993). Además, medimos la magnitud del cambio ocurrido entre pares de meses consecutivos como el complemento a la unidad de su similitud (Moreno 2001). Realizamos todos los análisis multivariantes con el paquete estadístico Primer 6.1.11 (Clarke y Gorley 2006), previa transformación de los datos (y’= y 1/2) para reducir la importancia de las especies más abundantes; como medida de la similitud utilizamos el índice de Bray-Curtis (Legendre y Legendre 2012).
Resultados
Estructura de la comunidad
La abundancia total (NTOT) varió notablemente entre meses (coeficiente de variación, CV = 70.5%), con mínimos entre 400 y 600 ind. (mayo-agosto) y máximos entre 3000 y 4500 ind. (octubre-enero; Figura 1). La especie más abundante fue la gallareta americana (Fulica americana; que representó entre el 25% y 80% del NTOT correspondiente), seguida por la garza blanca (Ardea alba; entre el 1% y 50%), y el pato tepalcate (Oxyura jamaicensis; entre el 1% y 15%) (Cuadro 1). Sólo seis especies se observaron todos los meses (Cuadro 1): el pato de collar mexicano (Anas platyrhynchos diazi), el pato tepalcate, la gallareta americana, la garza morena (Ardea herodias), la garceta pie dorado (Egretta thula) y la garza blanca. Especies muy poco abundantes (menos de 10 individuos acumulados en todos los meses; Cuadro 1) fueron el pato cabeza roja (Aythya americana), la garceta verde (Butorides virescens), la garza-tigre colorada (Tigrisoma mexicanum), el ibis blanco (Eudocimus albus) y el pato arcoíris (Aix sponsa). Finalmente, en términos de frecuencia, el pijije ala blanca (Dendrocygna autumnalis) y el pato arcoiris fueron especies muy raras, pues se observaron en un único mes.
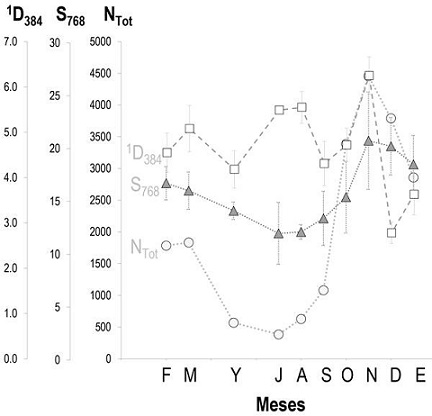
Figura 1 Cambios temporales de la abundancia total (NTOT), la riqueza (estandarizada a 768 individuos, S768) y la diversidad de especies (expresada como el número de especies equiprobables, estandarizado a 384 individuos, 1D384) de aves acuáticas registradas durante este estudio en la Presa de Valsequillo. Las barras de error muestran los intervalos de confianza al 95% para 1D384 y S768. Clave de los meses: F, febrero; M, marzo; Y, mayo; J, julio; A, agosto; S, septiembre; O, octubre; N, noviembre; D, diciembre; E, enero.
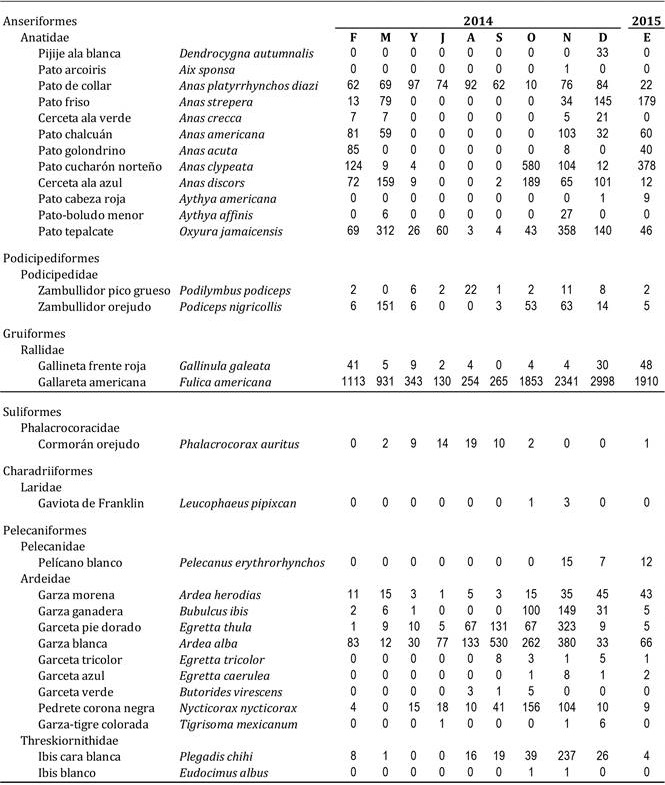
Cuadro 1 Abundancia (individuos/mes) de las especies de aves acuáticas registradas durante este estudio en la Presa de Valsequillo. Clave de los meses: F, febrero; M, marzo; Y, mayo; J, julio; A, agosto; S, septiembre; O, octubre; N, noviembre; D, diciembre; E, enero.
Aunque el número total de especies fue 30, la riqueza media esperada en cada mes con 768 individuos varió entre 12 (julio-septiembre) y 20 especies (noviembre-diciembre). De hecho, la riqueza estandarizada a 768 individuos (S768) fue el descriptor de la estructura de la comunidad menos variable a lo largo del tiempo (CV = 19.9%), y siguió un patrón temporal muy similar al de NTOT (coeficiente de correlación no paramétrico de Spearman, rs = 0.879; P = 0.0008; n = 10) (Figura 1). Finalmente, la diversidad esperada con 384 individuos (1D384) también varió poco entre meses (CV = 21.6%), pero mostró un patrón temporal menos claro (Figura 1). El mínimo se registró en diciembre (1D384 = 2.8 especies equiprobables) y el máximo en noviembre (6.3 especies equiprobables; i.e., 2.25 veces más).
Análisis multivariantes
Tras la prueba SIMPROF, el dendrograma reveló la existencia de sólo dos clusters de meses estadísticamente significativos (P = 0.001): primero, el grupo formado por los meses que van de mayo a septiembre (‘primavera-verano’); después, el resto de meses (‘otoño-invierno’) (Figura 2); no fue estadísticamente significativa la estructura interna del primero (P = 0.336) ni del segundo (P = 0.589) de estos clusters de meses.
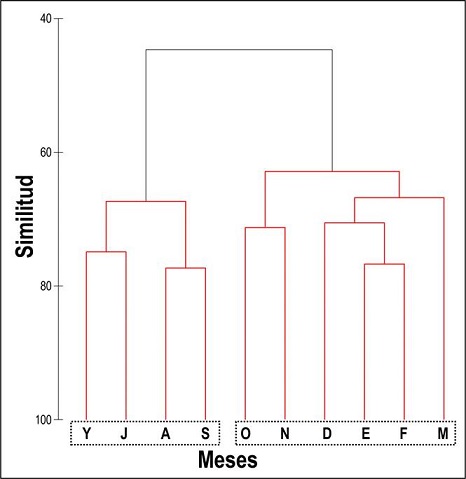
Figura 2 Análisis de aglomeración jerárquica (UPGMA) realizado sobre la matriz de similitud entre meses (coeficiente de Bray-Curtis), con los datos de abundancia de las aves acuáticas registradas durante este estudio en la Presa de Valsequillo. Se muestran los meses de estudio, agrupados en los dos únicos clusters con significación estadística (según la prueba SIMPROF): ‘primavera-verano’ (Y → S) vs. ‘otoño-invierno’ (O → M). Clave de los meses: F, febrero; M, marzo; Y, mayo; J, julio; A, agosto; S, septiembre; O, octubre; N, noviembre; D, diciembre; E, enero.
La especie que marcó las diferencias entre estos dos periodos fue la gallareta americana (que explicó cerca del 50% de tales diferencias), seguida por el pato cucharón norteño y el pato tepalcate (Cuadro 2). La abundancia de la gallareta fue mínima durante el primer cluster de meses (vg., sólo 130 ind. en julio), pero creció notablemente durante los meses del segundo cluster (v.g. casi 3000 ind. en diciembre; Cuadro 1). Lo mismo es válido para el pato cucharón norteño y el pato tepalcate. De hecho, la abundancia de las especies observadas fue generalmente mayor en otoño-invierno (el caso extremo lo observamos para el pato friso (Anas strepera) y el pato chalcuán (Anas americana), ausentes por completo en los meses de verano, pero con abundancias máximas de casi 180 individuos en enero para el pato friso, y de poco más de 100 individuos en noviembre para el pato chalcuán; Cuadro 1), pero unas pocas especies fueron más abundantes en verano (Cuadro 2) (v.g., la garza blanca, cuya abundancia máxima se registró en septiembre: 530 ind.; Cuadro 1). Finalmente, el cambio más notable en la comunidad entre pares de meses consecutivos se registró entre septiembre y octubre, y posteriormente la variación se observó entre marzo y mayo (Cuadro 3). Se desconoce si el cambio pudo haber sido más marcado a lo largo de los meses en los que no se muestreó (i.e., marzo-abril o abril-mayo).
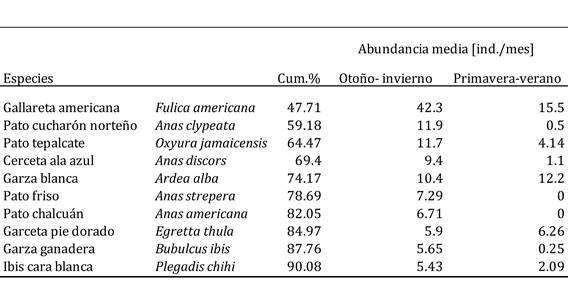
Cuadro 2 Análisis SIMPER realizado sobre las abundancias de las especies de aves acuáticas registradas durante este estudio en la Presa de Valsequillo: ‘otoño-invierno’ (octubre a marzo) vs. ‘primavera-verano’ (mayo a septiembre). La columna “Cum. %” muestra el porcentaje de la disimilitud total entre ambos clusters de meses que queda explicado hasta la especie correspondiente.
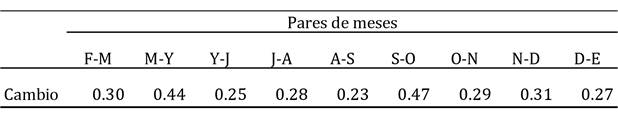
Cuadro 3 Magnitud del cambio ocurrido entre pares de meses consecutivos (1 ‒ Similitud) en la estructura de la comunidad de aves acuáticas registradas en este estudio en la Presa de Valsequillo. Como medida de la similitud se utilizó el índice de Bray-Curtis. Clave de los meses: F, febrero; M, marzo; Y, mayo; J, julio; A, agosto; S, septiembre; O, octubre; N, noviembre; D, diciembre; E, enero.
Discusión
La aproximación metodológica en este estudio fue que los datos “revelasen su propia historia” (véase, Clarke 1993): en lugar de forzar la agrupación de los meses de estudio en unos valores prefijados (clásicamente, temporada de secas vs. temporada de lluvias), los análisis han revelado la existencia de dos clusters de meses, que hemos llamado ‘primavera-verano’ y ‘otoño-invierno’. Nótese que sólo parcialmente coinciden estos clusters con las dos temporadas mencionadas. Nuestro estudio ha permitido revelar cómo cambia temporalmente la estructura de la comunidad formada por las aves acuáticas del sitio Ramsar Presa de Valsequillo. La comunidad varió de modo notable entre el otoño-invierno, periodo en el que fue estructuralmente más compleja (pues se registraron los valores máximos de abundancia de varias especies, así como de la riqueza y diversidad de especies de toda la comunidad), y la primavera-verano, periodo en el que fue estructuralmente más sencilla (con mínimos de los valores estimados). Este patrón es similar al descrito por otros autores que han estudiado los cambios temporales en la avifauna acuática que habita en humedales del “Corredor del Pacífico” en México. Cupul Magaña (1999) destacó un aumento de la riqueza de especies y la abundancia de aves acuáticas en la laguna El Quelele (Nayarit, México) entre octubre y marzo. Del mismo modo, Amador et al. (2006) señalaron que la comunidad de aves acuáticas del Estero Rancho Bueno (B.C.S, México) fue más diversa a principios del invierno y que la diversidad disminuyó desde entonces hacia finales de la primavera (junio), cuando se registró el mínimo número de especies. Además, en el “Corredor Migratorio del Centro” del Altiplano Mexicano, Fonseca et al. (2012) observaron en invierno las mayores riquezas y abundancias de aves acuáticas en la Laguna de Acuitlapico, Tlaxcala; y Ayala Pérez et al. (2013) también registraron en febrero los máximos en la abundancia de aves acuáticas invernantes en la ciénega de Tláhuac, dentro de la planicie lacustre de Chalco (al SE de la Ciudad de México). Estos aumentos en la riqueza y diversidad de la comunidad de aves acuáticas se deben a las numerosas especies migratorias que utilizan estos humedales, como la Presa de Valsequillo. Es el caso, por ejemplo, de varias especies de patos, como el pato cucharón norteño, el tepalcate, el friso y el panadero, que estuvieron ausentes de nuestro humedal durante los meses de verano.
En Valsequillo, el cambio más importante entre pares de meses consecutivos lo observamos en la transición del verano (septiembre) al otoño (octubre). La principal especie que explicó estos cambios fue la gallareta americana: aunque fue un ave residente, que estuvo presente todo el año (como el pato de collar mexicano y el pato tepalcate, entre las Anátidas; y varias especies de garzas, entre las Ardeidas), la abundancia de la gallareta fue mínima en verano, pero en otoño-invierno se multiplicó por siete (1,850 ind./mes). Otras especies, como el pato cucharón norteño, el pato tepalcate, la cerceta ala azul y el pato friso, mostraron un patrón de cambio en sus abundancias similar al de la gallareta. Aunque son especies residentes, la importancia de la gallareta y del pato tepalcate en la dinámica temporal de la avifauna que habita ecosistemas acuáticos ya ha sido observada por otros autores (Guzmán et al. 1994, Fonseca et al. 2012, Ayala et al. 2013). Esto indica la estacionalidad con la que la comunidad de aves acuáticas utiliza la Presa de Valsequillo, así como la mayor importancia de este humedal para las Anátidas y Rállidas durante la estancia invernal. Por su parte, entre los Pelecaniformes, los máximos de abundancia se registraron entre septiembre y noviembre, lo que sugiere que estas especies utilizaron la Presa de Valsequillo durante los desplazamientos migratorios otoñales, pero no como estancia migratoria. Otras variables pueden explicar estos cambios temporales en la abundancia de las aves acuáticas de Valsequillo, relacionadas con fenómenos regionales no ligados necesariamente a los movimientos migratorios, así como con otros de escala local (v.g., cambios en las condiciones ambientales de la Presa, como la profundidad del agua, la disponibilidad de recursos tróficos o la cantidad de oxígeno disuelto en el agua).
Consideraciones finales. Aprovechamiento y conservación
El conocimiento más reciente sugiere que los humedales artificiales (que han sido incluidos entre los humedales de México; Berlanga Robles et al. 2008) pueden desarrollar una importante función en la conservación de la diversidad de aves acuáticas del Altiplano Mexicano (Pineda López 2011, Pineda López et al. 2013), porque son áreas en las que se registra el paso migratorio o la invernada de gran diversidad de aves que hacen uso del Corredor Migratorio del Centro (Ayala Pérez et al. 2013), dentro del Sistema Neártico-Neotropical (Newton 2008). Además, la disponibilidad del recurso hídrico en áreas con bajos valores de precipitación es naturalmente escasa, lo que puede generalizarse a más de la mitad de México; por ello, la conservación de los humedales existentes, naturales o artificiales, debería ser prioritaria tanto para la vida silvestre como para los asentamientos humanos (López Saut et al. 2014). Aunque el humedal de Valsequillo ha sido incluido en la lista de sitios Ramsar, la importancia ambiental de su área de influencia aún permanece poco documentada (Rose Burney y Hernández Balzac 2013). De hecho, en el humedal se registran sistemáticamente altas concentraciones de metales pesados, elevadas cargas de materia orgánica en general (y coliformes fecales en particular), y baja disponibilidad de oxígeno disuelto (Rodríguez Tapia y Morales Novelo 2010, Mangas Ramírez 2011). Un sistema de gestión integral de los vertidos contaminantes que recibe la cuenca de los ríos Atoyac y Alseseca, que vierten finalmente en el humedal, redundaría en beneficio de la calidad ambiental de este ecosistema acuático y, probablemente, en un aumento de su importancia ornitológica.
Por otro lado, diversos autores han señalado que la variabilidad espacial y temporal de los recursos que proporciona la vegetación a las aves acuáticas (alimento, cobertura y protección) puede acarrear, a su vez, cambios en la distribución y abundancia de las aves afectadas (Ayala Pérez et al. 2013). Cerca del 60% del cuerpo de agua de Valsequillo (Mangas Ramírez 2011) está cubierto por poblaciones flotantes de lirio acuático (Eichhornia crassipes), una planta exótica invasora que en el área de estudio alcanza una densidad de 88 individuos/m2 y una biomasa de 43 kg/m2 (Rosano Ortega 2009). Desde hace décadas, el lirio acuático se ha convertido en un problema para la navegación y la pesca en gran parte del humedal, lo que evitó que pudiéramos realizar los conteos en la totalidad del cuerpo de agua. Ahora bien, observaciones aisladas sugieren que el área cubierta por el lirio acuático puede ser una excelente zona de descanso y alimentación para las aves acuáticas, así como refugio contra cazadores. Por ejemplo, en marzo de 2014 nos fue posible acceder a una parte del área cubierta por el lirio y en un solo punto de muestreo se registraron ca. 3000 patos cucharones, 30 patos trigueros, 80 patos panaderos y 11 pijijes, lo que contrasta con los valores registrados en el resto del humedal: 9 cucharones, 69 trigueros, 59 panaderos y ningún pijije. Por ello, es muy probable que la importancia ornitológica de este sitio Ramsar sea mayor de lo que se ha considerado. De hecho, recientemente se han asentado cuatro nuevos registros de especies de aves para este humedal, incluida la primera observación del pato arcoíris (Aix sponsa) en todo el estado de Puebla (Berumen Solórzano et al. 2016). En conclusión, es necesario incrementar los estudios sobre la función ecológica que este y otros humedales de interior, tanto naturales como artificiales, realizan como reservorios de la biodiversidad de aves acuáticas (Pineda López 2011, Fonseca et al. 2012, Pineda López et al. 2013).
Los resultados de este estudio tienen aplicación en actividades ambientalmente sustentables, como la observación de aves o el ecoturismo (Bibby 2002, Weller 2004, Lebbin et al. 2010). Hasta ahora, en las comunidades locales de Valsequillo no se generan empleos relacionados con el turismo de naturaleza, pero los habitantes locales (con la necesaria previsión y planeación; Palacio Núñez et al. 2000) podrían convertirse en guías ambientales (sensu Bennun 2002), rentar sus embarcaciones y generar una derrama económica que favoreciese la conservación de las aves y sus hábitats, en consonancia con los principios de la Convención de Ramsar 2015 (Boere y Rubec 2002). Por ejemplo, es posible programar visitas a Valsequillo durante la época de mayor diversidad de especies (octubre-noviembre), o considerando el máximo reemplazo en la comunidad de acuáticas (i.e., visitando el humedal primero en septiembre y después en octubre).











 nueva página del texto (beta)
nueva página del texto (beta)


