Editor asociado: Carlos Alberto Lara Rodríguez
Introducción
Los beneficios evolutivos del cuidado parental involucran una mayor sobrevivencia de la progenie, y un consecuente aumento en la adecuación de los padres (Balshine 2016). Aunque en vertebrados endotérmicos como las aves también se ha propuesto como ventajas del cuidado parental que la selección natural favorece tanto temperaturas altas como estabilidad térmica durante la incubación y empollamiento, porque esto incrementa las tasas de eclosión y desarrollo de la progenie (Farmer 2000). Sin embargo, para obtener estos beneficios, es necesario que los padres asuman grandes costos asociados con la vigilancia, alimentación y sobre todo con el mantenimiento de su propia homeotermia y la de sus polluelos. En aves y mamíferos los adultos gastan 30% de su presupuesto diario en mantener su propia endotermia, por lo que la enorme inversión adicional que representa la progenie podría explicar la necesidad del cuidado biparental observado en la mayoría de las especies de aves (90-95%) (Balshine 2016). Por lo anterior, se ha propuesto que la aparente incapacidad de los polluelos altriciales para producir calor endógeno (i.e. ectotermos) durante los primeros días después de la eclosión e incluso que retrasen la endotermia, es en realidad una estrategia que les permite invertir todos sus recursos en desarrollarse y cargar el gasto de su estabilidad térmica a los padres (Clavijo-Baque y Bozinovic 2012, Wegrzyn 2013).
Los colibríes son especies polígamas en donde todo el cuidado es uniparental y realizado por las hembras, esto incluye desde la elección del sitio de anidación, la construcción y materiales del nido, hasta la incubación y el cuidado de la progenie después de la eclosión (Southwick y Gates 1975, Baltosser 1996). La mayoría son especies pequeñas y por ello muy sensibles al estrés energético, además los polluelos al eclosionar son altriciales (Howell y Dawson 1954, Oniki et al. 2000), con altas tasas metabólicas y pocas reservas energéticas (Wolf y Hainswarth 1977), por lo que su sobrevivencia depende enteramente de la capacidad de las hembras para cubrir sus requerimientos metabólicos y térmicos, que en algunas aves representa casi 40% de su energía metabólica (Dunn 1976).
El cuidado materno exclusivo, así como los periodos de anidación e incubación relativamente largos que presentan la mayoría de las especies de colibríes (ca. 40 días, Calder 1971, Oniki et al. 2000, García y Botero 2013), imponen a las hembras anidantes extraordinarios retos energéticos. En general, pasan entre 57-80% del tiempo del día atendiendo su nido tanto para cubrir los requerimientos nutricionales como para mantener la estabilidad térmica de las crías (Baltosser 1996, Schuchman 1999). Recientemente en otras especies se ha sugerido que incrementar la fluctuación térmica del nido y las crías puede tener efectos negativos en el sistema inmunológico, el desempeño locomotor, el crecimiento, la supervivencia y la reproducción futura de la progenie (Palacios y Martin 2006, Du Rant et al. 2011, 2012; Martin et al. 2011), e incluso también que las temperaturas postnatales tempranas afectan la capacidad termorregulatoria de los individuos adultos. Esperaríamos entonces observar en colibríes que las conductas de cuidado materno relacionadas con la homeotermia del nido (i.e. incubación y empollamiento) estuvieran bajo fuertes presiones de selección para maximizar el desempeño, sobrevivencia y adecuación de la progenie, minimizando los costos asociados con la inversión parental relativa (Martin 2007). En ese sentido, se ha sugerido que rasgos como la capacidad de suprimir el torpor nocturno durante la anidación, la flexibilidad conductual para disminuir el tiempo de anidación si la temperatura del ambiente se incrementa y la intensa actividad territorial de las hembras durante las primeras etapas del desarrollo de su progenie, son algunas de las adaptaciones que han adquirido las hembras de la familia Trochillidae para enfrentar los retos del cuidado parental (Pitelka 1951, Baltosser 1996). Incluso, el que los huevos, por ser pequeños, experimenten altas tasas de enfriamiento aunado al alto costo energético necesario para volver a calentar los huevos si estos pierden mucho calor, son factores importantes para determinar la asignación del tiempo de los padres a las conductas de cuidado (Björn et al. 2012).
Los estudios realizados en algunas especies de colibríes sugieren que durante la incubación las hembras deben responder de manera eficiente a las variaciones en las condiciones ambientales y mantener la temperatura del nido por encima de un umbral mínimo de 24°C para garantizar el éxito de eclosión de la progenie (Calder 1971). Además, las hembras deben minimizar la variación en la temperatura dentro del nido para reducir los periodos totales de incubación y cuidado parental, y con ello los costos energéticos asociados a la reproducción (Tulp y Schekkerman 2006). Aunque la inmensa variedad de ambientes en que habitan los colibríes se traduce en una gran diversidad de retos, tanto térmicos como de conductas de cuidado materno durante la crianza, en las pocas especies que se han estudiado existe una gran similitud entre las condiciones de estabilidad térmicas observadas en los nidos. Por ejemplo, Archilochus alexandri y Calypte anna, habitan en ambientes 14ºC por encima de los ocupados por Calypte costae y Heliothryx barroti, sin embargo, a pesar de que sólo se estudió un nido de cada especie, la temperatura promedio de los nidos de las cuatro especies fue similar (ca. 34°C, Vleck 1981). De igual manera, en C. anna y Selasphorus calliope, que anidan en bosques montanos, las hembras logran mantener las temperaturas promedio dentro de sus nidos entre 34-37°C, aun cuando la duración promedio de las salidas de forrajeo en el primero son de 10.8 min y supe riores a los 40 min en S. calliope (Calder 1971).
Aunque el número de especies y de nidos estudiados es bajo, trabajos previos de ecología térmica durante la anidación en colibríes, sugieren que las hembras ajustan los periodos de atención del nido, a fin de favorecer el desempeño fisiológico y conductual de su progenie al mantenerla dentro de un rango estable de temperatura (Vleck 1981). Debido a ello se espera que las decisiones de la madre de abandonar el nido, así como el número y duración de los periodos de forrajeo e incubación no sean aleatorios, sino se establezcan para optimizar su propia tasa de forrajeo y balance energético, pero principalmente para regular la temperatura de la progenie de acuerdo con sus requerimientos térmicos, nutricionales y el estado de desarrollo (i.e. huevo y polluelo), y que respondan a los patrones de variación en la temperatura ambiental (Vleck 1981, Tulp y Schekkerman 2006).
Considerando estos antecedentes, en este estudio evaluamos la variación térmica durante la anidación en un nido de Phaethornis longirostris. Si bien, al ser un colibrí tropical, confiamos en que los eventos tanto de cuidado (i.e. empollamiento) como de ausencia de la madre sean prolongados. Sin embargo, esperamos también que ni el número ni la duración de las conductas sean aleatorias, sino determinados para minimizar la variación del ambiente térmico del nido.
Métodos
Sitio y especie de estudio
El estudio lo realizamos en una extensión de selva alta perennifolia sobre el río Otolum, dentro del Jardín Botánico del Área Natural Protegida de Palenque, Chiapas (17°29’12.1’’ N, 92°02’35.7’’ O) a una elevación de 67 msnm. El clima de la zona es tropical húmedo, con temperatura mínima anual de 24.8°C y máxima de 27.8°C, así como una precipitación media anual de 2 762.9 mm. (Díaz 1996).
Phaethornis longirostris es una especie poco común; mide entre 130 y 160 mm. Los machos y hembras son muy parecidos en el plumaje y solamente difieren en la longitud de las alas y en la longitud y curvatura del pico (las hembras tienen las alas más cortas, y el pico más corto y curvo que el macho; Arizmendi y Berlanga 2014). Es residente en sotobosques tanto de selvas húmedas y subhúmedas como de vegetación ribereña y bosques nublados desde el oeste de México (Nayarit y Colima) hasta Colombia, en altitudes desde 0 hasta 1 000 msnm (Arizmendi y Berlanga 2014). Se ha documentado que el periodo de anidación es de enero a junio, lo cual coincide con el periodo de floración del género Heliconia, que es su principal recurso de alimentación (Peterson y Chalif 1989). Esta especie pone de uno a tres huevos, tiene periodos de incubación de 17-18 días y un periodo de empollamiento de 21 días (Stiles y Wolf 1979).
Trabajo de campo
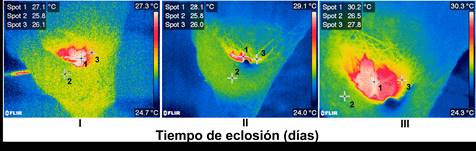
El 16 de mayo de 2012 localizamos un nido activo con dos huevos de P. longirostris en el Parque Natural Palenque sobre el río Otolum, en Chiapas, a una altura de 1.5 m del cauce del río, en el envés de una hoja de platanillo (Figura 1a); a la mañana siguiente ya contenía un pollo de un día de nacido y un huevo (Figura 1b), el cual eclosionó en el transcurso del día una vez iniciada la toma de datos. Durante un día (i.e. 17/05/2012) colocamos, entre el huevo y el polluelo, un termopar ultradelgado (Physitemp IT-24p, 0.127 mm), conectado a un termómetro electrónico para registrar la temperatura dentro del nido (Physitemp Bat 12, precisión 0.01ºC). Registramos también la temperatura ambiental con una mini-estación climática 850070 (Sper Scientific ltd, precisión 0.01ºC), colocada a la misma altura e idénticas condiciones de cobertura y tipo de vegetación que el nido. Ambas temperaturas se midieron exclusivamente el día en que se instalaron los equipos y se realizaron mediciones cada dos minutos en el periodo de 9:20 a 16:20 h. Sin embargo, para minimizar cualquier efecto relacionado con la instalación de los termopares dentro del nido, se excluyeron de los análisis las primeras dos horas de datos (Martin et al. 2007). Además, registramos la conducta de anidación de la hembra: a) tiempo de permanencia en el nido y b) tiempo y duración de las salidas. Posteriormente, para calibrar y probar la precisión de las estimaciones de la temperatura en el nido, mientras aún estaba colocado el termopar, tomamos fotografías térmicas de la progenie empleando una cámara termográfica (flir t-200, precisión 0.1ºC). La toma de imágenes termográficas la realizamos inmediatamente después de terminado el periodo de toma de datos para no afectar la conducta de la hembra. Para evaluar si los polluelos son capaces de generar calor endógeno a edades muy tempranas, repetimos la medición de su temperatura corporal utilizando imágenes termográficas durante los dos días posteriores a la toma de datos (simultáneamente con mediciones de la temperatura ambiente). Estas mediciones las realizamos a la misma hora que el primer día y dentro de los dos minutos posteriores a la salida de la hembra del nido.
Análisis estadísticos
Para determinar las tasas de enfriamiento potencial de la progenie por efecto del diferencial térmico con el ambiente, durante las salidas de forrajeo de la hembra, utilizando un análisis de varianza, evaluamos las diferencias entre la variación de la temperatura dentro del nido (i.e. temperatura de la progenie) y la variación de la temperatura del ambiente cada dos minutos durante el periodo total de muestreo (n = 170 mediciones, en los 340 min).
Eficiencia térmica de la hembra
La eficiencia térmica de la hembra, definida como su capacidad para minimizar la variación de temperatura dentro del nido (°C), entre los periodos de cuidado y ausencia del nido, la analizamos con un ancova, en el que se utilizó como variable de respuesta la temperatura dentro del nido y considerando como co-variable la temperatura del ambiente. Así mismo, para evaluar si las decisiones de la madre, respecto al tiempo que asigna a las conductas observadas en este estudio (i.e. cuidado materno y salidas del nido), resultan en una reducción significativa en la variación del ambiente térmico dentro del nido, utilizamos como variable de respuesta los valores del diferencial térmico del nido (i.e. diferencia entre la temperatura del nido y la del ambiente) durante las conductas de cuidado y forrajeo utilizando un ANOVA. Las pruebas de normalidad y homocedasticidad para todos los datos, así como los análisis los realizamos en el programa estadístico R (versión 3.2.0).
Resultados
Los 170 registros térmicos realizados en los 340 minutos de muestreo indican una temperatura media del nido de 26.9°C (± 0.41 DE) la cual se mantuvo significativamente superior a la temperatura ambiental (26.2°C ± 0.03 media ± DE; F 1,8 = 183.68, gl = 1, P < 0.0001). En promedio el diferencial térmico registrado entre ambas temperaturas fue de 0.72°C (min=0.1, max=1.4).
Durante los 340 minutos de observación, la hembra de P. longirostris realizó cuatro salidas, de duración muy variable (22, 32, 44 y 56 min). Entre cada evento de salida del nido observamos periodos de cuidado parental (n=4), también de duración variable (28, 40 y 68 min, el último evento inició poco antes de finalizar la toma de datos) (Figura 2). El porcentaje del tiempo total que asignó a cada conducta fue de 45% forrajeo y 55% cuidado parental (anidación y empollamiento). Nuestros datos muestran que aunque la temperatura del ambiente varió en más de 1°C, la hembra mantuvo la temperatura dentro del nido siempre superior a la ambiental con una variación por debajo de 1ºC (promedio -0.75 °C, rango máx. -1.5 °, mín. -0.01). Así mismo, la tasa de enfriamiento potencial dentro del nido por minuto fue muy reducida (máx. 0.025 °C, mín. 0.003 °C; Figura 2).
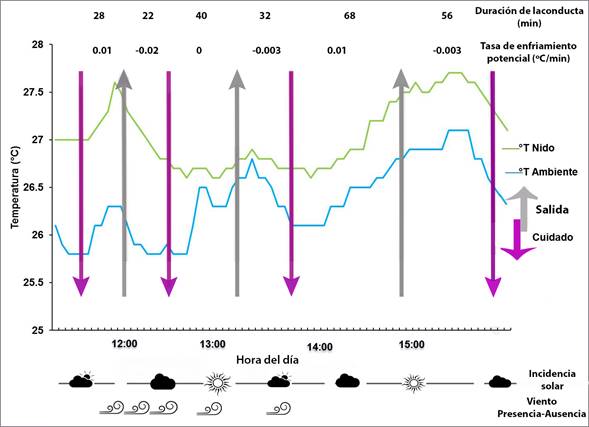
Figura 2 Variación en la temperatura dentro del nido y del ambiente durante el periodo de cuidado materno registrado en P. longirostris. Las flechas rosas indican el momento en que la hembra regresa al nido y empolla, las flechas grises los momentos en que la hembra abandona el nido. Se muestran en la parte superior el tiempo total que la hembra permanece dentro o fuera del nido en cada evento, así como la tasa de enfriamiento que experimentó el nido en esos eventos. En la parte inferior se indican los momentos en que el sitio estaba soleado, semi-nublado o nublado, así como la presencia o ausencia de viento.
Los resultados de eficiencia térmica muestran una mínima variación térmica dentro del nido sin diferencias significativas en ninguno de los periodos de forrajeo de la hembra (F1,8 = 0.92, P = 0.339). Tampoco se detectó un efecto significativo de la temperatura del ambiente (F1,8 = 0.16, P = 0.7), ni de la interacción entre la temperatura dentro del nido y el cambio de la temperatura ambiental (F = 2.95, gl. = 8, P = 0.09). En este mismo sentido, no se encontró variación significativa en el diferencial térmico del nido, entre las salidas de forrajeo y los periodos de cuidado de la hembra (F1, 8 = 0.533, P = 0.467; Figura 3).
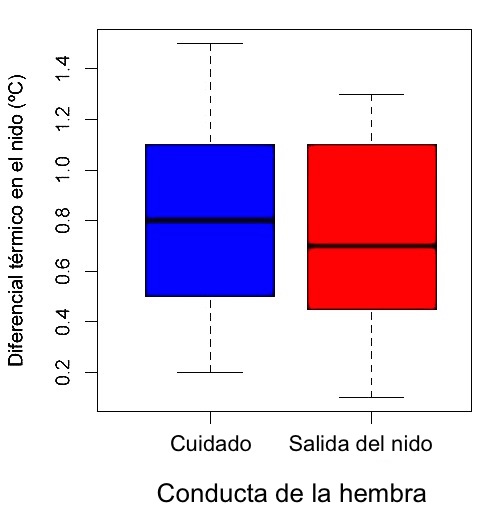
Figura 3 Diferencial térmico dentro del nido entre las conductas de cuidado maternal y salida del nido durante la anidación en Phaethornis longirostris.
Las imágenes termográficas muestran que la temperatura de los polluelos aumentó en 3.5°C entre el primero y el tercer día después de la eclosión (Figura 4), aun cuando la temperatura ambiente al momento de la medición fue inferior al promedio del primer día de medición (i.e. 26.5ºC).
Discusión
Los resultados de nuestro estudio muestran que durante el periodo completo de muestreo el nido de la hembra de P. longirostris mantuvo una gran eficiencia térmica, ya que se encontró una mínima variación térmica dentro del nido (<1.0ºC). Y también se observó que la temperatura promedio durante la presencia o ausencia de la hembra no varió significativamente, aun cuando la hembra abandonaba el nido por periodos de tiempo prolongados (i.e. 56 min).
Aunque lo anterior puede sugerir que la homeotermia en el nido de P. longirostris no es determinada por la conducta de la hembra, sino resultado de factores como la temperatura ambiental y el calor generado por los propios polluelos. La mayoría de nuestros datos refutan estos supuestos; por una parte, la temperatura del ambiente y el nido no se empataron ni aun durante el periodo de mayor ausencia de la hembra (Figura 2); por otra, las imágenes termográficas (Figura 4, día 1) muestran que la temperatura ambiente (26.3ºC, Figura 2 ) no determina la temperatura externa del nido (25.8, Figura 4, día 1), por lo que difícilmente podría hacerlo con la temperatura al interior. Con respecto a la contribución de los polluelos a la homeotermia del nido, consideramos que si los polluelos produjeran calor, la variación dentro del nido sería independiente de la temperatura ambiente. Sin embargo, nuestros resultados muestran lo contrario, apoyando lo mencionado en otros estudios donde los colibríes jóvenes son enteramente ectotermos durante los primeros días de edad (Oniki et al. 2000), y en este estudio ambos polluelos ya habían eclosionado el día de la toma de datos. A pesar de esto, nuestras imágenes termográficas en P. longirostris muestran por primera vez para una especie de colibrí, que los polluelos empiezan a producir calor endógeno a edades tan tempranas como al tercer día de la eclosión.
En ese contexto, aunque el periodo de muestreo fue muy corto, nuestros datos apoyan que es la hembra por medio de sus conductas (i.e. tiempos de cuidado materno y de salida), la que regula y mantiene la homeotermia del nido y de su progenie durante la incubación y al momento de la eclosión, lo que probablemente incremente las probabilidades de éxito futuro de los polluelos (Vleck 1981, Du Rant et al. 2011). Una variación de menos de un grado centígrado entre eventos (cuidado y salidas) no se había reportado antes en colibríes y está muy por debajo de la variación reportada en especies como Calype anna y Archilochus alexandri en que los huevos pueden enfriarse entre 3 y 6 grados durante las ausencias de las hembras (Vleck 1981). Aunque en estas especies la temperatura del nido durante el cuidado estuvo cerca de los 40ºC y la reducción en la temperatura en los polluelos podría no tener un efecto negativo.
En nuestro estudio, mantener la homeotermia del nido cercana a los 27ºC, cuando la temperatura del ambiente está por encima de los 25ºC, parecería no implicar una enorme inversión energética para la hembra de P. longirostris. Sin embargo, los datos históricos (1981-2010) indican que las temperaturas mínimas mensuales en Palenque durante mayo son menores a los 20°C (Fernández et al. 2015), lo que es más de 6°C por debajo de la temperatura promedio observada en el nido. Estudios similares con otras especies de colibríes, que anidan en sitios donde la temperatura del ambiente es hasta 8°C inferior a la del nido, muestran que no ocurre una reducción significativa en la temperatura del nido y soportan la idea de una gran eficiencia térmica por parte de las hembras de colibríes a pesar del gran esfuerzo energético involucrado en mantener la homeotermia del nido.
Consideramos que la hembra de P. longirostris, para poder cubrir los elevados requerimientos energéticos de su progenie, utilizó un alto porcentaje del tiempo para forrajear (45%), lo que es consistente con lo observado previamente en otras especies de colibríes como Cynanthus latirostris, C. costae y A. alexandri donde las hembras invierten entre 20-40% del tiempo fuera del nido (Baltosser 1996). Aunque de manera consistente con lo observado en otras especies de colibríes (Vleck 1981), la hembra de P. longirostris realizó largas salidas de forrajeo, la tasa de cambio de temperatura por minuto en el nido fue muy reducida y eso se reflejó en una mínima oscilación térmica al interior del mismo.
Los individuos adultos de P. longirostris mantienen tasas de ingesta de energía constantes a lo largo del día (López-Calleja et al. 1997, Gass y Garrison 1999), lo cual sugiere, como en otras especies de colibríes, que el forrajeo está determinado por los presupuestos energéticos de la hembra y la disponibilidad-calidad del alimento (Howell y Dawson 1954, Oniki 2000, Tulp y Schekkecman 2006). En nuestro estudio, la falta de relación entre el tiempo de forrajeo y la temperatura del nido, y la alta disponibilidad de recursos para la hembra (S. Barba, obs. per.), nos hace considerar que el principal factor que permitió a la hembra prolongar el forrajeo es el homogéneo ambiente térmico dentro del nido.
Sin embargo, para evaluar la contribución de otros factores al mantenimiento de la temperatura en el nido (Southwick 1975, García y Botero 2013), se requiere aumentar tanto el tamaño de muestra, como el tiempo de observación durante todo el periodo de anidación (i.e. huevos y polluelos). De esta forma se podrán determinar los niveles de variación individual en la eficiencia térmica y su efecto en el éxito de la nidada. Del mismo modo es necesario evaluar la contribución de las características del nido (e.g. materiales de construcción y diseño) y la elección del sitio de anidación en el ambiente térmico del nido y la tasa de pérdida de calor. Finalmente sería interesante evaluar si las hembras son capaces de utilizar señales del ambiente (i.e. temperatura y humedad) para determinar la tasa de enfriamiento potencial del nido y con ello el momento de regreso al nido.











 nueva página del texto (beta)
nueva página del texto (beta)