Editor asociado: Miguel Ángel Martínez Morales
Introducción
Las islas son ecosistemas con extensión relativamente pequeña (5.3% de la superficie terrestre), pero con una alta biodiversidad (por ejemplo, 19% del total de especies de aves, 17% de roedores y 17% de angiospermas a nivel global se distribuyen en islas) que es sumamente vulnerable, ya que tienen casi 30 veces más especies extintas y 14 más en peligro crítico de extinción por km2 en comparación con las áreas continentales (Tershy et al. 2015). La conservación de estos ecosistemas requiere de estudios básicos sobre biodiversidad y abundancia de la vida silvestre (CONABIO 2006, Ancrenaz et al. 2012) que permitan establecer una línea base para valorar el estado y los cambios en las poblaciones de especies que habitan en estos sitios (Kier et al. 2009, Weigelt et al. 2013).
Las islas dentro de la bahía de Mazatlán, en el estado de Sinaloa, forman parte del Área de Protección de Flora y Fauna Islas del Golfo de California, decretadas áreas naturales protegidas (ANP) desde 1978 por el gobierno mexicano (DOF 1978). Sin embargo, a pesar de que una gran cantidad de islas se encuentra dentro del decreto (aproximadamente 900, entre islas e islotes), la información sobre la biota que las habita es limitada. Específicamente, la información básica sobre las aves en estas islas es escasa, y los listados taxonómicos aún se encuentran incompletos (Anderson 1983, Cody y Velarde 2002). En la zona sur del golfo de California se han realizado algunos estudios sobre la presencia y abundancia de aves en islas adyacentes a la costa de Sinaloa, como en el Farallón de San Ignacio (González-Bernal et al. 2002, Guevara-Medina et al. 2008) y la Bahía Santa María-La Reforma (Carmona y Danemman 1994, González-Bernal et al. 2003, Castillo-Guerrero et al. 2014). Se requiere de mayor cobertura espacial y de un esfuerzo continuo que permitan determinar las variaciones temporales para poder evaluar de manera integral la riqueza y abundancia de aves en las islas del golfo de California.
Hemos indicado que los datos sobre biodiversidad son fundamentales para priorizar y gestionar los riesgos derivados de la degradación de los ecosistemas marinos (Šúr et al. 2013). Registrar la presencia y abundancia en la avifauna a nivel local es necesario para determinar cambios en los ecosistemas. En el caso de las islas en la bahía de Mazatlán, éstas han sido utilizadas para actividades de turismo y pesca, además de que la urbanización provoca impactos negativos a nivel local, incluido el ambiente marino (Implan-Mazatlán 2005, Nieto-Flores 2011). La comunidad de aves en estas islas ha sido poco estudiada, de manera que se necesitan datos para establecer una línea base que permita priorizar acciones de conservación y valorar posibles cambios. En este estudio se registró la presencia y abundancia de aves en las cinco islas: Pájaros, Venados, Lobos, Hermano Norte y Hermano Sur, que se ubican frente a la bahía de Mazatlán, México. En el caso de especies reproductoras, se describe el hábitat de anidación y la temporalidad de la reproducción.
Métodos
Área de estudio
El estudio lo realizamos en cinco islas ubicadas frente a la ciudad de Mazatlán (23º14’N, 106º24’O; Figura 1). Las tres primeras, de norte a sur, son: Pájaros, Venados y Lobos (Figura 1) con una cobertura de vegetación donde predomina el bosque espinoso y pastizal asociado con matorral (Flores-Campaña et al. 1996, Vega-Aviña et al. 2001). Las otras dos: Hermano Norte y Hermano Sur (Figura 1) son islotes rocosos desprovistos casi en su totalidad de vegetación. Además, los registros de aves también incluyeron a la marina de yates (Marina el Cid Mazatlán; Figura 1), debido a que detectamos la anidación del Ostrero Americano. Respecto a las variables ambientales de la zona: la temperatura media anual es de 24.7ºC y una precipitación media anual de 858.7 mm (las lluvias se presentan durante el verano y a principios de otoño, principalmente) (INEGI 2012, 2014). Las concentraciones de clorofila a alrededor de las islas y dentro de la bahía oscilan entre 0.04 mg/m3 durante el verano y hasta 5.79 mg/m3 en invierno, con una tasa de productividad primaria promedio anual entre los 2.21 y 16.11 mg C/m3/h, además de que se han reportado altas concentraciones de fosfato durante el invierno debido a la entrada de agua de fondo a la bahía, que está considerada de naturaleza eutrófica (Saavedra-Rojas 1996, Alonso-Rodríguez et al. 2000).
Trabajo de campo
El 25 de mayo de 2004 realizamos desembarcos en las islas de estudio para registrar a las especies de aves en reproducción (aquellas con presencia de nidos activos). Además, entre noviembre de 2014 y junio de 2015 realizamos recorridos a bordo de una embarcación alrededor de las islas e islotes. Durante todos los recorridos, la tripulación estuvo conformada por cuatro observadores y un conductor. Los recorridos fueron por las mañanas, entre las 06:00 o 07:00 h (UTC-7 y UTC-6 en verano), a una velocidad constante (5 km/h) con duración aproximada de 5-6 horas. Registramos el total de individuos observados por especie, así como el número de nidos. El 10 de febrero y el 11 de marzo de 2015 desembarcamos en isla Venados para realizar recorridos dentro de la isla y registrar aves terrestres. El 13 de mayo desembarcamos en el islote Hermano Sur para registrar los nidos activos del rabijunco pico rojo (Phaethon aethereus), pues al anidar en cavidades no es posible su detección desde la embarcación. Solamente desembarcamos en estas dos islas debido a que en Pájaros había especies coloniales, sensibles a perturbación, anidando; en la isla Lobos y Hermano Norte las condiciones de la marea no permitieron que desembarcáramos. Las observaciones alrededor de las islas e islotes las realizamos con ayuda de binoculares (10x) y corroboramos las identificaciones de las aves con guías de campo especializadas (Sibley 2003, Dunn y Alderfer 2011).
La abundancia de las especies de aves la reportamos como el máximo observado durante las salidas realizadas entre noviembre de 2014 y junio de 2015. La presencia de las especies se clasificó de acuerdo con su frecuencia de observación en tres categorías: las especies comunes (C), aquellas que observamos en más de la mitad de los recorridos realizados; las especies poco comunes (PC), aquellas observadas en más de un recorrido sin rebasar la mitad de éstos; y las especies raras (R), las que registramos únicamente durante un solo recorrido.
Resultados
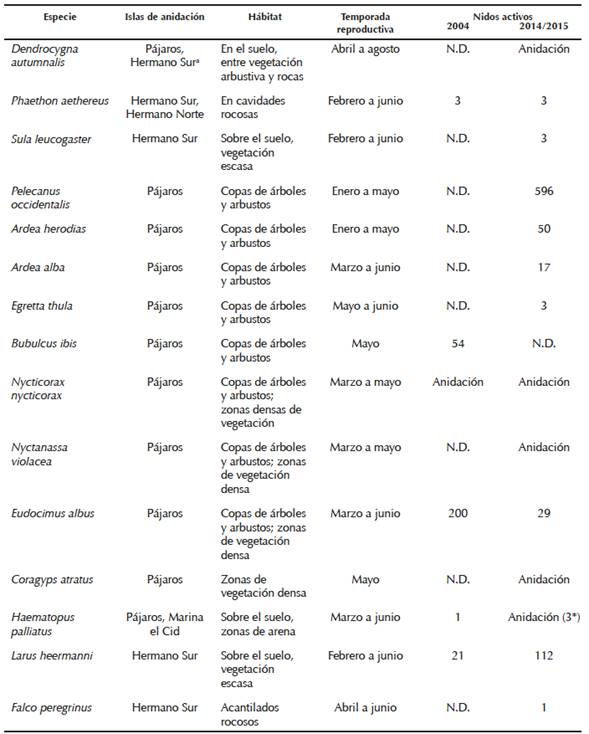
Registramos un total de 59 especies de aves, de las cuales 15 anidaron en las islas de estudio, 19 corresponden a aves acuáticas no reproductoras y 25 son especies de aves terrestres (Anexo 1). A continuación se hace un listado de las especies de aves reproductoras, en el que indicamos el número de individuos y nidos observados. También mostramos información de aquellas especies de aves cuyo registro fue notable en este estudio. En el Cuadro 1 señalamos las especies reproductoras, el tipo de hábitat, la temporalidad, las islas de anidación y el número de nidos activos para cada especie.
a Se considera esta isla como posible sitio de anidación de la especie.
Cuadro 1 Especies de aves que se reproducen en las islas de la bahía de Mazatlán. Se indican las islas de anidación, el tipo de hábitat, la temporalidad y número máximo de nidos activos para cada especie. No hay datos disponibles (N.D.). Anidación: se indica para aquellas especies para las cuales registramos su reproducción pero no se determinó el número de nidos debido a las dificultades para su detección.
Dendrocygna autumnalis (pijije ala blanca)
Observamos al pijije ala blanca de manera esporádica entre noviembre de 2014 y marzo de 2015. Sin embargo, en abril y mayo de 2015 lo registramos de manera común tanto en la isla Pájaros como en islote Hermano Sur con un máximo de 112 individuos entre ambas islas durante abril. En agosto de 2014 observamos varios pollos cerca de las islas nadando hacia el continente. De acuerdo con los datos obtenidos durante los meses de estudio, es claro que la especie se encuentra ausente durante la mayor parte del año y usa la isla Pájaros y posiblemente Hermano Sur como sitio de anidación.
Phaethon aethereus (rabijunco pico rojo)
Al rabijunco pico rojo lo registramos en mayo de 2004 en cavidades de los islotes Hermano Sur y Hermano Norte, en esta última isla con tres nidos activos. Entre febrero y mayo de 2015 registramos su presencia en Hermano Sur, con un máximo de 14 individuos y tres nidos activos, dos con pollos acompañados de un adulto (Figura 2B) y otro solamente con un pollo (Figura 2A). Éste es el primer registro de reproducción de la especie para la bahía de Mazatlán. Antes de este estudio, en Sinaloa, solamente se tenía registro de anidación en la isla Farallón de San Ignacio (González-Bernal et al. 2002, Guevara-Medina et al. 2008).
Sula leucogaster (bobo café)
Registramos al bobo café en los islotes Hermano Norte y Hermano Sur durante todos los recorridos que realizamos. El número máximo de individuos fue de 211 en 2004 y de 89 en 2015. En mayo de 2015, en la cima del Hermano Sur, registramos tres nidos activos con pollos de aproximadamente tres, cinco y siete semanas de edad (Figura 3A y 3B). La ausencia de huevos y la etapa de desarrollo de los pollos indican que la puesta de huevos ocurrió entre los meses de febrero-marzo, lo cual es diferente a la temporalidad observada en otras colonias del golfo de California (tres meses de retraso aproximado; Mellink 2000). Sin embargo, 2015 fue un año con presencia del fenómeno El Niño Oscilación del Sur y esto alteró la reproducción de las aves marinas en la región (Mellink 2000, Castillo-Guerrero et al. 2011). Al igual que el rabijunco pico rojo, es el primer registro de reproducción reportado para la especie en las islas en la bahía de Mazatlán, y junto con el Farallón de San Ignacio (González-Bernal et al. 2002, Guevara-Medina et al. 2008) son los únicos sitios donde se ha registrado su reproducción en Sinaloa.

Figura 3 (A) Adulto macho y pollo de 3 semanas de Sula leucogaster anidando en la planicie del islote Hermano Sur (13 de mayo de 2015). (B) Adulto macho y pollo de 3-4 semanas (lado izquierdo de la foto) descansando en el nido y pollo de 5 semanas en las cercanías del nido (lado derecho de la foto) en la cara suroeste del mismo islote (13 de mayo de 2015; foto: M. Lerma).
Pelecanus occidentalis (pelícano café)
Al pelícano café lo registramos en todas las islas e islotes durante todos los meses de muestreo. Fue la especie más abundante en las islas de estudio. El número de individuos varió entre un máximo de 1 559 en marzo de 2015 y un mínimo de 228 en mayo del mismo año. La reproducción de esta especie comenzó en enero y finalizó en mayo, anidó únicamente en isla Pájaros con un máximo de 596 nidos activos registrados en el mes de marzo. Anderson et al. (2007, 2013) calcularon 850 nidos en 2006 (año no Niño) en esta colonia y la consideran como la más importante para su segmento poblacional (subpoblación “Mexican Mainland Island”).
Ardea herodias (garza morena)
Observamos a la garza morena de manera común durante los recorridos realizados en todas las islas de estudio. En 2004 observamos 19 adultos, pero sin registro de nidos. En 2015 la época reproductiva inició en enero y concluyó en mayo. Los nidos de esta especie se colocaron en las copas de los árboles de la isla Pájaros, con un máximo de 50 nidos durante marzo. Otras localidades en el estado de Sinaloa donde se ha registrado anidación de esta especie son la isla Pájaros dentro de la bahía de Jitzamuri (Gámez-López et al. 2014), la isla Pájaros del complejo lagunar de San Ignacio-Navachiste-Macapule con 42 nidos (Sánchez-Bon et al. 2010), Ensenada de Pabellones con 20 nidos (Knoder et al. 1980) y bahía Santa María con una pequeña colonia de 75 a 100 nidos en la zona sur de la bahía (Carmona y Danemann 1994).
Ardea alba (garza blanca)
La reproducción de la garza blanca la registramos entre marzo y mayo de 2015 en la isla Pájaros. Aunque es muy común ver a esta especie durante todo el año en las islas de estudio. La época reproductiva ocurrió de marzo a junio de 2015, con un máximo de 17 nidos durante mayo y un mínimo de 9 nidos al iniciar la temporada en marzo. La temporada de reproducción coincide con la registrada para la especie, entre mayo y julio (Knoder et al. 1980). En Sinaloa se ha registrado anidación en el sistema lagunar San Ignacio-Navachiste-Macapule con 99 nidos registrados (Sánchez-Bon et al. 2010), Ensenada de Pabellones y la bahía de Santa María, ambos con 200 nidos (Knoder et al. 1980).
Egretta thula (garza pie dorado)
Registramos la reproducción de la garceta pie dorado en la isla Pájaros entre enero y mayo de 2015. El máximo de individuos que observamos fue de 10 en mayo. Registramos su reproducción durante este mismo mes con un total de tres nidos. En Sinaloa se ha reportado la reproducción de la garza pie dorado en la bahía de Jitzamuri (Gámez-López et al. 2014), en el complejo lagunar San Ignacio-Navachiste-Macapule (48 nidos; Sánchez-Bon et al. 2010) y en la bahía Santa María (90 nidos; Knoder et al. 1980). Además, su presencia es común a lo largo del estado de Sinaloa.
Bubulcus ibis (garza ganadera)
Observamos a la garza ganadera en las islas Pájaros y Venados. En mayo de 2004 registramos 54 nidos en Pájaros, entre nidos de ibis blanco. Sin embargo, en 2015, no registramos anidación de esta especie, solamente un total de 83 individuos. Knoder et al. (1980) reportaron dos grandes colonias reproductivas en Sinaloa, una de 6 300 parejas en Ensenada de Pabellones y la otra de 8 100 parejas en la bahía Santa María. Por otra parte, Carmona y Danemann (1994) reportaron aproximadamente 3 600 parejas para esta última bahía. Además, un estudio más reciente reporta su reproducción en el complejo lagunar San Ignacio-Navachiste-Macapule (Sánchez-Bon et al. 2010). En México es una especie exótica que se observa de manera común anidando junto con otras especies de tamaño similar y compitiendo por espacio y material para la construcción de nidos (Burger 1978, Ehrlich et al. 1988).
Nycticorax nycticorax (pedrete corona negra)
Observamos comúnmente al pedrete corona negra durante los recorridos realizados alrededor de las islas. En mayo de 2004 estimamos un total de 250 individuos en la isla Pájaros y registramos nidos entre las copas de los árboles, lo que dificultó el conteo de nidos desde el sendero de la isla. En 2015 observamos a la especie desde enero hasta mayo con un máximo de siete individuos y detectamos la anidación sólo en isla Pájaros. En Sinaloa la anidación de esta especie ha sido reportada en el sistema lagunar San Ignacio-Navachiste-Macapule (Sánchez-Bon et al. 2010) y en la bahía de Santa María, donde Knoder et al. (1980) registraron 12 nidos. Sin embargo, la presencia de esta especie al igual que el de otras garzas es común en sitios con presencia de manglar (Behrouzi-Rad 2014), por lo tanto, es probable que se esté reproduciendo a lo largo de la costa de Sinaloa (p. ej. Ensenada de Pabellones, bahía de Santa María, Marismas Nacionales).
Nyctanassa violacea (pedrete corona clara)
El pedrete corona clara lo registramos como común en las islas Venados y Pájaros. El máximo de individuos fue de 37 adultos en la isla Pájaros durante mayo de 2004. En 2015 registramos un total de ocho individuos entre enero y mayo. La especie estableció sus nidos junto con los nidos de pedrete corona negra. Debido a que los nidos estaban en las copas de los árboles y en zonas con vegetación densa fue difícil contarlos. Para Sinaloa se ha reportado anidación de esta especie en San Ignacio-Navachiste-Macapule (26 nidos; Sánchez-Bon et al. 2010), Ensenada de Pabellones y bahía de Santa María (Knoder et al. 1980, Carmona y Danemann 1994).
Eudocimus albus (ibis blanco)
Al ibis blanco lo registramos en la isla Pájaros. El máximo de nidos fue de 200 en mayo de 2004. En 2015 el número de individuos osciló entre 20 y 62 entre marzo y mayo, respectivamente. La reproducción de esta especie inició en marzo con el registro de 10 nidos en la isla Pájaros y se extendió hasta junio, durante mayo contabilizamos un máximo de 29 nidos. La reproducción de esta especie es común en zonas de manglar a lo largo del estado de Sinaloa. Se han estimado 155 nidos en la isla Pájaros, del sistema lagunar San Ignacio-Navachiste-Macapule (Sánchez-Bon et al. 2010) y 1 750 nidos para la bahía de Santa María (Knoder et al. 1980,). Su presencia es común en la zona costera de Sinaloa.
Coragyps atratus (zopilote común)
El zopilote común fue una especie que observamos de manera habitual durante todos los recorridos entre noviembre de 2014 y mayo de 2015 en todas las islas con excepción del islote Hermano Norte. El número de individuos osciló entre un máximo de 54 en noviembre de 2014 y un mínimo de 39 en enero de 2015. Documentamos la anidación de la especie en la isla Pájaros y registramos un nido con un pollo pequeño en mayo de 2015. Durante los recorridos no fue posible contabilizar el número de nidos porque éstos se localizaron ocultos en zonas con vegetación densa.
Haematopus palliatus (ostrero americano)
El ostrero americano lo registramos en las islas Pájaros y Venados. En mayo de 2004 se detectó un pollo en la isla Pájaros. En 2015 el número de individuos registrados osciló entre un mínimo de 3 en febrero y un máximo de 15 en mayo. Registramos un nido activo en un muelle en desuso dentro de la marina de yates de Mazatlán (23° 16’N, 106° 27’O; Figura 1). En las islas, los individuos que observamos entre marzo y mayo presentaron un comportamiento común de pareja con nido activo (con posible presencia de tres nidos). La época reproductiva para esta especie en Sinaloa va de marzo a junio (Palacios et al. 2017). Para el estado de Sinaloa se ha registrado anidación de la especie en bahía de Ohuira, bahía de Navachiste, bahía de Santa María y Huizache-Caimanero (Palacios et al. 2017).
Larus heermanni (gaviota ploma)
Observamos la presencia de esta especie en las cinco islas visitadas durante todo el muestreo. En mayo de 2004 contabilizamos 21 pollos en el islote Hermano Sur. En 2015 el número de individuos osciló entre un máximo de 307 en enero y un mínimo de 126 en mayo. La época reproductiva inició en febrero y registramos cortejo y cópula, la incubación la observamos en marzo (Figura 4A) y la presencia de pollos en mayo (Figura 4B). El máximo de nidos fue de 34 en Hermano Norte y 78 en Hermano Sur, donde también registramos aproximadamente 70 pollos. Bent (1921) reportó la reproducción de esta especie en Mazatlán, pero Mellink (2001) cuestiona su validez debido a la falta de reportes posteriores en los que se indicara la anidación de la especie. Aquí confirmamos la presencia de una pequeña colonia reproductiva, aunque es difícil saber si su asentamiento es reciente. En Sinaloa, las colonias previamente reportadas para esta especie incluyen a la isla Pájaros, bahía de Jitzamuri (Gámez-López et al. 2014), el Farallón de San Ignacio (González-Bernal et al. 2002, Guevara-Medina et al. 2008) y la isla El Rancho (Castillo-Guerrero et al. 2014).
Falco peregrinus (halcón peregrino)
La presencia de algunos individuos o parejas, posados sobre los acantilados o sobrevolando las islas, fue común en todas las visitas, principalmente en las islas Pájaros y Hermano Sur. En esta última detectamos un nido en mayo de 2015. Registramos a una pareja en los acantilados del islote que se comportaba en defensa del nido y en junio la observamos con un pollo recién emplumado. La anidación de esta especie para islas en la región de Sinaloa solamente se había registrado en Farallón de San Ignacio (Guevara-Medina et al. 2008), aunque también se han detectado nidos en los islotes El Negro y Cerritos Blancos en la bahía de Navachiste (Guevara-Medina datos no publicados).
Registros adicionales
Fregata magnificens (fragata magnífica)
La fragata magnífica la registramos en las cinco islas de estudio; además es común observarla a lo largo del año en la bahía de Mazatlán. Durante 2015 contamos 252 individuos en febrero y 1 526 en marzo. Fue la segunda especie más abundante en las islas. La isla Pájaros congregó más del 90% (1 429) de los registros de esta especie. Durante las observaciones realizadas no encontramos nidos ni pollos, aunque observamos conductas de cortejo de noviembre a marzo. En Sinaloa se ha reportado la reproducción de esta especie en el complejo lagunar San Ignacio-Navachiste-Macapule (Sánchez-Bon et al. 2010), en Ensenada de Pabellones (10 000-20 000 parejas reproductivas; Everett y Anderson 1991) y en la isla Pájaros, en la bahía Santa María-La Reforma con un tamaño de colonia promedio de 8 294 nidos (16 588 individuos; Castillo-Guerrero et al. 2014). Además, otro sitio de reproducción reportado para la especie cercano a las islas de estudio es la isla Isabel en Nayarit. La isla Pájaros, en la bahía de Mazatlán, está localizada entre estos sitios de reproducción, y es usada sólo como sitio de descanso.
Sula nebouxii (bobo pata azul)
La presencia del bobo pata azul fue común en las cinco islas de estudio durante todo el muestreo. El número de individuos registrados osciló entre 102 durante febrero y un máximo de 1 100 en marzo de 2015. El islote Hermano Sur fue el sitio donde observamos más del 70% de los individuos registrados durante los conteos. La mayoría de los individuos se encontraban posados alrededor de las islas formando pequeños grupos, en ocasiones con individuos de bobo café. Los individuos observados eran adultos que no se reprodujeron durante ese año, pues la temporada reproductiva de la especie en el golfo de California va de diciembre a mayo (Castillo-Guerrero et al. 2014). En Sinaloa se han registrado colonias reproductivas de la especie en el islote Farallón de San Ignacio (Guevara-Medina et al. 2008), la isla Pájaros en la bahía de Jitzámuri (Gámez-Lopéz et al. 2014) y la isla El Rancho dentro de la bahía Santa María (Castillo-Guerrero et al. 2014).
Discusión
En este estudio registramos la presencia de 59 especies de aves, de las cuales 15 se reproducen en las islas de la bahía de Mazatlán. Principalmente, las aves acuáticas son las que utilizan estas islas para reproducirse. En las cinco islas visitadas, las temporadas reproductivas de las especies de aves coinciden con lo reportado previamente en Sinaloa y el golfo de California (Knoder et al. 1980, Carmona y Danemann 1994, Mellink 2000, Guevara-Medina et al. 2008; Castillo-Guerrero et al. 2011), con excepción de P. aethereus y S. leucogaster, cuya temporada reproductiva fue tardía en comparación con los reportes de puesta de huevos en otras islas del golfo de California (véase Mellink 2000 para S. leucogaster y Castillo-Guerrero et al. 2011 para P. aethereus).
En el golfo de California hay una marcada estacionalidad con las surgencias; durante el invierno ocurren en el margen oriental del golfo, lo que incrementa la productividad general en la región (Álvarez-Borrego 2010). Estas condiciones oceanográficas (p. ej., disminución en la temperatura superficial del mar, incrementos en la concentración de clorofila a) influyen fuertemente en la fenología reproductiva de los bobos, pelícanos y rabijuncos en el golfo de California (Castillo-Guerrero et al. 2011, Ancona et al. 2011). Sin embargo, la estacionalidad de las surgencias solamente coincidió con la temporada reproductiva de Pelecanus occidentalis. La posible explicación del inicio tardío de la reproducción de Phaethon aethereus y Sula leucogaster con respecto a otras localidades en el golfo de California puede estar relacionado con el fenómeno El Niño-Oscilación del Sur que se presentó en la región desde febrero de 2015 (NOAA 2015). Se ha demostrado que la biología reproductiva de P. aethereus en el golfo de California puede diferir entre un año considerado normal y un año con presencia del fenómeno El Niño-Oscilación del Sur moderado (Castillo-Guerrero et al. 2011). En el caso de las gaviotas y garzas coincidió con reportes previos que indican su reproducción en primavera.
Respecto a la abundancia de nidos registrados en las islas de la bahía de Mazatlán, es difícil hacer un censo riguroso para todas las especies. En principio, el recorrido fue establecido pensando en documentar la presencia de especies acuáticas anidantes de detección relativamente fácil y sensibles a la presencia humana, como el caso del pelicano café y la garza morena (nidos grandes y evidentes, en las partes altas de los árboles). Al detectar otras especies como las garzas nocturnas e ibis blanco, es claro que sólo detectamos una fracción de lo que había (y así lo indicamos al describir los datos de estas especies). Las islas son pequeñas y escarpadas, de manera que para especies grandes, con nidos conspicuos, consideramos que los conteos pueden reflejar cercanamente el total.
En la isla Pájaros registramos el mayor número de especies reproductoras (10 especies). Este resultado puede deberse al hecho de que en esta isla, al igual que en los islotes Hermanos, no hay presencia de mamíferos terrestres que depreden a las aves que anidan en ella. En contraste, en las islas Venados y Lobos hay presencia de coatí (Nasua narica), lo cual puede explicar que no haya anidación de aves en ambas islas. Además, el turismo de recreación (p. ej., entrada de turistas a las islas) se concentra principalmente en las islas Venados y Lobos, y durante la reproducción, las aves acuáticas son muy sensibles a la perturbación (p. ej., pelícano café; Anderson 1988). El elenco de especies reproductoras fue distinto entre las islas de la bahía de Mazatlán. En Pájaros anidaron principalmente especies que utilizan las copas de los árboles o arbustos (p. ej., garzas y pelícanos); además, el material que utilizan para construir sus nidos son principalmente ramas (Burger 1978). En contraste, en los otros dos islotes (Hermano Norte y Hermano Sur) se registró la anidación de especies que usan el suelo, cavidades y sitios abiertos. Por lo tanto, el tipo de sustrato y la vegetación que utiliza cada especie determinó en buena medida su presencia y reproducción en las islas de estudio.
Durante el estudio realizado en las islas se observó la presencia de mamíferos no nativos, en isla Venados hay cabras (Capra aegagrus hircus), ratas (Rattus spp.) y ardillas (Sciurus colliaei); en las islas Venados y Lobos hay coatís (Nasua narica), y en isla Pájaros hay conejos (Oryctolagus cuniculus). La introducción de especies no nativas a las islas se ha considerado la principal amenaza para las especies que ahí habitan (Coblentz 1990, Bester et al. 2002, Smith y Bester 2004). Las aves marinas son particularmente sensibles a ello, ya que por lo regular anidan en islas con ausencia de mamíferos depredadores nativos. Cuando se introducen mamíferos a islas las poblaciones de aves se reducen o extirpan localmente ( Van Aarde 1980, Moors 1985, Bloomer y Bester 1992, Rauzon 1992). Además, las especies introducidas que no depredan a las aves marinas pueden competir por los recursos de la isla o modificar el hábitat; por ejemplo, los mamíferos herbívoros introducidos en las islas del canal de California han interferido en el éxito de anidación de aves marinas, pues han destruido sus zonas de reproducción (McChesney y Tershy 1998).
Las islas de la bahía de Mazatlán se encuentran bajo protección a nivel estatal y federal (Gobierno del Estado de Sinaloa 1991, SEMARNAP 2000). A partir de 2014 se iniciaron programas para el control de conejos en isla Pájaros y la erradicación de cabras en Venados. Sin embargo, es necesario mantener el monitoreo a largo plazo de las poblaciones de aves en islas, esto permitiría evaluar su dinámica y los efectos de las perturbaciones por actividades humanas o los efectos negativos producidos por especies introducidas, así como valorar la implementación de nuevos programas para el control o erradicación del resto de especies no nativas.











 nueva página del texto (beta)
nueva página del texto (beta)





