Introducción
Los humedales costeros se consideran uno de los ecosistemas más productivos. Por sus características físicas y químicas son ambientes ricos en flora y fauna, y de gran valor ecológico (Keddy 2000). Un grupo biológico que utiliza estos ecosistemas son las aves acuáticas residentes y migratorias, las cuales son especies que "dependen ecológicamente" de los humedales y hacen uso de éstos de modo permanente o temporal para cubrir una determinada etapa de su ciclo de vida (Blanco 1999, Ruiz-Campos et al. 2005, Wetlands International 2006). En estos ecosistemas, las aves acuáticas cumplen importantes funciones como consumidoras, aportadoras de materia orgánica y modificadoras del ambiente circundante. Por otro lado, los humedales ofrecen a las aves abrigo, alimento y, entre las funciones ecológicas más importantes, sitios para la nidificación y migración anual (Blanco 1999). La distribución, riqueza y abundancia de las aves dentro de los humedales están asociadas a características ambientales locales y a requerimientos particulares de cada especie (Weller 1999, Gatto et al. 2005).
La generación de información sobre el uso de los humedales por las aves puede ser un elemento importante para el establecimiento de estrategias de manejo y conservación de estos ecosistemas. En el sureste de México, se encuentra ubicada la laguna Mar Muerto, considerada como área prioritaria en cuanto a la necesidad de estudios de evaluación ecológica de sus recursos. Durante los últimos 40 años, el crecimiento de las poblaciones humanas en las costas, la apertura de áreas agrícolas y ganaderas, además de la construcción de obras acuícolas ha alterado y acelerado la pérdida de las áreas de manglar, de las cuales dependen muchas especies de aves (Tovilla-Hernández y Loa 1991, Tovilla-Hernández y Vázquez-Lule 2009, Rodríguez-Zúñiga et al. 2012). A pesar de que es considerada una importante zona de nidificación de aves acuáticas, el conocimiento sobre la avifauna asociada a este cuerpo lagunar es escaso; por tanto, el objetivo del presente trabajo fue generar información sobre la composición y abundancia avifaunística de la laguna Mar Muerto, durante las estaciones de estiaje y de lluvias, así como determinar el uso del espacio en tres paisajes de la laguna.
Métodos
Área de estudio
La laguna Mar Muerto se localiza en la franja costera del istmo de Tehuantepec, en los estados de Oaxaca y Chiapas (16°18' a 15°55'N y 94°28' a 93°48'O; Figura 1). Su extensión es de 68,310 ha, de las cuales 21,310 ha se ubican en Chiapas (Contreras 1988, Castillo et al. 2009). La comunicación del cuerpo lagunar con el mar es permanente y se realiza a través de la Boca Tonalá con profundidades variables de 2 a 7 m (Cervantes-Castro1969). Los principales afluentes corresponden a los ríos Cabrestrada, Guadalupe, Tapanatepec, Zanatenco, Novillero, Lagartero y Tiltepec. La zona presenta clima cálido y una precipitación media anual de 1,100 mm. La Llanura Costera del Golfo de Tehuantepec presenta dos estaciones bien definidas: una de lluvias de mayo a octubre y una de estiaje de noviembre a abril (García 1973). El área presenta cinco tipos de vegetación: selva baja caducifolia, matorral espinoso, asociaciones de manglar (dominada por Avicennia germinans, además de Rhizophora mangle, Laguncularia racemosa y Conocarpus erectus), pastos halófilos de dunas costeras y una superficie cubierta por vegetación introducida (Castillo et al. 2009).
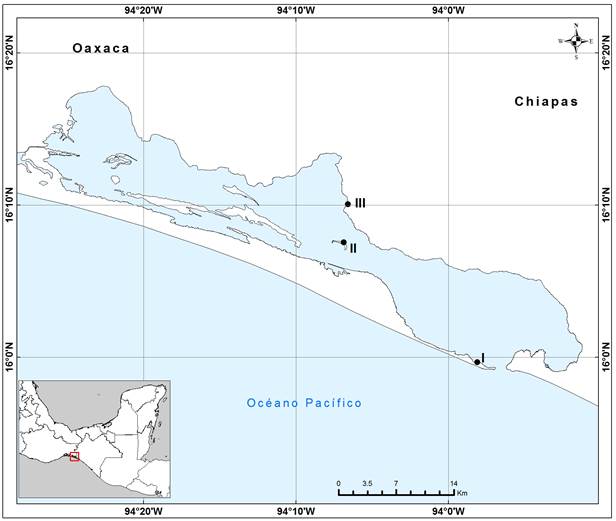
Figura 1 Localización de los sitios de muestreo en la laguna Mar Muerto, Oaxaca-Chiapas: (I) Boca Tonalá, (II) isla Los pájaros y (III) comunidad de Santa Brígida (elaboró: J.L. Liévano Trujillo).
Dentro de la laguna seleccionamos tres paisajes que difieren en estructura y vegetación: isla Los Pájaros (IP), Boca Tonalá (BT) y las zonas circundantes a la comunidad de Santa Brígida (CSB). IP se encuentra en la zona de transición entre el subsistema eurihalino y el subsistema marino de la laguna. El islote está rodeado principalmente por bosque de A. germinans y hacia el interior se presentan algunos arbustos de R. mangle y L. racemosa. Cuenta con pequeños espejos de agua permanentes que fluctúan entre los 30-60 cm de profundidad. Tiene en sus orillas una planicie de conchal y hacia las zonas más internas planicies lodosas con pastos marinos donde están presentes algas verdiazules y en el fondo una gran abundancia de bivalvos. BT es una estrecha entrada de aproximadamente 1,600 m de ancho y 3.6 m de profundidad localizada hacia el sureste de la laguna Mar Muerto, dentro del subsistema marino. Se caracteriza por presentar grandes playones arenosos (Cervantes-Castro 1969), con una vegetación predominante de A. germinans (60%) y en menor proporción de C. erectus con algunos matorrales de R. mangle, pastizales y vegetación introducida. Presenta espejos de agua descubiertos de vegetación. Asimismo, la CSB se encuentra en la parte más interna de la laguna, hacia el interior se forman planicies lodosas con parches de mangle, en su mayoría de A. germinans; presenta espejos de agua que se secan en su totalidad en temporada de estiaje y comienzan a llenarse de agua a mediados de mayo. Esta área está asociada a sitios con actividad antropogénica.
Muestreo
Llevamos a cabo la determinación y cuantificación de la avifauna durante dos meses de la estación de estiaje (marzo y abril de 2011) y dos meses de la estación de lluvias (mayo y septiembre de 2011) empleando la técnica de puntos de radio fijo (Ralph et al. 1996, Ruiz 2004, Gerardo-Tercero et al. 2010) y mediante observaciones directas con la ayuda de binoculares (Vortex 8x42 mm). Realizamos el muestreo de aves una vez al mes en cada uno de los paisajes seleccionados donde establecimos tres puntos de conteo de 100 m de radio (9 puntos en total). Efectuamos los avistamientos entre las 06:00 y 12:00 h, durante 10 min para cada punto de muestreo (Ralph et al. 1996, Gerardo-Tercero et al. 2010). En la identificación de las especies utilizamos las guías de Peterson y Chalif (1989), Howell y Webb (1995), Sibley (2000) y Alonzo-Parra (2007). En cada paisaje determinamos la riqueza específica (número de especies de aves acuáticas registradas durante todo el estudio) y la abundancia (total de registros de cada especie obtenidos durante todo el estudio). Para determinar el uso del espacio en cada paisaje contabilizamos aquellos individuos observados en actividad dentro de las zonas identificadas, asumiendo que cada ave usó una zona cuando ésta se encontró anidando, alimentándose, en posa o nado (Ortiz-Pulido et al. 1995). Las zonas identificadas en cada paisaje fueron: espejo de agua (EA), planicie lodosa (PL), planicie de conchal (PC), playa arenosa (PA) y manglar (M). Aquellas aves que registramos en vuelo no fueron consideradas para este fin.
Las aves incluidas en este estudio pertenecen a órdenes estrictamente acuáticos como Anseriformes, Ciconiiformes, Suliformes, Pelecaniformes y Charadriiformes, así como las familias Rallidae (Gruiformes) y Alcedinidae (Coraciiformes) que son representantes de órdenes con afinidad semiacuática (Wetlands International 2006, Medellín et al. 2009). También consideramos para este estudio como aves semiacuáticas a especies como Pandion haliaetus y Tachycineta albilinea. El sistema de clasificación y nomenclatura que utilizamos fue el propuesto por la American Ornithologist' Union (AOU 1998, 2016). En el caso de la estacionalidad de las especies en el sitio de estudio, utilizamos dos categorías: residente y visitante estacional debido a que los muestreos cubrieron dos temporadas climáticas. Cotejamos esta condición de las especies en los mapas de distribución general para las aves mexicanas de Howell y Webb (1995).
Con la riqueza de las aves para el área y cada paisaje estudiado evaluamos la completitud del muestreo mediante curvas de acumulación de especies (Jiménez-Valverde y Hortal 2003) empleando el estimador no paramétrico Chao2. Realizamos el análisis con el programa primer 6 & permanova (Clarke y Gorley 2006).
Resultados
En laguna Mar Muerto y zonas circundantes registramos un total de 40 especies de aves consideradas acuáticas o semiacuáticas, pertenecientes a 30 géneros, 16 familias y 9 órdenes, con un total de 1,557 registros visuales (Cuadro 1). La proporción de especies observadas en la laguna con relación al estimado por Chao2 fue del 71.4% (Cuadro 2). Los órdenes con mayor número de especies fueron Charadriiformes con 17 (25.68% del total de las observaciones) y Pelecaniformes con 12 (14.96%), mientras que el orden Suliformes, con dos especies, presentó la mayor abundancia (54.66%).

Cuadro 1 Distribución y abundancia de las aves acuáticas registradas en la laguna Mar Muerto durante el periodo de marzo, abril, mayo y septiembre de 2011. Paisaje: IP, isla Los Pájaros; BT, Boca Tonalá; CSB, zonas circundantes a la comunidad de Santa Brígida. Época: S, seca; LL, lluvias. Zona: M, Manglar; EA, Espejo de agua; PL, Planicie lodosa; PC, Planicie de conchal; PA, Playa arenosa. Estacionalidad: residente (R), visitante estacional (VE) (Howell y Webb 1995). NOM-059-SEMARNAT-2010: sujeta a protección especial (Pr). Los nombres científicos y el orden taxonómico se presentan con base en la AOU (1998, 2016).
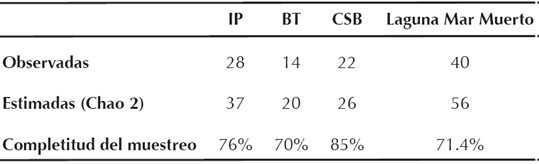
Cuadro 2 Riqueza de especies observada y estimada en los paisajes de la laguna Mar Muerto. Paisaje: IP, isla Los Pájaros; BT, Boca Tonalá; CSB, zonas circundantes a la comunidad de Santa Brígida.
Las familias de aves más representativas fueron Ardeidae y Scolopacidae con nueve especies cada una, seguidas de Anatidae y Laridae con cuatro especies cada una. Las restantes 12 familias fueron representadas por sólo una o dos especies (Cuadro 1). Las especies más importantes en abundancia fueron Fregata magnificens con 651 registros (39.1% del total de aves observadas), Phalacrocorax brasilianus con 211 (12.7%), Calidris minutilla con 117 (7%) y Leucophaeus atricilla con 94 (6%). En contraste, solamente tuvimos un registro para las siguientes especies: Anas discors, Calidris virgata, Haematopus palliatus, Pluvialis squatorola y Pandion haliaetus (Cuadro 1).
La riqueza específica y abundancia mostraron patrones diferentes entre los paisajes muestreados; IP con 28 especies y 79.07% del total de aves registradas, seguida de las zonas circundantes a la CSB con 22 y 13.76 % y BT con 14 y 7.16% respectivamente. El estimador no paramétrico Chao2 sugiere un muestreo más completo para la CSB, ya que obtuvimos porcentajes de representatividad superiores al 80%, mientras que en IP y BT fueron del 70% (Cuadro 2). En la IP F. magnificens (627 registros) y P. brasilianus (182) fueron las especies más abundantes, mientras que en BT fue Calidris alba (41 registros) y finalmente, en zonas circundantes a la CSB fueron L. atricilla (70 registros), C. minutilla (26) e Himantopus mexicanus (25) (Cuadro 1).
Con respecto al uso del espacio, 50% de las especies hicie ron uso de una sola zona, 35% ocupó dos, 10% ocupó tres y 5% de las aves acuáticas usaron todas las zonas identificadas. De las aves observadas en actividad, 19 especies hicieron uso del manglar, 17 de la planicie lodosa, 10 del espejo de agua, 9 de la planicie de conchal y 8 de la playa arenosa. En la IP, el manglar fue utilizado principalmente como un sitio de descanso (814 registros) y anidación (26 registros). Por su parte, en la CSB, la zona más frecuentada fue la planicie lodosa, la cual funcionó como un sitio importante para la alimentación (112 registros) básicamente de garzas, ibis y espátulas. Asimismo, en BT, registramos la mayor presencia de aves en la playa arenosa, utilizándolo como sitio de alimentación (54 registros) (Cuadro 1 y Figura 2).
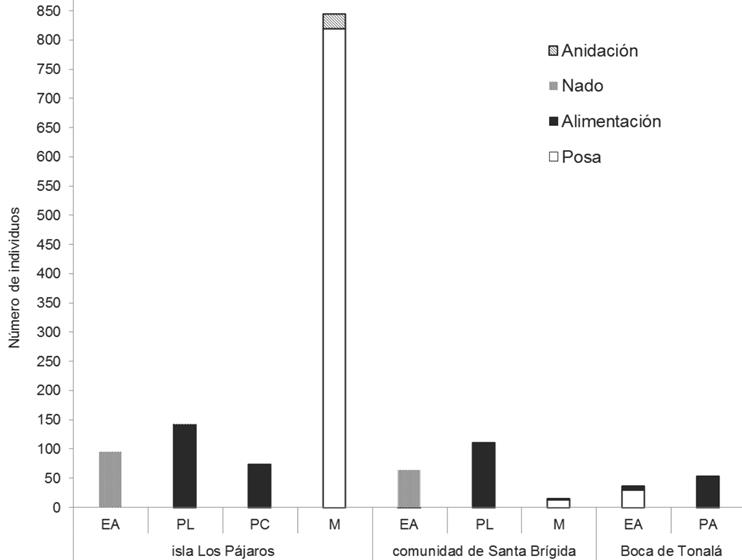
Figura 2 Uso del espacio por la comunidad de aves acuáticas en los paisajes estudiados de la laguna Mar Muerto. Zonas: M, Manglar; EA, Espejo de agua; PL, Planicie lodosa; PA, Playa arenosa; PC, Planicie de conchal.
En cuanto a la permanencia temporal de las aves, en los meses de estiaje (marzo y abril) registramos 29 especies, mientras que en los meses de lluvia (mayo y septiembre) fueron 33 (Cuadro 1). Las especies que observamos en los cuatro meses de muestreo fueron: F. magnificens, P. brasilianus, Egretta rufescens, E. thula, E. tricolor, Eudocimus albus, Platalea ajaja, H. mexicanus, C. minutilla y L. atricilla.
Entre las especies que anidaron en los manglares de la IP se encuentran F. magnificens (marzo), Bubulcus ibis y E. rufescens (mayo); así también observamos la construcción de nidos de Butorides virescens (mayo) y F. magnificens (septiembre). Es importante mencionar que de las aves presentes en la laguna, dos fueron catalogadas en algún nivel de riesgo en la NOM-059-SEMARNAT-2010: E. rufescens y Mycteria americana en la categoría de sujetas a protección especial.
Discusión
La riqueza y abundancia de aves acuáticas (40 especies y 1,577 registros) en la laguna Mar Muerto fue baja en relación con la extensión de la laguna y en comparación con otros humedales de menor extensión ubicados a lo largo del Pacífico tropical mexicano: laguna Pampa El Cabildo (39 especies, 89,413 individuos; Gerardo-Tercero et al. 2010) y Reserva de la Biosfera La Encrucijada (80 especies; Cartas-Heredia et al. 1999) en Chiapas; los lagos temporales de Santa María del Mar (75 especies; Rioja-Paradela et al. 2014) en Oaxaca; estero La Manzanilla (45 especies; 4,180 individuos; Hernández-Vázquez 2000), Laguna de Agua Dulce (78 y 66,976 respectivamente) y estero El Ermitaño (73 y 112,832) en Jalisco (Hernández-Vázquez 2004), y el sistema lagunar San Ignacio-Navachiste-Macapule (71 y 55,849) en Sinaloa (Sánchez-Bon et al. 2010). Posiblemente, la complejidad estructural de los ambientes en cada uno de estos cuerpos de agua está influyendo en la presencia y abundancia de las aves; de esta forma, la heterogeneidad en tipos de vegetación (tulares, zapotonales, carrizales) como las que se ven en La Encrucijada y El Cabildo, debido al mayor aporte de agua dulce, permite la coexistencia de un mayor número de especies en comparación con un ambiente más homogéneo como el que presenta la laguna Mar Muerto (Gerardo-Tercero et al. 2010, Pinelli 2011). Asimismo, dado que nuestro periodo de estudio únicamente comprendió cuatro meses y, con base en la completitud de nuestro muestreo y la estimación de la riqueza obtenida para la laguna (71.4%), es probable que existan especies que no registramos en este estudio, por lo que la riqueza avifaunística se podría incrementar a 56 especies.
Dentro del orden Charadriiformes, la familia Scolopacidae fue la más representativa. Cabe mencionar que en los meses de mayo y septiembre registramos mayor riqueza y abundancia de aves playeras, las cuales observamos alimentándose en la planicie lodosa, conchal y playa arenosa. Esto se debe principalmente a la dinámica de la migración debido a que varias especies migratorias arribaron al sitio en mayo durante su ruta de migración hacia el norte y otras en septiembre cuando se dirigían hacia el sur (Howes y Bakewell 1989, Hernández-Vázquez 2004). Aunado a ello, la presencia de lluvias y la dinámica mareal en la laguna influyeron en la proliferación de vertebrados y en la presencia y disponibilidad de sitios de forrajeo, convirtiendo la laguna en un zona importante en el suministro de alimento y áreas de descanso para las aves migratorias (Moreira 1995, Hernández-Vázquez 2000, Ysebaert et al. 2000, Ruiz 2004).
La especie de playerito más abundante fue C. minutilla, la especie migratoria neártica más pequeña de este grupo que inverna en nuestro país (Howell y Webb 1995, Alonzo-Parra 2007, Carmona et al. 2008). Observamos a esta especie en los tres paisajes estudiados, alimentándose siempre junto a Calidris pusilla, C. alba y Arenaria interpres. Por otra parte, el mayor número de aves playeras lo registramos en IP, donde se presentó una mayor diversidad de sitios atractivos para este grupo.
Las familias Ardeidae y Threskiornithidae estuvieron distribuidas regularmente a lo largo de laguna, esto puede deberse básicamente a la gran variedad de organismos que forman parte de su dieta (anfibios, lagartijas, invertebrados, pequeños roedores) lo que permite tener mayor variedad de sitios para forrajear (Custer y Osborn et al. 1996). Sin embargo, observamos un mayor número de individuos alimentándose en las planicies lodosas y áreas más someras, siendo IP el sitio preferido por este grupo. Aunado a ello, este lugar se asocia a una mayor cobertura de vegetación (manglar) proporcionando sitios para que más aves puedan descansar, pernoctar y realizar sus actividades de reproducción.
Se sabe que la riqueza o abundancia de ardeídos se encuentra relacionada con la disponibilidad temporal del alimento y que a su vez esta disponibilidad puede estar influenciada por cambios en el nivel del agua en los cuerpos costeros (Custer y Osborn 1978, David 1994, Hernández-Vázquez 2000, Rioja-Paradela et al. 2014); tal es el caso de la CSB, donde la abundancia de los ardeídos se vio afectada por el incremento en el nivel del agua durante el mes de mayo y septiembre; con estas condiciones se dificulta la captura de peces y se restringen los hábitos de forrajeo (David 1994, Hernández-Vázquez 2000, Hernández-Vázquez 2005). De acuerdo con su biología, los ardeídos prefieren alimentarse en aguas más someras (Custer y Osborn 1978, David 1994, Hernández-Vázquez 2000), lo que provocó desplazamientos cortos de individuos a nivel local, relacionados con la búsqueda de sitios alternativos de forrajeo y descanso. Aunado a ello, en el mes de mayo (periodo vacacional en la zona) registramos alta actividad humana en la CSB, lo que posiblemente provocó disturbios en el área, lo cual ocasionó una disminución en las actividades de alimentación, descanso y reproducción de las aves (Whittaker y Knight 1998, Hernández-Vázquez 2005).
Las familias Anatidae y Rallidae tuvieron una clara prefe rencia por zonas abiertas con vegetación sumergida y áreas someras con poca velocidad de corriente, sitios que les permiten obtener abundante alimento a menor costo energético (Ysebaert et al. 2000, Hernández-Vázquez 2005). Registramos estos grupos de aves únicamente en el espejo de agua y planicies lodosas dentro de la IP. Cabe mencionar que, aunque estas especies muestran baja sensibilidad al disturbio humano (Hoyo et al. 1992), prefieren sitios alejados y seguros donde puedan realizar sus actividades. Por otro lado, el incremento en la abundancia de los anátidos se vio influenciado por la llegada de una parvada de Anas clypeata conformada por 44 registros individuales, éstos parecen usar la laguna como sitio de escala durante sus movimientos migratorios. La abundancia de esta especie fue relativamente baja al compararlo con la registrada en otros trabajos: Ruiz-Campos et al. (2005) registraron 86 individuos en los humedales costeros al noroeste de Baja California; Carmona y Danemann (1998) registraron 220 individuos en la salina de Guerrero Negro en Baja California Sur; Hernández-Vázquez (2004) registró 716 y 235 individuos en la laguna de Agua Dulce y el estero El Ermitaño en Jalisco, respectivamente.
En contraste, las familias Fregatidae y Phalacrocoracidae, con una especie cada una (F. magnificens y P. brasilianus res pectivamente), representaron 52% de la abundancia total de aves; siendo las especies residentes y anidantes más abundantes en la laguna. Estas aves marinas se alimentan principalmente en ambientes marinos y su presencia en los ambientes acuáticos costeros es por lo regular para descansar y anidar (Schreiber y Schreiber 1984, Hernández-Vázquez 2005). Es importante recalcar que en latitudes tropicales es de esperarse que las aves migratorias, en específico Anseriformes y Charadriiformes, sean menos abundantes en comparación con latitudes templadas, siendo mayor en latitudes tropicales el porcentaje de especies residentes y reproductoras (Palomera et al. 1994).
Se sabe que el uso y preferencias espaciales por parte de las diferentes especies de aves es causado principalmente por las diferencias estructurales que presentan los cuerpos de agua, en este caso por las condiciones hidrológicas, estructura de la vegetación, así como tipo y extensión de ambientes, lo que propicia que la riqueza y abundancia de aves no se distribuya uniformemente (Ysebeart et al. 2000, Hernández-Vázquez 2005). Para el caso de la laguna Mar Muerto, 85% de las especies mostraron una tendencia a ser más especialistas en el uso del espacio, mientras que el resto fue más generalista al utilizar de tres a cuatro zonas identificadas en el estudio.
Asimismo, se observó un comportamiento diferente en cada uno de los paisajes con respecto al uso del espacio. En IP se presentó la mayor riqueza específica y abundancia, lo cual puede estar asociado a una mayor complejidad estructural, ya que cuenta con diferentes ambientes tales como cuerpos de agua, bosque de manglar, planicies de conchal y lodo que ofrecen amplia disponibilidad de recursos, además de ser un islote inmerso dentro del cuerpo lagunar con menos intervención antropogénica. Asimismo, se caracteriza por presentar una mayor cobertura de vegetación de manglar con respecto a los otros sitios de muestreo, lo cual es importante para la posa, descanso y anidación de varias especies, principalmente de F. magnificens y P. brasilianus. Cabe mencionar que IP es utilizado por algunas especies sólo durante la época de reproducción y anidación como E. rufescens y B. ibis lo que posiblemente obedece a una mayor disponibilidad de sitios protegidos. Por el contrario, los sitios de BT y la CSB presentaron zonas más abiertas con poca vegetación, como la planicie lodosa y la playa arenosa, que básicamente fueron utilizadas como sitios de alimentación y descanso; esto posiblemente influyó en el registro de una menor riqueza y abundancia de aves acuáticas, ligado también a una mayor actividad antropogénica.
Los resultados obtenidos en este trabajo enfatizan la importancia de laguna Mar Muerto como un sitio importante de descanso, alimentación y abrigo para especies residentes y visitantes estacionales. Cabe mencionar que IP funge como una colonia reproductiva para varias especies residentes; sin embargo, pese a que en este estudio se refleja la importancia de este sitio, presenta visualmente grados de contaminación debido a la acumulación y quema de basura por parte de la población aledaña y, aunque aún no se ha evaluado el efecto de dichas actividades sobre la población de aves, la protección y el manejo de esta área es esencial. La presencia de especies con cierto grado de vulnerabilidad como E. rufescens, M. americana y de aquellas que emplean el área de manglar como sitio de anidación como F. magnificens, B. ibis, E. rufescens y B. virescens justifica la conservación de los sistemas de manglar como un área importante para su conservación, por lo cual la preservación de este cuerpo de agua debería ser una prioridad regional.











 nueva página del texto (beta)
nueva página del texto (beta)


