Introducción
Debido a que son nectarívoros especializados, los colibríes son importantes dispersores de polen en los ecosistemas terrestres de América, principalmente en el trópico (Proctor et al. 1996). Estas aves también son importantes desde el punto de vista cultural (Arizmendi y Berlanga 2014), desde las antiguas culturas mesoamericanas hasta la actualidad (Cantú et al 2011). Han sido consideradas como especies bandera, pues por sus vistosos plumajes y agilidad en el vuelo son capaces de atraer la atención del público hacia los problemas de conservación (Sánchez-Jasso y Cebrián-Abellán 2015).
De igual forma, en ecosistemas tropicales, los colibríes han sido utilizados como especies indicadoras de perturbación. Por ejemplo, en las selvas secas de Yucatán se ha documentado que su abundancia se relaciona con la cobertura de árboles y los niveles de sucesión (Navarro-Alberto et al. 2016). En otras selvas tropicales se ha sugerido que la fragmentación de hábitat afecta sus patrones de vuelo y forrajeo (Hadley y Betts 2009); aunque, en general, los colibríes parecen ser menos afectados por los cambios de uso de suelo que otros polinizadores (Stouffer y Bierregaard 1995).
Muchas especies y subespecies de colibríes tienen algún grado de amenaza según la Norma Oficial Mexicana (SEMARNAT 2010) y el libro rojo de la IUCN (2015). Aunque en las zonas costeras de Yucatán se han llevado a cabo estudios de la diversidad de colibríes y aspectos generales de su estacionalidad (Chablé-Santos 2009, Santamaría-Rivero et al. 2013, Licona-Vera y Ornelas 2014), no se han descrito otros aspectos básicos de su ecología como su abundancia, los recursos florales que utilizan y sus estrategias de forrajeo. El conocimiento de estos aspectos puede ser esencial no sólo para comprender un poco más de la ecología de las especies de la zona, sino que puede ayudar a establecer medidas para su conservación. Por ejemplo, conocer las especies de plantas de las que se alimentan los colibríes durante la época de sequía permitiría entender si, en sitios altamente estacionales, los recursos florales pueden ser una limitante para sus poblaciones. Con esta información se podría, por ejemplo, evaluar si las especies de colibríes visitan las flores de cada especie de planta en diferentes proporciones y si existe evidencia que sugiera una selección de algún recurso.
En este trabajo documentamos las especies de colibríes y las especies de plantas que usan como alimento durante el trimestre enero-marzo que es parte de la estación seca que va de enero hasta principios de julio en la Reserva de la Biosfera Ría Lagartos (RBRL), Yucatán. También evaluamos la probabilidad de que las plantas sean visitadas en proporción diferente a la abundancia de sus flores y exploramos la correlación temporal entre la abundancia de colibríes y plantas.
Métodos
Área de estudio
Realizamos este estudio en Holchit, una zona conservada de la duna costera de la RBRL, que abarca aproximadamente 15 km de largo (21°37'23.4"N - 88°07'42.3"O y 21°34'19"N - 88°06'00.9"O; 0-20 msnm).
El clima del área de estudio es cálido semiárido (CNA 2010), la precipitación anual es de 670 mm y la temperatura anual promedio supera los 25 °C. La mayor parte de la precipitación ocurre entre los meses de agosto y octubre. Durante los meses de estudio (enero a marzo), la precipitación acumulada es en promedio de 112 mm, es decir el 17% de la precipitación media anual histórica.
Los tipos de vegetación principales en la RBRL son la selva baja subcaducifolia, selva mediana subperennifolia, selva baja inundable y matorral costero; en este último tipo de vegetación desarrollamos el presente estudio. El matorral costero, por su estructura, es muy similar a los matorrales xerófilos del centro y norte del país, con abundancia de arbustos espinosos, cactáceas y agaves, aunque consta de elementos de las selvas tropicales como Caesalpinia vesicaria y Bumelia retusa y elementos costeros como Thrinax radiata, Pseudophoenix sargentii y Coccothrinax readii (Flores y Espejel 1995).
En la RBRL se han reportado siete especies de colibríes: Anthracothorax prevostii Chlorostilbon canivetii, Amazilia candida, A. yucatanensis, A. rutila, Doricha eliza y Archilochus colubris (CONANP 2007).
Muestreo
Para determinar la diversidad de especies de colibríes presentes en la RBRL durante el periodo de enero a marzo de 2013 de la época seca, realizamos observaciones visuales directas. La técnica utilizada para determinar la presencia y diversidad colibríes fue la de Emlen (1971) modificada por Ortiz-Pulido y Díaz-Valenzuela (2001), la cual consiste en buscar a estas aves a lo largo de trayectos, recorriéndolos a una velocidad de 1 km/h y observando con mayor atención a las agrupaciones de plantas con flores que presentan características de ser visitadas por colibríes (i. e., corolas largas y colores vistosos).
Decidimos realizar el estudio sólo en el periodo de enero a marzo, pues permitiría representar uno de los trimestres más secos del año en la localidad. En ese trimestre, con temperaturas cálidas (en promedio de 26 a 28°C; CNA 2010), muy pocas especies producen flores en la RBRL (Campos-Navarrete et al. 2013), lo cual da como resultado condiciones críticas que pueden determinar la presencia y abundancia de colibríes y otros polinizadores.
El área en donde hicimos las observaciones es una franja de 5 km de largo de la costa del municipio de Río Lagartos. Con el fin de mejorar la visualización de los colibríes, dividimos el área en tres secciones debido a que cada una presentó diferencias en cuanto a la estructura de la vegetación. Cada trayecto de cada sección lo recorrimos por un día al mes para cubrir toda el área de estudio durante tres días de muestreo mensual.
En la primera sección (1.3 km de largo) realizamos recorridos en 15 trayectos perpendiculares al mar de aproximadamente 40 m de ancho por 150 m de largo cada uno. En la segunda recorrimos tres trayectos de 40 m de ancho por 1.7 km de largo, mientras que en la tercera sección establecimos cuatro trayectos de 40 m de ancho por 2 km de largo. En la segunda y tercera secciones los trayectos fueron paralelos al mar debido a que la vegetación presenta este patrón de distribución provocado por la presencia de hondonadas entre dunas que forman franjas que corren paralelas a la línea de costa.
Los recorridos de cada sección los realizamos a partir de las 07:00 h hasta las 14:00 h. Para cada colibrí detectado anotamos la sección, hora y trayecto en el que lo observamos, y el número de flores visitadas por especie de planta. La identificación de las especies la hicimos con la ayuda de binoculares 12× 50 mm (Brushnell) y las guías de identificación de Peterson y Chalif (1989) y Howell y Webb (1995). Comprobamos que los nombres científicos de las especies de colibríes se ajustaran a la nomenclatura propuesta por AOU (2016).
Durante los recorridos efectuados marcamos las plantas cuyas flores fueron visitadas por los colibríes y procedimos a identificarlas a nivel de especie con ayuda del listado florístico de la RBRL (CONANP 2007) y comparando ejemplares colectados en el campo con ejemplares del herbario de la Universidad Autónoma de Yucatán. Una vez identificadas, contamos el número total de flores de estas especies (no solamente las de los individuos visitados) dentro del área en la que se muestrearon los colibríes.
Análisis de datos
Para probar la hipótesis de que el número de visitas a cada especie de planta era proporcional a la abundancia de sus flores, hicimos un análisis de Chi cuadrada para varias muestras independientes, que es una prueba de asociación no paramétrica (Siegel y Castellan 1995). Dado que esta prueba sugirió rechazar la hipótesis nula, realizamos un análisis post hoc de residuos ajustados (Haberman 1973) para saber qué especies de plantas eran visitadas en proporciones diferentes a las esperadas. El signo de este valor indica si la frecuencia observada fue mayor o menor de la esperada y su valor absoluto sirve para estimar su probabiliad (P) en las tablas estadísticas de distribución normal (Z) (Sharpe 2015). Estos análisis los realizamos usando el programa Statgraphics Centurion XV(r) v 15.2.06 (StatPoint Inc. 2007).
Realizamos análisis de correlación temporal entre las siguientes variables: número de flores y avistamiento de colibríes. Las variables de todos los trayectos y secciones fueron sumadas, de manera que se tuvo un dato para cada fecha; el total de días de muestreo fue de 10. Para asegurar la distribución normal de los datos y reducir la heterogeneidad de varianzas, las densidades diarias de las flores fueron transformadas a ln(x) y el número de avistamientos/día de colibríes a ln(x+1); después de la transformación se comprobó que los residuales de los análisis se distribuyeran normalmente con la prueba de Kolmogorov-Smirnov y no estuvieran correlacionados con la variable independiente, cumpliendo con estos supuestos de validez de la prueba (Wackerly et al. 2010). Los análisis los realizamos en el programa citado anteriormente. En los análisis de correlación fueron tomadas en cuenta todas las especies de plantas en las que se observó alguna visita de colibríes durante el tiempo del estudio, aunque se excluyeron del análisis los colibríes A. colubris y A. yucatanensis debido a que fueron observadas únicamente durante una y dos fechas respectivamente, y no proporcionaban datos suficientes para realizar una correlación temporal.
Debido a que la localización de cada planta o de cada colibrí avistado no se geoposicionó de manera detallada, no fue posible comprobar si las variables presentaban autocorrelación espacial, la cual se ha estimado que ocurre a distancias de menos de 200 m (Leirana-Alcocer 2010). Sin embargo, dado que la variación temporal de las densidades de flores dentro de cada trayecto fue alta, consideramos que el efecto temporal no es enmascarado por los patrones espaciales; aunque se sugiere que en subsiguientes estudios se incluyan las localizaciones detalladas tanto de las plantas con flores como de los colibríes observados para poder relacionar los cambios temporales con los patrones espaciales.
Resultados
Registramos cuatro especies de colibríes Doricha eliza, Amazilia rutila, A. yucatanensis y Archilochus colubris. Del total de las 285 visitas a flores de las seis especies de plantas observadas (Cuadro 1) D. eliza y A. rutila fueron las especies que realizaron más visitas (179 y 92 respectivamente), mientras que A. yucatanensis y A. colubris fueron las que realizaron menos (11 y 3 respectivamente).
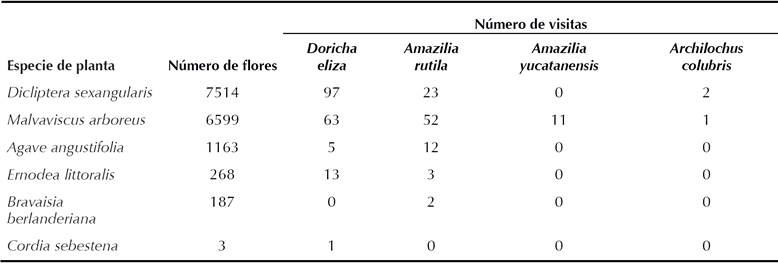
Cuadro 1 Número de flores y número de visitas observadas a cada especie de planta por especie de colibrí en la RBEL, de enero a marzo de 2013.
Del total de flores registradas en los trayectos, Dicliptera sexangularis presentó un total de 7514 y Malvaviscus arboreus 6599 (Cuadro 1), lo que representa el 47% y 41% del total de flores registradas respectivamente.
El análisis de chi cuadrado sugirió que alguna de las seis especies de plantas fue visitada en diferente proporción a la esperada por sus abundancias de flores (x2= 50.4, gl = 15, P<0.001). El análisis post hoc de residuos ajustados sugirió que D. eliza visitó con mayor frecuencia de lo esperado las flores de D. sexangularis (P<0.01), pero menos de lo esperado a las de M. arboreus y Agave angustifolia (P<0.05). En contraste A. rutila hizo más visitas de las esperadas a A. angustifolia (P<0.005) y M. arboreus (P<0.05), pero menos a D. sexangularis (P<0.005); es decir un patrón contrario al de D. eliza.
Amazilia yucatanensis visitó M. arboreus más veces de lo esperado por el número de flores que produjo (P<0.01) y menos veces a las flores de D. sexangularis (P<0.05). Para las demás especies de flores no hubo diferencias significativas entre el número de visitas observadas y esperadas.
En cuanto a las correlaciones temporales, observamos que hubo una correlación positiva y significativa entre los registros de D. eliza y A. rutila y la abundancia combinada de las flores de M. arboreus y D. sexangularis (Figura 1). En general, observamos que la correlación con el número de flores fue mayor en D. eliza (r = 0.94, P< 0.005) que en A. rutila (r = 0.78, P<0.005). Las abundancias de las flores de M. arboreus y D. sexangularis también presentaron una alta correlación entre ellas (r= 0.92, P< 0.005).
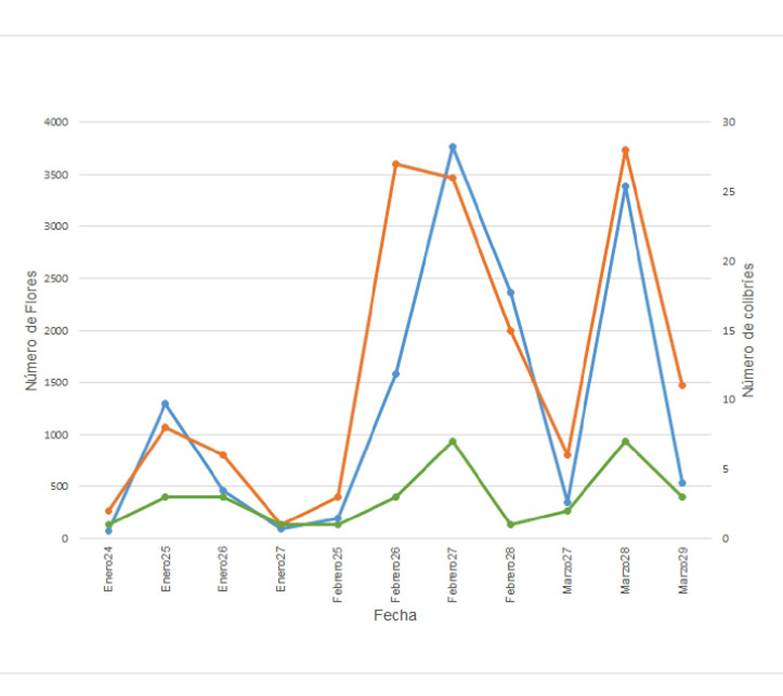
Figura 1 Variación temporal del número de flores conjunto de Malvaviscus arboreus y Dicliptera sexangularis (línea color azul) y del número de visitas observadas de los colibríes Doricha eliza (línea color naranja) y Amazilia rutila (línea color verde) en la RBRL, durante los días de muestreo en el periodo enero-marzo de 2013.
Discusión
Es importante destacar que el colibrí más frecuentemente observado fue D. eliza, una especie cuasiendémica de la zona costera de Yucatán y clasificada como en peligro de extinción (SEMARNAT 2010) o casi amenazada (IUCN 2015); cuya distribución geográfica está restringida al norte de Yucatán con poblaciones aisladas en el estado de Veracruz, algunas de las cuales se encuentran amenazadas (Ortiz-Pulido et al. 2002, Díaz-Valenzuela et al. 2011). Esto acentúa la importancia de la RBRL en la conservación de sus poblaciones y sus hábitats.
La segunda especie más abundante fue A. rutila, uno de los colibríes más comunes en Yucatán. Esta especie ocupa diversos tipos de ambientes que incluyen los fuertemente urbanizados. Es capaz de aprovechar diferentes tipos de flores, incluso algunas que no son típicamente ornitofílicas (Chablé-Santos et al. 2007). Por otro lado, A. colubris, la especie menos frecuente en este trabajo, es una especie migratoria (Robinson et al. 1996) que posiblemente se le encuentre en mayor abundancia en otras zonas de la reserva con mayor abundancia y diversidad de recursos florales.
Las especies de plantas con mayor número de flores fueron también las más visitadas por los colibríes; aunque las especies de colibríes compartieron hasta cuatro de las especies de plantas, cada colibrí visitó a las diferentes especies en diferente proporción. Esto podría deberse a las diferencias morfológicas y de comportamiento entre colibríes que los hacen más eficientes en el uso de determinados recursos, lo que puede provocar una segregación del uso de las flores cuando coexis ten diferentes especies. Por ejemplo, D. eliza, que presenta la mayor longitud del pico y menor masa corporal (Howell y Webb 1995, Guerrero-González 2007) de los cuatro colibríes observados, lo avistamos visitando a la planta D. sexangularis en mayor proporción que lo esperado por la abundancia de sus flores. Esta especie de planta presentó la corola más larga (23 mm), menor contenido energético (11 cal/ml) y mayor dispersión espacial que las otras especies de plantas registradas (Medina van Berkum 2014).
Por su parte, A. rutila, que tiene mayor biomasa y un pico más corto (Arizmendi y Berlanga 2014, Guerrero-González 2007), tuvo mayor actividad de forrajeo que la esperada sobre las flores de M. arboreus. Esta especie de planta presentó corolas más cortas (18 mm), mayor recompensa en volumen y concentración de néctar y, por lo tanto, en contenido energético (62 cal/ml) y mayor agregación espacial (Medina van Berkum 2014). También, A. yucatanensis, que tiene una biomasa corporal y longitud del pico similares a los del A. rutila (Sibley 2000, Guerrero-González 2007, Arizmendi y Berlanga 2014), fue encontrado forrajeando exclusivamente sobre las flores de M. arboreus. Sin embargo, evidentemente es necesario llevar a cabo estudios más específicos para comprender las razones subyacentes al patrón observado de visitas. Por ejemplo, considerar no sólo el balance energético que cada especie de planta provee a cada especie de colibrí, sino evaluar además si existe competencia inter e intraespecífica por los recursos florales y si este factor modifica la selección de los mismos (Medina van Berkum 2014).
También cabe resaltar la importancia del arbusto M. arboreus y la herbácea D. sexangularis, que presentan flores abundantes durante este trimestre seco del año, cuando otras especies ornitofílicas tienen escasa producción de flores. Nuestros datos sugieren que el manejo y conservación de ambas especies resulta crucial para que los colibríes de la zona tengan alimento en los meses de mayor estrés hídrico.
Otro recurso que los colibríes usaron, aunque tiene flores asociadas a otros polinizadores, fue el Agave angustifolia, género cuyos visitantes reportados son principalmente murciélagos y polillas halcón (Trejo-Salazar et al. 2015). Los magueyes, sin embargo, son importantes en las redes de interacción planta-colibrí en otras partes del país (Lara-Rodríguez et al. 2012); en este estudio, A. angustifolia ocupó el tercer lugar en cuanto a la abundancia de flores y fue visitado por A. rutila en mayor proporción de lo esperado por su disponibilidad. Así, esta planta puede ser importante para mejorar la calidad de los hábitats para los colibríes, sobre todo en los meses más secos, pues no depende de lluvias recientes para producir flores sino del agua y fotosintatos almacenados en sus hojas durante toda su vida (Nobel 2003).
La correlación entre la abundancia de flores de M. arboreus y D. sexangularis sugiere que existen factores a los que ambas especies pudieran estar respondiendo, tales como varia ciones en la humedad, iluminación y temperatura que son elementos que inducen la producción de flores en plantas de ecosistemas semiáridos (Pavón y Briones 2001). La abundancia de flores de estas dos especies se correlaciona con la frecuencia de los colibríes D. eliza y A. rutila, lo que sugiere que su floración es la principal atracción de estas aves al matorral de duna costera, su principal fuente de alimentación, y que puede ser determinante para que las especies vivan en esta zona. Según Howell y Webb (1995), D. eliza se reproduce de agosto a abril en tanto que A. rutila lo hace de enero a abril; es decir, la floración de estas plantas puede ser clave en el éxito reproductivo de ambas aves al generar alimento en los meses menos lluviosos y que abarcan parte de su época reproductiva.
Por último, cabe mencionar que la ausencia en nuestros registros observacionales de tres de las siete especies de colibríes reportadas para la RBRL puede tener varias explicaciones. Algunas especies pueden estar ausentes o ser muy raras en los meses más secos, en los que el matorral costero produce muy pocas flores. Por ejemplo, Chablé-Santos (2009) encontró que en este tipo de vegetación los colibríes Chlorostilbon caniveti y Amazilia candida están ausentes durante la temporada seca. Además, en el listado del programa de manejo de la RBRL se incluyen todas las especies de colibríes (CONANP 2007), sin discriminar el tipo de vegetación en el que están presentes o son más abundantes; por ello, es posible que las especies no registradas utilicen el matorral costero solamente en los meses lluviosos, cuando una gran diversidad de plantas producen flores (Flores y Espejel 1995, Parra-Tabla obs. pers).
En conclusión, nuestros resultados sugieren que en el matorral costero, durante los meses de baja productividad y menor disponibilidad de recursos florales en la RBRL, las flores de M. arboreus, D. sexangularis y A. angustifolia son fundamentales para el mantenimiento del sistema colibrí-planta. La identificación de los recursos alimenticios de especies polinizadoras de diversas plantas es un elemento básico para establecer medidas de conservación integrales en ecosistemas tan importantes como lo es la RBRL.











 nueva página del texto (beta)
nueva página del texto (beta)


