Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Huitzil
versión On-line ISSN 1870-7459
Huitzil vol.15 no.1 Omitlán ene./jun. 2014
Científica
Diversidad avifaunística en agroecosistemas de riego y temporal de la cuenca baja del Lago de Cuitzeo, Michoacán
Avian diversity in irrigated and rain feed agricultural fields in the lower basin of Lake Cuitzeo, Michoacán
Elvis Herrera Rodríguez y Javier Salgado Ortiz*
Laboratorio de Investigación en Ornitología, Facultad de Biología, Universidad Michoacana de San Nicolás de Hidalgo. Francisco J. Múgica s/n, Colonia Felícitas del Río, Morelia, Michoacán, 58030, México. Correo electrónico: *javo_salgado@yahoo.com.mx
Recibido: 8 de mayo de 2013
Revisión aceptada: 7 de mayo de 2014
Editora Asociada: Iriana Leticia Zuria Jordan
Resumen
Las áreas naturales protegidas representan la principal estrategia de conservación de la biodiversidad. Sin embargo, sólo el 12.93% del territorio nacional se encuentra bajo protección legal. En este escenario surge la necesidad de encontrar alternativas para la conservación de la biodiversidad. Los agroecosistemas (ecosistemas bajo manejo antropogénico) pueden ser una alternativa de conservación, debido a su potencial de ser hábitats productivos para algunas especies silvestres. Aunque se ha encontrado que los agroecosistemas pueden albergar una gran riqueza de aves, hay pocos estudios sobre la avifauna en los agroecosistemas de México. En este estudio comparamos la diversidad de la avifauna en dos tipos de agroecosistemas de la cuenca del Lago de Cuitzeo, en Michoacán, para evaluar su importancia en la conservación de las aves de la región. Llevamos a cabo muestreos de aves en áreas de agricultura de riego y temporal, entre febrero de 2009 y febrero de 2010. En 143 puntos de conteo detectamos 99 especies de aves, 64% de las reportadas para la vegetación original del área. Aunque la riqueza de especies fue similar entre agroecosistemas, los sitios con agricultura de riego presentaron mayor abundancia de insectívoros, mientras que la abundancia de granívoros fue mayor en los sitios con agricultura de temporal. Los agroecosistemas con agricultura de riego fueron más diversos que los de temporal. Ambos agroecosistemas comparten 44 especies y tuvieron una similitud de 0.62 (Morisita-Horn). Ya que una buena proporción de aves habita en estos agroecosistemas, consideramos que son importantes para la conservación de las aves de la región.
Palabras clave: agrobiodiversidad, avifauna agrícola.
Abstract
Natural protected areas represent the main strategy for biodiversity conservation. However, in México only 12.93% of its territory is under legal protection. Given these circumstances, it is necessary to find alternative conservation strategies. Agroecosystems (human managed ecosystems) can be one of such alternative strategies because of their potential to be productive habitats for some wildlife species. Agroecosystems have been found to harbour substantial bird richness; however, there are few studies of birds in Mexican agroecosystems. In this study, we compared avian diversity in two types of agroecosystems of the basin of Lake Cuitzeo, in Michoacán, to evaluate their importance for bird conservation in the region. We sampled birds in areas of irrigated and rain feed agricultural fields from February 2009 to February 2010. We detected 99 species in 143 point counts, 64% of the species reported for the original vegetation in the area. Species richness was similar between irrigated and rain feed fields; however, insectivores were more abundant in irrigated fields, while granivores were more abundant in rain feed fields. Irrigated fields were more diverse than rain feed fields. The similarity between these agroecosystems was 0.62 (Morisita-Horn) and 44 species were shared by both. A good proportion of birds inhabit these agroecosystems, therefore, we consider them to be important for bird conservation in the region.
Keywords: agrobiodiversity, farmland birds.
Introducción
Los esfuerzos para la conservación de la biodiversidad se han enfocado principalmente en la protección de grandes extensiones de tierra bajo el esquema de áreas naturales protegidas (ANP; Peña-Jiménez et al. 1998, Perfecto y Vandermeer 2008). Sin embargo, en México sólo el 12.93% del territorio nacional se encuentra protegido bajo alguna categoría de ANP (CONANP 2013). Si bien esta iniciativa es significativa, la extensión espacial requerida para la conservación de algunas especies puede ser mayor a la extensión de muchas ANP o incluso, más de lo que pueda estar disponible de vegetación nativa (Perfecto y Vandermeer 2008). En este escenario, surge la necesidad de encontrar estrategias complementarias para la conservación de la biodiversidad.
Los agroecosistemas son paisajes cada vez más comunes y, con un manejo adecuado, pueden convertirse en una alternativa complementaria para la conservación de flora y fauna silvestre. Los agroecosistemas se definen como paisajes resultantes de las actividades agrícolas o pecuarias, conformados por cultivos, pastizales y vegetación nativa remanente. En su sentido más amplio, también comprenden plantaciones forestales, parques recreativos, áreas verdes, jardines, huertos y prácticamente cualquier ecosistema bajo manejo (Thrupp 2000).
A pesar de que la expansión de los ecosistemas agrícolas se considera como una de las principales causas de deforestación en las zonas tropicales (Gibbs et al. 2010), los agroecosistemas también tienen el potencial de ser hábitats muy productivos para algunas especies silvestres (Alkorta et al. 2003). Dado el impacto de las prácticas agrícolas sobre la vida silvestre, los agroecosistemas generalmente tienen una menor riqueza de especies que los ecosistemas naturales (pero ver Moguel y Toledo 1999). Entre estos impactos se incluyen la perturbación y pérdida de hábitat, menor cantidad y calidad del agua, la toxicidad por pesticidas, además de la disminución de la heterogeneidad del paisaje por la reducción de la vegetación nativa remanente (Tilman et al. 2002, Tscharntke et al. 2005). Sin embargo, los agroecosistemas también pueden proporcionar servicios de gran importancia para algunas especies silvestres, tales como la alimentación, refugio, hábitat temporal y permanente, y facilitar la dispersión de individuos entre parches de vegetación (Greenberg 1996). Si bien, la trasformación de la vegetación nativa en agroecosistemas supone una reducción de la diversidad a nivel local, a nivel regional pueden incluso incrementarla al aumentar la heterogeneidad del paisaje, siempre y cuando la perturbación sea moderada (Mellink 1991, Salgado-Ortiz 2000). A pesar de los argumentos anteriores, preguntas como ¿cuál es la diversidad de flora y fauna silvestre en agroecosistemas? y ¿qué tipo de agroecosistemas generalmente alberga mayor biodiversidad? han surgido sólo recientemente como preguntas de interés científico (Perfecto y Vandermeer 2008) y apenas están siendo abordadas dada la necesidad de promover alternativas de conservación más allá de las ANP.
En las zonas cafetaleras del sureste de México, por ejemplo, se ha encontrado que las plantaciones de café y cacao de sombra, así como fragmentos de vegetación nativa, pueden albergar una riqueza y abundancia de especies de aves similar a la vegetación original (Greenberg et al. 1997, Moguel y Toledo 1999, Gordon et al. 2007). También se ha encontrado que muchas especies de aves se benefician de la existencia de fragmentos en etapas tempranas y tardías de la sucesión ecológica, asociados a la agricultura de tumba, roza y quema (Salgado-Ortiz 2000, Smith et al. 2001).
En la región de Los Tuxtlas, Veracruz, se ha encontrado que diversos agroecosistemas como cultivos de café, cacao, cítricos, cercos vivos y fragmentos de vegetación secundaria pueden favorecer la presencia de un mayor número de especies, a nivel de paisaje, que los pastizales y campos de cultivo (Estrada y Coates-Estrada 2005). Aunque estos tipos de vegetación pudieran no ser adecuados para una residencia permanente, proveen conectividad entre fragmentos de vegetación, cobertura vegetal y recursos alimenticios, por lo que son importantes elementos del paisaje para la conservación de la avifauna regional (Estrada et al. 2000). También hay evidencia de que remanentes de vegetación arbórea, incluso si no forman una estructura continua o compleja, influyen positivamente en la diversidad de aves en paisajes altamente perturbados (Salgado-Ortiz 1993, Greenberg 1996, Graham y Blake 2001).
En el occidente y centro de México, los bordes agrícolas albergan una gran riqueza de especies y son particularmente importantes para las aves migratorias (Villaseñor-Gómez y Hutto 1995, Zuria y Gates 2013). Se ha reportado además que las aves migratorias, a diferencia de las residentes, parecen ser más abundantes en sitios con niveles intermedios de perturbación (Hutto 1989).
Los paisajes agropecuarios abarcan hoy día una gran extensión del territorio nacional; desafortunadamente, la tendencia actual de la vegetación remanente en estos agroecosistemas es a su desaparición como consecuencia de su transformación en monocultivos extensivos (Villaseñor-Gómez y Hutto 1995, Tilman et al. 2001).
La cuenca del Lago de Cuitzeo, en Michoacán, constituye un área importante para la conservación de la biodiversidad de acuerdo a varios criterios. Está considerada (toda o partes de su extensión) como una de las áreas prioritarias para la conservación de la biodiversidad en Michoacán (Velázquez et al. 2005), así como dentro de las regiones terrestres e hidrológicas prioritarias de México (Arriaga et al. 2000, 2002) e identificada como una de las áreas de importancia para la conservación de las aves (Villaseñor-Gómez et al. 2000). Sin embargo, esta cuenca también es un área agrícola importante del Bajío michoacano. De su superficie total aproximada (3,800 km2), el 39% está dedicada a la agricultura. De la superficie cultivada, el 24% (560 km2) corresponden a zonas de agricultura de riego y el 15% (900 km2) a agricultura de temporal (Sotelo et al. 2005).
Este trabajo es un esfuerzo encaminado a determinar cómo el esquema de manejo en agroecosistemas de agricultura de riego y de temporal afecta la diversidad, abundancia y estructura de la comunidad de aves de la parte baja de la cuenca del Lago de Cuitzeo en Michoacán, y a evaluar la contribución de estos paisajes como alternativas de conservación de especies a nivel regional.
Métodos
La parte baja de la cuenca del Lago de Cuitzeo es un mosaico de remanentes de matorral subtropical y áreas agrícolas y ganaderas. La agricultura se desarrolla en las partes llanas, mientras que la mayor parte la vegetación nativa remanente se ubica en suelos con pendiente como cerros y lomeríos. Los sitios de agricultura de temporal se caracterizan por campos de cultivo de entre 1 y 6 ha, intercalados con pastizales para ganado y con abundantes cercos vivos, principalmente de mezquite (Prosopis laevigata). Además, es común encontrar mezquites aislados, esparcidos dentro de las parcelas. Las parcelas en los sitios de agricultura de riego son de entre 1 y 10 ha, el área ocupada por cercos vivos ha sido drásticamente reducida y en su lugar existen canales de riego donde crece vegetación acuática y sub-acuática, principalmente lirio (Eichornia crassipes) y junco (Scirpus lacustres, Typha domingensis, Cyperus aristatus) y que en ocasiones están flanqueados por árboles de sauce (Salix bonplandiana), fresno (Fraxinus sp.) y mezquite.
Llevamos a cabo muestreos de aves empleando el método de conteos por punto sin estimación de distancia, en campos de cultivo aledaños al Lago de Cuitzeo. Los puntos de conteo en áreas con agricultura de riego los realizamos en zonas al sur del lago, dentro del área del Valle de Queréndaro, mientras que los censos en áreas con agricultura de temporal los realizamos en zonas al noroeste del lago, dentro del área del municipio de Cuitzeo. Visitamos estos sitios de estudio aproximadamente cada dos meses, de febrero de 2009 a febrero de 2010. Los puntos de conteo los realizamos entre las 07:00 y 13:00 h, a lo largo de caminos y brechas con una distancia de 200 m entre cada punto. Durante 10 min registramos a todas las aves observadas o escuchadas sin considerar la distancia a la que se encontrasen (Wunderle 1994), tomando en cuenta que la detección está limitada por el paisaje, la distancia a la que se pueden escuchar los cantos y la máxima distancia a la que es posible identificar correctamente un individuo (50-100 m). En total realizamos 143 puntos de conteo: 75 en los sitios de riego y 68 en los de temporal. Adicionalmente, llevamos a cabo registros generales de aves para obtener un listado de especies más completo. Excluimos de los análisis estadísticos a las especies gregarias que se mueven en grandes grupos como los tordos. Estas especies las consideramos como abundantes de manera arbitraria para evitar algún sesgo negativo en la estimación de las abundancias de las especies solitarias o que se mueven en grupos pequeños. También excluimos de los análisis a las especies que no son adecuadamente registradas mediante los puntos de conteo y a las que, por sus hábitos, se sabe que no hacen uso directamente de los agroecosistemas (como las acuáticas y las asociadas a poblaciones humanas). Arbitrariamente consideramos a estas especies como raras.
Determinamos la riqueza de especies y su abundancia relativa en ambos tipos de agroecosistemas a partir de los registros obtenidos en los muestreos. Para la abundancia relativa, a la especie con mayor número de registros se le asignó una abundancia del 100%. Calculamos las abundancias de las demás especies en relación con la especie más abundante de acuerdo a la siguiente fórmula:
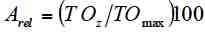
Donde:
Arel = Abundancia relativa
TOz = Total de observaciones de la especie z
TOmax = Total de observaciones de la especie más abundante
Según su porcentaje de abundancia, las asignamos a una de las categorías de abundancia relativa propuestas por Pettingill (1970):
(A) = Abundante, de 90 a 100%
(C) = Común, de 65 a 89%
(MC) = Medianamente común, de 31 a 64%
(NC) = No común, de 10 a 30%
(R) = Rara, de 1 a 9%
Calculamos dos estimadores de riqueza, uno basado en abundancia (Chao1) y otro en incidencia (Chao2) para verificar si el esfuerzo de muestreo fue adecuado. También calculamos el número promedio de especies e individuos detectados por punto de conteo (con su desviación estándar, DE) y aplicamos una prueba de Mann-Whitney para determinar si hay diferencias en la detección entre ambos agroecosistemas.
Determinamos cambios en la estructura de la comunidad avifaunística entre agroecosistemas, comparando la proporción de individuos entre gremios alimenticios, empleando tablas de contingencia. Asignamos las especies a uno de seis gremios alimenticios (carnívoros, carroñeros, granívoros, insectívoros, nectarívoros y omnívoros) de acuerdo a Ehrlich et al. (1988) y a observaciones de campo. Para observar cambios en la distribución de las abundancias de las especies entre ambos agroecosistemas, elaboramos curvas de rango-abundancia y comparamos sus pendientes mediante un análisis de covarianza. También comparamos la proporción de especies e individuos entre categorías de ocurrencia estacional (migratorias y residentes) mediante tablas de contingencia. Además, comparamos las 10 especies más abundantes en ambos agroecosistemas para observar cambios en la dominancia de las especies.
Para determinar la diversidad avifaunística en ambos agroecosistemas calculamos dos índices de diversidad. Debido a que los diversos índices responden de forma diferente a cambios en la riqueza y abundancia de los organismos (componentes de la diversidad), es recomendable utilizar dos índices, uno que le asigne mayor peso a la riqueza y otro que le asigne mayor peso a la abundancia, e interpretar los resultados comparando los valores obtenidos para ambos índices (Magurran 1988). Empleamos los índices alfa de Fisher (α) basado en riqueza y el índice de dominancia de Berger-Parker (d) basado en abundancia (presentamos su inverso d-1 para que el resultado se exprese en términos de equitatividad y se facilite su interpretación), y posteriormente realizamos una prueba de bootstrap para determinar diferencias significativas entre agroecosistemas. También calculamos la similitud entre los sitios de agricultura de riego y de temporal (diversidad beta) empleando el índice de Morisita-Horn. Además, evaluamos la similitud de ambos agroecosistemas con el matorral subtropical, la vegetación original de la zona de estudio, empleando el índice cualitativo de Sörensen. Para ello elaboramos un listado de especies del matorral subtropical de la región a partir de las especies reportadas en trabajos previos (Cruz-Angón 1996, Torres-Hernández 1998, Martínez-Meza 2002, Soto-Rojas 2005, Flores-González 2005).
Para el cálculo de los estimadores de riqueza y de los índices de diversidad empleamos los paquetes estadísticos EstimateS (Colwell 2006) y PAST (Hammer et al. 2001).
Resultados
En total registramos 99 especies de aves pertenecientes a 13 órdenes y 32 familias. Esto representa un 64% de la riqueza de aves registrada en el matorral subtropical en Michoacán (165 especies). Del total de especies dos son endémicas, nueve semi-endémicas, dos amenazadas y una bajo protección especial (Anexo 1). El orden mejor representado fue el de las Passeriformes y la familia mejor representada fue la Emberizidae. La riqueza total acumulada para la agricultura de riego fue de 86 especies y para la agricultura de temporal fue de 75 (Anexo 1).
Mediante puntos de conteo logramos registrar 60 especies y 1,022 individuos en los sitios de agricultura de riego, siendo la especie más abundante Sporophila torqueola con 114 individuos observados. En los sitios de temporal registramos 56 especies y 1,181 individuos. La especies más abundante fue Spinus psaltria, con 171 individuos observados. De acuerdo a los estimadores de riqueza (Chao1 y Chao 2), detectamos entre el 75% y 89% de las especies esperadas para ambos agroecosistemas con este método de muestreo (Cuadro 1).
Detectamos un promedio de 8.3 ± 2.9 especies por punto de conteo en los sitios de agricultura de temporal y un promedio de 7.8 ± 3.1 en los sitios de riego, pero la diferencia no fue significativa (P=0.33). En cuanto al número de individuos, nuestro promedio de detección por punto de conteo fue significativamente mayor (P=0.001) en los sitios de agricultura de temporal (18.2 ± 8.9) con respecto a los sitios de riego (13.6 ± 6.2).
Con respecto a la estructura de la comunidad, encontramos diferencias significativas en las proporciones de individuos en los gremios de granívoros e insectívoros entre sitios de riego y temporal (Χ2=14.33, gl=1, P=0.0002). Los granívoros fueron más abundantes en agricultura de temporal, mientras que los insectívoros fueron más abundantes en agricultura de riego (Figura 1). Debido a la baja proporción de individuos detectados en los gremios restantes, los excluimos de este análisis. No encontramos diferencias significativas en la distribución de las abundancias de las especies entre ambos agroecosistemas (F=2.28, P=0.59). En ambos agroecosistemas, la mayoría de las especies fue rara y solo unas pocas fueron abundantes (Figura 2). Presentamos las abundancias relativas para cada especie y agroecosistema en el Anexo 1. Aunque no encontramos diferencias significativas entre las proporciones de especies por categorías de ocurrencia estacional (X2=0.13, gl=1, P=0.71), sí encontramos diferencias significativas entre las proporciones a nivel de individuos. En los sitios de agricultura de temporal, la proporción de individuos migratorios fue mayor que en los sitios de agricultura de riego (X2=30.36, gl=1, P=0.0001). En agricultura de riego el 68.3% de las especies detectadas fueron residentes y el 31.7% fueron migratorias, mientras que en agricultura de temporal el 71.4% fueron residentes y el 28.6% fueron migratorias. A nivel de individuos, 84.9% fueron residentes y 15.1% fueron migratorios en los sitios de riego, mientras que en temporal el 75.6% de los individuos registrados fueron residentes y el 24.4% fueron migratorios. Considerando las 10 especies más abundantes en cada agroecosistema, encontramos cambios en la composición de la comunidad. Especies como Sporophila torqueola y Geothlypis trichas que fueron abundantes en los sitios de riego (primer y tercer lugar en abundancia respectivamente) no aparecen entre las 10 más abundantes en los sitios de temporal. Por el contrario, especies como Chondestes grammacus y Haemorhous mexicanus que estuvieron entre las 10 más abundantes en sitios de temporal no aparecen entre las más abundantes en riego. Especies como Melozone fusca y Columbina inca tuvieron abundancias relativas similares en ambos tipos de agroecosistemas, mientras que Passerina caerulea, aunque aparece entre las más abundantes en ambos agroecosistemas, es mucho más abundante en sitios de riego (segundo vs. noveno lugar en abundancia; Figura 2).
De acuerdo al índice de diversidad α de Fisher, los sitios de agricultura de riego tuvieron mayor diversidad (13.98) que los de temporal (11.82), pero la diferencia no fue significativa (P=0.08). Sin embargo, la diferencia sí fue significativa de acuerdo al índice de Berger-Parker (d-1=8.96 en riego vs d-1=7.05 en temporal, P=0.005). Con respecto a la diversidad beta, ambos agroecosistemas tuvieron una similitud de 0.62 (Morisita-Horn) con 44 especies compartidas. Al agrupar las especies detectadas en ambos agroecosistemas, su similitud con respecto al matorral subtropical fue de 0.52 (Sörensen).
Discusión
La agricultura ha sido y sigue siendo la actividad de mayor importancia económica en la región de la Cuenca de Cuitzeo. Junto con la ganadería, se consideran las actividades que más efecto han tenido en la conversión de la vegetación nativa de la región. La transformación del paisaje generada por las actividades agrícolas ha ocasionado una reducción significativa en la riqueza de aves en estas áreas; sin embargo, los resultados de este trabajo muestran que una proporción importante (64 %) de las aves presentes en el matorral subtropical (la vegetación nativa de las áreas de estudio), aún pueden ser encontradas en los agroecosistemas de la región. En estos agroecosistemas registramos especies semi-endémicas (p. ej., Amazilia violiceps, Selasphorus platycercus y Spizella pallida) y especies consideradas en riesgo (Accipiter striatus), además de un número importante de especies migratorias (principalmente gorriones como Spizella pallida, Chondestes grammacus y Melospiza lincolnii) propias de pastizales y praderas de la región Neártica, lo que sugiere que algunas de estas especies podrían haberse visto beneficiadas por las condiciones de campo abierto que ofrecen los agroecosistemas. Sin embargo, otras especies comunes en el matorral subtropical han desaparecido o son muy raras (como Geothlypis poliocephala, Aimophila ruficeps y Melozone kieneri).
De acuerdo a los estimadores de riqueza Chao 1 y Chao 2, logramos registrar entre el 75 y el 89% de las especies esperadas en nuestros sitios de estudio mediante los puntos de conteo. Sin embargo, si consideramos a las especies observadas fuera de los puntos de conteo y a las excluidas de los análisis, registramos incluso más especies que las predichas por los estimadores. Por ello consideramos que nuestro muestreo fue razonablemente completo y es adecuado para permitirnos hacer comparaciones entre ambos agroecosistemas.
La riqueza de aves y la estructura de la comunidad, en cuanto a la distribución de las abundancias relativas de las especies, fueron similares para ambos tipos de agroecosistemas. No obstante, encontramos diferencias en lo que respecta al número de individuos registrados por punto de conteo. En los sitos de agricultura de temporal registramos un mayor número de individuos por punto de conteo, que en sitios de riego. Este patrón está dado principalmente por especies como Haemorhous mexicanus y Spinus psaltria que, aunque los registramos frecuentemente en ambos agroecosistemas, en los sitios de temporal generalmente se mueven en grupos medianos (entre 4 y 8 individuos), mientras que en los de riego es más frecuente observarlos en parejas o en solitario.
Con relación a los gremios alimenticios, en los sitos de temporal registramos más individuos granívoros que en los sitios de riego, donde hubo una mayor abundancia de insectívoros. Este patrón podría explicarse, en buena medida, como resultado de las diferencias en el manejo agrícola entre ambos tipos de agroecosistemas, resultando en una variación en la disponibilidad y abundancia de recursos alimenticios. En sitios de riego, la disponibilidad de agua en canales del sistema de riego y la irrigación frecuente de los campos agrícolas, que permiten el cultivo durante todo el año, potencialmente influyen en una mayor abundancia de insectos, favoreciendo a su vez una mayor abundancia de aves que dependen de este recurso (Parrish y Sherry 1994). En contraste, la dominancia y abundancia de pastos y suelos desnudos post-cosecha en los sitios de temporal, podrían favorecer una mayor disponibilidad de semillas y por ende, también influir en una mayor abundancia de granívoros, muchos de los cuales forman grandes bandadas de forrajeo, explicando también la diferencia en el número de individuos detectados por punto de conteo entre agroecosistemas. Este resultado concuerda con los resultados de otros estudios (Salgado-Ortiz 1993, Villaseñor-Gómez y Hutto 1995) donde se ha documentado el incremento de los granívoros y en menor medida de los insectívoros, como consecuencia de la perturbación del hábitat, la simplificación de la estructura de la vegetación y también, en respuesta a la disponibilidad de alimento derivado de las actividades agrícolas.
En relación a la ocurrencia estacional, aunque no se detectaron diferencias entre las proporciones de especies residentes y migratorias presentes en ambos agroecosistemas, la diferencia entre las proporciones de individuos sí fue significativa, encontrándose más individuos migratorios en los sitios de agricultura de temporal. Este patrón está dado principalmente por las especies Polioptila caerulea, Spizella pallida y Chondestes grammacus, las cuales son mucho más abundantes en los sitios de temporal.
En cuanto a la diversidad, los sitios de agricultura de riego fueron más diversos que los de temporal de acuerdo a ambos índices; sin embargo la diferencia sólo fue significativa con el índice de Berger-Parker y no con el índice α. Esta ambigüedad en los resultados se puede esclarecer considerando las propiedades de ambos índices. El índice α de Fisher se basa en la riqueza y el tamaño de la muestra y es poco afectado tanto por las especies raras como por las más dominantes. En cambio, el índice de Berger-Parker, al ser un índice de dominancia, es más sensible a los cambios en las abundancias de las especies (Magurran 1988). Si bien, ambos agroecosistemas tienen una riqueza similar (como lo indica el índice α), en los sitios de riego las abundancias de las especies son más equitativas y, por lo tanto, estos sitios son más diversos que los de temporal.
Este resultado es inesperado, ya que en otros estudios se ha reportado que la intensificación de las prácticas agrícolas va acompañada por la reducción o extinción local de las poblaciones de aves (Vance 1976, Chamberlain et al. 2000). Por ello, esperábamos que los sitios de agricultura de riego, al ser más intensiva y con una estructura vegetal más simplificada que los sitios de temporal, tuvieran una menor riqueza y diversidad. Este resultado puede ser debido a que, en los sitios de agricultura de riego en la cuenca de Cuitzeo, se mantienen componentes del paisaje entre los que destacan los canales de riego. Estos canales permiten el establecimiento de especies de plantas acuáticas como el lirio y tule, además de que los agricultores, como parte del manejo, mantienen árboles como mezquites, sauces y casuarinas (Casuarina equisetifolia) a lo largo de los canales de riego y de los linderos de las parcelas. Esta vegetación, a lo largo de los canales, forma bordes a manera de vegetación riparia y es en estos sitios donde se observan especies de aves afines a cuerpos de agua que no se encuentran o que son muy raras en los sitios de temporal (p. ej., Geothlypis trichas, Pitangus sulphuratus y Gallinula galeata).Varios estudios han encontrado que la vegetación riparia es de gran importancia para las aves, especialmente en paisajes perturbados (Warkentin et al. 1995, Merola-Zwartjes y DeLong 2005, Villaseñor-Gómez 2009). Por ello, es posible que la presencia de los canales de riego y su vegetación asociada promuevan una mayor diversidad en los agroecosistemas de riego de la cuenca de Cuitzeo. En contraste, los estudios que reportan una reducción de la diversidad de aves con la intensificación de las prácticas agrícolas han sido realizados en Europa Occidental (Fuller 2000, Donald et al. 2001), donde la agricultura de riego se caracteriza por un alto grado de mecanización, la aplicación de grandes cantidades de fertilizantes, herbicidas y plaguicidas, y por extensos monocultivos, prácticamente desprovistos de vegetación arbórea. Comparados con éstos, los sitios de agricultura de riego en la cuenca de Cuitzeo cuentan aún con una vegetación arbórea considerable y el manejo agrícola es de menor intensidad. Además, los impactos de la intensificación agrícola no son evidentes en el corto plazo. Debido a que los cambios en las prácticas agrícolas son graduales, es posible que deba excederse un umbral de modificación del hábitat, antes de poder observar un efecto sobre las poblaciones de aves (Fuller 2000).
Aunque los sitios de agricultura de riego en la región de Cuitzeo fueron más diversos que los de temporal, esto no quiere decir que introducir sistemas de agricultura de riego sea la mejor propuesta desde el punto de vista de la conservación de las aves. El índice de similitud de Morisita-Horn mostró un nivel de similitud media entre agroecosistemas (0.62), lo cual indica que un buen número de especies no son compartidas entre ambos, de tal forma que es importante considerar la complementariedad de estos agroecosistemas a nivel de paisaje para favorecer la diversidad regional de las aves. En este mismo sentido, deben mantenerse en el paisaje extensiones de matorral subtropical para promover un mayor número de especies a nivel regional.
Los agroecosistemas son y serán cada vez más comunes en el futuro próximo y, con la tendencia de incremento en la demanda de alimentos y materias primas, aun los agroecosistemas de manejo tradicional podrían ser considerados como un tipo de hábitat en riesgo. Las principales amenazas que enfrentan a nivel global son la intensificación hacia monocultivos (Tilman et al. 2001) y en el caso particular de la cuenca de Cuitzeo, el crecimiento urbano (Sotelo et al. 2005). En la cuenca de Cuitzeo la población urbana tuvo un incremento de 187% en los últimos 30 años, desplazando cultivos y asentamientos rurales, de tal forma que los factores que favorecieron el desarrollo agrícola original (suelos fértiles, terrenos planos y disponibilidad de agua), actualmente se encuentran sujetos a una fuerte presión por el crecimiento urbano (Bravo-Espinosa et al. 2008).
Actualmente, las áreas agrícolas abarcan un 39% del área total de la cuenca del Lago de Cuitzeo (Sotelo et al. 2005). Debido a su gran extensión, pequeños cambios en el manejo de los agroecosistemas a nivel local, pueden tener un gran impacto sobre la diversidad de aves a nivel regional (Warkentin et al. 1995). Por este motivo, así como por su riqueza y su diversidad, los agroecosistemas de riego y de temporal de la cuenca del Lago de Cuitzeo son muy importantes para la conservación de las aves de la región.
Además, el valor para la conservación de estos agroecosistemas puede ser incrementado con algunas acciones de manejo como la protección y promoción de la vegetación riparia que también ayuda a reducir la erosión del suelo y mejorar la calidad del agua (Warkentin et al. 1995); el mantenimiento y promoción de bordes y cercos vivos entre campos de cultivo que pueden proveer de hábitat a algunas especies silvestres, así como el proveer de material para construcción, madera, materia orgánica y otros servicios a la gente local (Villaseñor-Gómez y Hutto 1995, Zuria y Gates 2013), y el mantenimiento y protección de fragmentos de vegetación remanente en el paisaje, pues estos favorecen la presencia de especies vulnerables y en declive (Cunningham et al. 2008). Prácticas como la reducción en el uso de pesticidas, el uso adecuado de fertilizantes tanto orgánicos como inorgánicos, la rotación de cultivos y los policultivos; la reducción del uso de la maquinaria y el reciclado de residuos orgánicos, también resultan benéficas para algunas especies silvestres (Gemmill 2002). La presencia de diferentes tipos de agroecosistemas inmersos en un paisaje más heterogéneo puede aumentar la riqueza de especies a nivel regional y también puede proteger la economía local en caso de que las condiciones ambientales, políticas o socioeconómicas se vuelvan desfavorables para algunos tipos de producción, lo que permitiría prevenir el abandono de tierras a gran escala (Moonen y Bàrberi 2008). La presencia de áreas sin cultivar dentro de terrenos de cultivo ha mostrado ser benéfica para las aves, aun si no son manejadas para tal propósito (Henderson y Evans 2000). Incluso, agroecosistemas intensamente manejados pueden aumentar su valor de conservación incrementando la complejidad del paisaje, la estructura vertical y el uso de plantas nativas (Salgado-Ortiz 1993, Merola-Zwartjes y DeLong 2005).
Irónicamente, con la pérdida de vegetación nativa causada principalmente por algunos agroecosistemas es que ahora éstos se están convirtiendo en hábitats importantes para la conservación de las aves (Schifferli 2000). Por ello, uno de los retos más grandes en el futuro cercano será la implementación y promoción de agroecosistemas altamente productivos que sean redituables y a la vez valiosos para la conservación de la biodiversidad (Tilman et al. 2002, Chazdon et al. 2009).
Hasta ahora, las ANP han sido efectivas en la protección de los ecosistemas y especies dentro de sus límites (Bruner et al. 2001) y como tal deben permanecer como un componente central en las estrategias de conservación. Sin embargo, dada la naturaleza cada vez más fragmentada de la mayoría de los ecosistemas, las estrategias de conservación futuras deberán incluir, además de las ANP, agroecosistemas bajo diferentes esquemas de manejo que favorezcan un paisaje heterogéneo y así promuevan una mayor diversidad tanto agrícola como silvestre.
Agradecimientos
El estudio se realizó con financiamiento y becas de la Coordinación de la Investigación Científica de la Universidad Michoacana de San Nicolás de Hidalgo (UMSNH), proyecto 8.28, 2009, y de la Coordinación Nacional de Becas de Educación Superior de la SEP. Agradecemos a estudiantes y personal del Laboratorio de Ornitología de la Facultad de Biología de la UMSNH por el apoyo en campo. También agradecemos a los revisores anónimos que, con sus críticas, comentarios y sugerencias, ayudaron al enriquecimiento de este manuscrito.
Literatura citada
Alkorta, I., I. Albizu y C. Garbisu. 2003. Biodiversity and agroecosystems. Biodiversity and Conservation 12:2521-2522. [ Links ]
Arriaga, L., J.M. Espinoza, C. Aguilar, E. Martínez, L. Gómez y E. Loa (en línea). 2000. Regiones terrestres prioritarias de México. CONABIO. <www.conabio.gob.mx/conocimiento/regionalizacion/doctos/terrestres.html> (consultado 26 de enero de 2011). [ Links ]
Arriaga, L., V. Aguilar y J. Alcocer (en línea). 2002. Aguas continentales y diversidad biológica de México. CONABIO. <www.conabio.gob.mx/conocimiento/regionalizacion/doctos/hidrologicas.html> (consultado 26 de enero de 2011). [ Links ]
Bravo-Espinosa, M., F. García-Oliva, E. Ríos-Patrón, M. Mendoza-Cantú, G. Barrera-Camacho, E. López-Granados, B.E. Serrato-Barajas y T. Sáenz-Reyes. 2008. La Cuenca del Lago de Cuitzeo: Problemática, Perspectivas y Retos Hacia su Desarrollo Sostenible. Fondo Editorial Morevallado. Morelia, Michoacán, México. [ Links ]
Bruner, A.G., R.E. Gullison, R.E. Rice y G.A.E. da Fonseca. 2001. Effectiveness of parks in protecting tropical biodiversity. Science 291:125-128. [ Links ]
Chamberlain, D.E., R.J. Fuller, R.G.H. Bunce, J.C. Duckworth y B. Shrubb. 2000. Changes in the abundance of farmland birds in relation to the timing of agricultural intensification in England and Wales. Journal of Applied Ecology 37:771-788. [ Links ]
Chazdon, R.L., C.A. Harvey, O. Komar, D.M. Griffith, B.G. Ferguson, M. Martinez-Ramos, H. Morales, R. Nigh, L. Soto-Pinto, M. van Breugel y S.M. Philpott. 2009. Beyond reserves: a research agenda for conserving biodiversity in human-modified tropical landscapes. Biotropica 41:142-153. [ Links ]
Colwell, R.K. (en línea). 2006. EstimateS: Statistical estimation of species richness and shared species from samples. Versión 8.2. <purl.oclc.org/estimates> (consultado 20 de marzo de 2014). [ Links ]
CONANP (Comisión Nacional de Áreas Naturales Protegidas) (en línea). 2013. Áreas Protegidas Decretadas. SEMARNAT, CONANP. <www.conanp.gob.mx/que_hacemos/> (consultado 20 de diciembre de 2013). [ Links ]
Cruz-Angón, A. 1996. Distribución de la subfamilia Parulinae (Aves: Emberizidae) en el estado de Michoacán, México. Tesis de licenciatura, Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Michoacán, México. [ Links ]
Cunningham, R.B., D.B. Lindenmayer, M. Crane, D. Michael, C. MacGregor, R. Montague-Drake y J. Fischer. 2008. The combined effects of remnant vegetation and tree planting on farmland birds. Conservation Biology 22:742-752. [ Links ]
Donald, P.F., R.E. Green y M.F. Heath. 2001. Agricultural intensification and the collapse of Europe's farmland bird populations. Proceedings of the Royal Society of London. Series B: Biological Sciences 268:25-29. [ Links ]
Ehrlich, P.R., D.S. Dobkin y D. Wheye. 1988. The birder's handbook. Simon & Schuster Inc. New York, EUA. [ Links ]
Estrada, A., P. Cammarano y R. Coates-Estrada. 2000. Bird species richness in vegetation fences and in strips of residual rain forest vegetation at Los Tuxtlas, Mexico. Biodiversity and Conservation 9:1399-1416. [ Links ]
Estrada, A. y R. Coates-Estrada. 2005. Diversity of Neotropical migratory landbird species assemblages in forest fragments and man-made vegetation in Los Tuxtlas, Mexico. Biodiversity and Conservation 14:1719-1734. [ Links ]
Flores-González, B. 2005. Avifauna reproductiva del matorral subtropical en el bajío de Michoacán, México. Tesis de licenciatura, Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Michoacán, México. [ Links ]
Fuller, R.J. 2000. Relationships between recent changes in lowland British agriculture farmland bird populations: an overview. Pp. 5-16. In: N.J. Aebischer, A.D. Evans, P.V. Grice y J.A. Vickery (eds.). Ecology and conservation of lowland farmland birds. British Ornithologists' Union. Norwich, Reino Unido. [ Links ]
Gemmill, B. 2002. Managing Agricultural Resources for Biodiversity Conservation: A Guide to Best Practices. UNEP (United Nations Environment Programme), UNDP (United Nations Development Programme), GEF (Global Environment Facility). Nairobi, Kenya. [ Links ]
Gibbs, H.K., A.S. Ruesch, F. Achard, M.K. Clayton, P. Holmgren, N. Ramankutty y J.A. Foley. 2010. Tropical forest were the primary sources of new agricultural land in the 1980s and 1990s. Proceedings of the National Academy of Sciences 107:16732-16737. [ Links ]
Gordon, C., R. Manson, J. Sundberg y A. Cruz-Angón. 2007. Biodiversity, profitability, and vegetation structure in a Mexican coffee agroecosystem. Agriculture, Ecosystems & Environment 118:256-266. [ Links ]
Graham, C.H. y J.G. Blake. 2001. Influence of patch and landscape level factors on bird assemblages in a fragmented tropical landscape. Ecological Applications 11:1709-1721. [ Links ]
Greenberg, R. 1996. Managed forest patches and the diversity of birds in southern Mexico. Pp. 59-90. In: J. Schelhas y R. Greenberg (eds.). Forest Patches in Tropical Landscapes. Island Press. Washington, DC, EUA. [ Links ]
Greenberg, R., P. Bichier y J. Sterling. 1997. Bird populations in rustic and planted shade coffee plantations of eastern Chiapas, México. Biotropica 29:501-514. [ Links ]
Hammer, Ø., D.A.T. Harper y P.D. Ryan (en línea). 2001. PAST: Paleontological statistics software package for education and data analysis. Versión 2.17. Paleontología Electrónica 4:1-9. <folk.uio.no/ohammer/past/> (consultado 20 de marzo de 2014). [ Links ]
Henderson, I.G. y A.D. Evans. 2000. Responses of farmland birds to set-aside and its management. Pp. 69-76. In: N.J. Aebischer, A.D. Evans, P.V. Grice y J.A. Vickery (eds.). Ecology and Conservation of Lowland Farmland Birds. British Ornithologists' Union. Norwich, Reino Unido. [ Links ]
Hutto, R.L. 1989. The effect of habitat alteration on migratory land birds in a west Mexican tropical deciduous forest: a conservation perspective. Conservation Biology 3:138-148. [ Links ]
Magurran, A.E. 1988. Ecological Diversity and Its Measurement. Princeton University Press. Princeton, New Jersey, EUA. [ Links ]
Martínez-Meza, F. 2002. Contribución al conocimiento de la familia Tyrannidae (Clase: Aves) en el estado de Michoacán, México. Tesis de licenciatura, Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Michoacán, México. [ Links ]
Mellink, E. 1991. Bird communities associated with three traditional agroecosystems in the San Luis Potosi Plateau, Mexico. Agriculture, Ecosystems & Environment 36:37-50. [ Links ]
Merola-Zwartjes, M. y J.P. DeLong. 2005. Avian species assemblages on New Mexico golf courses: surrogate riparian habitat for birds? Wildlife Society Bulletin 33:435-447. [ Links ]
Moguel, P. y V.M. Toledo. 1999. Biodiversity conservation in traditional coffee systems of Mexico. Conservation Biology 13:11-21. [ Links ]
Moonen, A.C. y P. Bàrberi. 2008. Functional biodiversity: an agroecosystem approach. Agriculture, Ecosystems and Environment 127:7-21. [ Links ]
Parrish, D.J. y T.W. Sherry. 1994. Sexual habitat segregation by american redstarts wintering in Jamaica: importance of resource seasonality. The Auk 111:39-49. [ Links ]
Peña-Jiménez, A., L. Durand-Smith y C. Álvarez-Echegaray. 1998. Conservación. Pp. 183-210. In: CONABIO. La diversidad biológica de México: Estudio de País, 1998. Comisión Nacional para el Conocimiento y uso de la Biodiversidad. México, DF. [ Links ]
Perfecto, I. y J. Vandermeer. 2008. Biodiversity conservation in tropical agroecosystems: a new conservation paradigm. Annals of the New York Academy of Sciences 1134:173-200. [ Links ]
Pettingill, O.S., Jr. 1970. Ornithology in the laboratory and field. Burguess Publishing Company. Minnesota, EUA. [ Links ]
Salgado-Ortiz, J. 1993. Utilización de manchones de vegetación secundaria en áreas de agostadero por una comunidad de aves. Tesis de licenciatura, Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Michoacán, México. [ Links ]
Salgado-Ortiz, J. 2000. Slash-and-burn disturbance and patterns of avian diversity at the Calakmul Biosphere Reserve, Campeche, Mexico: the conservation implications of a habitat mosaic. Tesis de maestría, Queen's University. Kingston, Ontario, Canadá [ Links ].
Schifferli, L. 2000. Changes in agriculture and the status of birds breeding in European farmland. Pp. 17-25. In: N.J. Aebischer, A.D. Evans, P.V. Grice y J.A.Vickery (eds.). Ecology and conservation of lowland farmland birds. British Ornithologists' Union. Norwich, Reino Unido. [ Links ]
SEMARNAT (Secretaría de Medio Ambiente y Recursos Naturales). 2010. Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección Ambiental — Especies nativas de México de flora y fauna silvestres — Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio — lista de especies en riesgo. Diario Oficial de la Federación. 30 de diciembre de 2010, Segunda Sección. México, DF. [ Links ]
Smith, A.L., J. Salgado-Ortiz y R.J. Robertson. 2001. Distribution patterns of migrant and resident birds in successional forests of the Yucatan Peninsula, Mexico. Biotropica 33:153-170. [ Links ]
Sotelo, E., N. Cardona, A. Fregoso, C. Enríquez, A. Garrido, G. Caire y H. Cotler. 2005. Acciones estratégicas para la recuperación de la cuenca Lerma-Chapala: recomendaciones técnicas para las diecinueve subcuencas. Instituto Nacional de Ecología. México, DF. [ Links ]
Soto-Rojas, O. 2005. Avifauna de la presa La Mintzita, municipio de Morelia, Michoacán, México. Tesis de licenciatura, Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Michoacán, México. [ Links ]
Thrupp, L.A. 2000. Linking agricultural biodiversity and food security: the valuable role of agrobiodiversity for sustainable agriculture. International Affairs 76:265-281. [ Links ]
Tilman, D., J. Fargione, B. Wolff, C. D'Antonio, A. Dobson, R. Howarth, D. Schindler, W.H. Schlesinger, D. Simberloff y D. Swakhamer. 2001. Forecasting agriculturally driven global environment change. Science 292:281-284. [ Links ]
Tilman, D., K.G. Cassman, P.A. Matson, R. Naylor y S. Polasky. 2002. Agricultural sustainability and intensive production practices. Nature 418:671-677. [ Links ]
Torres-Hernández, R.M. 1998. Distribución de las aves migratorias terrestres del estado de Michoacán, México. Tesis de licenciatura, Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Michoacán, México. [ Links ]
Tscharntke, T., A.M. Klein, A. Kruess, I. Steffan-Dewenter y C. Thies. 2005. Landscape perspectives on agricultural intensification and biodiversity-ecosystem service management. Ecology Letters. 8:857-874. [ Links ]
Vance, D.R. 1976. Changes in land use and wildlife populations in southeastern Illinois. Wildlife Society Bulletin 4:11-15. [ Links ]
Velázquez, A., N. Sosa, J.A. Navarrete y A. Torres. 2005. Programa de Conservación para el Estado de Michoacán 2003-2008. Bases para la Conformación del Sistema de Áreas de Conservación del Estado de Michoacán. SUMA, UNAM. Morelia, Michoacán, México. [ Links ]
Villaseñor-Gómez, J.F. 2009. Habitat use of wintering bird communities in Sonora, México: the importance of riparian habitats. Studies in Avian Biology 37:53-68. [ Links ]
Villaseñor-Gómez, J.F. y R.L. Hutto.1995. The importance of agricultural areas for the conservation of neotropical migratory landbirds in western México. Pp. 59-80. In: M. Wilson y S. Sader (eds.). Conservation of Neotropical Migratory Birds in Mexico. Maine Agricultural and Forest Experiment Station Miscellaneous Publication 727. University of Montana. Missoula, Montana EUA. [ Links ]
Villaseñor-Gómez, J.F., L.E. Villaseñor-Gómez y G. Chavez-León. 2000. AICA 2 Cuitzeo. Pp. 359-359. In: M.C. Arizmendi y L. Márquez-Valdelamar (eds.). Áreas de Importancia para la Conservación de las Aves en México. CIPAMEX (Sociedad para el Estudio y Conservación de las Aves en México), CONABIO. México, D.F. [ Links ]
Warkentin, I.G., R. Greenberg y J. Salgado-Ortiz. 1995. Songbird use of gallery woodlands in recently cleared and older settled landscapes of the Selva Lacandona, Chiapas, Mexico. Conservation Biology 9:1095-1106. [ Links ]
Wunderle, J.M., Jr. 1995. Métodos para contar aves terrestres del Caribe. U.S. Department of Agriculture, Forest Service, Southern Forest Experiment Station. New Orleans, Louisiana, EUA. [ Links ]
Zuria, I. y J.E. Gates. 2013. Community composition, species richness, and abundance of birds in field margins of central Mexico: local and landscape-scale effects. Agroforestry Systems 87:377-393. [ Links ]














