Casos clínicos
Diarrea crónica como manifestación inicial de mutación en TNFSF13B
Chronic diarrhea as the initial manifestation of TNFSF13B mutation
1 Servicio de Inmunología Clínica y Alergia. Centro Médico Nacional 20 de Noviembre, Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado. México.
2 Servicio de Inmunología Clínica y Alergia. Centro Médico Nacional 20 de Noviembre, Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado. México. ORCID: https://orcid.org/0000-0002-5249-2727.
3 Servicio de Pediatría. Hospital de Ginecología y Obstetricia 3A, Instituto Mexicano del Seguro Social. México. ORCID: https://orcid.org/0000-0002-6515-7573.
4 Servicio de Inmunología Clínica y Alergia. Centro Médico Nacional 20 de Noviembre, Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado. México. ORCID: https://orcid.org/0000-0002-7556-5810.
5 Servicio de Inmunología Clínica y Alergia. Centro Médico Nacional 20 de Noviembre, Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado. México. ORCID: https://orcid.org/0000-0002-6620-6322.
Resumen:
Introducción:
la inmunodeficiencia común variable se clasifica en el grupo III de IX, donde se incluyen las inmunodeficiencias con predominio de deficiencia de anticuerpos. La mutación en el gen TNFSF13B es responsable de codificar la proteína TACI y provoca una expresión clínica variable que acompaña a la enfermedad.
Reporte de caso:
paciente femenino de 25 años de edad que inicia padecimiento desde el nacimiento, estudiada por diarrea crónica sin etiología definida; al agudizarse la sintomatología presenta evacuaciones disminuidas en consistencia y rectorragia. Se realiza el diagnóstico de inmunodeficiencia común variable y se inicia el tratamiento de sustitución con inmunoglobulina intravenosa a dosis de sustitución cada cuatro semanas con mejoría clínica. En la secuenciación de ADN de siguiente generación (NGS) de exoma completo se identifica una variante en TNFRSF13B en el exón 3 c.310T>C; p.cys104Arg.
Conclusiones:
la presentación clínica de la inmunodeficiencia común variable es diversa. Dentro del estudio clínico de un paciente con la sospecha de esta enfermedad es primordial tomar en cuenta la presencia y evolución de los síntomas gastrointestinales. El diagnóstico molecular de los errores innatos de la inmunidad contribuye a esclarecer la fisiopatología de este grupo de enfermedades.
Palabras clave: inmunodeficiencia común variable; diarrea; hipogammaglobulinemia
Abstract:
Introduction:
the common variable immunodeficiency is classified in group III of IX, which includes immunodeficiencies with a predominance of antibody deficiency. It is known that the mutation in the TNFSF13B gene, responsible for encoding the TACI protein, causes a variable clinical expression that accompanies the disease.
Case report:
a 25-year-old female patient, who started her condition from birth, was studied for chronic diarrhea without a definite etiology; the symptomatology was worsened by presenting decreased stools in consistency. The common variable immunodeficiency was made, and replacement therapy with intravenous immunoglobulin G was initiated every four weeks with significant clinical improvement. Next-generation DNA sequencing (NGS) of complete DNA exome was realized with a variant identification in TNFRSF13B, in exon 3 c.310T> C; p.cys104Arg.
Conclusions:
the clinical presentation of the shared variable immunodeficiency is diverse; within the clinical study of a patient suspected of this disease, it is essential to consider the presence and evolution of gastrointestinal symptoms. The molecular diagnosis of innate immunity errors helps clarify the pathophysiology of this group of diseases.
Keywords: common variable immunodeficiency; diarrhea; hypogammaglobinemia
Introducción
Las inmunodeficiencias primarias son un grupo de enfermedades que ocurren por mutaciones genéticas. En nuestros días se prefiere utilizar el término errores innatos de la inmunidad para su referencia en las clasificaciones fenotípicas.1 La inmunodeficiencia común variable (IDCV) se clasifica en el grupo III de errores innatos de la inmunidad en la clasificación de la Unión Internacional de Sociedades Inmunológicas.2 Se conoce que la mutación en el gen TNFSF13B, responsable de codificar la proteína TACI (transmembrane activator and calcium-modulator and cytophilin ligand interactor), provoca una expresión clínica variable que acompaña a la IDCV; la proteína TACI activa el cambio de isotipo de inmunoglobulinas.3 Presentamos el caso clínico de una paciente de 25 años de edad que inició con manifestaciones gastrointestinales desde el nacimiento, en quien se sospechó IDCV por los hallazgos de la colonoscopia.
Reporte del caso
Paciente femenino de 25 años de edad, originaria y residente de Hermosillo, Sonora, México. Inició padecimiento desde el nacimiento con infecciones respiratorias recurrentes en número mayor de ocho en un año, sin presentar infecciones respiratorias graves. Se estudió por diarrea crónica sin etiología definida por gastroenterología, en mayo de 2012 se agudizó la sintomatología al presentar evacuaciones disminuidas en consistencia hasta en 15 eventos al día, dolor epigástrico y rectorragia. Gastroenterología descartó enfermedad celíaca. Inmunología realizó estudios complementarios donde se reportó hipogammaglobulinemia (Tabla 1). Se diagnosticó IDCV e inició el tratamiento con inmunoglobulina intravenosa (400-600 mg/kg) cada cuatro semanas con mejoría clínica completa. Los resultados de la secuenciación de ADN de siguiente generación (NGS) identificaron una variante en TNFRSF13B en el exón 3 c.310T>C; p.cys104Arg. Variante heterocigota clasificada como patogénica y con tipo de herencia autosómica dominante. Actualmente la paciente continúa con aplicación de inmunoglobulina intravenosa en su lugar de residencia, acude a valoración de forma semestral.
Tabla 1: Estudios inmunológicos de la paciente acorde a la evolución.
|
|
22 de mayo de 2012 |
21 de junio de 2019 |
| Inmunoglobulina (mg/dL) |
G |
580 (700-1,600) |
1,050 |
|
A |
23.1 (70-400) |
28.0 |
|
M |
64.9 (40-230) |
88.3 |
| Linfocitos (cel/μL) |
CD3+ |
1,704 (690-2,540) |
1,763 |
|
CD4+ |
977 (410-1,590) |
1,126 |
|
CD8+ |
685 (190-1,140) |
594 |
|
CD16/56+ |
103 (90-590) |
116 |
|
CD19+ |
738 (90-660) |
605 |
Resultados de laboratorio antes y después del tratamiento con inmunoglobulina G intravenosa. Es evidente la mejoría de los niveles de inmunoglobulina G. No se espera mejoría en los niveles de inmuno-globulina A, ya que ésta no se administra como parte del tratamiento.
Conclusión
Las manifestaciones iniciales de la IDCV son diversas, es necesario sospecharla en pacientes con manifestaciones atípicas que pudieran simular enfermedad inflamatoria intestinal. En el caso de la paciente, la sospecha de una inmunodeficiencia primaria por la falta de respuesta a tratamiento médico fue primordial para el diagnóstico. La paciente había presentado desde el inicio del padecimiento diarrea crónica y rectorragia sin etiología identificada, esta forma de presentación clínica ha sido documentada en diversos reportes de caso con IDCV, algunos con lesiones polipoides en íleon terminal y otros con inflamación inespecífica en colon; el inicio de la enfermedad es en la mayoría de los casos en la vida adulta.4
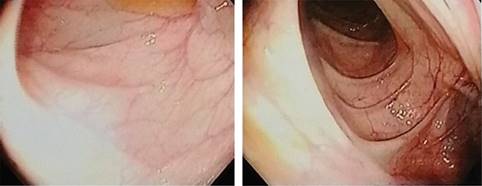
El tratamiento amerita la administración de inmunoglobulina intravenosa cada tres a cuatro semanas a dosis de 400-600 mg/kg, con el cual hay mejoría clínica.5 Los hallazgos de la colonoscopia mostraron hiperplasia nodular linfoide, que no se reporta con frecuencia como hallazgo en esta enfermedad. Los cambios en la mucosa del colon se ilustran en las Figuras 1 y 2.
En este caso se identificó mutación heterocigota, estos hallazgos son relevantes para poder ofrecer a la paciente consejo genético oportuno por la característica hereditaria de esta enfermedad.
Referencias bibliográficas
1. Bousfiha A, Jeddane L, Picard C, Ailal F, Bobby Gaspar H, Al-Herz W et al. The 2017 IUIS phenotypic classification for primary immunodeficiencies. J Clin Immunol. 2018; 38 (1): 129-143. doi: 10.1007/s10875-017-0465-8.
[ Links ]
2. Picard C, Bobby Gaspar H, Al-Herz W, Bousfiha A, Casanova JL, Chatila T et al. International Union of Immunological Societies: 2017 primary immunodeficiency diseases committee report on inborn errors of immunity. J Clin Immunol. 2018; 38 (1): 96-128. doi: 10.1007/s10875-017-0464-9.
[ Links ]
3. Lee JJ, Ozcan E, Rauter I, Geha RS. Transmembrane activator and calcium-modulator and cyclophilin ligand interactor mutations in common variable immunodeficiency. Curr Opin Allergy Clin Immunol. 2008; 8 (6): 520-526. doi: 10.1097/ACI.0b013e3283141200.
[ Links ]
4. Odetola O, Ananthanarayanan V. Gastrointestinal presentations of common variable immunodeficiency: hiding in plain sight. Arch Pathol Lab Med. 2019; 143 (4): 525-530. doi: 10.5858/arpa.2017-0372-RS.
[ Links ]
5. Ezzaitouni F, Thiyfa Y, Tahiri M, Haddad F, Hliwa W, Bellabah A et al. Common variable immune deficiency lately revealed by gastrointestinal problems: about a case. Pan Afr Med J. 2017; 28 (1): 48. doi: 10.1182/blood.2019002062.
[ Links ]












 nueva página del texto (beta)
nueva página del texto (beta)