Introducción
La enfermedad renal crónica (ERC) es una condición frecuente en México con una prevalencia aproximada de 10.2% (7.7-13.0%), se ha asociado a incremento en la mortalidad, dificultad en el acceso a la atención médica y guarda una estrecha relación con otros factores de riesgo comunes en nuestro país como obesidad, diabetes mellitus tipo 2, hipertensión y síndrome metabólico.1-3
Un síntoma frecuente y poco reconocido en pacientes con ERC es el prurito, especialmente en etapas avanzadas de la enfermedad en sujetos en tratamiento con terapia de reemplazo renal (TRR), ya sea hemodiálisis (HD) o diálisis peritoneal (DP).4,5 La etiología del prurito urémico es multifactorial, podría involucrar mecanismos como inflamación local, hiperparatiroidismo y alteraciones en el metabolismo mineral, elevación de sustancia P, acumulación de toxinas urémicas en piel y terminales nerviosas, xerosis y daño microvascular, lo que afecta la piel y sus Anexos, y su fisiopatología es compleja.6,7
Estudios previos realizados en América y otras poblaciones han descrito una prevalencia aproximada de 63-72% de prurito. Además, estas cohortes de sujetos en TRR por DP y HD han investigado factores de riesgo para prurito, gravedad del prurito, así como otros aspectos psicosociales, la topografía, el efecto del prurito sobre la calidad de vida y el horario de presentación.8-10 Sin embargo, los estudios en México sobre el comportamiento del prurito son escasos11 y la información sobre el efecto de variables como el índice de masa corporal (IMC), la edad, variables clínicas y bioquímicas de la ERC y su relación con la gravedad y la afección de la calidad del sueño es desconocida. Por lo que realizamos este estudio para describir el papel de estos factores y su impacto sobre la gravedad y características del prurito en pacientes con ERC en TRR del Hospital General de México.
Material y métodos
Diseñamos un estudio descriptivo, transversal que reunió datos de pacientes ambulatorios evaluados en la consulta externa del departamento de hemodiálisis y diálisis peritoneal del servicio de nefrología del Hospital General de México durante agosto a septiembre de 2018. Se tomaron variables clínicas y demográficas, IMC por la fórmula de Quetelet,12 estudios de laboratorio y preguntas sobre la presencia y características del prurito durante las cuatro semanas previas a la evaluación. Las características evaluadas incluyeron intensidad con la escala visual análoga (EVA) del 0-10, frecuencia de alteraciones en el sueño mediante la escala de Likert y la frecuencia de despertares. Las características psicosociales evaluadas fueron el impacto sobre la convivencia y el rendimiento laboral. Se excluyeron a pacientes con requerimientos de diálisis de urgencia. Todos los pacientes firmaron un consentimiento informado y el estudio fue aprobado por el comité de bioética de la institución.
Análisis estadístico: utilizamos estadística descriptiva con medidas de tendencia central y de dispersión; las variables categóricas fueron expresadas como medidas de frecuencia absoluta y relativa y las variables lineales como media y desviación estándar (DE); para las variables con distribución normal o medianas con rangos intercuartílicos (RIQ) de acuerdo al tipo de distribución de frecuencias. Las variables numéricas fueron comparadas con la prueba t de Student para muestras independientes o la de U de Mann-Whitney de acuerdo con las características de la distribución. Las variables fueron comparadas con χ2 o prueba exacta de Fisher. La medida de fuerza de asociación para estudios trasversales con Odds Ratio (OR) con intervalos de confianza del 95%. El análisis multivariado incluyó la construcción de modelos de regresión logística binaria en el que la variable dependiente fue la presencia de prurito con un puntaje de EVA > 6 puntos. Un error alfa ajustado menor de 5% a dos colas fue considerado significativo. El paquete estadístico fue STATA SE v 11.0.
Resultados
Se incluyeron datos de 99 pacientes, 60.6% fue del sexo masculino y 39.4% del femenino. La edad promedio fue de 44.9 ± 4.2 años. El IMC fue de 24 ± 4.2 kg/m2. Sesenta y cinco punto siete por ciento se encontraba en hemodiálisis y 34.3% en diálisis peritoneal. La mediana del tiempo de evolución de la ERC fue de 13 meses (RIQ 6-36) y para el tiempo en terapia de sustitución fue de 5 meses (RIQ 1-15). Del total de los pacientes incluidos encontramos una prevalencia de 81% de aquellos que clínicamente tuvieron como síntomas rascado en 75.8% y xerosis en 77.9%. La intensidad por EVA del prurito tuvo un promedio de 4.5 ± 2.9 puntos. Recibieron tratamiento específico para el prurito con emolientes 49.5%, con antihistamínicos 2% y con gabapentina 1%. Las características demográficas y clínicas completas se muestran en la Tabla 1.
Tabla 1: Características clínicas de pacientes con prurito. N = 99.
| n (%) | |
|---|---|
| Edad (años) | 44.9 ± 4.2 |
| Sexo | |
| Masculino | 60 (60.6) |
| Femenino | 39 (39.4) |
| Índice de masa corporal, kg/m2 | 24 (4.2) |
| Etiología de la enfermedad renal crónica | |
| Diabetes | 48 (48.5) |
| HAS | 16 (16.2) |
| ERPA | 2 (2.0) |
| GMN | 2 (2.0) |
| Vasculitis | 1 (1.0) |
| Desconocida | 26 (26.3) |
| Otras | 4 (4.0) |
| Frecuencia de prurito a la semana (días) | |
| Sin prurito | 17 (17.2) |
| 1-2 | 23 (23.2) |
| 3-4 | 24 (24.2) |
| 5-6 | 3 (3.0) |
| 7 | 31 (31.3) |
| Topografía | |
| No especificado | 6 (6.1) |
| Generalizado | 5 (5.1) |
| Diseminado | 55 (55.6) |
| Localizado | 21 (21.2) |
| Características de las excoriaciones | |
| Sin excoriaciones | 2 (2.0) |
| Excoriaciones superficiales | 53 (53.5) |
| Excoriaciones profundas | 32 (32.3) |
| Frecuencia de afección del sueño | |
| Nunca | 65 (65.7) |
| Rara vez | 4 (4.0) |
| A veces | 14 (14.1) |
| Casi siempre | 4 (4.0) |
| Siempre | 1 (1.0) |
| Rara vez | 1 (1.1) |
| A veces | 2 (2.3) |
| Frecuencia de afección laboral | |
| Nunca | 84 (84.8) |
| Rara vez | 3 (3.0) |
| Casi siempre | 1 (1.0) |
HAS = hipertensión, ERPA = enfermedad renal poliquística autosómica, GMN = glomerulonefritis.
Identificamos un patrón de mayor intensidad sin alcanzar diferencias significativas en la EVA de intensidad del prurito medido de forma lineal a medida que aumentan la edad (p = 0.14) y el IMC (p = 0.34), con una prevalencia que oscila entre 76.2 a 88.9%, y sin diferencias al comparar entre los grupos etarios (p = 0.83) o grupos del IMC (p = 0.44). Estas comparaciones se detallan en las Figuras 1 a 3. Las variables asociadas a prurito grave fueron la edad (42.4 vs 49.7, p = 0.021), el peso (61.2 vs 66.7, p = 0.05) y el IMC (23.8 vs 25.9, p = 0.019) (Figura 3). Por otro lado, no se observó correlación entre las variables que miden intensidad y frecuencia de prurito y los estudios de laboratorio. La comparación de las variables relevantes, incluidos los resultados de laboratorio, se detallan en la Tabla 2. El análisis multivariado reveló que las variables asociadas a prurito grave fueron la presencia de prurito diseminado OR = 17.2 (IC95% 1.039-286.6, p = 0.047), IMC ≥ 24 OR = 3.37 (IC95% 1.008-11.29, p = 0.049), despertares OR = 10.9 (IC95% 2.21-53.87, p = 0.003) (Tabla 3).
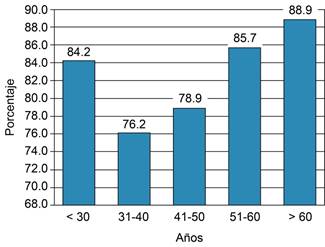
Figura 1: Comparación entre la proporción de pacientes con prurito entre los diferentes grupos etarios. Al comparar los porcentajes entre los diferentes grupos no se encontraron diferencias significativas (p = 0.83).

Figura 2: Comparación entre la proporción de pacientes con prurito entre los grupos estratificados por índice de masa corporal. Al comparar los porcentajes entre los diferentes grupos no se encontraron diferencias significativas (p = 0.34).
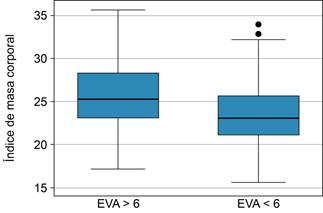
Figura 3: Comparación del índice de masa corporal entre los grupos divididos de acuerdo con la intensidad del prurito medido por escala visual análoga en > 6 vs < 6, con un resultado de 23.8 vs 25.9, (p = 0.019).
Tabla 2: Comparación entre sujetos con prurito estratificado por intensidad.
| EVA ≤ 6 (n = 65) | EVA > 6 (n = 34) | ||
|---|---|---|---|
| n (%) | n (%) | p | |
| Características generales | |||
| Edad | 42.4 ± 15.1 | 49.7 ± 13.8 | 0.021 |
| Femenino | 23 (35.4) | 16 (47.1) | 0.250 |
| Índice de masa corporal | 23.8 (4.1) | 25.9 (4.2) | 0.019 |
| Tiempo en ERC | 24.2 (36.3) | 39.6 (49.7) | 0.083 |
| Hemodiálisis | 45 (69.2) | 20 (58.8) | 0.300 |
| Tiempo en TTR | 13.5 (24.8) | 14.1 (18.6) | 0.900 |
| Tratamiento de prurito | |||
| Antihistamínicos | 0 (0.0) | 2 (5.9) | 0.048 |
| Emolientes | 28 (43.1) | 21 (61.8) | 0.077 |
| Gabapentina | 0 (0.0) | 1 (2.9) | 0.160 |
| Estudios de laboratorio | |||
| Urea, mg/dL | 170.9 ± 87.1 | 173.1 ± 71.1 | 0.450 |
| Creatinina, mg/dL | 11.7 ±.8 | 11.5 ± 5.0 | 0.900 |
| Sodio, mEq/L | 133.6 ± 15.6 | 135.6 ± 2.9 | 0.910 |
| Potasio, mEq/L | 5.1 ± 1.4 | 4.8 ± 1.1 | 0.470 |
| Cloro, mEq/L | 101.1 ± 5.2 | 100.3 ± 5.8 | 0.350 |
| Fósforo, mg/dL | 5.9 ± 2.0 | 6.3 ± 2.8 | 0.480 |
| Calcio, mg/dL | 7.9 ± 1.0 | 8.0 ± 1.5 | 0.450 |
| Parathormona, ng/dL | 844.4 ± 781.8 | 877.8 ± 439.1 | 0.800 |
ERC = enfermedad renal crónica, TTR = terapia de reemplazo renal.
Tabla 3: Factores asociados a la presencia de prurito grave*.
| OR (IC 95%) | p | |
|---|---|---|
| Prurito diseminado | 17.26 (1.039-286.6) | 0.047 |
| Edad ≥ 46 años | 1.54 (0.399-5.9) | 0.53 |
| Índice de masa corporal ≥ 24 kg/m2 | 3.37 (1.008-11.29) | 0.049 |
| Excoriaciones | 2.83 (0.823-9.74) | 0.09 |
| Xerosis | 0.67 (0.120-3.78) | 0.65 |
| Despertares | 10.92 (2.21-53.87) | 0.003 |
| Sexo masculino | 0.44 (0.131-1.48) | 0.18 |
| Urea ≥ 150 mg/dL | 2.89 (0.772-10.82) | 0.11 |
| Fósforo ≥ 7 mg/dL | 2.16 (0.560-8.37) | 0.26 |
*Análisis realizado por regresión logística binaria multivariada con variable dependiente de prurito intensidad con EVA > 6.
Discusión
Presentamos un estudio epidemiológico que explora las características, frecuencia e intensidad del prurito urémico y sus posibles asociaciones con variables clínicas y bioquímicas en pacientes en TRR. Nuestro trabajo explora variables no previamente abordadas en estudios realizados en México. Un trabajo similar realizado anteriormente en el Hospital General de México logró demostrar que el prurito está asociado al deterioro de la calidad de vida medida por DLQI con un coeficiente de correlación de Pearson (r) = 0.47, CI 0.36-0.57, (p < 0.0001).11 Por otro lado, otro estudio realizado en Perú no describió la presencia o la gravedad del prurito definida como una EVA > 7 con el deterioro de la calidad de vida, pero sí con la presencia de hiperfosfatemia con una ratio de prevalencia (PR) de 1.71, (IC95% 1.09-267) y el uso de antihistamínicos PR = 2.48 (IC95% 1.56-3.94) sin existir un papel asociado con el tiempo de tratamiento con la TTR.8
Los hallazgos de nuestra investigación revelaron que los pacientes con prurito grave requieren tratamiento con mayor frecuencia y a pesar de no incluir la medición de la calidad de vida con un instrumento validado para dicho propósito, nuestros datos revelan que el prurito impacta sobre los factores psicosociales de los pacientes; sin embargo, no logramos demostrar una diferencia con respecto a los parámetros bioquímicos relacionados con la eficiencia de la diálisis. Las teorías que explican el origen del prurito en pacientes con TRR son diversas. De forma clásica derivada de estudios realizados hace más de cuatro décadas, la teoría con mayor aceptación que explica el origen del prurito propone un mecanismo de lesión directa en los tejidos inducida por anemia, hiperparatiroidismo, acumulación de urea, hiperfosfatemia y neurotransmisores a nivel local como la sustancia P,7,13 dicha teoría se ha reafirmado en protocolos de diálisis de alta eficiencia con mejoría de prurito con una Kt/V ≥ 1.5 que redujo la intensidad del prurito en pacientes en TRR con HD.14 No obstante, la evidencia con respecto a la modalidad y la eficiencia de la misma es contradictoria y podría explicarse por fenómenos adicionales a la TRR.8,15,16 Dado lo anterior, hoy en día la evidencia sugiere que existen mecanismos fisiopatológicos adicionales, como en un estudio realizado por Kimmel y colaboradores, en el que se dieron a la tarea de investigar la diferenciación de linfocitos Th1 y las citocinas intracelulares y plasmáticas en pacientes en TRR vs controles sin prurito, dicha investigación reveló que los pacientes con prurito urémico eran similares en características clínicas generales, pero presentaron un fenotipo de citocinas diferente a los controles, caracterizado por una mayor proporción de linfocitos Th1 y también marcadores de inflamación y citocinas relacionadas como proteína C reactiva, interleucina 6, así como receptores CXCR3 en este grupo de pacientes, concluyendo que este fenómeno no ocurre únicamente como un fenómeno bioquímico de lesión directa como se pensaba antes, sino más bien podría ser una manifestación clínica que ocurre en el contexto de inflamación sistémica crónica.6 Otro trabajo propuso la participación de la interleucina 31 y la proteína C reactiva en pacientes en TRR con HD.17
Por último, dado el contexto específico en el que realizamos nuestra investigación, es posible que otros mecanismos no tradicionales pudieran estar involucrados, es bien sabido que en México la obesidad es un factor con alta prevalencia y en pacientes con ERC se ha documentado la participación de la obesidad como un factor importante en el desarrollo de inflamación sistémica en estos pacientes; además, existe una línea de investigación nueva que explora la posible participación del adipocito como un protagonista dentro de la compleja interacción entre inflamación sistémica y ERC, así nuevas estrategias encaminadas a la investigación de la activación de la AMP quinasa, la función oxidativa del NADPH y el factor de crecimiento transformante β podrían significar que el riñón y el adipocito comparten dicha cascada inflamatoria y estrés oxidativo y finalmente podrían explicar, al menos en parte, la fibrosis renal en ERC.18,19 Nuestros resultados podrían sustentarse entonces en la premisa de un mecanismo complejo y multifactorial que va mucho más allá de los resultados de laboratorio que son una variable subrogada de la eficiencia de la diálisis, el estado de la PTH revela la posible participación de un factor adicional recientemente descrito atribuible a la obesidad y otro factor suficiente, aunque no necesario, relacionado con la edad. Nuestra población tiene además algunas particularidades ligadas a la idiosincrasia de los pacientes atendidos en nuestro centro, donde habitualmente por tratarse de una institución pública de concentración que reúne a pacientes de todo el país se compone de pacientes sin acceso a seguridad social y en una situación socioeconómica vulnerable, lo cual se ha explorado en estudios previos en México.2 Dicho factor socioeconómico no está descrito como una variable de riesgo para prurito; sin embargo, la marginación social podría asociarse lógicamente con una menor búsqueda de atención médica para un síntoma que desde el punto de vista de un paciente de escasos recursos podría parecer irrelevante. No obstante, a pesar de ser un síntoma poco reconocido, ignorado o incluso desconocido desde el punto de vista epidemiológico,5 se ha demostrado que éste es grave y se correlaciona con variables como la depresión, la calidad del sueño y la calidad de vida medida por instrumentos como EQ5-D, PHQ-9 y DLQI, los cuales en conjunto sí se han asociado a mal pronóstico en cohortes prospectivas de pacientes con ERC,20,21 por lo que su diagnóstico y tratamiento podría tener un impacto sobre la mortalidad y la calidad de vida de los pacientes con ERC.9,22
Dado lo anterior, podríamos proponer que las fortalezas de nuestro trabajo son la identificación de factores de riesgo para la gravedad del prurito urémico, así como aumentar la información disponible en México; no obstante, tenemos limitaciones relacionadas con el diseño, al ser transversal y no abordar el efecto del tratamiento sobre las variables analizadas de la calidad de sueño y los factores psicosociales. Estudios ulteriores longitudinales, o incluso ensayos clínicos, podrían responder las interrogantes que sobrepasan los objetivos de nuestro trabajo.
Conclusiones
El prurito urémico es una entidad muy frecuente y poco reconocida en pacientes con ERC en TTR. Su fisiopatología es compleja y podría involucrar mecanismos recientemente descritos como inflamación sistémica y obesidad. Adicionalmente, el tratamiento del prurito podría mejorar la calidad de vida, la calidad del sueño y mejorar el pronóstico de estos pacientes, por lo que el tratamiento del prurito urémico es un área de investigación en continuo desarrollo.











 nueva página del texto (beta)
nueva página del texto (beta)


