Introducción
Las malformaciones arteriovenosas pulmonares (MAVP) son comunicaciones de los sistemas arterial y venoso pulmonar.1 La primera descripción de las MAVP fue realizada en 1897 por Churton, quien describió los hallazgos post mortem de un niño de 12 años con MAVP bilateral.2
Las MAVP son infrecuentes; la incidencia es dos o tres casos por cada 100,000 habitantes, y son más frecuentes en el género femenino (relación 2:1). Entre 65 y 70% se presentan en pacientes con telangiectasia hemorrágica hereditaria o enfermedad de Rendu-Osler-Weber (EROW).1
Las formas más frecuentes (85%) consisten en comunicaciones únicas entre una arteria aferente y una vena eferente. En ningún caso existe territorio capilar entre ambas estructuras. La mayoría de los pacientes presentan MAVP múltiples, de tamaño variable, localizadas generalmente en los lóbulos inferiores.3
En la etapa embrionaria, las conexiones primitivas se desarrollan a modo de diminutas fístulas arteriovenosas; más adelante, se forman septos vasculares entre las circulaciones arterial y venosa, los cuales establecerán el lecho capilar. Las MAVP se configurarían por el incompleto desarrollo de los septos vasculares.
Las MAVP pueden ser congénitas, producidas por el desarrollo incompleto de los septos vasculares, o no congénitas, asociadas a cirugía torácica, traumatismos, actinomicosis, esquistosomiasis, cirrosis y metástasis pulmonares.4
Caso clínico
Paciente femenino de 54 años, la cual contaba con antecedente de nódulos pulmonares observados en un estudio topográfico de control por diagnóstico de neumonía siete meses atrás; en el momento de su ingreso presentaba una pérdida de peso no intencional de 8 kg en seis meses, sin más síntomas agregados.
Se realizó una tomografía computarizada en fase simple y contrastada, donde se identificaron nódulos pulmonares en el lóbulo medio, los cuales, tras la administración del material de contraste endovenoso, mostraron un realce ávido, hasta alcanzar 280UH en la fase arterial (Figura 1); se observó la continuidad con estructuras vasculares arteriales y venosas subsegmentarias del segmento lateral del lóbulo medio del pulmón derecho (Figura 2). El resto del estudio fue de características normales.
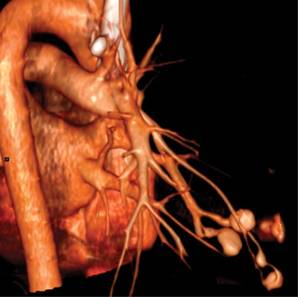
Figura 1: Vista posterior, con reconstrucción en 3D de tomografía en fase arterial, donde se observa la formación de trayectos dilatados y tortuosos que asocian arterias subsegmentarias del lóbulo medio con venas subsegmentarias de la vena pulmonar superior derecha.
Discusión
Muchos pacientes portadores de esta patología son asintomáticos; otros pueden presentar síntomas como disnea, cianosis y hemoptisis. Más de 70% de las MAVP están relacionadas con el síndrome hereditario de telangiectasias hemorrágicas, también conocido por síndrome de Rendu-Osler-Weber.5
Las MAVP se clasifican en dos grupos
Simples: con una sola arteria aferente y una vena eferente. El lecho venoso suele estar dilatado, con morfología fusiforme o aneurismática. Son las formas más frecuentes (hasta un 80% de total). La embolia paradójica se observa en este tipo de MAVP.
Complejas: con una o más arterias aferentes y un sistema venoso de drenaje muy desarrollado y complejo. Existe un sistema de canales vasculares interpuestos entre las arterias y las venas.
siguientes criterios
Medición de la fracción de derivación y gasometría arterial. Una SaO2 < 96% y una PaO2 < 85 mmHg se correlacionan con una fracción de derivación > 5%.3
Radiografía de tórax. Más de 95% de los pacientes muestran alteraciones radiológicas. La más frecuente es la presencia de un nódulo periférico bien definido, no calcificado y unido a estructuras hiliares (sensibilidad y especificidad de 92 y 83%, respectivamente).5
Tomografía computarizada. Combinada con la reconstrucción 3D puede proporcionar información no sólo de la MAVP, sino también del número y tamaño de los vasos aferentes y eferentes.
Arteriografía pulmonar. Constituye el “estándar de oro”. Establece el diagnóstico definitivo por su alta sensibilidad y especificidad. Ha de realizarse arteriografía selectiva y en varias proyecciones para obtener la correcta visualización de la lesión con sus vasos aferentes y eferentes.3,6
Entre los diagnósticos diferenciales por imagen podemos encontrar a los vasos sistémicos anormales, masas parenquimatosas altamente vascularizadas, otras lesiones arteriales o venosas pulmonares congénitas o adquiridas (por ejemplo, las várices pulmonares), broncoceles.7 Es aquí donde recae la importancia de la tomografía computarizada; de ser posible, contar con la angiotomografía, realizando la reconstrucción 3D. Ante la persistencia de sospecha diagnóstica y de no contar con el método de estudio ya mencionado, se debe continuar la evaluación mediante la arteriografía pulmonar como antes se describió,8 descartando la posibilidad de que se trate de un nódulo pulmonar sólido y, a su vez, evitando hacer una biopsia, que complicaría el manejo y, por lo tanto, el tratamiento.9
La finalidad del tratamiento es la prevención de embolización paradójica y las posibles secuelas neurológicas, ya que el riesgo de un accidente cerebrovascular anual en un paciente con MAVP que presente un diámetro igual o superior a tres milímetros es de 1.5%. Asimismo, la prevención de hemoptisis masiva y el tratamiento de los síntomas derivados de la derivación derecho-izquierda, como la cianosis y la disnea, sobre todo en el ejercicio.
Desde la primera intervención, en 1940, y hasta los años setenta, la lobectomía, segmentectomía y resección o ligadura quirúrgica constituyeron el único tratamiento posible en esta patología. En la actualidad, sólo se realizan en aquellos casos donde no es posible la embolización percutánea o cuando ésta falla. Los avances tecnológicos en el desarrollo y diseño de nuevos materiales (carretes, diversas partículas de embolización, balones, guías, etcétera), junto con el perfeccionamiento de los métodos de imagen han llevado a que este tipo de tratamiento obtenga buenos resultados. El éxito inmediato de estos procedimientos en grupos entrenados supera el 95%.3
La recurrencia tras el tratamiento endovascular es alrededor de 5%, dependiendo fundamentalmente de la complejidad y el número de las lesiones.5,6
Conclusión
Las MAVP muestran un amplio espectro clínico, por lo que llegar al diagnóstico por clínica es poco frecuente; su importancia radica en las complicaciones graves que pueden presentarse; por lo tanto, ante la sospecha, se recomienda una angiotomografía y, de ser necesario, usar el recurso de las reconstrucciones 3D, para así determinar de manera correcta las características anatómicas de la lesión y dar el tratamiento más acorde, independientemente de la sintomatología.











 nueva página del texto (beta)
nueva página del texto (beta)



