Introducción
Actualmente, una de las intervenciones más importantes dentro de la anestesiología es la administración de glucocorticoides, que tiene como propósito mejorar la evolución clínica del paciente, previniendo y tratando las náuseas y vómitos postoperatorios (NVPO),1 el manejo de la vía aérea comprometida, la atenuación de la respuesta inflamatoria, analgesia, etcétera.2,3
Los glucocorticoides son derivados del cortisol, hormona producida por la corteza adrenal, esencial para la adaptación al estrés físico o emocional.4 Se clasifican por su vida media biológica: duración de la supresión de la hormona corticotropina (ACTH).
Acción corta (de ocho a 12 horas): cortisol y cortisona.
Acción intermedia (de 12 a 36 horas): prednisona, prednisolona, metilprednisolona, triamcinolona.
Acción larga (de 36 a 54 horas): dexametasona y betametasona.
La administración endovenosa de bloqueadores neuromusculares tiene como fin producir parálisis muscular; actúan a nivel de la unión neuromuscular, específicamente en el receptor de acetilcolina nicotínico (nAChR), bloqueando la transmisión del impulso nervioso y la contracción muscular.5,6 Su propósito es proveer condiciones de intubación buenas y atraumáticas, facilitando el control de la ventilación y proporcionando parálisis muscular cuando ésta es requerida durante el acto quirúrgico.7
Estos fármacos se clasifican por su mecanismo de acción en bloqueadores neuromusculares despolarizantes y no despolarizantes; por su grupo químico, en bencilisoquinolinas y aminoesteroides; por su duración de acción, en ultracorta, corta, intermedia y larga.8
El rocuronio es un bloqueador neuromuscular no despolarizante, análogo esteroide monocuaternario del vecuronio diseñado para obtener un inicio de acción rápido con una duración de acción intermedia. La DE90 (dosis requerida para producir una depresión del 90% de la transmisión neuromuscular del pulgar a la estimulación del nervio ulnar) durante la anestesia general es de aproximadamente 0.3 mg/kg de peso corporal. Las dosis estándar para intubación endotraqueal son de 0.6 mg/kg.9,10
Hoy en día, las guías de buena práctica recomiendan la monitorización neuromuscular cuando se precisa la administración de un bloqueador neuromuscular, lo que ofrece mejora en la calidad de la intubación, disminuye las lesiones en la vía aérea y mantiene un bloqueo neuromuscular adecuado, administrando la dosis mínima efectiva y evitando sobredosificación y bloqueo residual antes de la extubación de los pacientes.11
El método cuantitativo ideal para evaluar el grado de bloqueo neuromuscular (intenso, profundo, moderado) es la aceleromiografía;12,13 el músculo aductor del pulgar (AP) es el mejor estudiado como marcador de la función neuromuscular14 por medio del monitor TOF-Watch®SX (instrumento para monitorizar la transmisión neuromuscular durante la anestesia en cirugía y en unidades de cuidados intensivos mediante aceleromiografía).15
Se han analizado investigaciones anteriores en pacientes que recibieron tratamiento a largo plazo con prednisolona, en quienes la duración del bloqueo neuromuscular se redujo después de la administración de atracurio o rocuronio; también, el recibir betametasona durante varios meses antes atenuó el efecto del bloqueo neuromuscular del vecuronio. Se describieron efectos similares con metilprednisolona y dexametasona. Sin embargo, todas las investigaciones mencionadas se llevaron a cabo en pacientes que recibieron tratamiento a largo plazo con glucocorticoides.16
Esto ha llevado a la necesidad del uso de mayor número de dosis de mantenimiento del bloqueador neuromuscular (BNM) y, por consiguiente, al riesgo de presentar bloqueo residual en la recuperación postquirúrgica; también, al término precipitado del efecto del bloqueo neuromuscular, lo que desencadena como consecuencia el movimiento y la ventilación durante la cirugía, situación que aumenta el riesgo de graves lesiones anatómicas y fisiológicas.
Por todo esto, se investigó si una monodosis de dexametasona podría disminuir la duración del efecto del bloqueo neuromuscular. El objetivo fue determinar el efecto de una dosis única de dexametasona (200 μg/kg) en la duración del bloqueo neuromuscular inducido con rocuronio.
Material y métodos
Se realizó un estudio observacional, aleatorizado, longitudinal y prospectivo.
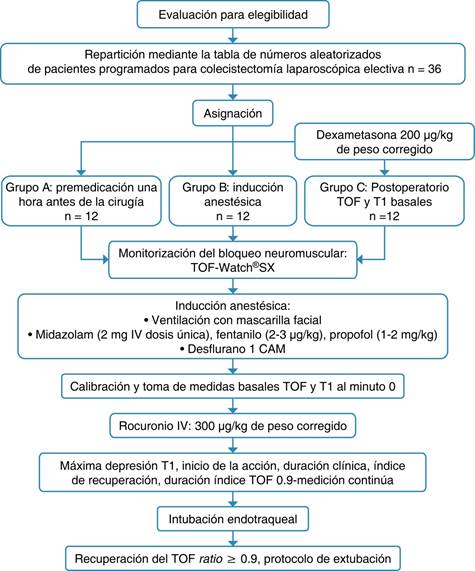
El trabajo se elaboró en los meses de noviembre de 2017 a febrero de 2018 en el Hospital Ángeles Clínica Londres, en el área de quirófano, previa aprobación de los Comités de Ética e Investigación de este hospital. El proyecto se hizo conforme con lo estipulado en el Reglamento de la Ley General de Salud en Materia de Investigación para la Salud: título segundo, capítulo I, y la Norma Oficial Mexicana NOM-012-SSA3-2012, que establece los criterios para la ejecución de proyectos de investigación para la salud en seres humanos. El tamaño de la muestra se basó en la fórmula de comparación de dos proporciones, tomando y ajustado a pérdidas del 10%, por lo que en esta investigación se conformaron tres grupos con 12 casos cada uno, teniendo un total de 36 pacientes, con un nivel alfa de 0.05, potencia de prueba de 90% y un nivel estadístico de 80%. Antes de iniciar el estudio, se obtuvo la firma del consentimiento informado de cada paciente.
Los criterios de inclusión fueron: pacientes sometidos a colecistectomía laparoscópica electiva, aquéllos sin contraindicaciones para ser sometidos a anestesia general balanceada y los agentes farmacológicos utilizados en el presente estudio, individuos con clasificación ASA I y II, pacientes con consentimiento informado debidamente firmado, sexo femenino o masculino, edad de 18 a 60 años, IMC < 30 kg/m².
Criterios de exclusión: pacientes que no aceptaran de manera explícita participar en el presente estudio, los que no contaran con el consentimiento informado firmado, aquellos menores de 18 años, mayores de 60 o con alguna discapacidad mental; pacientes con enfermedades crónico-degenerativas descontroladas, enfermos bajo tratamiento antirretroviral por VIH, los que estuvieran bajo tratamiento esteroideo de larga evolución, individuos bajo tratamientos con medicamentos que interfirieran con el bloqueo neuromuscular, mujeres embarazadas, pacientes con enfermedades de la colágena o neuromusculares, los fisicoculturistas, o aquéllos con insuficiencia renal o hepática.
Mediante una Tabla de números aleatorizados, se conformaron tres grupos de 12 pacientes:
Grupo A: pacientes que recibieron una dosis de dexametasona calculada a 200 μg/kg de peso una hora antes de la cirugía.
Grupo B: pacientes que recibieron una dosis de dexametasona calculada a 200 μg/kg de peso durante la inducción anestésica.
Grupo C: pacientes que recibieron una dosis de dexametasona calculada a 200 μg/kg de peso después de la recuperación del bloqueo neuromuscular.
Como técnica anestésica, se empleó la anestesia general balanceada; en la inducción anestésica por vía endovenosa se administró midazolam (2 mg dosis única), fentanilo (2-3 μg/kg), propofol (1-2 mg/kg); para el mantenimiento anestésico por vía inhalatoria se administró desflurano a una concentración alveolar mínima (CAM), bajo ventilación asistida con mascarilla facial y en plano anestésico, se calibró el monitor TOF-Watch®SX (Figura 1) y se tomaron las medidas basales de la transmisión neuromuscular evaluando el estímulo simple (T1%) y tren de cuatro (TOF) (minuto cero). Se procedió a administrar por vía endovenosa rocuronio (300 μg/kg peso corregido) a los tres grupos; se estableció una medida continua de la transmisión neuromuscular con el monitor TOF-Watch®SX, evaluando la máxima depresión del estímulo simple (T1%) y el inicio de la acción (min) del rocuronio, indicando las condiciones óptimas para la intubación endotraqueal. Durante todo el procedimiento quirúrgico se registraron la frecuencia cardiaca en latidos por minuto, la presión arterial en mmHg, la oximetría capilar (%), la fracción inspirada de oxígeno, la fracción espirada de dióxido de carbono; también se registró cada tres minutos el grado de bloqueo neuromuscular por medio del TOF-Watch®SX, evaluando la duración clínica 25% (min), el índice de recuperación 25-75% (min), el tren de cuatro (TOF), la cuenta postetánica (PTC) hasta obtener el índice de recuperación del tren de cuatro (TOFR) ≥ 0.9 óptimo para el protocolo de extubación (Figura 2).

Figura 1: Monitorización cuantitativa en el músculo Adductor pollicis (AP); los electrodos estimulan el nervio cubital con el electrodo negativo negro distal y el transductor de aceleración fijado con cinta adhesiva en la cara interna distal del dedo pulgar. El modelo corresponde al monitor TOF-Watch®-SX (instrumento para monitorizar la transmisión neuromuscular durante la anestesia en cirugía y en unidades de cuidados intensivos mediante aceleromiografía).
Mediciones
Estímulo simple (T1) basal: consiste en la aplicación de estímulos supramáximos sobre un nervio motor periférico a una frecuencia que oscila entre 1 Hertz (Hz) (un estímulo cada segundo) y 0.1 Hz (un estímulo cada 10 s).
TOF: tren de cuatro (train of four): método estándar de la monitorización neuromuscular. Son cuatro estímulos producidos a 0.2 Hz en intervalos de 0.5 s.
Inicio de la acción: tiempo entre el comienzo de la inyección de rocuronio y la depresión máxima del estímulo simple (T1) basal (transmisión neuromuscular).
Duración T1 25%: es la duración clínica (duración hasta la recuperación espontánea del 25% de la transmisión neuromuscular).
Recuperación 75%: es el tiempo de recuperación del 75% de la transmisión neuromuscular.
Índice de recuperación 25-75%: es el tiempo medio de la recuperación espontánea del 25 al 75% de la transmisión neuromuscular.
TOF-ratio 0.9: la duración total (tiempo hasta la recuperación espontánea del 90% de la transmisión neuromuscular).
PTC: cuenta postetánica, estímulo tetánico a 50 Hz durante 5 s, 3 s de pausa, seguido por 20 estímulos simples a intervalos de 1 s.
Análisis estadístico
El análisis estadístico se realizó utilizando el paquete estadístico GraphPad Prism Versión 6.0c para Mac. Los datos que no se distribuyeron de manera normal se compararon usando el análisis de varianza de una vía de Kruskal-Wallis en rangos, seguido de un análisis post hoc de Dunns para comparaciones múltiples. Los datos distribuidos normalmente se compararon usando ANOVA de dos vías para datos repetidos en un tiempo, seguido de la prueba HolmSidak para todos los procedimientos de comparaciones múltiples. Todas las pruebas fueron de dos colas, con un nivel de significancia p ≤ 0.05 y una potencia de 80%; los datos fueron corregidos para comparaciones múltiples (corrección de Bonferroni).
Resultados
En los tres grupos estudiados se evaluó un total de 36 pacientes, 12 por cada grupo (A, B y C); sus características demográficas se detallan en la Tabla 1. Se observa en las características demográficas de los pacientes que recibieron dexametasona que no existieron diferencias significativas en las variables universales.
Tabla 1: Características de los pacientes que recibieron dexametasona.
| Grupo A | Grupo B | Grupo C | |
|---|---|---|---|
| Premedicación (n = 12) |
Inducción (n = 12) |
Postoperatorio (n = 12) |
|
| Edad | 43.1 ± 13.1 | 46.5 ± 17.8 | 50.3 ± 19.3 |
| Peso | 70.1 ± 15.4 | 64.3 ± 11.5 | 68.4 ± 9.3 |
| Peso corregido | 77.4 ± 9.3 | 63.7 ± 9.6 | 64.9 ± 8.5 |
| Talla | 166.2 ± 9.3 | 160.8 ± 10.5 | 164.4 ± 10.1 |
| IMC | 25.1 ± 3.2 | 24.7 ± 2.3 | 25.3 ± 3.3 |
| ASA | 1.5 ± 0.5 | 1.5 ± 0.5 | 1.7 ± 0.5 |
Los valores son media ± desviación estándar.
Los resultados del efecto de la administración de dexametasona en la duración del bloqueo neuromuscular inducido por rocuronio se pueden ver en la Tabla 2.
Tabla 2: El efecto de la administración de dexametasona en la duración del bloqueo neuromuscular inducido por rocuronio.
| Grupo A | Grupo B | Grupo C | |
|---|---|---|---|
| Premedicación (n = 12) |
Inducción (n = 12) |
Postoperatorio (n = 12) |
|
| Rocuronio (mg) | 20.1 ± 3.8 | 18.5 ± 3.3 | 19.4 ± 2.6 |
| Dexametasona (mg) | 13.5 ± 2.6 | 12.3 ± 2.1 | 12.9 ± 1.7 |
| T1 basal (%) | 104 ± 5.8 | 104.8 ± 6.7 | 101.6 ± 4.8 |
| TOF basal (%) | 105.3 ± 6.7 | 104.5 ± 5.6 | 105 ± 6.6 |
| Inicio de la acción (min) | 1.3 ± 0.4 | 1.5 ± 0.4 | 1.5 ± 0.5 |
| Duración T1 25% | 18.7 ± 6.5 | 19.7 ± 3.3 | 21.7 ± 6.5 |
| Recuperación 75% (min) | 30.2 ± 10.9 | 30.4 ± 2.1 | 33.8 ± 16.1 |
| Índice de recuperación 25-75% (min) | 11.4 ± 5.5 | 10.5 ± 6.7 | 11.9 ± 10.4 |
| TOF-ratio 0.9 (%) | 94.8 ± 6 | 94.1 ± 5.6 | 94.3 ± 5.7 |
| TOF-ratio 0.9 (min) | 42.6 ± 9.1 | 49.6 ± 0.4 | 55 ± 16.2 |
Los valores son media ± desviación estándar o número (o proporción). Grupo A, dexametasona 200 µg/kg una hora antes de la cirugía; grupo B, dexametasona 200 µg/kg durante la inducción; grupo C, dexametasona 200 µg/kg en el área de recuperación (grupo control); p < 0.05 grupo A versus grupo B; p < 0.05 grupo A versus grupo C.
Respecto a las dosis administradas de rocuronio-dexametasona, en los tres grupos no hubo diferencias significativas. La transmisión neuromuscular fue evaluada por el método de aceleromiografía por medio del monitor TOF-Watch®SX en el músculo aductor del pulgar inervado por el nervio cubital.
Se midió el valor de la altura de la contracción muscular basal sin efecto del bloqueador neuromuscular no despolarizante inducido por rocuronio mediante un estímulo simple T1 (%) y el tren de cuatro, TOF (%), emitidos por el monitor TOF-Watch®SX; los resultados fueron similares en todos los grupos (A, B y C): De igual manera, el porcentaje de la proporción del tren de cuatro ≥ 0.9 nos demuestra que el 90% de la recuperación de la transmisión neuromuscular resultó no tener diferencias en los tres grupos estudiados.
Sin embargo, en lo que respecta a las siguientes variables, en los grupos A, B y C, se nota una clara diferencia significativa en el inicio de la acción (min) del efecto del bloqueo neuromuscular no despolarizante inducido por rocuronio, la duración clínica (duración T1 25%), la recuperación 75%, el índice de recuperación 25-75% y TOF-ratio 0.9 (min) de la recuperación de la transmisión neuromuscular, demostrando una p < 0.05 grupo A (premedicación) versus grupo B (inducción anestésica), p < 0.05 grupo A (premedicación) versus grupo C (postoperatorio) (Figura 3).
Discusión
En el presente estudio demostramos que la administración de dexametasona una hora antes de la cirugía (grupo A) y en la inducción anestésica (grupo B) causó la disminución en la duración del tiempo del bloqueo neuromuscular producido por el rocuronio en 10 a 20%.
Se demostró que el comienzo del inicio de la acción del efecto del bloqueo neuromuscular inducido por rocuronio fue más rápido en el grupo A (premedicación) versus el grupo B (inducción anestésica) y grupo C (postoperatorio). Esto se debe a que la máxima concentración plasmática de la dexametasona se obtiene al cabo de una o dos horas después de su administración; por lo tanto, el grupo A (premedicación) se vio mayormente influenciado en el inicio de la acción del bloqueo neuromuscular causado por rocuronio con respecto a los demás grupos estudiados, ya que la dexametasona fue administrada una hora antes del evento quirúrgico, por lo que había mayor concentración, efecto e interacción de ésta con el rocuronio al momento del inicio de la anestesia.
Se demostraron mayores diferencias significativas en las variables que corresponden a la duración clínica T1 25% (recuperación del 25% de la transmisión neuromuscular), recuperación 75% de la transmisión neuromuscular, índice de recuperación del 25-75% y recuperación del 90% del bloqueo neuromuscular TOFR 0.9 del grupo A versus grupo C. La causa de estos resultados es que tanto la concentración plasmática como el inicio de la vida media biológica de la dexametasona van de una a tres horas y, por lo tanto, la dexametasona tiene una mayor interacción con el rocuronio, lo que causa mayor disminución en la duración del bloqueo neuromuscular (Tabla 3).
Tabla 3:
| Grupo A (premedicación) |
Grupo B (inducción anestésica) |
Grupo C (postoperatorio) |
|
|---|---|---|---|
| Duración T1 25% | 18.7 ± 6.5 | 19.7 ± 3.3 | 21.7 ± 6.5 |
| Recuperación 75% (min) | 30.2 ± 10.9 | 30.4 ± 2.1 | 33.8 ± 16.1 |
| Índice de recuperación 25-75% (min) | 11.4 ± 5.5 | 10.5 ± 6.7 | 11.9 ± 10.4 |
| TOF-ratio 0.9 (min) | 42.6 ± 9.1 | 49.6 ± 0.4 | 55 ± 16.2 |
En el grupo B versus el grupo C también se muestra una diferencia en las variables antes mencionadas, un poco menos espectacular comparada con el grupo A. La causa de estos resultados es el momento en que se administró la monodosis de dexametasona, que fue al inicio de la anestesia; por lo tanto, el tiempo para alcanzar la concentración plasmática y el inicio de la vida media biológica de la dexametasona se recorrió. Aun así, queda demostrado que tanto en la premedicación como en la inducción anestésica, la dexametasona sí disminuye el curso en el tiempo del efecto del bloqueo neuromuscular causado por el rocuronio, bloqueador neuromuscular no despolarizante.
Conclusión
Estos resultados nos llevan a concluir lo siguiente:
• El efecto de la dexametasona es clínicamente relevante durante el transoperatorio y postoperatorio; tiene grandes beneficios, por lo que se administra de rutina para prevenir y tratar las náuseas y vómitos postoperatorios (NVPO), el manejo de la vía aérea comprometida, la disminución de la respuesta inflamatoria, el manejo del dolor agudo y crónico, etcétera.
• A todos los pacientes de los tres grupos se les administró dexametasona lo más pronto posible para obtener su efecto benéfico a tiempo. La administración de dexametasona después de la finalización de las mediciones (grupo C) no influyó en los resultados obtenidos.
• Es importante mencionar que, en general, la dexametasona se inyecta antes de la cirugía, en la inducción anestésica, debido al retraso en el inicio de sus efectos deseados. De acuerdo con los resultados, la dexametasona requiere tiempo para producir su efecto sobre el bloqueo neuromuscular. Por lo tanto, no produce un efecto antagonista directo en la placa terminal.
• La dosis de rocuronio usada en nuestro estudio (300 μg/kg) es sustancialmente menor que las dosis administradas de rutina. Sin embargo, las guías de buena práctica de investigación clínica (GCRP) recomiendan el uso de dosis bajas para evaluar el inicio y el curso temporal del bloqueo neuromuscular.
• La intubación endotraqueal sin el uso de bloqueadores neuromusculares no es recomendada para situaciones clínicas como la anestesia general, pues produciría mayor incidencia de lesiones a las cuerdas vocales, mayores condiciones difíciles de intubación y mayores complicaciones durante la ventilación mecánica (ejemplo, broncoespasmo, movimientos involuntarios).
• El uso de glucocorticoides por periodos a largo plazo afecta sólo a un pequeño grupo de pacientes. En contraste, una monodosis de glucocorticoides se administra con frecuencia durante la anestesia debido a sus efectos antieméticos, antiinflamatorios y analgésicos.
• Los glucocorticoides poseen un efecto facilitador directo en el extremo generador de impulsos del axón del nervio motor; actúan presinápticamente, estimulando la síntesis y liberación de acetilcolina.
• Es de buena práctica la monitorización neuromuscular en la anestesia general; está demostrado que previene el riesgo de presentar complicaciones pulmonares, movimientos involuntarios, complicaciones quirúrgicas, etcétera, durante el transoperatorio por administración de dosis insuficientes de bloqueador neuromuscular no despolarizante, retraso en la administración de dosis de mantenimiento subsecuentes de bloqueador neuromuscular y, durante el postoperatorio, la parálisis residual en el área de recuperación secundaria a un bloqueo neuromuscular prolongado por un gran número de dosis de mantenimiento.











 text new page (beta)
text new page (beta)