Introducción
Los bloqueadores neuromusculares (BNM) son sustancias que actúan a nivel de la transmisión del impulso nervioso en la unión neuromuscular;1 se utilizan para facilitar intubación endotraqueal, manejo invasivo de vía aérea y relajación transoperatoria para obtener acceso quirúrgico a las cavidades corporales. A pesar de los importantes avances en el manejo de los BNM, el bloqueo neuromuscular residual (BNMR) sigue siendo un problema frecuente y muchas veces no detectado en la Unidad de Cuidados Postanestésicos (UCPA).2,3
Macario et al.4,5 refieren que el 44% de los costos hospitalarios totales son costos directos variables, en los cuales se contemplan la mano de obra y suministros directamente involucrados en la producción de un servicio específico para el paciente. La sala de operaciones genera el mayor costo hospitalario (33%), seguida de la sala de recuperación postanestésica (31%), dentro de los cuales se incluyen costo del personal de sala de operaciones y de suministro necesarios para realizar un trabajo de anestesia o de enfermería. Los costos de anestesia intraoperatoria representaron el 5.6% del costo total del hospital, siendo principalmente costos directos variables (suministros endovenosos). Se deduce que es importante controlar el tiempo quirúrgico y evaluar de qué manera se pueden reducir los costos. Alrededor de un 3% de los costes totales están sujetos a las decisiones clínicas de los anestesiólogos. Si esta cifra se multiplicara por el número de cirugías anuales, brindaría cifras importantes.6
Arbous et al.7 refieren que una recuperación incompleta de los BNM está relacionada con complicaciones anestésicas graves, siendo la presencia de BNMR uno de los factores de riesgo asociados directamente con la anestesia, y que demostró estar relacionado con la morbimortalidad en las primeras 24 horas del postoperatorio. Debe realizarse monitorización neuromuscular para conocer el grado de bloqueo, y posteriormente administrar reversión oportuna para lograr la recuperación del tono muscular y minimizar los riesgos al final de la cirugía.8 El TOF (train of four) es el método más útil de monitorización de la función neuromuscular, debido a su simplicidad y facilidad para valorar cuantitativamente el grado de bloqueo neuromuscular.9 Es una serie de cuatro estímulos supramáximos de 0.5 segundos a frecuencias de 2 Hz/seg. La proporción resultante de la división de la cuarta respuesta entre la primera respuesta evocada es el TOFR (train of four ratio) T4/T1.
La evaluación de la profundidad de los bloqueadores neuromusculares no despolarizantes se clasifica en varios grados según el TOF. Bloqueo intenso: es el inducido inmediatamente después de la administración de un BNMND; no existe respuesta a estímulos simples evocados tras un estímulo tetánico. Bloqueo profundo: no existe respuesta al TOF. Empieza con respuestas a estímulos simples sucesivos a un estímulo tetánico y termina con la aparición de la primera respuesta al TOF. Bloqueo moderado: periodo desde la aparición de la primera respuesta hasta la cuarta respuesta del TOF. Fase de recuperación: aparición de la cuarta respuesta del TOF y establecimiento del TOFR.10
La neostigmina se utiliza para la reversión del BNM, ya que es un inhibidor de la acetilcolinesterasa; sin embargo, tiene una acción limitada que puede ocasionar parálisis residual con presencia de bronco aspiración, hipoxemia, debilidad muscular y obstrucción de vía aérea, así como algunos efectos colaterales como náusea, vómito o bradicardia,11 por lo cual es recomendable que se combine con atropina para disminuir estos efectos.
El sugammadex es un inhibidor selectivo de los BNM aminoesteroideos que permite la encapsulación del anillo esteroideo del rocuronio y reduce la cantidad del bloqueador disponible para unirse a los receptores nicotínicos de la unión neuromuscular, provocando una reversión del BNM. El tiempo de recuperación es cuantitativamente mejor que el de los anticolinesterásicos; sin embargo, presenta un costo mayor.12
El objetivo del estudio es realizar una evaluación económica de sugammadex versus neostigmina para comparar las alternativas en términos de costos y efectividad en la salud, debido a que cada vez es más importante el gasto en los insumos y medicamentos, siendo necesario un uso más eficiente de los recursos.13 Se compara el costo total que generan la neostigmina y el sugammadex para lograr la reversión neuromuscular de bloqueo moderado con rocuronio (hasta obtener tren de cuatro o TOF 4/4) en sala de operaciones, en pacientes sometidos a cirugía laparoscópica electiva en el Hospital Ángeles Pedregal. Asimismo, se cuantifica el número de minutos ahorrados al realizar la reversión con ambos medicamentos en sala de operaciones y en UCPA. También se determinan los efectos adversos que causan ambos medicamentos y si influyen para que el paciente requiera atención especializada o mayor estancia en UCPA.
Material y métodos
Después de obtener la aprobación del Comité de Ética del Hospital Ángeles Pedregal y consentimiento informado de cada paciente para la utilización de reversor neuromuscular, se realizó un estudio observacional y prospectivo en dos grupos de pacientes tratados con distintos medicamentos reversores.
El estudio se llevó a cabo siguiendo la Declaración de Helsinki de la Asociación Médica Mundial. Asimismo, se siguen los criterios de Buena Práctica Clínica en Investigación Clínica con Bloqueadores Neuromusculares de la revisión de Estocolmo.14
Se comparó la reversión farmacológica del BNM moderado en dos grupos: grupo 1 (n = 30) en el que se usó sugammadex a 2 mg/kg y grupo 2 (n = 30) donde se usó neostigmina a 0.04 mg/kg y atropina a 0.15 mg/kg.
Sujetos de estudio: Los candidatos fueron pacientes sometidos a cirugía laparoscópica programada bajo anestesia general balanceada con intubación endotraqueal y relajación neuromuscular con rocuronio. Se incluyeron 60 pacientes. Las cirugías se realizaron en el Hospital Ángeles Pedregal entre febrero y junio de 2017.
Criterios de inclusión: Conocer y haber aceptado características del estudio, presentando lectura y firma del consentimiento informado; pacientes mayores de 18 años; estado físico de la American Society of Anesthesiologists (ASA) I-II, programados para cirugía laparoscópica electiva bajo anestesia general con mínimo de 30 minutos y máximo de 120 min, con presencia de bloqueo neuromuscular moderado al término de la cirugía, comprobado con la aparición de la segunda respuesta (T2) del TOF.
Criterios de exclusión: Pacientes que no pudieron leer, entender o firmar el consentimiento informado; padecer enfermedades neuromusculares que alteran la respuesta a los BNM; padecer insuficiencia hepática, obesidad (IMC > 30, ya que está relacionada con una prolongación del BNM15); pacientes alérgicos a los fármacos utilizados en el estudio; embarazadas o en lactancia; pacientes en estado de choque, en tratamiento con quimioterapia y/o radioterapia, con trastornos psiquiátricos, musculares o neurológicos diagnosticados.
Variables: Se tomaron en cuenta variables demográficas (edad, sexo), fisiológicas (PAM, FC, SpO2, EtCO2, temperatura), clínicas (peso, talla, IMC), anestésicas (clasificación ASA, TOFr al momento de reversión, tiempo en alcanzar TOFr > 90%), quirúrgicas (tipo de cirugía, tiempo anestésico), farmacoeconómicas (minutos ahorrados al realizar reversión en sala de operaciones y UCPA, costo del tiempo ahorrado), farmacológicas (dosis de rocuronio, sugammadex y neostigmina), relacionadas con reversión neuromuscular (nivel de consciencia, capacidad de mantener cabeza elevada durante más de cinco segundos, existencia de tos efectiva, mantenimiento de apertura ocular durante más de cinco segundos). En UCPA se evalúan las mismas variables relacionadas con reversión neuromuscular a su llegada, 15 min, 30 min y al alta. En sala de operaciones y UCPA se evalúa presencia de eventos adversos (EA) causados por los medicamentos reversores.
Análisis estadístico: Se utilizó el programa XLSTAT versión 2016 para el análisis de datos. Se realizó este estudio mediante estadística descriptiva (frecuencias, proporciones, medias aritméticas, desviaciones estándar) e inferencial (t de Student) considerando significativo un valor de p < 0.05.
Técnica de anestesia
En área preoperatoria se administran adyuvantes (protector gástrico, antihemético y profilaxis antibiótica), corroborando signos vitales estables del paciente. Al llegar a quirófano se registra la información en la hoja de recolección de datos por paciente en formato 00:00 de los eventos cronológicos.
Monitorización del paciente con PANI, ECG, SpO2, EtCO2, temperatura. Se preoxigena administrando oxígeno con mascarilla facial a tres litros por minuto. Inducción anestésica con midazolam 1-2 mg, fentanil 3 μg/kg, propofol 1.5-2 mg/kg, rocuronio 0.6 mg/kg. Posteriormente, se realiza monitorización de la función neuromuscular mediante estimulación del nervio cubital a través de la muñeca con el equipo TOF-Watch® SX, previa asepsia de la zona para disminuir resistencia, iniciando estimulaciones TOF cada 20 segundos. La información se registra en tiempo real en la hoja de recolección de datos. Se mantiene anestesia con sevoflurano a 1 CAM, FiO2 oxígeno/aire 50%, fentanil bolos de 1 μg/kg cada 30 min y rocuronio bolos 0.15 mg/kg si TOF > 25%, bajo ventilación mecánica con parámetros óptimos para mantener saturación de oxígeno > 97% y CO2 entre 32 y 35 mmHg. Se administra protección térmica con mantas o colchón térmico para mantener temperatura > 36 oC medida con termómetro esofágico. La medición de la relajación neuromuscular se mantiene con TOF-Watch® SX y luego de la intubación se modifica frecuencia cada 15 min.
Al terminar el procedimiento quirúrgico, se detiene la administración de sevofluorano y se modifica FiO2 100%. Al alcanzar TOFr de 10-25%, se anotan signos vitales como valor de referencia. Posteriormente, se administra al grupo 1 sugammadex (2 mg/kg) y al grupo 2 neostigmina (0.04 mg/kg) y atropina (0.15 mg/kg). En ambos grupos, al alcanzar TOFr > 90% con ventilación espontánea, se valora el nivel de consciencia, capacidad de mantener elevada la cabeza por más de cinco segundos, existencia de tos efectiva y capacidad de mantener ojos abiertos por más de cinco segundos.
Posteriormente, se traslada el paciente a UCPA, continuando con monitorización (PANI, ECG, PC, SpO2, To), donde se evalúan mismas variables a su llegada, 15 min, 30 min y al alta.
Elección del medicamento reversor a utilizar: se crearon sobres con el nombre del reversor neuromuscular a utilizar y se sellaron. Al inicio de cada cirugía se eligió un sobre al azar. La persona que realizó la toma del sobre era ajena al estudio de investigación. Se abrió el sobre y se preparó medicamento reversor indicado en el mismo.
El análisis del impacto farmacoeconómico se consideró al momento de la administración del reversor neuromuscular, ya que hasta este punto los costes de personal y material utilizados eran equiparables.
Los efectos sobre los recursos o costes se valoraron en unidades monetarias (pesos mexicanos). Se estudió el costo de los fármacos reversores (sugammadex, neostigmina y atropina) y el costo de estancia en sala de operaciones y UCPA (valorados por fracción de tiempo de 15 minutos, siendo el método que utiliza el hospital al cuantificar estadía).
Los efectos sobre la salud se valoraron en unidades naturales de efectividad, tomando en cuenta el tiempo que tarda en conseguir la reversión neuromuscular, desde la administración del reversor hasta que se alcanza TOFr > 90% expresado en minutos, así como los efectos adversos observados en sala de operaciones y UCPA (Tablas 1 y 2).
Tabla 1: Costo de medicamentos reversores.
| Dosis media | MG por vial | Precio promedio | |||
|---|---|---|---|---|---|
| Grupo 1 | 134.33 | 200 | $3,300.00 | ||
| Sugammadex | |||||
| Grupo 2 | N | A | N | A | $568.85 |
| Neostigmina/atropina | 2.65 | 0.66 | 0.5 | 1 | (89.87 {$437.75-$748.25}) |
Datos proporcionados por el Servicio de Análisis de Cuenta del Hospital Ángeles Pedregal. Dosis expresada en miligramos. Precio expresado en pesos mexicanos. Se ha calculado con la media de las dosis en mg obtenidos en cada grupo.
Tabla 2: Costo de estancia en sala de operaciones y Unidad de Cuidados Postanestésicos por fracción de tiempo.
| Costo de estancia y personal en quirófano | Costo de UCPA y monitorización | |
|---|---|---|
| 1-15 min | $1,343.50 | $1,380.25 |
| 16-30 min | $2,687.00 | $2,760.50 |
| 31-45 min | $4,030.50 | $4,140.75 |
| 26-60 min | $5,374.00 | $5,521.00 |
Datos proporcionados por el Servicio de Análisis de Cuenta del Hospital Ángeles Pedregal.
UCPA = Unidad de Cuidados Postanestésicos.
Para definir si sugammadex es costo-efectivo debe obtenerse la ratio incremental: promedio del costo de sugammadex ($3,300.00), promedio de costo neostigmina/atropina ($568.85) = $2,731.15. Al obtener el presente resultado, se contempló que sugammadex es costo-efectivo al tener un ahorro de más de 16 minutos en sala de operaciones y UCPA.
Resultados
De los 60 pacientes incluidos en el estudio, se observó que no presentaron diferencias estadísticamente significativas en cuanto a características demográficas (p < 0.05), evitando sesgos en el análisis de las variables farmacodinámicas del BNM entre ambos grupos. El grupo 1 estaba constituido por ocho hombres y 22 mujeres, mientras que en el grupo 2 hubo siete hombres y 23 mujeres. La edad media fue de 45.7 años en el grupo 1 y de 41.5 años en el grupo 2. El IMC medio fue de 24.88 kg/m2 en el grupo 1 y de 24.31 kg/m2 en el grupo 2. En ambos grupos la mayoría de los pacientes fueron ASA I (Tablas 3 y 4).
Tabla 3: Características demográficas y antropométricas.
| Grupo 1 Sugammadex |
Grupo 2 Neostigmina/atropina |
Valor de p | |
|---|---|---|---|
| Edad (años) | 45.77 (12.67 [26-69]) | 41.57 (9.19 [25-65]) | 0.18 |
| Peso (kg) | 67.17 (9.037 [49-88]) | 66.13 (8.46 [50-85]) | 0.72 |
| Talla (m) | 1.64 (0.067 [1.5-1.78]) | 1.65 (0.072 [1.53-1.81]) | 0.72 |
| Sexo (H/M) | 8/22 (26.6%/73.3%) | 7/23 (23.3%/76.6%) | – |
| IMC (kg/m2) | 24.88 (2.35 [20.07-27.77]) | 24.31 (2.16 [20.07-29.75]) | 0.37 |
| ASA (I/II) | 18/12 | 17/13 | – |
Datos expresados como media (DE [mín.-máx.]). Fuente: Hospital Ángeles Pedregal, 2017.
Tabla 4: Procedimientos quirúrgicos a los que se sometieron los pacientes.
| Cirugía | Grupo 1 Sugammadex |
Grupo 2 Neostigmina/atropina |
|---|---|---|
| Histerectomía | 9 | 8 |
| Miomectomía | 3 | 4 |
| Histeroscopia | 1 | 2 |
| Laparoscopia por endometriosis | 4 | 2 |
| Quiste de ovario | 2 | 1 |
| Plastia inguinal | 2 | 1 |
| Colecistectomía | 5 | 6 |
| Funduplicatura | 3 | 4 |
| Apendicetomía | 1 | 2 |
Intervenciones quirúrgicas realizadas sobre los pacientes del estudio. Fuente: Hospital Ángeles Pedregal, 2017.
La duración del tiempo anestésico al que se sometieron los pacientes fue en promedio de 81.3 minutos en el grupo 1 y de 82 minutos en el grupo 2, como se detalla en la Tabla 5, sin encontrar diferencias estadísticamente significativas (p = 0.89).
Tabla 5: Comparación del ahorro económico en minutos entre ambos grupos.
| Grupo 1 Sugammadex |
Grupo 2 Neostigmina/ atropina |
|
|---|---|---|
| Duración de tiempo anestésico (min) | 81.3 (14.36 [50-111]) |
82 (18.58 [48-113]) |
Duración de las intervenciones anestésicas. Datos expresados como media (DE [mín.-máx.]) *p < 0.05 entre grupos. Fuente: Hospital Ángeles Pedregal, 2017.
Se observó que la dosis total administrada de rocuronio en el grupo 1 fue en promedio de 46 mg con TOFr al momento de la reversión de 18.1 y la dosis de rocuronio en el grupo 2 de 46 mg con TOFr al momento de la reversión de 17.53 sin mostrar significancia estadística (p > 0.05). Al comparar el tiempo en minutos que tardan ambos grupos en alcanzar TOFr > 90%, se encuentra que el sugammadex a dosis de 2 mg/kg tarda 1.4 minutos y neostigmina a dosis de 0.03 mg/kg 15.42 minutos, mostrando diferencia significativa (p = 0.00), con un ahorro de tiempo en sala de operaciones de 14.01 minutos y proporcionando un ahorro en costo por fracción de $1,343.5 pesos (Tabla 6 y Figura 1).
Tabla 6: Variables de relajación neuromuscular.
| Grupo 1 Sugammadex |
Grupo 2 Neostigmina/atropina |
Valor p | |
|---|---|---|---|
| Dosis total de rocuronio (mg) | 46 (8.18 [30-65]) | 46 (7.59 [35-61]) | 0.065 |
| TOFr en el momento de reversión (%) | 18.1 (4.09 [11-24]) | 17.53 (4.11 [1-24]) | 0.302 |
| Tiempo en min hasta alcanzar TOFr > 90% (min) | 1.41 (0.35 [0.6-1.9]) | 15.42 (3.95 [11.2-27.3]) | 0.00001 |
| Dosis de reversor (mg) | 134.33 (18.07 [98-176]) | 2.64 (0.338 [2-3.4]) |
Datos expresados como media (DE [mín-máx]). Fuente: Hospital Ángeles Pedregal, 2017.
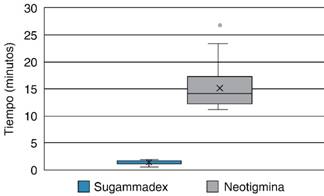
Fuente: Hospital Ángeles Pedregal, 2017.
Figura 1: Representación en diagrama de cajas y barras del TOFr > 90 en sala de operaciones.
En cuanto a los minutos de estancia total en UCPA, el tiempo promedio del grupo de sugammadex fue de 52.03 min y para el grupo de neostigmina de 68.9 minutos, mostrando un ahorro de tiempo en UCPA de 16.87 minutos. La diferencia fue estadísticamente significativa (p = 0.0002), pudiéndose expresar un ahorro en costo por fracción de $2,760.50 pesos en UCPA (Tablas 7 y 8,Figuras 2 y 3) y realizando un análisis del costo que genera la reversión neuromuscular en ambos grupos en sala de operaciones. El uso de sugammadex presenta un costo significativamente mayor que neostigmina (p = 0.000).
Tabla 7: Tiempo de estancia en Unidad de Cuidados Postanestésicos.
| Grupo 1 Sugammadex |
Grupo 2 Neostigmina/atropina |
|---|---|
| 52.03 (4.84 [43-60]) | 68.9 (11.46 [60-91]) |
Tiempo de estancia en Unidad de Cuidados Postanestésicos expresado en minutos. Datos expresados como media (DE [mín.-máx.]). p < 0.05 entre grupos. Fuente: Hospital Ángeles Pedregal, 2017.
Tabla 8: Comparativo de ambos grupos: tiempo para alcanzar TOFr > 90, minutos ahorrados en el quirófano y Unidad de Cuidados Postanestésicos, costo ahorrado por fracción.
| Grupo 1 Sugammadex |
Grupo 2 Neostigmina/atropina |
|
|---|---|---|
| Tiempo en min hasta alcanzar TOFr > 90% | 1.4 | 15.42 |
| Minutos ahorrados en quirófano respecto al grupo 2 | 14.01 | 0 |
| Costo generado según minutos ahorrados | 0 | $1,343.5 |
| Tiempo UCPA | 52.03 (4.84 [43-60]) | 68.90 (11.46 [60-91]) |
| Minutos ahorrados en UCPA respecto al grupo 2 | 16.87 min | 0 |
| Costo generado según minutos ahorrados | 0 | $2,760.5 |
Cuadro base de análisis farmacoeconómico. Fuente: Hospital Ángeles Pedregal, 2017. UCPA = Unidad de Cuidados Postanestésicos.
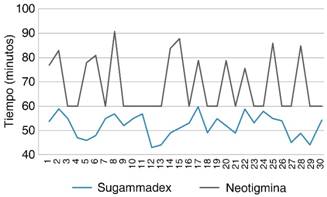
Fuente: Hospital Ángeles Pedregal, 2017.
Figura 2: Comparación del tiempo de estancia en Unidad de Cuidados Postanestésicos.
Se analizó de igual forma, en la UCPA, que sugammadex mantiene el mismo costo en la sala de operaciones, sin presentar variabilidad por el tiempo de estancia o atención de efectos secundarios; sin embargo, en el grupo de neostigmina hay mayor aumento de costo debido al tiempo de estancia prolongada (p = 0.002) (Figura 4).
Finalmente, se realizó análisis del costo total de la reversión neuromuscular, comparando ambos medicamentos, y se encontró que sugammadex representa un gasto importante al usarse en sala de operaciones, pero en algunos casos compensa significativamente su costo al momento de egresar el paciente de UCPA (p = 0.018) (Tabla 9 y Figura 5).
Tabla 9: Costo total de reversores.
| Grupo 1 Sugammadex |
Grupo 2 Neostigmina/atropina |
p | |
|---|---|---|---|
| Costo total (medicamento/estancia en quirófano/estancia en UCPA) | $9,268.83 (644.16 [$3,300.00-$4,673.50]) |
$8,657.76 (1,280.54 [$7,302.25-$12,723.14]) |
0.018 |
UCPA = Unidad de Cuidados Postanestésicos.
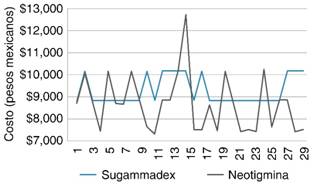
Fuente: Hospital Ángeles Pedregal, 2017.
Figura 5: Representación gráfica del costo total de la reversión neuromuscular.
Al contar el tiempo de recuperación y monitorización en UCPA, se observó que en tres pacientes del grupo 2 (neostigmina) la SpO2 fue menor de 90%, de los cuales, un paciente requirió apoyo ventilatorio con bolsa autoinflable. Se encontraron los siguientes eventos adversos asociados con la reversión del BNM: náusea y vómitos, disgeusia, sialorrea, rigidez muscular. En la Tabla 10 se detalla el número de pacientes que manifestaron estos efectos.
Tabla 10: Efectos presentados por los pacientes.
| Grupo 1 Sugammadex |
Grupo 2 Neostigmina/atropina |
|
|---|---|---|
| NVPO | 0 | 8 |
| Disgeusia | 2 | 0 |
| Sialorrea | 0 | 3 |
| Rigidez muscular | 0 | 2 |
La incidencia de NVPO en el grupo 1 fue de 0% y del 26.6% en el grupo 2. La diferencia fue estadísticamente significativa (p = 0.0029). La incidencia de disgeusia fue del 6.66% en el grupo 1 y de 0% en el grupo 2, sin presentar significancia estadística (p = 0.16). La incidencia de sialorrea fue de 0% en el grupo 1 y de 10% en el grupo 2, sin presentar significancia estadística (p = 0.08). La incidencia de rigidez muscular fue del 0% en el grupo 1 y del 6.66% en el grupo 2, sin presentar significancia estadística (p = 0.16). Ningún paciente presentó arritmias, reacción anafiláctica u otro evento adverso.
Discusión
Los medicamentos en anestesia representan aproximadamente el 10% del presupuesto de un hospital, pudiendo el anestesiólogo influir directamente en los costos de la atención médica a través de su práctica.16 La implementación de medidas tales como la educación del personal de anestesia respecto a los costos de medicamentos y la disminución del desperdicio de los mismos puede ser un medio eficaz para controlar su gasto y brindar beneficios farmacoeconómicos considerando la rentabilidad general y la calidad de la recuperación.17
El bloqueo neuromuscular se controla en menos de un tercio de los pacientes paralizados18 debido a la poca disponibilidad de monitores en salas de operaciones, a que se encuentran en mal estado o al desconocimiento de los efectos adversos del bloqueo neuromuscular residual.19 Cuando se cuenta con la monitorización, es posible que las mediciones del TOF (incluso siendo > 0.9) no sean lo suficientemente sensibles como para detectar pequeños grados de disfunción del músculo esquelético por parálisis parcial20,21 como la disminución del tono del esfínter esofágico superior o el flujo inspiratorio máximo.22 El realizar extubación traqueal con TOF < 0.9 se ha asociado a hipoxia, obstrucción de la vía aérea superior, desaturación de oxígeno, microaspiración y reintubación.23
Norton et al.24 encontraron que la incidencia residual de bloqueo neuromuscular en UCPA fue del 29.7%, observando que los pacientes tuvieron mayor frecuencia de eventos respiratorios críticos generales (51%), obstrucción de las vías respiratorias (10%), hipoxemia leve-moderada (23%), hipoxemia severa (7%), insuficiencia respiratoria (8%), incapacidad para respirar profundamente (38%) y debilidad muscular (16%). La reversión de rutina al final del procedimiento quirúrgico debe considerarse cuidadosamente y no siempre asegura la restauración completa de la fuerza muscular de los pacientes.25
La neostigmina tiene limitaciones importantes; es necesaria su asociación con atropina para evitar efectos secundarios muscarínicos. Sin embargo, el uso concomitante induce sus propios efectos secundarios: arritmias, náuseas y vómito postoperatorio;26 sequedad de boca, visión borrosa,27 broncoespasmo28 e incluso asistolia.29 La neostigmina es efectiva para revertir el bloqueo neuromuscular después de que haya comenzado la recuperación espontánea. Y debe verificarse esta recuperación mediante monitorización objetiva y cuantitativa, ya que si se administra en pacientes con recuperación completa puede causar alteración en la función del geniogloso y diafragmática.30,31 La latencia de la neostigmina es relativamente lenta y la duración de su efecto puede ser más corta que la vida media de eliminación del rocuronio, causando consecuencias clínicas como volúmenes reducidos de las vías respiratorias superiores, obstrucción de las vías respiratorias, eventos de hipoxemia y complicaciones pulmonares postoperatorias.32 Además, si se utilizan dosis altas (> 0.6 μg/kg), se asocia a presencia de atelectasia, edema pulmonar, reintubación traqueal y estancia hospitalaria prolongada.33
Paton et al.12 realizaron un estudio de costo-efectividad de sugammadex y demostraron que 2 o 4 mg/kg de sugammadex fueron rentables para la reversión de rutina del bloqueo neuromuscular superficial y profundo, observando reducciones en los tiempos de recuperación en el quirófano y mejoras en la productividad con uso más eficiente de los miembros del personal.
Chambers et al.34 supusieron que, con una incidencia del 1% de “no se puede intubar, no se puede ventilar”, sugammadex podría ser rentable si se evita al menos una muerte por cada 1,942 pacientes. Y demostró su rentabilidad al usarlo en sala de operaciones y no en UCPA. En comparación con neostigmina, los costos de sugammadex son significativamente mayores; estos costos directos deben equilibrarse con los posibles riesgos de la recuperación neuromuscular incompleta.
Ledowski et al.35,36 plantearon la hipótesis de que la reducción en la estadía hospitalaria podría compensar los costos de sugammadex. La mayoría de los efectos secundarios son inespecíficos, como hipotensión, tos, sequedad de boca o náuseas.37 Se ha descrito prolongación del intervalo QT corregido, pero con la misma frecuencia informada en el grupo de placebo,38 confirmando la falta de efectos cardiovasculares en pacientes con enfermedad cardiovascular sometidos a cirugía no cardiaca. Se considera que sugammadex reduce el número de pacientes con signos clínicos de parálisis residual postoperatoria causada por el rocuronio,39 en comparación con la neostigmina, independientemente de la profundidad del bloqueo, teniendo mejor perfil de seguridad que la neostigmina.40
Conclusión
En la población estudiada, se observa costo-efectividad al utilizar sugammadex en pacientes con bloqueo moderado en sala de operaciones, encontrando TOF > 0.9 con diferencia significativa en el tiempo ahorrado (14.01 minutos) frente a neostigmina, pero no en el costo ahorrado por fracción de tiempo en sala de operaciones. Sin embargo, su uso oportuno permite obtener un ahorro significativo en tiempo y costo en UCPA, al presentar diferencia de estancia de 16.87 minutos y mínimos eventos adversos a su egreso. Al realizar análisis de los costos totales de ambos grupos, se encuentra significancia estadística (p < 0.05). Es muy importante realizar monitorización del grado de relajación neuromuscular41 y tomar la decisión adecuada al elegir el reversor a utilizar con base en el grado de TOF, puntualizando lo referido en la discusión. La finalidad es evitar el bloqueo neuromuscular residual, obtener ahorro en tiempos de estancia y costos totales, realizar buen uso de consumibles, ejercer adecuada práctica clínica, evitar eventos adversos y, posteriormente, lograr egreso oportuno del paciente de UCPA.











 nova página do texto(beta)
nova página do texto(beta)