Introducción
Aproximadamente 5% de la población se ve afectada por una o más enfermedades autoinmunes (EA),1 siendo su prevalencia predominante en mujeres; los pacientes con una EA tienen alto riesgo de desarrollar una segunda EA. La miastenia gravis (MG) es una EA rara causada por anticuerpos contra las proteínas de la unión neuromuscular. Respecto a la tiroiditis de Hashimoto es una EA en la que el sistema inmunológico reacciona contra una variedad de antígenos tiroideos. La asociación de MG y tiroiditis de Hashimoto es rara, tiene una prevalencia que varía de 0.2 a 1.1%, mientras que la asociación de enfermedad tiroidea autoinmune con fibrosis pulmonar es muy rara y la asociación de MG con fibrosis pulmonar es extraordinaria. Al presentarse una paciente cuyo diagnóstico fue de las tres enfermedades asociadas y una asociación extraordinaria, de la que sólo existe un reporte en la literatura anglosajona, realizamos esta comunicación, que probablemente es el segundo reporte a nivel mundial y el primero en México.
Caso clínico
Paciente femenino de 69 años, ama de casa, originaria y residente de Sinaloa, que a su paso por el Bajío acude a urgencias de esta institución; con antecedentes de: colecistectomía a los 31 años, cesárea a los 28 años, histerectomía a los 36 años, resección de quistes óseos en miembro pélvico derecho hace 28 años y alergia a ceftriaxona. Refiere padecimiento de 11 años de evolución, caracterizado por episodios de accesos de tos, productiva (esputo blanquecino, en ocasiones amarillo) y disnea que se incrementó paulatinamente, atendida en lugar de origen con diagnóstico de fibrosis pulmonar, hospitalizada en múltiples ocasiones por cuadros neumónicos manejados con fármacos inhalados no especificados, en los dos últimos años manejada con pirfenidona; refiriendo menos accesos de tos con disminución de duración y severidad, pero con disnea de medianos esfuerzos que en el último año ha pasado a ser de pequeños esfuerzos, se agregan diagnósticos de diabetes mellitus tipo II, hipotiroidismo controlada con hormona tiroidea (sin controles posteriores desde su inicio) y presencia de diplopía con moderada ptosis palpebral bilateral manejada con piridostigmina; sin cambios importantes en diplopía; con pérdida de peso de 11 kilos en los dos últimos meses, sudoración profusa, taquicardia y palpitaciones. Acude a urgencias de la institución con disnea de pequeños esfuerzos, diplopía, ptosis palpebral y temblor fino generalizado. A la exploración física: paciente disneica, pálida, con diplopía y ptosis palpebral moderada bilateral, con reflejos pupilares normales a la luz; marcha no valorable por disnea; cuello con signo de ingurgitación yugular a 45o; tiroides no palpable; sin adenomegalia; FC 120X’; FR 20X’; T 36.5o; oximetría con saturación de O2 de 85% que mejora a 96% con oxígeno por puntas nasales. Campos pulmonares con estertores crepitantes en ambas bases, ruidos cardiacos: soplo diastólico en foco pulmonar y reforzamiento del segundo ruido, abdomen sin visceromegalias; extremidades pélvicas con venas varicosas abundantes, pulsos presentes, reflejos y llenado capilar normales. Se hospitaliza para su estudio con los diagnósticos de: enfermedad pulmonar intersticial, probable hipertensión pulmonar secundaria, hipertiroidismo iatrogénico, diabetes mellitus tipo II y posible miastenia gravis ocular. Los estudios de laboratorio reportaron: biometría hemática, electrolitos séricos, pruebas de función hepática, BUN, urea y creatinina normales; glucosa de 128 mg/dL; gasometría: Ph 7.48, pCO2 35 mmHg, pO2 99 mmHg, Na 138 mMol/L, K 3.5 mMol/L, Ca 1.18 mMol/L, glucosa 129 mg/dL, lactato 0.7, Ca iónico estándar a Ph 1.22 mMol/L, bicarbonato real 26.1 mMol/L, bicarbonato estándar 27.1 mMol/L, dióxido de carbono total 27.2 mMol/L, ex-base en líquido extracelular 2.6 mMol/L, ex-base en sangre 2.7mMol/L, saturación de O2 97%; perfil tiroideo: T3 captación 0.99U, triyodotironina T3 222 ng/dL, tiroxina T4 14.1 μg/dL, índice de tiroxina libre 14.20 μg/dL, TSH 0.004 mcUI/mL, T3 libre 7.2 pg/mL, T4 libre 2.01 ng/dL, con lo que se confirma hipertiroidismo iatrogénico; creatinfosfokinasa: 21 U/l (baja). El electrocardiograma mostró: frecuencia de 120 X; ritmo sinusal; eje con desviación a la derecha a 120o; R alta en AVR; S en V5 > de 7 mm mayor que en R en V5 y V6; la ecocardiografía mostró presión de arteria pulmonar en 35 mmHg. Se solicitó búsqueda de anticuerpos (Cuadro 1). Resultando positivos: anticuerpos antitiroglobulina 85.5 IU/mL (elevado); antiperoxidasa tiroidea 926.3 IU/mL (elevado), confirmando tiroiditis de Hashimoto; anticuerpos antirreceptor de acetilcolina 0.50 mmol/L (positivo), confirmando MG de presentación ocular; anticuerpos antinucleares positivos con patrón homogéneo 1:80 y moteado fino 1:40: La tomografía de tórax (Figuras 1 y 2) reportó: cambios de fibrosis pulmonar manifestados por áreas con patrón en panal de abeja, principalmente hacia la periferia y regiones basales, con destrucción de paredes septales y bronquiectasias bilaterales, además de bula basal izquierda, angioesclerosis y cambios degenerativos osteoarticulares en columna dorsal. La resonancia magnética de cráneo mostró: ligera disminución del volumen córtico subcortical, discretos cambios por enfermedad de pequeños vasos y sinusitis etmoido-esfeno maxilar. La prueba de Jolly (estimulación eléctrica repetitiva) reveló disminución paulatina de la amplitud del componente del potencial de acción de ambos músculos orbiculares, siendo normal en el extensor común de los dedos en ambas manos. El estudio de fibra única (Jitter) en ambos músculos orbiculares evidenció: alargamiento paulatino del tiempo de latencia, la prueba se repitió en el músculo aductor del pulgar de manera bilateral encontrando respuestas normales.
Cuadro 1: Resultados de anticuerpos en paciente con miastenia gravis, tiroiditis de Hashimoto y fibrosis pulmonar.
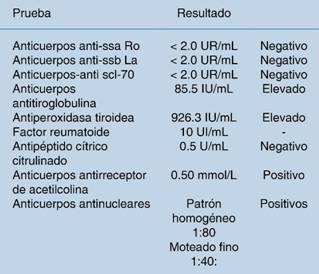
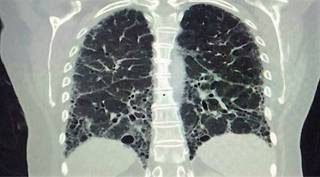
Figura 1: Imagen tomográfica de tórax en plano coronal que muestra cambios de fibrosis, manifestados por áreas con patrón en panal de abeja, principalmente hacia la periferia y regiones basales, destrucción de paredes septales y bronquiectasias de distribución bilateral.
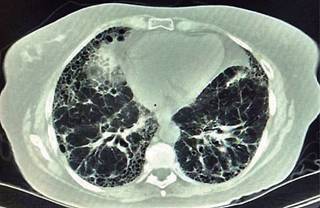
Figura 2: Imagen tomográfica de tórax en corte axial, se observan imágenes en panal de abeja principalmente hacia la periferia. En paciente con diagnósticos de tiroiditis de Hashimoto asociada a miastenia gravis.
Se suspendió levotiroxina, se continuó con pirfenadina, oxígeno continuo e inhaloterapia, permaneció cinco días en la institución, se dio de alta con mejoría, con diagnósticos y sugerencias de manejo a su médico tratante en su lugar de residencia.
Discusión
Está ampliamente documentada la asociación de diversas enfermedades autoinmunes (EA) que actúan ya sea en: el receptor nicotínico de acetilcolina (ACgR), la tirosina cinasa específica del músculo (MuSK, por sus siglas en inglés) o por baja densidad del receptor de lipoproteínas relacionadas con la proteína 4 (LRP4); la prevalencia de MG es de 100-200 por millón de personas. Los pacientes con MG tienen riesgo incrementado (de 13 a 22%) de desarrollar otra EA comparados con la población general,3,4 siendo aun más alto en pacientes femeninos con inicio temprano de MG, principalmente de presentación ocular. Algunas EA asociadas a MG5 son lupus eritematoso sistémico, artritis reumatoide, dermotopolimiositis y enfermedad de Addison. En relación con pacientes con MG asociados específicamente a enfermedad tiroidea autoinmune, Chen6 et al. reportaron que 121 (8.2%) de 1,482 pacientes con MG padecían enfermedad tiroidea autoinmune, detectaron la enfermedad de Graves en 5.7%, en tanto que la asociación con tiroiditis de Hashimoto fue de 1.1%, con predominio del género femenino. En este grupo de pacientes se observa con mayor frecuencia hiperplasia tímica, en tanto que el timoma es más común en MG sin asociación a enfermedad tiroidea, otros reportes indican que los pacientes con enfermedad tiroidea autoinmune presentan una asociación con MG de 0.2%. En una revisión sistemática la enfermedad tiroidea autoinmune fue asociada a 23 EA, siendo la asociación con MG de 10%. Ochenta por ciento de los pacientes con anticuerpos anti-AChR presentan MG, ya sea de variedad ocular o generalizada; no obstante, la sensibilidad de la prueba de MG ocular es baja; actualmente los pacientes con MG pueden clasificarse en siete subgrupos,3 cada uno con diferentes anticuerpos y hallazgos clínicos distintos, de ellos un subgrupo conformado por 8% de pacientes con MG primordialmente ocular se asocia ya sea a: enfermedad tiroidea autoinmune (siendo más frecuente con enfermedad de Graves que con tiroiditis de Hashimoto) o síndrome de Sjögren relacionado con anticuerpos anti-AChR, que es una asociación reportada en pacientes de cualquier edad con predominio 3:1 a favor del género femenino, con expresión clínica de leve a moderada, prácticamente sin crisis miasténicas y cambios tímicos muy poco frecuentes (que corresponde al caso presentado).
La tiroiditis de Hashimoto es una EA frente a la que el sistema inmunológico reacciona contra una variedad de antígenos tiroideos. Los hallazgos principales de la tiroiditis de Hashimoto son la depleción progresiva de células epiteliales tiroideas que gradualmente son reemplazadas por una infiltración de células mononucleares y fibrosis. Múltiples mecanismos inmunológicos pueden contribuir a la muerte de los tirocitos. La sensibilización de células T-cooperadoras CD4+ autorreactivas a los antígenos tiroideos parece ser el factor desencadenante. Los mecanismos efectores responsables de la muerte de los tirocitos incluyen: a) muerte celular mediada por células T citotóxicas CD8+; b) muerte celular mediada por citocinas: las células T CD4+ producen citocinas inflamatorias tales como INF-gamma en el entorno inmediato al tirocito, provocando reclutamiento y activación de macrófagos y la lesión de los folículos y c) unión de anticuerpos tiroideos (anticuerpos antirreceptor de TSH, antitiroglobulina y anticuerpos antiperoxidasa tiroidea) seguidos de citotoxicidad mediada por células dependientes de anticuerpos.
En relación con la fisiopatogenia de las EA, la autoinmunidad se inicia en una respuesta inapropiada contra elementos tisulares normales, lo que provoca enfermedades crónicas complejas caracterizadas por la pérdida de tolerancia inmunológica a autoantígeno. La asociación y sobreposición o traslape de EA refleja mecanismos patogénicos comunes; los factores inmunológicos ocasionan la activación de células B y T autorreactivas, la susceptibilidad genética involucra factores epigenéticos, los genes habitualmente involucrados son los HLA del complejo mayor de histocompatibilidad, los cuales están fuertemente asociados a EA. De este modo las EA como MG, artritis reumatoide, esclerosis múltiple, diabetes mellitus insulinodependiente, miocarditis autoinmune, enfermedad tiroidea autoinmune y la uveítis se han desarrollado a nivel experimental con el uso de ratones transgénicos con alelos HLA para lograr entender la patogenia de las enfermedades autoinmunes y se ha observado que la influencia genética del complejo mayor de histocompatibilidad en MG es mediado a través de una señal simple en la región de los antígenos de clase I, inducida por la vecindad del complejo de proteínas del gen 5 localizado entre MICA y MICB;7 la MG ocular y otras enfermedades autoinmunes se asocian a los haplotipos HLA A1. B8- DR3- DQ2. Un estudio de 694 casos de MG ocular y 2,596 controles reveló: una fuerte asociación del antígeno en el alelo del locus HLA-B*08 y en dos sitios adicionales externos al complejo mayor de histocompatibilidad, como el gen PTPN22 y la proteína interactuante denominada TNIP18 (por su siglas en inglés), por lo que el gen HLA-B*08 representa un riesgo alélico para la mayoría de las enfermedades autoinmunes. Tanto in vivo como in vitro los estudios sugieren que TNIP1 tiene un papel crucial en la regulación de varias vías celulares involucradas en las EA, siendo un alelo con riesgo de presentar artritis reumatoide, psoriasis, síndrome de Sjögren y lupus eritematosos sistémico.
Por otra parte, existe una serie de enfermedades del tejido conectivo de origen autoinmune que originan fibrosis sistémica como la esclerodermia y enfermedades asociadas al colágeno, la cuales además de afectar la piel de cualquier parte del cuerpo, originan problemas en: vasos sanguíneos, corazón, articulaciones, músculos, esófago, intestinos, riñones y pulmones, siendo la afección fibrosa de estos últimos la causa principal de mortalidad. En estas enfermedades la patogenia de fibrosis pulmonar se inicia por una lesión microvascular que ocasiona daño epitelial alveolar con activación de la cascada de coagulación y donde la expresión de anticuerpos es un predictor de la afección sistémica, especialmente a nivel pulmonar. Por lo tanto, la presencia de anticuerpos antitopoisomerasa (Scl-70) se asocia de manera importante al desarrollo de enfermedad pulmonar intersticial, mientras que la aparición de anticuerpos anticentrómeros brinda protección evitando su desarrollo.9
La asociación de fibrosis pulmonar idiopática con tiroiditis de Hashimoto10 es muy rara, en esta última sus rasgos histológicos son la infiltración linfocítica del estroma y el cambio oxifílico del epitelio folicular, el tejido linfoide muestra folículos grandes con centros germinales y en raras ocasiones puede observarse infiltración linfocítica con base autoinmune en otros órganos como la adrenalitis linfocítica y la neumonitis intersticial linfocítica que explicaría la enfermedad pulmonar intersticial del paciente motivo de esta presentación como lo describe Khardori et al.11 en cuatro casos de fibrosis pulmonar asociada a tiroiditis de Hashimoto, en la que en todos los casos la enfermedad pulmonar fue diagnosticada después de la enfermedad tiroidea autoinmune.
Respecto a la asociación de fibrosis pulmonar y MG, después de una extensa revisión de la literatura solamente existe un caso reportado por el grupo de Chogtu,12 lo que confirma que esta asociación es muy rara. Las implicaciones clínicas de esta asociación repercuten directamente en la función respiratoria, pues además de estar disminuida la difusión por la fibrosis, se agrega el factor de restricción de la caja torácica por la falta de apoyo de los músculos respiratorios, por tal motivo el tratamiento de la MG es de suma importancia e imperativo. Por último, la asociación de MG, tiroiditis de Hashimoto y fibrosis pulmonar es extraordinaria, pues existe un caso en la literatura reportado por Verghese et al.,13 lo que representa un caso de asociación especial de enfermedades comórbidas como lo menciona Lifshitz.14 En relación con el pronóstico, 78% de los pacientes con MG ocular desarrollarán la forma generalizada en el primer año, un tercio permanecerá con MG ocular pura. El tratamiento de la MG, dependiendo del caso particular, incluye un equipo multidisciplinario que implica desde uso de sintomáticos, fármacos anticolinesterasa, esteroides e inmunomoduladores hasta timectomía y cirugía correctora de ptosis y estrabismo.
Conclusiones
La comorbilidad autoinmune entre miastenia gravis y otras enfermedades autoinmunes refleja un mecanismo patogénico común, la miastenia gravis de presentación ocular se asocia con mayor frecuencia a manifestaciones autoinmunes contra otros órganos. Es importante considerar la coexistencia de miastenia gravis con otras manifestaciones autoinmunes en pacientes con debilidad muscular, fatiga e insuficiencia respiratoria.











 nova página do texto(beta)
nova página do texto(beta)


