Introducción
La neumocistosis (N)1 es un reto clínico para los médicos que se ven involucrados en aquellos pacientes que presentan alteración de la inmunidad; el agente responsable es Pneumocystis jirovecii (PJ),2 que se consideró durante muchos años parte del reino protista. Actualmente se ha reconocido que pertenece al reino fungi, basados en secuencia de genes, su RNA ribosomal, la composición de su pared celular y la estructura de sus enzimas. Los miembros del género Pneumocystis son hongos microscópicos semejantes a las levaduras que residen en los pulmones de casi todos los mamíferos. Crecen extracelularmente en los alvéolos y no se desarrollan en medios artificiales. Están normalmente restringidos a los pulmones; las determinaciones filogenéticas, basadas en secuencias de genes, han permitido la identidad de las diferentes especies del género Pneumocystis. Actualmente, han sido descritas cinco: Pneumocystis carinii y Pneumocystis wakefieldiae, que infectan a las ratas; Pneumocystis murina en ratones; Pneumocystis oryctolagi en conejos, y Pneumocystis jirovecii, que infecta a los seres humanos.3 Aún no se conoce si la enfermedad es adquirida del medio ambiente o si se trata de una reactivación de enfermedad contraída en la infancia, o si es una reactivación o infección de novo. El papel exacto de la transmisión interhumanos es motivo de debate. Actualmente no se pueden efectuar cultivos de P. jirovecii. Su importancia fue reconocida durante la epidemia de VIH en humanos. La pneumocistosis ha sido ampliamente estudiada en muchos países y ha disminuido en aquellos pacientes con VIH que tienen acceso a terapia retroviral. A partir del 2000, se sabe que la pneumocistosis no está restringida a pacientes con VIH, ya que es principalmente diagnosticada en pacientes no VIH positivos, asociada a enfermedades que implican deterioro del sistema inmunológico, entre las cuales se encuentran la artritis reumatoide, el cáncer, las enfermedades hematológicas y las producidas por trasplantes de órganos, lo que ha creado nuevos retos de profilaxis, diagnóstico y tratamiento de la población susceptible, aumentándose el número de reportes de estos pacientes.4 Los estudios sistemáticos confirman que la neumonía por PJ se presenta con más frecuencia en pacientes VIH negativos, siendo mayor la mortalidad en este grupo. Al presentarse una paciente con artritis reumatoide manejada con esteroides y metotrexate, en la que se llegó al diagnóstico de N, realizamos el presente reporte.
Caso clínico
Paciente femenino de 68 años, profesionista, que ingresa al hospital por fiebre de 15 días de evolución y disnea, con antecedentes positivos para DM en madre y hermano; cuenta con antecedentes de DM tipo 2 de 6 años de evolución manejada con hipoglucemiantes orales, hipertensión arterial de 16 años controlada con lisinopril, artritis reumatoide de 15 años de evolución, tratada regularmente con AINES, metotrexate y esteroides regularmente y, de manera irregular, con leflunomida y etanercept.
Cursó con varias hospitalizaciones, cuatro y dos meses antes de su ingreso a esta institución, ocasionadas por cuadro de disnea, durante las cuales se le efectuaron estudios exhaustivos para descartar tuberculosis pulmonar con resultados negativos; fue manejada con múltiples antibióticos y dada de alta en ambas ocasiones con oxígeno domiciliario; 15 días antes de su ingreso es nuevamente hospitalizada por disnea, hipoxemia y tos seca, practicándosele broncoscopia con cepillado bronquial y biopsia transbronquial de pulmón. Al continuar con deterioro del estado general es trasladada a esta Institución, en la que se le recibe con fiebre de 39.5 oC, disnea en decúbito, saturación de 90% con 6 L de oxígeno/minuto e hipotensión de 90/60 mmHg. Se le efectuó radiografía PA de tórax mostrando datos de neumopatía intersticial con lesiones en panal de abeja y zonas de consolidación (Figura 1); los estudios paraclínicos mostraron: Hb de 16 g/L y leucocitos de 7 × 109/L; Albúmina 2.6 g/dL; fosfatasa alcalina 173 UI/L u/L; GGT 650 UI/L; SGOT 51 mU/mL SGPT 63 mU/mL, glucosa 172 mg/dL; INR 1.01; procalcitonina normal, triglicéridos 602 mg/d; colesterol total 240 mg/dL; DHL 834 UI/L; BAARES (3) en expectoración negativos: hemocultivo, urocultivo y coprocultivo negativos, y VIH negativos. Se efectuó TC que mostró aumento de zonas de consolidación (Figura 2). Ante el antecedente de uso crónico de esteroides y metotrexato y con imágenes de neumopatía intersticial se sospecha neumonía por Pneumocystis jirovecii, por lo que se realizó técnica de Grocott para PJ resultando compatible, al igual que con técnica de ácido peryódico. Se inició manejo con trimetoprima-sulfametoxazol, presentando mejoría parcial (desapareció fiebre), persistiendo tendencia a hipoxemia sin oxígeno. Con el diagnóstico de neumonía organizada criptogénica asociada a artritis reumatoide se decidió iniciar bolos de metilprednisolona (5) con mejoría importante de la oxigenación al medio ambiente, de la tos y de la disnea, así como de imagen tomográfica (Figura 3).
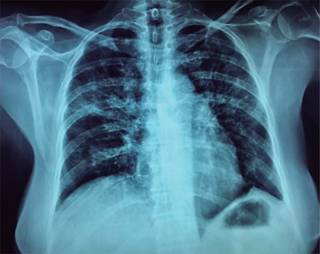
Figura 1: Imagen radiográfica PA de tórax mostrando: parénquima pulmonar con infiltrado mixto, intersticial y alveolar, con zonas de consolidación basal parahiliar en el lado derecho.
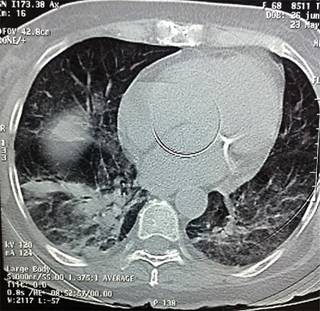
Figura 2: Imagen tomográfica en corte axial que muestra amplias zonas con engrosamiento septal interlobulillar e intralobulillar, con zonas en “vidrio despulido”, patrón en parches y múltiples áreas de nódulos centro-lobulares con patrón lineal de ramificación predominando en lóbulos superiores bilateral.

Figura 3: Imagen tomográfica en corte axial que muestra cambios neumopáticos crónicos (fibrosis pulmonar y bronquiectasias), con tipo de infiltrado pulmonar de patología aguda probablemente infecciosa, infiltrado en vidrio deslustrado y múltiples áreas de nódulos centro-lobulares con patrón lineal de ramificación, compatible con etiología atípica u oportunista.
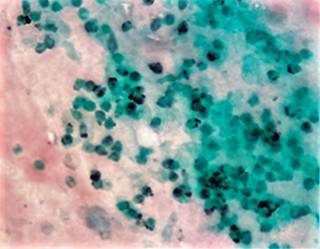
Los resultados de biopsia transbronquial, teñidas con tinción de Grocott, fueron compatibles con PJ (Figura 4) así como PCR de expectoración bronquial positiva para Pneumocystis jirovecii. La evolución de la paciente fue hacia la mejoría, egresándose a los 11 días de su ingreso sin disnea, sin tos con saturación del 94% al aire ambiental, y pasó a control como externa por Neumología y Reumatología.
Discusión
La prevalencia de enfermedad pulmonar intersticial (EPI) en pacientes con artritis reumatoide5 (AR) se encuentra entre 10 y 50%; los factores de riesgo incluyen: artritis reumatoide severa, género masculino, edad, tabaquismo y anticuerpos anticitrulina y uso de fármacos como metotrexato. Sin embargo, sólo 2 a 5% de los pacientes reumatológicos desarrollan N, particularmente aquéllos en quienes se usa glucocorticoides en combinación con inmunosupresores (en el caso presentado, la paciente era manejada con metotrexato y glucocorticoides, existiendo por tanto factor de riesgo).
La fisiopatogenia relacionada con N6 en pacientes AR se ha tratado de explicar por la supresión de inmunidad celular y alteraciones del surfactante pulmonar causada por el uso de esteroides.
Los síntomas de EPI en pacientes con AR incluyen primordialmente disnea y tos no productiva de inicio insidioso; la fiebre y dolor torácico son menos frecuentes; una presentación aguda de EPI-AR habitualmente es atípica, por lo que debe pensarse en problema infeccioso agregado. En pacientes con EPI-AR con infección por PJ, la presentación es insuficiencia respiratoria fulminante, con fiebre y tos seca, la cual se asocia a disminución y raramente a incremento de fármacos inmunosupresores. Al respecto, en el estudio de Bievenu et al se menciona que de 2005 a 2013 el número de casos anuales de pneumocistosis se ha incrementado de 63 a 85% en los pacientes VIH negativos, siendo los síntomas más frecuentes: disnea en 65.9% de los casos, fiebre en 65.4% y tos no productiva en 55.4%; los tres síntomas se presentan en 31% de los casos; dos síntomas (fiebre y disnea) en 27%, y un síntoma aislado: 16.5% con fiebre, 14.7% con disnea y 5% con tos. Los estudios indican que hasta 8.9% de los pacientes con EPI y PJ asintomáticos están colonizados. El diagnóstico biológico al examen microscópico proporciona del 30 al 48% de seguridad diagnóstica, mientras que la PCR en tiempo real brinda el 100% de certeza, además de ser más específica que la PCR efectuada de forma convencional.7
Los hallazgos típicos en EPI-AR se manifiestan por patrón restrictivo en los volúmenes pulmonares y transferencia anormal de gases, además de disminución de la saturación de oxígeno durante la oximetría. Hasta 5% de los pacientes con AR tienen posibilidad de desarrollar EPI por PJ.
La tomografía8 de alta resolución es de gran ayuda para determinar el patrón radiográfico, de tipo vidrio esmerilado, áreas de consolidación, cambios reticulares y apariencia de panal de abeja, así como valorar la extensión de la enfermedad. En relación a esto, los hallazgos tomográficos pueden ser sugestivos de N hasta en 86.4% de los pacientes, caracterizados por infiltrados intersticiales perihiliares, anotando que hasta 11.3% de los estudios radiológicos no muestran datos sugestivos de NPJ, pero que resultan positivos a la PCR.
Es importante efectuar diagnóstico diferencial de los pacientes con EPI-AR en cuanto al origen de la neumopatía, como son: enfermedad pulmonar inducida por drogas, infección (en especial mantener en mente a la N), insuficiencia cardiaca, aspiración recurrente por reflujo gastroesofágico y malignidad.
El diagnóstico de EPI-AR se sustenta en la presentación clínica, pruebas de función pulmonar, resultados de la tomografía de alta resolución y, en algunos casos, basados en biopsia pulmonar. Los hallazgos del lavado broncoalveolar no son específicos, por lo que resulta más útil para excluir otros procesos agregados que para confirmar EPI-AR. En relación específica de EPI-AR con N, el diagnóstico biológico por examen microscópico sólo alcanza el 48% mientras que la PCR en tiempo real tiene 100% de seguridad diagnóstica.
La biopsia pulmonar no es necesaria a menos que las manifestaciones clínicas o la tomografía muestren datos atípicos de neumonitis intersticial como: rápida progresión, fiebre, predominio de opacidades en vidrio esmerilado sobre patrón reticular en la tomografía. En aquellos pacientes en quienes se requiere un diagnóstico histopatológico, la realización de biopsia pulmonar debe efectuarse por toracoscopia video-asistida o toracotomía, pues la biopsia transbronquial habitualmente proporciona tejido insuficiente.
Los hallazgos histopatológicos9 más comúnmente encontrados en pacientes con EPI-AR son: neumonitis intersticial habitual y neumonitis intersticial no específica en igual proporción; otros hallazgos incluyen neumonitis organizada, neumonitis intersticial linfoide y daño alveolar difuso.
Existe cierta incertidumbre sobre los efectos de los fármacos antirreumáticos tradicionales modificadores de la enfermedad y, al utilizar nuevos agentes biológicos en el desarrollo y evolución de la EPI en pacientes con AR, se requiere evaluación pretratamiento y vigilancia estrecha posterior a su prescripción, principalmente en pacientes con alto riesgo de progresión, independientemente del tratamiento elegido. Por lo tanto, debe persistir la preocupación por el riesgo de progresión de EPI inducida por medicamentos, los cuales deben valorarse en cuanto al riesgo-beneficio, no obstante la rareza de reacciones severas a estos fármacos. Existen reportes de N o EPI por otro motivo, relacionados con uso de fármacos como metotrexato. El 5% de los pacientes con AR en tratamiento con dicho fármaco pueden presentarla, al igual que con el uso de anticuerpos monoclonales.10
Los factores principales que influyen en la decisión del tratamiento de los pacientes con EPI-AR son la edad, el tipo histológico, la severidad del cuadro, la rapidez de progresión de la neumopatía y la presencia de enfermedades concomitantes. En aquellos pacientes con EPI-AR sin evidencia de infección pulmonar se sugiere terapia oral con prednisona o sus equivalentes; la dosis habitual es de 0.5 mg/kg/día (tomando como base el peso ideal) sin exceder los 60 mg/día. En los pacientes que no responden a este esquema, un segundo agente inmunosupresor debe utilizarse; las posibilidades son: micofenolato y azatioprina; la ciclosporina debe utilizarse en casos más severos. En los pacientes con enfermedad fulminante, después de excluir las posibilidades de infección y/o toxicidad inducida por fármacos, se sugiere iniciar con un glucocorticoide sistémico como metilprednisolona, en dosis alta de 1 a 2 g/día por vía endovenosa, aplicada en bolos con dosis divididas durante tres a cinco días, agregando además un segundo agente inmunosupresor. Actualmente debe considerarse en todo paciente inmunocomprometido, incluyendo aquéllos con AR, la profilaxis para PJ. Cuando se efectúa diagnóstico de N5-10 en los pacientes con EPI-AR, el tratamiento en 95% de los casos es a base de trimetoprima-sulfametoxazol, existiendo otros fármacos útiles como atovacuona y pentamidina.
El monitoreo del tratamiento incluye la evaluación clínica, radiografías seriadas de tórax y pruebas de funcionamiento pulmonar, incluyendo la medición de saturación de oxígeno en ambulación de seis minutos.
El pronóstico de EPI-AR depende del subtipo histológico, siendo levemente mejor cuando no existe fibrosis pulmonar idiopática. En el estudio de Song, en 84 pacientes con EPI-AR con seguimiento las anormalidades respiratorias permanecieron estables en 50% de los casos hasta por 45 meses de seguimiento; en 30% las anormalidades progresaron lentamente y 17% de los casos presentaron rápido deterioro. Si el paciente presenta N severa deben utilizarse corticosteroides como terapia adyuvante (como en el caso presentado). Respecto al pronóstico de N, la mortalidad al día 14 alcanza hasta 16%; en personas con VIH negativo, la mortalidad alcanza cifras del 30 al 50%, la cual no se ha modificado en los últimos 20 años, siendo la capacidad de difusión pulmonar menor de 55% un indicador de pobre pronóstico.
Conclusiones
El PCR en tiempo real es la herramienta más útil para el diagnóstico de la neumonía por Pneumocystis, por lo que debe efectuarse incluso en pacientes que no tienen síntomas, pero presentan factores de riesgo como cáncer, trastornos hematológicos u otras enfermedades inmunológicas y/o reciben terapia inmunosupresora.











 nueva página del texto (beta)
nueva página del texto (beta)