Introducción
La enfermedad tromboembólica venosa (ETV) comprende a la trombosis venosa profunda (TVP) y la embolia pulmonar (EP), padecimiento que se constituye como causa frecuente de muerte. Se trata de la tercera patología cardiovascular más frecuente después de la cardiopatía isquémica y la enfermedad cerebrovascular, con una tasa de incidencia anual de 100-200/100,000 habitantes; en personas mayores de 80 años de edad, la incidencia puede ser tan elevada como 1/100 habitantes.1 Se estima que un poco más de 250,0000 personas fallecen anualmente en los Estados Unidos de América a causa de la ETV; 10-30% de ellas mueren dentro del primer mes de efectuarse el diagnóstico. Se calcula que la tasa de mortalidad por EP no diagnosticada puede alcanzar un 30%, mientras que sólo alrededor del 8% de los casos de EP diagnosticados y tratados oportunamente culminan en defunción. La ETV puede ser letal durante la fase aguda o generar patología crónica y discapacidad a largo plazo; no obstante, se trata de una entidad nosológica prevenible. La EP aguda (EPA) es la manifestación clínica más severa de la ETV.2
Resulta complicado establecer la epidemiología de la EP, pues en muchos casos es asintomática; sin embargo, la tasa de prevalencia estimada es del 1.5%. En algunas circunstancias constituye un hallazgo incidental, mientras que en otras sólo se detecta postmortem, ya que 25% de los casos de EP se presentan como muerte súbita.3 La EP constituye una causa importante de morbimortalidad y hospitalización a nivel mundial. Sin tratamiento, la EP tiene una tasa de mortalidad del 30%, la cual puede reducirse a un 2-8% con un abordaje anticoagulante efectivo; de hecho, la EP se considera la causa evitable de muerte más común en pacientes hospitalizados. Se estima que una tercera parte de los individuos con EP presentarán recurrencia en los 10 años siguientes al momento del diagnóstico.4
Factores de riesgo
Existe una amplia gama de factores ambientales y genéticos que incrementan el riesgo de presentar ETV y, por ende, EP.5 Es bien sabido que ciertos trastornos genéticos predisponen a estados protrombóticos; los más frecuentes están representados por las mutaciones del factor V de Leiden (FVL) y del gen de protrombina 20210.6 Se calcula que la prevalencia de trombofilias hereditarias en la población general es del 0.2-0.4% por deficiencia de proteína C (PC), 0.2% por déficit de proteína S (PS), 0.02% por déficit de antitrombina III (AT-III) y, por último, 4-5% por mutaciones en el FVL.7 Se estima que un 11-29% de los sujetos con ETV presentan la mutación del FVL; asimismo, los portadores heterocigotos de dicha mutación poseen un riesgo 3-8 veces mayor de presentar ETV. La ETV se clasifica como poseedora de una causa aparente si existe un factor de riesgo temporal o reversible en un periodo de 1.5-6 semanas previas al diagnóstico, o sin causa aparente en caso de ausencia de él. Entre los factores de riesgo reversibles más destacables se encuentran cirugía, traumatismos, fracturas en miembros pélvicos, inmovilización prolongada, viajes largos en aeronaves, tabaquismo, obesidad, hipercolesterolemia, embarazo, uso de anticonceptivos orales y terapia de reemplazo hormonal durante la menopausia.6,7
Diversas situaciones clínicas actúan también como factores predisponentes en la EP; por ejemplo, Stojanovich y sus colaboradores observaron en un estudio clínico prospectivo que la tasa de prevalencia de EP en personas con síndrome antifosfolípido era del 12.3-13.2%; dicha variación dependía de la subclase de anticuerpos antifosfolípidos expresados.8 Asimismo, la EP es una de las complicaciones más frecuentes y peligrosas en pacientes con lesión de médula espinal en fase aguda, presentándose en un 10-30% de los casos.9 La ETV con y sin EP asociada ocupa la segunda causa de mortalidad en individuos oncológicos, con una incidencia estimada del 10-15% en dicho grupo de población.10 Mraovic y su grupo demostraron en un trabajo que el riesgo de EP era mayor en sujetos con síndrome metabólico postoperados de artroplastia de cadera o rodilla, e inclusive evidenciaron que la incidencia de EP incrementaba en relación con la cantidad de componentes del síndrome metabólico presentes en una persona determinada.11 Otras patologías y circunstancias clínicas en las cuales existe un riesgo elevado de EP son la hipertensión arterial sistémica, neumopatía obstructiva crónica, nefropatía crónica, diabetes mellitus y transfusión de hemoderivados.12 Cabe señalar que la EP puede llegar a presentarse incluso en ausencia total de factores de riesgo.
Fisiopatología
Al establecerse un episodio agudo de EP, se presentan múltiples anormalidades fisiopatológicas, las cuales se describen a continuación.
En primer lugar, debido a la oclusión de la permeabilidad de la arteria pulmonar, se altera la relación ventilación/perfusión (V/Q) y, por lo tanto, se incrementa el espacio muerto fisiológico. Asimismo, se establece un cortocircuito derecha-izquierda (intrapulmonar o intracardiaco); lo anterior condiciona una respuesta refleja neurogénica que se traduce en hiperventilación alveolar. Por otro lado, se produce broncoconstricción en las vías aéreas distales al sitio de oclusión vascular, lo que conlleva un incremento de la resistencia al flujo aéreo. La EPA desencadena una disminución del factor surfactante, generalmente acompañada de hemorragia o edema, lo cual disminuye la distensibilidad pulmonar. Si el tromboembolismo ocluye más del 30-50% del área de sección transversal del lecho arterial pulmonar, se produce un incremento de la presión arterial pulmonar sistólica (PAPS).13 Varias investigaciones han demostrado que la PAPS experimenta un incremento brusco dentro de los primeros 30 minutos posteriores al embolismo, alcanzando un valor máximo 1-2 horas después de dicho evento. Se estima que alrededor del 80% de los pacientes con TEP presentan hipertensión arterial pulmonar (HAP), mientras que un 0.5-4% desarrollarán hipertensión pulmonar tromboembólica crónica.14
La EP genera vasoconstricción a nivel local mediada por sustancias liberadas por plaquetas activadas tales como el tromboxano A2 (TxA2) y la serotonina, lo cual influye en el aumento inicial de la resistencia vascular pulmonar (RVP); asimismo, existe una disminución proporcional en la distensibilidad arterial. Múltiples estudios han demostrado que en las etapas iniciales de la EP existe una mayor síntesis de TxA2; asimismo, varios trabajos con modelos animales de TEP muestran una correlación entre la producción de dicha sustancia vasoconstrictora y un riesgo de mortalidad incrementado.15
Con el aumento súbito de la RVP se produce una dilatación del ventrículo derecho (VD), con la concomitante alteración de la contractilidad miocárdica e insuficiencia ventricular derecha (IVD). Se considera que la IVD debida a sobrecarga de presión es la principal causa de muerte en la EP severa.16 Cho y sus colegas concluyeron en un metaanálisis que la IVD demostrada mediante estudios ecocardiográficos acrecentaba la mortalidad por EPA a corto plazo hasta 2.29 veces.17 El alza en la presión y volumen del VD conlleva una subida en la tensión parietal y estiramiento miocítico, lo cual prolonga el tiempo de contracción del VD, mientras que una activación neurohumoral condiciona una estimulación cronotrópica e inotrópica. Dichos mecanismos compensatorios aumentan la PAPS, que mejora el flujo sanguíneo a través de la vasculatura pulmonar obstruida, estabilizando temporalmente la presión arterial sistémica. El alargamiento del periodo de contracción del VD conduce a un abombamiento del septo interventricular hacia el ventrículo izquierdo (VI) durante la fase inicial de la diástole; asimismo, se puede suscitar un bloqueo de la rama derecha del haz de His. Todo ello resulta en un defecto de llenado del VI, lo cual genera una reducción del gasto cardiaco que contribuye a la hipotensión sistémica e inestabilidad hemodinámica. Existe una elevación de los niveles plasmáticos de biomarcadores de daño miocárdico debido a isquemia del VD.18,19
Cuadro clínico
La EP puede ser una entidad patológica severa de difícil diagnóstico gracias a la inespecificidad de sus signos y síntomas, por lo que debe sospecharse en todo individuo con sintomatología cardiovascular.20 En una investigación realizada en el año 2011, Pollack y colaboradores fueron capaces de apreciar la frecuencia de los principales signos y síntomas de EP confirmado en sujetos que ingresaban al servicio de urgencias, los cuales se muestran a continuación por orden de frecuencia: 1) disnea (50%), 2) dolor torácico de tipo pleurítico (39%), 3) signos de TVP (24%), 4) tos (23%), 5) dolor torácico subesternal (15%), 6) fiebre (10%), 7) hemoptisis (8%) y 8) síncope (6%).21
Un hallazgo típico casi invariable de la EPA es la hipoxemia; sin embargo, hasta en un 40% de las personas la saturación de O2 en la gasometría arterial es normal; asimismo, hasta un 20% de los casos tienen un gradiente alvéolo-arterial de O2 normal. Otro resultado frecuente en la gasometría es la hipocapnia.22 Si la presentación clínica sugiere EP, debe asumirse un enfoque diagnóstico objetivo. Resulta fundamental reconocer los factores de riesgo para ETV para determinar la probabilidad de EP; no obstante, hasta en un 30% de los casos no es posible identificar algún factor predisponente.
El abordaje diagnóstico actual para individuos en quienes se sospecha EP está basado en la valoración de las pruebas de probabilidad clínica; para esto, se emplean desde hace varios años diversas escalas de predicción clínica. Las escalas de Wells (Cuadro 1) y de Ginebra se han validado de forma extensa; estas utilizan un esquema de tres categorías (probabilidad clínica baja, moderada o alta para EP) y otro de dos categorías (probable o no probable EP). Se estima que un 10% de los pacientes en la categoría de baja probabilidad clínica tendrán EP, 30% en la categoría de probabilidad moderada y 65% en la categoría de probabilidad alta.23,24 Angriman y colaboradores evidenciaron en un estudio de individuos con EP subsegmentario que aquellos con una puntuación elevada en la escala de Wells al momento del diagnóstico de ETV presentaban un incremento de cuatro veces en la incidencia de muerte o episodio recidivante de ETV durante el seguimiento.25 Di Marca y su grupo efectuaron un trabajo donde compararon las escalas de Wells y Ginebra como medidas predictivas de la probabilidad clínica de EP en sujetos ancianos hospitalizados y considerados de alto riesgo; encontraron que la escala de Wells tenía una mayor exactitud en dicho grupo de población.26
Diagnóstico
Dímero-D
Es la prueba diagnóstica más ampliamente utilizada en caso de sospecha de EP. El dímero-D es un marcador biológico cuya presencia es indicativa de formación y degradación de fibrina; se detecta en plasma tras la fibrinólisis de un coágulo. Posee una elevada sensibilidad (98-100%) y baja especificidad (35-39%), mientras que el valor predictivo negativo (VPN) es del 95%. Por lo anterior, la prueba de dímero-D únicamente tiene utilidad para descartar EP en sujetos con probabilidad clínica baja o intermedia con una puntuación ≤ 4 en las escalas de predicción clínica y niveles séricos de dímero-D ≤ 500 μg/L; dicha combinación se presenta en 30-40% de las personas con sospecha de EP.27,28 La reducida especificidad del dímero-D para el diagnóstico de ETV, especialmente en pacientes ancianos, se debe a que se observan concentraciones plasmáticas elevadas de dímero-D en individuos con procesos inflamatorios extensos, heridas en proceso de cicatrización, cáncer, hepatopatía, traumatismos y cirugías, etcétera.29
Se hace valorable el dímero-D principalmente cuando se emplea en conjunto con escalas de predicción clínica que dictaminan una probabilidad clínica baja o intermedia.30,31 Se ha demostrado que menos del 5% de los sujetos mayores de 80 años de edad tienen un valor negativo en la prueba del dímero-D, por lo que la relación costo-beneficio de dicho ensayo diagnóstico en la población geriátrica es desfavorable. Sin embargo, un dato a destacar es que por una parte, un dímero-D dentro de parámetros normales descarta el diagnóstico de TVP y EP en aquellas personas con una probabilidad clínica baja de ETV.32,33
El dímero-D no constituye una simple molécula homogénea; por tanto, la mayor parte de los problemas de cuantificación del mismo emergen de su heterogeneidad bioquímica. A manera de resumen, el dímero-D es el producto de la degradación de entrecruzamientos de fibrina y, por ende, refleja la activación de procesos como la hemostasia y fibrinólisis.34 La degradación de la molécula de fibrina mediada por plasmina, en la cual dos partículas D adyacentes se han entrecruzado por activación del factor XIII (FXIII) de la coagulación, genera una variedad de fragmentos que contienen el dominio-D dimérico (Figura 1).35 La presencia del dímero-D puede ser detectada utilizando anticuerpos monoclonales cuyo blanco específico consiste en un epítopo presente en el fragmento de FXIII activado entrecruzado con el dominio-D de la fibrina, más no así en los productos de la degradación del fibrinógeno o en los productos de la degradación de la fibrina no entrecruzados. El resultado final de la degradación de la fibrina es, por tanto, una clase heterogénea de péptidos caracterizados por la presencia de múltiples dominios-D entrecruzados.36,37
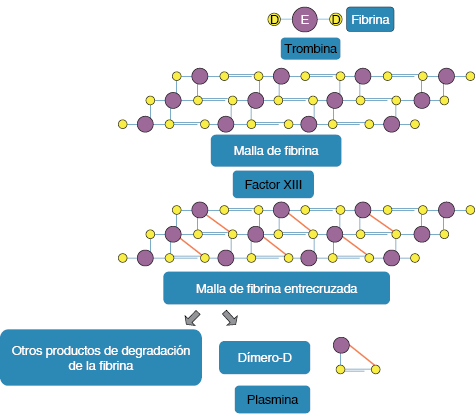
Eur Heart J Cardiovasc Pharmacother [Soomro AY, Guerchicoff A, Nichols DJ, Suleman J, Dangas GD. The current role and future prospects of D-dimer biomarker. Eur Heart J Cardiovasc Pharmacother. 2(3): 175-184], derechos reservados (2016).
Figura 1: Formación del dímero-D y otros productos de degradación de la fibrina.
Angiografía pulmonar por tomografía computarizada
La angiografía pulmonar por tomografía computarizada (APTC) constituye la prueba de imagen diagnóstica más utilizada para EP en pacientes hemodinámicamente estables.38,39 Resulta evidentemente superior a diferentes métodos de imagen y es considerada un excelente método diagnóstico al permitir apreciar las dimensiones de las cámaras cardiacas y la visualización directa de la circulación arterial pulmonar posteriormente a la inyección intravenosa (IV) de un medio de contraste yodado; en muchos casos, es capaz de detectar hallazgos incidentales en la mayoría de los individuos, los cuales ocasionalmente permiten explicar su sintomatología.40,41 La APTC genera imágenes de alta resolución que son capaces de visualizar elementos de sexto orden de la vasculatura pulmonar. Un marcador importante de IVD es el índice o relación VD/VI; se ha establecido que aquellos sujetos en quienes se realiza la APTC y se determina una relación ventrículo derecho/ventrículo izquierdo ≥ 0.9 presentan un riesgo mayor de mortalidad dentro del primer mes de la EP, por lo que proporciona información valiosa en términos pronósticos.42
Entre sus ventajas están el ser un método no invasivo y de rápida realización que posee una sensibilidad y especificidad elevadas (96-100% y 97-98%, respectivamente), sobre todo en los modernos dispositivos de tecnología multicorte. Sin embargo, se deben mencionar desventajas de esta modalidad diagnóstica, ya que la utilización de radiación ionizante y el riesgo de nefropatía inducida por el medio de contraste es de 4%.43,44 Se ha reportado en diversas investigaciones que la APTC incrementa el riesgo de padecer cáncer de mama hasta en un 14% después de la administración de una dosis de 10 mGy.45
La APTC deberá ser utilizada en combinación con una escala de predicción clínica. Los criterios diagnósticos aceptados para EP por APTC son: 1) ausencia de opacificación del lumen vascular a expensas de un defecto de llenado central, 2) un defecto de llenado parcial rodeado por material de contraste en un corte transversal, 3) la presencia de material de contraste entre el defecto de llenado central y la pared arterial en un corte longitudinal o 4) un defecto intraluminal periférico que forma un ángulo agudo con la arteria.46,47 Se ha demostrado en varios estudios que una APTC con resultado negativo descarta de manera segura el diagnóstico de EP, puesto que existe un riesgo muy bajo de ETV a los tres meses en personas sin tratamiento después de una APTC negativa (1.2%, [intervalo de confianza de 95%, 0.8-1.8]).48
Angiografía por resonancia magnética (ARM)
La imagen por resonancia magnética (IRM) ha sido recientemente evaluada por algunos investigadores como una técnica alternativa para el diagnóstico de la EP; empero, aún no se recomienda su empleo aislado como prueba diagnóstica; por ello, se combina con otras técnicas no invasivas como la angiografía pulmonar.49 La ARM posee una elevada sensibilidad (77-100%) para el diagnóstico de la EP proximal; sin embargo, se ha reportado una baja sensibilidad en el diagnóstico de la misma ante la segmentación progresiva y extensión distal de la arteria pulmonar (84% en las arterias segmentarias y 40% en las subsegmentarias), así como una tasa elevada de estudios técnicamente inadecuados. Por otro lado, hay reportes donde la IRM ha demostrado tener una alta especificidad (97.4-100%) en el diagnóstico de la EP; sin embargo, no son resultados contundentes.50
Es bien sabido que la IRM presenta gran susceptibilidad a los artefactos, lo cual podría limitar su uso; a pesar de las implementaciones técnicas, la tasa de resultados inconclusos llega a alcanzar valores de hasta un 30%. Otra de las limitaciones en el uso de la IRM es el riesgo inherente de fibrosis sistémica nefrogénica inducida por medios de contraste a base de gadolinio, tales como la gadodiamida y el gadopentetato de dimeglumina, en pacientes con insuficiencia renal.51 Otras desventajas de esta modalidad diagnóstica son la duración prolongada del proceso de examinación y la baja disponibilidad del equipo en cuestión, sobre todo en el escenario de urgencias hospitalarias. Actualmente, la ARM no está recomendada como opción principal y para su realización se sugiere en centros hospitalarios que cuenten con personal altamente especializado y capacitado, así como en aquellos individuos con alguna contraindicación para las pruebas estándar.52
Gammagrafía pulmonar de ventilación/perfusión
La gammagrafía pulmonar estudia dos funciones esenciales: perfusión pulmonar y ventilación. Dicha técnica involucra comúnmente la demostración de perfusión pulmonar empleando un bloqueo capilar limitado a través de partículas radioactivas inyectadas (microesferas de albúmina humana o microagregados de albúmina marcados con tecnecio-99m [99mTc-MAH y 99mTc-MAA, respectivamente]), así como la evaluación del intercambio gaseoso utilizando gases o aerosoles inertes inhalados (81mKr y ácido dietilentriaminopentaacético marcado con tecnecio-99m [99mTc-ADTP], entre otros).53 Se trata de una prueba esencialmente cualitativa que muestra una ventaja sobre la mayoría de las pruebas cuantitativas de la función pulmonar global al ser capaz de distinguir entre neumopatía difusa y regional, con la opción de una semicuantificación locorregional.54
La gammagrafía de ventilación/perfusión resulta una herramienta diagnóstica de utilidad para la detección y seguimiento clínico de la EP. La visualización de la vía aérea regional y la integridad vascular constituyen el fundamento del diagnóstico gammagráfico de dicha entidad, siendo a la vez su principal indicación. La gammagrafía pulmonar tiene ciertas ventajas en comparación con la tomografía computarizada helicoidal (TCH), sobre todo en lo concerniente a la detección de émbolos pulmonares más periféricos y de menores dimensiones, así como la necesidad de una menor dosis de radiación. Adicionalmente, resulta factible descubrir de forma incidental hallazgos indicativos de otras neumopatías, tales como enfermedad pulmonar obstructiva crónica (EPOC), neumonía e insuficiencia cardiaca izquierda, entre otras.55
Las anomalías ventilatorias comúnmente ocasionan una redistribución de la perfusión pulmonar. La hipoventilación condiciona hipoxia regional y una redistribución refleja de la perfusión distante a las regiones hipoventiladas.56 Se recomienda contar con una radiografía de tórax en dos proyecciones distintas al momento de la gammagrafía para definir o excluir la presencia de infiltrados, derrame pleural, neumotórax o lesiones ocupantes de espacio al interior del tórax. Siempre que sea posible, se deberá adicionar una prueba simple de función pulmonar, como la espirometría con parámetros ventilatorios forzados.5
Tomografía computarizada helicoidal (TCH)
Con esta modalidad se obtiene una imagen volumétrica bidimensional del sujeto mediante un detector rotacional.57 Los émbolos pulmonares se aprecian como defectos de llenado en la circulación pulmonar, pueden tener una localización central, mural o excéntrica y ocluir parcial o totalmente una arteria pulmonar. De forma adicional, la TCH proporciona valor pronóstico al evaluar las dimensiones del VD y, en ciertos casos, establecer diagnósticos alternativos.58 Esta prueba de imagen tiene reportada una sensibilidad para el diagnóstico de EP de 53-100%, generalmente baja en caso de obstrucción de arterias subsegmentarias periféricas; asimismo las especificidades van del 81 al 100%.59
La TCH con medio de contraste se ha convertido en la modalidad de imagen preferida en el caso de sospecha de EP en muchos hospitales, pues su resultado es inequívoco, se demuestra o descarta la presencia de un trombo. Tiene la desventaja de no encontrarse disponible en todos los centros hospitalarios. Cabe destacar su contraindicación en personas con insuficiencia renal y/o alergia al medio de contraste.60
La TCH no debe utilizarse como prueba única para descartar la presencia de EP, puesto que no se ha determinado la seguridad clínica de retardar la terapia anticoagulante tras un estudio con resultados normales. La TCH resulta útil en combinación con otras pruebas diagnósticas, particularmente después de una primera ronda diagnóstica que haya incluido escalas de probabilidad clínica y determinación de dímero-D.61
Rayos X
Se trata de una modalidad diagnóstica con baja sensibilidad; puede llegar a ser normal inclusive en pacientes con una clínica altamente sugestiva de EP. La radiografía torácica cobra importancia para corroborar o excluir el diagnóstico de otras entidades patológicas con un cuadro clínico similar a la EP. En un trabajo de Abbas y colaboradores se demostró que el signo radiológico de Westermark (oligohemia focal con hipertransparencia pulmonar) estaba presente en 8-14% de los casos confirmados de EP. Otros hallazgos radiológicos típicos de la EP son el signo de Fleischner (dilatación de la arteria pulmonar en el sitio de enclavamiento del émbolo) y la joroba de Hampton (condensación parenquimatosa focal segmentaria cuneiforme con base pleural y vértice central, correspondiente a la zona de infarto pulmonar). Asimismo, el signo de Palla (rama descendente de la arteria pulmonar derecha prominente) representa un posible hallazgo imagenológico. Por último, existen datos radiográficos inespecíficos que, no obstante, pueden evidenciarse en la EP, tales como la elevación del hemidiafragma y reducción del volumen del pulmón afectado, imágenes de derrame pleural y atelectasias laminares.62-64
Electrocardiograma (ECG)
El ECG es generalmente anormal en caso de EP; sin embargo, sus hallazgos no son lo suficientemente sensibles o específicos. Por ello, resulta particularmente útil para descartar otras patologías que también ponen en riesgo la vida, como el infarto agudo al miocardio (IAM). Es posible identificar los siguientes hallazgos electrocardiográficos: taquicardia sinusal, bloqueo completo/incompleto de la rama derecha del haz de His, ondas T invertidas en derivaciones precordiales derechas (V1, V2, V3, V4, DII, DIII y aVF), dextrorrotación del eje cardiaco, onda R dominante en V1, hipertrofia atrial derecha (onda P pulmonale), onda S persistente en V6, taquiarritmias atriales y elevación/descenso del segmento ST. Cabe destacar que Zhan y colaboradores objetivaron en una investigación la presencia del patrón electrocardiográfico SI-QIII-TIII (complejo de McGinn-White) en 15-25% de los individuos con EP confirmada.65-67
Ecocardiograma
El ecocardiograma es un método diagnóstico capaz de definir el grado de repercusión funcional del VD secundaria a TEP; asimismo, posee implicaciones terapéuticas y pronósticas, pues permite determinar las dimensiones de las cavidades cardiacas derechas y calcular la PAPS.68 Se ha reportado un VPN para el ecocardiograma del 40-50%; por ello, un resultado negativo no excluye el diagnóstico de EP. Por otro lado, los signos de sobrecarga o IVD también pueden observarse aun en la ausencia de EP y estar condicionados por alguna cardiopatía/neumopatía subyacente.69
Los siguientes son posibles hallazgos ecocardiográficos en la EP:70
Dilatación ventricular derecha en alrededor del 25% de los casos.
Contractilidad disminuida de la pared libre del VD en comparación con su ápex (signo de McConnell).
Trombos móviles en corazón derecho (detectados sobre todo mediante ecocardiografía transtorácica o transesofágica).
La exploración ecocardiográfica es un requisito de la evaluación diagnóstica en sujetos hemodinámicamente estables, normotensos, con sospecha de bajo riesgo para EP. En caso de sospecha de alto riesgo para EP, la ausencia de signos ecocardiográficos de sobrecarga ventricular derecha o insuficiencia prácticamente excluye a la EP como la causa de la inestabilidad hemodinámica.71
Ecografía venosa (EV)
En la mayoría de los casos, la EP se origina a partir de una TVP en un miembro pélvico. Actualmente, la EV ha reemplazado a la venografía como prueba diagnóstica de TVP, con una sensibilidad mayor al 90% y especificidad del 95% para TVP sintomática. La EV demuestra la presencia de TVP en 30-50% de las personas con EP; asimismo, encontrar TVP proximal en pacientes con sospecha de EP constituye una indicación para iniciar la terapia anticoagulante sin necesidad de realizar pruebas adicionales.72 Sin embargo, en múltiples estudios clínicos retrospectivos y prospectivos se ha encontrado que solamente 0-22% de los individuos con diagnóstico de EP presentan de forma simultánea TVP en las extremidades inferiores.73
En caso de sospecha de EP, la EV se puede limitar a una simple exploración en cuatro puntos (regiones inguinales y fosas poplíteas). El único criterio diagnóstico validado para TVP es la compresibilidad incompleta de la vena, lo cual señala la presencia de un coágulo, mientras que las mediciones de flujo se consideran poco confiables. El rendimiento diagnóstico de la EV en EP sospechada puede incrementarse mediante la realización de una ultrasonografía completa que incluya también las venas distales.74
Pletismografía de impedancia (PI)
La PI es una técnica no invasiva establecida para detectar trombosis proximal (venas poplíteas, femorales e iliacas) en sujetos con un primer episodio de trombosis venosa clínicamente sospechada. Tiene como finalidad cuantificar los cambios en el volumen sanguíneo del miembro pélvico en términos de modificaciones en la resistencia eléctrica; es decir, la impedancia. Dicho instrumento provee una corriente eléctrica débil y constante que pasa a través de la pantorrilla y es detectada mediante electrodos situados en la región crural.75 Las variaciones en el volumen sanguíneo son producidas por la insuflación de un manguito crural a una presión que excede la presión venosa pero es menor a la presión arterial diastólica. Al dejar de ejercer presión mediante dicho manguito, se debe presentar un flujo venoso rápido en los miembros pélvicos normales; sin embargo, en presencia de trombosis venosa, el vaciamiento venoso es lento. Con el advenimiento de la EVC, la PI ha caído en desuso.76
Flebografía
La flebografía con contraste representa el método diagnóstico tradicional de TVP. Más recientemente, se ha implementado la flebografía por medicina nuclear, la cual emplea fibrinógeno marcado. A semejanza de la PI, la flebografía ha sido desplazada gradualmente por los métodos no invasivos.77
Pruebas de laboratorio y marcadores biológicos
La EP está caracterizada por anormalidades en el intercambio gaseoso. Es bien sabido que el establecimiento de un cortocircuito intrapulmonar es el principal factor generador de hipoxemia y disminución de la PaO2 en la EP. Diversos trabajos han demostrado que la leucocitosis contribuye como un factor diagnóstico y pronóstico en personas con EP, ya que un contexto clínico y un conteo de glóbulos blancos ≥ a 11,000/mm3 están relacionados con un incremento en la mortalidad durante los primeros 30 días de ingreso hospitalario.78
Las dimensiones del émbolo, el grado de obstrucción del lumen vascular, el tiempo de embolización y la patología cardiopulmonar subyacente son distintos factores que eventualmente determinan el grado de afección del intercambio gaseoso. Por otro lado, durante la EPA se presenta una respuesta compensatoria de hiperventilación, la cual eventualmente ocasiona hipocapnia y disminución de la PaCO2, con la alcalosis respiratoria concomitante.79 Conforme progresa la EP, es posible detectar incremento en los niveles séricos de la enzima lactato deshidrogenasa; esto sugiere daño celular y/o necrosis.80
La proteína cardiaca de unión a los ácidos grasos (PCUAG) es una proteína citosólica de bajo peso molecular que se detecta en el torrente sanguíneo tras un IAM; en el contexto de una EPA, la tensión incrementada en el VD ocasiona daño miocárdico y la liberación subsecuente de PCUAG. Investigaciones previas han demostrado que la PCUAG posee una sensibilidad y VPN elevados, lo cual permite estratificar de forma temprana a la EPA con mayor riesgo de eventos adversos y/o mortalidad.81 Otros marcadores de daño miocárdico como la troponina T, péptido natriurético cerebral (PNC) y el fragmento N-terminal de su prohormona (NT-proPNC) se consideran actualmente biomarcadores vigentes y muy útiles en pacientes con EP.82 El PNC y NT-pro PNC son indicadores altamente sensibles de IVD, por lo que pueden emplearse con fines de exclusión de mortalidad elevada o complicaciones en caso de EPA.83-85
La lipocalina asociada con la gelatinasa de los neutrófilos (LAGN) es una sustancia implicada en la formación de nefronas en el riñón embrionario; su síntesis se ve incrementada de forma masiva ante una lesión renal aguda (LRA). Kostrubiec y colaboradores demostraron en un estudio que hasta un 30% de los individuos con EPA presentan datos de LRA, lo cual se encuentra asociado con un incremento de los niveles séricos de LAGN. La cistatina C es un marcador endógeno de disfunción renal, se detecta en el plasma antes del incremento de la creatinina. Asimismo, la elevación de los niveles de cistatina C y una reducción en la tasa de filtrado glomerular (TFG) están asociadas con un peor pronóstico de la EPA en los primeros 30 días.86
Conclusiones
La EP constituye la presentación clínica más severa de la ETV. La mayoría de las veces, la EP es consecuencia de la TVP; por ello, la información existente en la actualidad respecto a su epidemiología, factores de riesgo e historia natural de la enfermedad se encuentra determinada por trabajos que analizan a la ETV de forma general. El cuadro clínico de la EP puede ser muy inespecífico; por tanto, los sujetos con sospecha de dicha patología deben ser sometidos a múltiples estudios de laboratorio y gabinete capaces de confirmarla o, en su defecto, plantear diagnósticos diferenciales. Existen diversas herramientas diagnósticas con utilidad en la EP, como escalas de predicción clínica (Wells y Ginebra modificadas), dímero-D, gasometría arterial, citometría hemática completa, determinación sérica de troponina y/o PNC, angiografía, flebografía, TCH, IRM, radiografía torácica, gammagrafía pulmonar de ventilación/perfusión, electrocardiografía, ecocardiografía y ecografía venosa, entre otras.











 nueva página del texto (beta)
nueva página del texto (beta)



