Introducción
La flora brasileña es reconocida como la más grande del mundo (BFG, 2022; Flora e Funga do Brasil, 2022). El bosque Atlántico se destaca entre los biomas brasileños por presentar alta diversidad y endemismo; sin embargo, actualmente tiene solo 12.4% de su cobertura vegetal original y es considerado uno de los 34 hotspots de conservación de la biodiversidad y uno de los ecosistemas más amenazados del mundo (Myers et al., 2000; SOS Mata Atlântica e INPE, 2020).
El bosque Atlántico comprende 2 tipos principales de vegetación: el bosque costero o bosque lluvioso Atlántico y el bosque tropical estacional o bosque Atlántico semicaducifolio. El bosque costero comprende las elevaciones bajas a medias (~ 1,000 m snm) de la cadena montañosa que corre a lo largo de la costa del sur al noreste de Brasil, con clima cálido y húmedo sin una estación seca. El bosque tropical estacional se extiende a lo largo de la meseta (usualmente > 600 m snm) en el centro y sureste interior del país con clima estacional con una estación seca relativamente severa, entre abril y septiembre (Morellato y Haddad, 2000; Oliveira y Fontes, 2000).
Entre las 35,500 especies de angiospermas brasileñas, 15,553 (43.6%) se encuentran en el bosque Atlántico, y de éstas, 8,413 son endémicas de este bioma (54.1%) (Flora e Funga do Brasil, 2022). Las familias de las especies presentadas en este trabajo también reflejan gran riqueza y endemismo (Tabla 1). El presente trabajo reporta 9 nuevos registros de 5 familias para el bosque Atlántico. Presentamos la descripción morfológica de las especies, comentarios taxonómicos y comentamos sobre el estado de conservación, así como la distribución geográfica y fotografías.
Tabla 1 Cantidad de especies en Brasil y endémicas del bosque Atlántico para las familias de las especies tratadas en este trabajo. Datos: Acanthaceae y Apocynaceae (Flora e Funga do Brasil, 2022); Aristolochiaceae (Freitas et al., 2020); Asteraceae (Roque et al., 2022) y Monimiaceae (Lírio et al., 2020).
| Família | Géneros en Brasil | Especies en Brasil | Géneros endémicos del bosque Atlántico | Especies endémicas del bosque Atlántico |
|---|---|---|---|---|
| Acanthaceae | 48 | 498 | 3 | 176 |
| Apocynaceae | 94 | 974 | 3 | 176 |
| Aristolochiaceae | 1 | 83 | 0 | 18 |
| Asteraceae | 326 | 2,205 | 19 | 384 |
| Monimiaceae | 5 | 44 | 3 | 36 |
Materiales y métodos
Este estudio se basa en información adquirida a partir de especímenes recolectados en campo y ejemplares de los herbarios: ALCB, BHCB, CEN*, CEPEC, CVRD, HCF*, HRCB, HSTM, HUEFS, IAC, IAN, INPA, MBML, M, MG, MO*, NY*, P, R, RB, SP, SPF, UEC y VIES (Thiers, 2022). Especímenes de colecciones indicadas con “*” fueron estudiadas con base en imágenes digitales disponibles en los herbarios virtuales (REFLORA, 2022; Specieslink, 2022). Las descripciones que usan caracteres morfológicos generales de las especies siguen a Font Quer (1953) y Harris y Harris (2001), salvo aquellos caracteres propios de las flores y frutos de Aristolochia que fueron descritos de acuerdo con González (1990). Para el caso de Macropeplus se sigue a Santos y Peixoto (2001), para Mollinedia se sigue a Lírio et al. (2020) y Perkins (1900), para Odontadenia a Morales (1999) y con la descripción de las partes de la corola, a Morales y Fuentes (2004). Para Pseuderanthemum se siguió a Rodrigues (2019), para Ruellia según Braz et al. (2002) y para Senecio a Matzenbacher y Schneider (2008) y Teles et al. (2022).
Descripciones
Acanthaceae
Pseuderanthemum congestum (S.Moore) Wassh., Prodr. Fl. Matogrossensis 1: 3. 1998. (Fig. 1E-F).

Autores de las imágenes: A, B Mauro Peixoto; C, D Juan Morales; E-H Danilo Zavatin.
Figura 1 A, B, Aristolochia stomachoides. C, D, Odontadenia gracilipes. E, F, Pseuderanthemum congestum. G, H, Ruellia subsessilis.
Hierbas rizomatosas 30-45 cm de altura. Ramas ca. 3 mm de largo, tetragonales, con nudos geniculados, ocasionalmente cilíndricos cuando jóvenes, estriados, pilosos, pubescentes a híspidos, tricomas concentrados a lo largo de 2 estrías, superior y inferior, ramificados, corteza rojiza, descamante, entrenudos ca. 3 mm de largo. Hojas sésiles o raramente pecioladas, pecíolos ca. 2 mm de largo, aplanados, estriados, pubérulos; láminas (2-) 4 (-6) × (1-) 1.5 (-2.5) cm, lanceoladas a ovado-lanceoladas, ápice agudo, base sésil, más raramente decurrente cuando peciolada, margen ciliado, membranáceas, pubérulas a híspidas en ambas caras, tricomas concentrados a lo largo de las venas primarias y secundarias. Inflorescencia dicasios axilares o terminales, fasciculados, 1 flor en la axila de la rama terminal, pedúnculo ca. 2 mm de largo, híspido, tricomas amarillentos; brácteas 1 par en la base del pedúnculo y solitaria, inconspicuas; bractéolas lanceoladas, 1-1.2 × 0.4-0.6 mm, ápice agudo, margen no ciliado, pubescentes, tricomas glandulares. Flores pediceladas, 1-1.3 mm de largo; cáliz 3-4 mm de largo, sépalos fusionados en la parte inferior, lobos subulados, híspidos, tricomas glandulares; corola (0.8-) 1 (-1.5) cm de largo, pubérula, lila a azul pálido, tubo cilíndrico ca. 1 cm de largo, lobos ca. 6 × 3-5 mm; estambres incluidos, 8.4-7 mm de largo, filete ca. 6.5 mm de largo, tecas ca. 2 mm de largo; estaminodios hasta 1.2 mm de largo, estilete 1-1.2 cm de largo, glabro, estigma simple. Cápsulas 1.6-2 × 0.2-0.4 cm, pubescentes, tricomas glandulares erguidos, similar al cáliz. Semillas ca. 0.6 × 2 mm, glabras.
Material examinado: Brasil: São Paulo: Americana, borda de mata ciliar do rio Piracicaba (22°40’57” S, 47º21’59” O, 509 m) fl., 12 ago. 2020, D.A. Zavatin y E.Z. Viana 255 (SPF); ídem (22°40’57” S, 47º21’59” O, 509 m) fl., 13 ago. 2020, D.A. Zavatin y E.Z. Viana 258 (SPF); ídem: Goias: Alvorada do Norte, beira do rio Santa Maria, lado direito (14°29’17” S, 46º51’02” O, 467 m) fl., 29 ago. 2003, A.C. Sevilha et al. 3209 (CEN 58254).
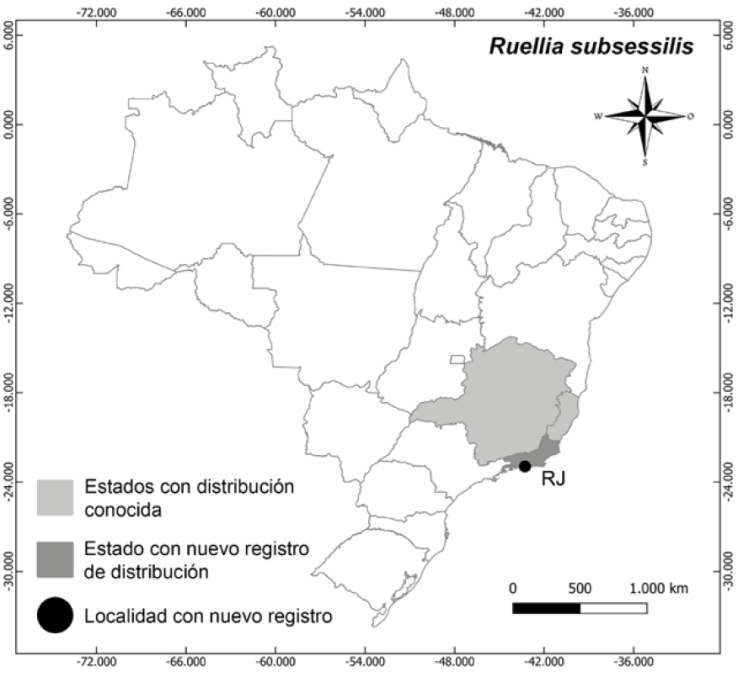
Distribución, hábitat y estado de conservación: Pseuderanthemum congestum crece generalmente en suelos arenosos en las sabanas húmedas y bosques estacionales de Bolivia (departamentos de El Beni, Santa Cruz y Pando). En Brasil se encuentra en los bosques de transición entre Caatinga y Bosque húmedo, bosque de tierra firme, pradera de ríos, bosques de Igapó y en bosques mixtos, en los estados de Acre, Amazonas, Ceará, Goiás, Mato Grosso, Pará y Rondônia (Rodrigues, 2019; Rodrigues y Souza, 2022). La especie fue recolectada en la ciudad de Americana, estado de São Paulo, en bosque estacional semideciduo, en suelo arenoso cerca del río Piracicaba, aumentando su distribución como primer registro para todo el bosque Atlántico, la región sudeste brasileña y en el estado de São Paulo (Fig. 2). La especie no posee evaluación para su estado de conservación.
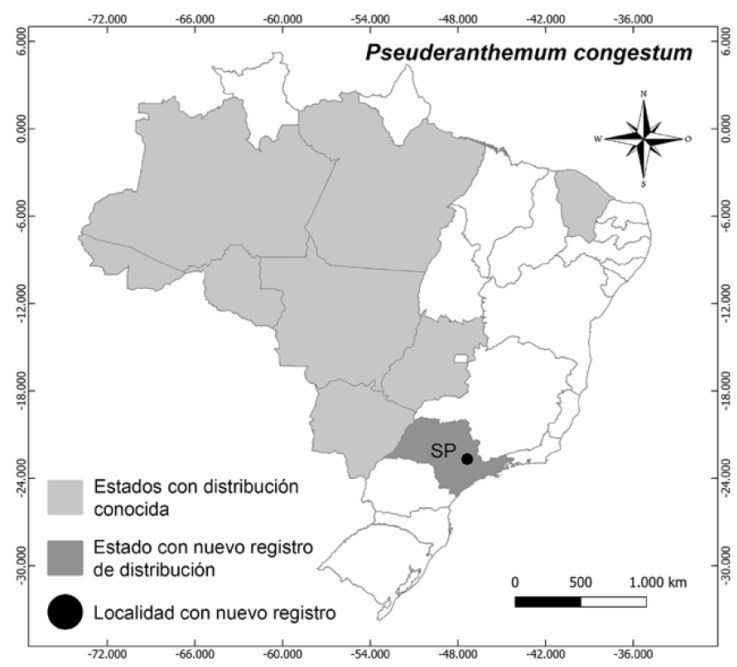
Figura 2 Pseuderanthemum congestum: distribución conocida y nuevo registro reportado en este trabajo.
Fenología: recolectada con flores y frutos verdes en agosto.
Comentarios taxonómicos
La especie se asemeja a P. heterophyllum (Nees) Radlk. por las hojas membranosas e inflorescencia en dicasios axilares o terminales, pero puede ser diferenciada por el tallo rizomatoso con nodos geniculados y corteza rojiza descamante y hojas no anisófilas, en contraposición de P. heterophyllum, la cual presenta tallo no rizomatoso sin nodos geniculados y corteza marrón descamante y hojas anisófilas (Rodrigues, 2019).
Ruellia subsessilis (Mart.) Lindau in Engler y Prantl, Nat. Pflanzenfam. 4(3b): 311. 1895. (Fig. 1G, H).
Arbustos, 0.7-1.5 m de altura. Ramas ligeramente comprimidas, tricomas simples, densos en los extremos. Pecíolo 2-8 mm de largo; lámina elíptica a estrechamente elíptica, 14-32 × 4-9 cm, ápice acuminado, base acuñada a atenuada, margen entero, concolor, glabrescente, nervaduras secundarias 11-14 pares. Inflorescencia en cimas monocasiales, 1-5 flores por rama, pedúnculo y raquis secundario alados; pedúnculo 5.5-30.5 cm de largo; brácteas y bractéolas foliáceas. Flores subsésiles; pedicelo 1.5-3 mm de largo; sépalos lineares, 1.3-2 cm de largo, tricomas multicelulares no glandulares, dispersos; corola rosa a fucsia, blanquecina en la fauce, infundibuliforme; 4-5.5 cm de largo, sin distinción entre porciones basales y apicales, lobos 5-8,7 mm de largo; estambres ligeramente didínamos, filamentos 4-5.3 cm de largo, anteras alargadas, sub-oblongas, 2-4 mm de largo; ovario glabrescente, estilete 4.4-5.2 cm de largo, estigma 2-lobado, lobo anterior muy reducido. Cápsula obovada, 2-3 cm de largo, porción basal sólida reducida, densamente pubescente. Semillas 12-14, orbiculares.
Material examinado: Brasil: Río de Janeiro: Río de Janeiro, caminho Dom Pedro de Alcântara (22°57’16” S, 43º17’08” O, 521 m) fl., 7 feb. 2022, D.A. Zavatin y D.F. Silva 530 (SPF); ídem: Nova Friburgo, Alto Macaé (22°28’19” S, 42º53’11” O) fl., 20 jul. 1891, Glaziou 18397 (P 3566770).
Distribución, hábitat y estado de conservación: Ruellia subsessilis ocurre en el interior de bosques sombreados en los estados de Espírito Santo y Minas Gerais. En el estado de Río de Janeiro, la especie tiene su primera y única recoleta en la ciudad de Nova Friburgo por A.F.M. Glaziou en 1891 (N. 18397) y desde entonces nunca más fue reportada. A pesar de la existencia del registro hecho por Glaziou, la Flora e Funga do Brasil (Fernandes et al., 2022) no ha incluido la presencia de la especie para el estado de Río de Janeiro. En este trabajo reportamos la recolecta de la especie 131 años después para el estado de Río de Janeiro. En la ciudad de Río de Janeiro, la especie fue recolectada en el Parque Nacional da Tijuca (Fig. 3), donde había cerca de treinta individuos cercanos con flores. La especie no posee evaluación para su estado de conservación.
Fenología: la especie fue recolectada con flores en febrero.
Comentarios taxonómicos
Ruellia subsessilis se caracteriza por la cresta monocasial axilar, con pedúnculo y raquis secundario alado, sosteniendo 1-5 flores subsésiles y por la corola de rosa al fucsia, infundibuliforme (Braz et al., 2002). La especie se asemeja a Ruellia capotyra Braz e I. Azevedo, pero puede reconocerse por las hojas sésiles o subsésiles con pecíolos hasta 8 mm, pedúnculos y raquis alados, lobos del cáliz lineares e iguales en tamaño y 12-14 semillas por cápsula (vs. pecíolos 3-7.2 cm, pedúnculos y raquis cuadrangulares, lobos subulados, desigual en tamaño, con el lobo posterior más largo que los otros y 3-8 semillas por cápsula en R. capotyra) (Braz et al., 2020).
Apocynaceae
Odontadenia gracilipes (Stadelm.) Woodson, Annals of the Missouri Botanical Garden 22(2): 294. 1935. (Fig. 1C, D).
Bejuco leñoso, tallos cilíndricos y lenticelados cuando viejos, glabrescentes, estípulas no examinadas. Hojas con peciolos 0.5-1 cm de largo, lámina 7-11 × 2.3-5.3 cm, elíptica, acuminada apicalmente, la base obtusa, glabra adaxialmente, algunas veces puberulenta abaxialmente, nervaduras secundarias prominentes en ambas caras. Inflorescencia con menos de 9 flores laxamente dispuestas, pedicelos 1.1-1.5 cm de largo, brácteas escariosas; sépalos 0.5-0.9 cm de largo, desiguales, ovados, redondeados apicalmente, con 1 ó 2 coleteres en forma alterna con los sépalos, corola subhipocrateriforme, amarillo claro a crema, tubo de 1-1.5 cm de largo, lóbulos 0.7-1 cm de largo, obovados, estambres insertos ca. en la mitad de la longitud del tubo de la corola, anteras 4-5 mm de largo, ovario glabro. Folículos desconocidos.
Material examinado: Brasil: Espírito Santo: Muqui, Torre da Claro, fr., 24 abr. 2007, L. Kollmann et al. 9630 (MBML 29934); ídem: Santa Teresa, Valsugana Velha, fl., 17 may. 1984, W. Pizziolo 90 (MBML 4193); ídem: Nova Lombardia, Reserva Biológica Augusto Ruschi, fl., 23 ene. 2003, R.R. Vervloet y E. Bausen 1729 (CR, MBML 19532, UEC); ídem, camino a Goipabo-Açu, fl., 22 abr. 2003, R.R. Vervloet, E. Bausen y W. Pizziolo 2289 (CR, MBLM 20540, UEC 145743) ídem: São Paulo, sin datos de localidad, fl., 1816-1821, A. St. Hilaire 739 (P). ídem: Guararema, fragmento próximo à rua João Ramos s/n perpendicular ao rio Paraíba do Sul, fl., 20 jan. 2020, E.J. Lírio 1823 (SPF).
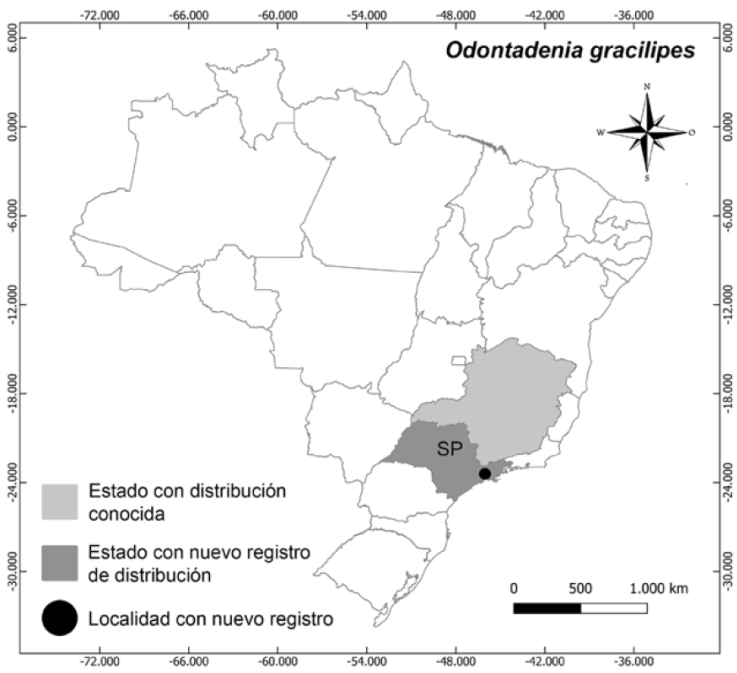
Distribución, hábitat y estado de conservación: Odontadenia gracilipes tiene una distribución hasta ahora conocida solo para el estado de Minas Gerais (BFG, 2022), pero ha sido recolectada recientemente en los estados de Espírito Santo y São Paulo, creciendo en bordes de bosque de galería o en bordes de inselbergs, entre 400-800 m de altitud. Morales (1999) solo reportó una recolecta de Minas Gerais (aparte del tipo). En el estado de São Paulo, existe un espécimen sin localidad precisa recolectado por St. Hilaire durante su expedición en Brasil, que no fue incluido en la monografía de Morales (1999); en este trabajo reportamos la recolecta en la ciudad de Guararema en el estado de São Paulo (Fig. 4). La especie no posee evaluación para su estado de conservación.
Fenología: la especie fue recolectada con flores en enero, abril y mayo y con frutos en abril.
Comentarios taxonómicos
Odontadenia gracilipes es una especie bastante singular que se reconoce fácilmente por el pequeño tamaño de sus corolas hipocrateriformes.
Aristolochiaceae
Aristolochia stomachoides Hoehne Relat. Commiss. Linhas Telegr. Estratég. Mato Grosso Amazonas 5(1): 65, t. 60. 1910. (Fig. 1A-B).
Trepadoras. Ramas cilíndricas con entrenudos 7.2-9.6 cm glabrescentes. Pseudoestípulas ausentes. Pecíolo 2.5-3.8 cm de largo, glabrescente; lámina oval a ovalada estrecha, 6-8.2 × 4.8-6.2 cm, cara adaxial glabra, abaxial glabrescente, cartácea, base cordada (con un sinus 0.5-1.8 cm de profundidad), ápice obtuso a agudo. Flores solitarias, ocasionalmente 2-3 flores por axila, no subtendidas por brácteas; pedúnculo y ovario ca. 2.6-12 cm de largo, glabro. Perianto externamente glabro, beige con vetas vinosas; utrículo ampliamente obovado, ca. 3.1 × 2.3 cm; tubo casi no diferenciado con el utrículo, 1.2-0.8 cm de largo; limbo ovalada a estrechamente ovalada, 1.8-2.3 × 1-1.2 cm, base constreñida, no peltada, ápice agudo, glabro. Cápsula cilíndrica, ca. 6 × 1.5-2 cm, glabra, corto rostrado, con rostro 2-3 mm.
Material examinado: Brasil: São Paulo: Presidente Epitácio, 11 km de Presidente Epitácio a Planalto do Sul (21°46’01” S, 52º06’33” O, 521 m), fl., 15 ene. 2000, M.C.C. Ferreira 09 (UEC 109876); ídem: Mato Grosso: Mundo Novo, Rio Paraná, Porto Frangeli, fl., fr., 29 sep. 2008, J.M. Silva, J. Cordeiro, C.B. Poliquesi y O.S. Ribas 7000 (HCF 28017).
Distribución, hábitat y estado de conservación: la especie ocurre en Argentina (Misiones) y Brasil (Goiás, Maranhão, Mato Grosso do Sul, Mato Grosso, Minas Gerais, Paraná y Tocantins) (Freitas et al., 2020; Gónzalez et al., 2015) y en este trabajo se presenta la expansión de su distribución al estado de São Paulo (Fig. 5). Prospera en bordes de bosques, matorrales y planicies marginales de los ríos, en suelos anegables (Gónzalez et al., 2015). La especie no posee evaluación para su estado de conservación.

Figura 5 Aristolochia stomachoides: distribución conocida y nuevo registro reportado en este trabajo.
Fenología: la especie fue recolectada con flores en enero.
Comentarios taxonómicos
Aristolochia stomachoides se reconoce por su perianto con utrículo y tubo casi no diferenciados, con una forma que recuerda a un estómago, lo que justifica su nombre (Hoehne, 1942).
Asteraceae
Senecio madagascariensis Poir., in Lamark, M., Encyc. Suppl., 5: 130. 1827. (Fig. 6)

Autor de la imagen: Danilo Zavatin.
Figura 6 Senecio madagascariensis. A, Rama con raíces, hojas y flores; B, inflorescencia en vista frontal; C, inflorescencia en vista lateral con corte longitudinal; D, flor del rayo; E, corola; F, capítulo en corte longitudinal con exposición de los aquenios; G, aquenio; H, hoja con ampliación en los dientes del margen.
Subarbusto anual o bianual, hasta 45 cm de altura, ramificado desde la base y con hojas hasta la inflorescencia, ramas estriadas, glabras. Hojas alternas, sésiles, oblanceoladas, agudas en el ápice y atenuadas en la base, dentadas en la margen, penninervias, con nervadura primaria prominente en la cara abaxial, 3.5-6.5 cm × 3-10 mm; glabras, con brillo seríceo en la hipofila, a veces con algunos tricomas esparcidos. Capítulos en corimbos laxos en el ápice de las ramas; pedicelos glabros, 2-5 cm de largo, con brácteas basales lineares. Involucro campanulado, glabro, ca. 5 × 5 mm, caliculado, con bractéolas lanceoladas ca. 2 mm de largo; brácteas involucrales 19-23, linear-lanceoladas, largamente atenuadas en el ápice. Flores blancas en la base y amarillas en el ápice, dimorfas: las del rayo l3, pistiladas, liguladas, con lígula tridentada en el ápice, 5-6 × 1.5-1.8 mm, tetranervadas; las del disco muy numerosas, monoclinas, tubulares, con tubo 4-5 mm de largo; anteras con base sagital; estiletes insertados con ramas reflexas y ápices truncados donde llevan una corona de pelos. Aquenios cilíndricos, numerosos, cortamente seríceo-pubescentes sobre las estrías, ca. 2 mm de largo. Papo caducado, ca. 5 mm de largo.
Material examinado: Brasil: São Paulo: Americana, Parque da Gruta Dainese, área próxima à ponte da rua Florindo Cibin (22°42’52” S, 47º21’10” O, 532 m) fl., 4 dic. 2021, D.A. Zavatin y E.Z. Viana 457 (SPF); ídem: São Paulo, Cidade Universitária, área de borda de mata ao lado do Arquivo Histórico da USP (23°34’12” S, 46º44’02” O, 810 m) fl., 30 mar. 2022, D.A. Zavatin 582 (SPF); ídem: Minas Gerais: Camanducaia, Monte Verde, terreno em frente ao Paulo da truta próximo à cidade (22°51’32” S, 46º01’57” O) fl., 9 jun. 2017, G. Piassa 39 (UEC 199566); ídem: Santa Catarina: Campo Alegre, Serra do Quiriri (26°19’24” S, 49º26’55” O, 1,300 m) fl., 14 sep. 2007, O.S. Ribas, P. Labiak y J Cordeiro 6537 (MBM 301576); ídem, Campos do Quiriri (26°02’12” S, 48º57’12” O) fl., 4 nov. 2014, L.A. Funez, R. Trevisan, J.P.R. Ferreira y S. Venturi 3830 (FLOR 59783); ídem: Doutor Pedrinho, Cerro Azul (26°38’25” S, 49º35’26” O, 957 m) fl., 1 sep. 2010, A. Korte y A. Kniess 4269 (FURB 31964); ídem: Paraná: Balsa Nova, São Luis do Purunã, próximo ao mirante do Cristo (25°28’19” S, 49º38’20” O) fl., 2 sep. 2014, E.D. Lozano 2018 (MBM 428677). ídem: Curitiba, Jardim Botânico Municipal (25°44’19” S, 49º23’88” O) fl., 21 oct. 2005, J. Cordeiro 2257 (FURB 4436); ídem, coleção do campo nativo (25°44’36” S, 49º23’75” O, 920 m) fl., 11 jun. 2015, M.L. Brotto 1945 (MBM 400493); ídem, coleção do campo nativo (25°44’36” S, 49º23’75” O, 920 m) fl., 15. feb. 2016, M.L. Brotto y E. Barboza, 2199 (MBM 402571); ídem: Tarumã, Rua Konrad Adenauer (25°42’13” S, 49º21’72” O, 890 m) fl., 18 nov. 2019, M.L. Brotto 3789 (MBM 429816); ídem, Parque Pedaleiro (25°48’22” S, 49º19’13” O, 900 m) fl., 17. sep. 2016, E. Barboza 4496 (MBM 411733); ídem: Palmeira, Fazenda Santa Rita (25°42’93” S, 50º00’64” O) fl., 10 nov. 2005, J.M. Silva 4503 (JOI 6766); ídem: Piraquara, reservatório Piraquara II, estrada para o morro do canal, próximo ao reservatório (25°51’61” S, 49º01’38” O) fl., 30 oct. 2013, E.D. Lozano 1599 (MBM 428677); ídem: Ponta Grossa, Parque Estadual de Vila Velha (25°25’27” S, 50º59’99” O, 965 m) fl., 20 ene. 2013, M. Savarais 550 (MBM 399118); ídem, propriedade particular -”Furnas gêmeas” (25°23’32” S, 49º99’91” O) fl., 12. ene. 2017, K.S. Valdemarin, T.B. Flores y O.H. Rocha 723 (UEC 195603); ídem, Passo do Pupo (25°14’36” S, 49º96’33” O, 1,000 m) fl., 19 abr. 2009, O.S. Ribas y M. Morales 8223 (MBM 402423); ídem: Nossa Senhora das Pedras, cercado (25°30’08” S, 49º83’33” O, 1,030 m) fl., 17 ago. 2011, O.S. Ribas, J.M. Silva y E. Barboza 8503 (MBM 402465); ídem: Tibagi, Fazenda Pinheirinho (24°63’22” S, 50º41’36” O, 1,080 m) fl., 7 nov. 2016, F. Marinero, M.C. Abbud, P.C. Ferreira, V. Ariati, E.D. Lozano y B.K. Canestraro 499 (MBM 407160).
Distribución, hábitat y estado de conservación: la especie es originaria de Esuatini, Islas Mascarenes, Madagascar, Mozambique y Sudáfrica (Ramadan et al., 2010; Scott et al., 1998; Wijayabandara, 2022) y fue introducida en diversos países como en Argentina, Uruguay y Brasil (Cabrera, 1963; Lombardo, 1983; Matzenbacher y Schneider, 2008). La especie ruderal se presenta como una fuerte invasora tóxica a los animales de pastoreo (Cruz et al., 2010; Grecco et al., 2011). En Brasil se reportó la primera ocurrencia en el estado de Río Grande del Sur en 1995 (Mader et al., 2016; Matzenbacher y Schneider, 2008). En este trabajo se reporta la ocurrencia en los estados de Minas Gerais, Paraná, Santa Catarina y São Paulo (Fig. 7), indicando la dispersión de la especie en Brasil. En el estado de São Paulo, la especie fue recolectada en la ciudad de Americana; la planta estaba en el borde del bosque Atlántico en un área que sufrió deforestación del Parque Gruta Dainese. En la ciudad de São Paulo la planta estaba dentro de la Universidad de São Paulo en el borde del bosque Atlántico.
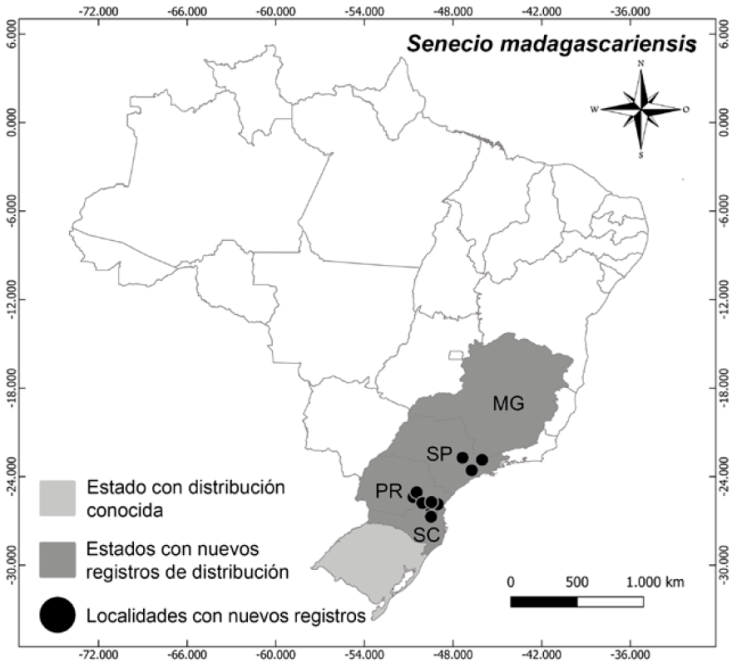
Figura 7 Senecio madagascariensis: distribución conocida y nuevo registro reportado en este trabajo.
Fenología: recolectada con flores en los meses de enero, febrero, marzo, junio y de agosto a diciembre.
Comentarios taxonómicos
Senecio madagascariensis puede ser reconocido por su tamaño herbáceo 10-70 cm, capítulos amarillos dorados ca. 2 cm y hojas sésiles, lanceoladas y dentadas. El número de brácteas involucrales es importante para determinar la especie: entre 16 y 24, ya que S. madagascariensis puede confundirse con Senecio pinnatifolius A.Rich., ambas tienen el mismo tamaño herbáceo e inflorescencias radiadas del mismo color, pero S. pinnatifolius tiene 13 brácteas involucrales. El nombre de la especie hace mención al primer lugar conocido de origen: Madagascar (Wijayabandara, 2022).
Monimiaceae
Macropeplus ligustrinus (Tul.) Perkins, Bot. Jahrb. Syst. 25: 558. 1898. (Fig. 8).

Autor de la imagen: Danilo Zavatin.
Figura 8 Macropeplus ligustrinus: A, Rama con flores estaminadas; B, rama con flores pistiladas; C, ampliación del pecíolo rojizo; D, capullo de la flor; E, capullo en desarrollo; F, apertura de la flor pistilada; G, flor pistilada en antesis; H, flor pistilada después de la fecundación; I, caída de la calyptra; J, frutos jóvenes; K, flor estaminada en corte; L, flor estaminada en vista frontal; M, estambres; N, flor pistilada en corte.
Arbustos o árboles, 1.5-8 m de altura, dioicas; ritidoma liso, ramas cilíndricas, estriados, lenticelados. Hojas opuestas, pecíolo 0.3-1 cm de largo, vinoso, canaliculado, láminas 4-12.5 × 2-4.5 cm, ovadas, elípticas a oblongas, ápice agudo a acuminado, base aguda, enteras o raramente con 3-7 dientes poco prominentes, irregulares, ligeramente revolutas, cartáceas, nervaduras secundarias 8-11 pares, prominentes en la cara abaxial. Flores estaminadas blancas, fragantes, 6-10 (15) × 2-5 mm, en crestas trifloros axilares o extra-axilares, en ramas de crecimiento continuo, pedúnculo 0.7-3.5 cm de largo, pedicelo 0.2-2 cm de largo, brácteas 1-15 mm de largo, ovadas, pubérulas en la cara abaxial, bractéolas 3-7 mm de largo, lanceoladas, receptáculo campanulado, tépalos ca. 3/5 del tamaño de la flor, oblongas a ovadas, ápice agudo, estambres 12-28, anteras oblongas, dehiscentes por hendidura longitudinal, centrales subsésiles, externos con filetes cortos. Flores pistiladas blancas, fragantes, ca. 5.5 × 2 mm, unifloras, axilares o extra-axilares, en ramas de crecimiento continuo, pedúnculo 1.2-1.9 cm de largo, pedicelo 0.6-1.0 cm de largo, brácteas y bractéolas caducas, receptáculo campanulado, tépalos ca. 2/3 del tamaño de la flor, lanceoladas, carpelos 15-26, ovario oblongo, sésil, pubérulo, estigma 1/2 del tamaño del carpelo. Drupeolas verde-amarillentos, rojizos y después morados, 1-1.5 × 0.6-1 cm, elípticas, ápice redondeado, estipitadas o no, estigma persistente, pedúnculo y pedicelo juntos 1.9-2.7 cm de largo, receptáculo fructífero 0.5-0.9 cm de largo, verde-amarillento, reflejo, cicatrices de los frutos sobresalientes.
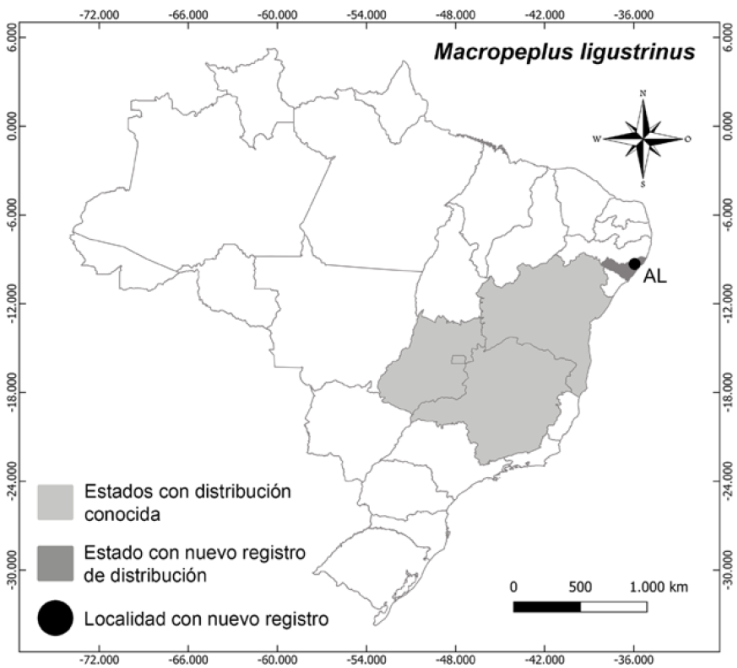
Distribución, hábitat y estado de conservación: Macropeplus ligustrinus es endémico de Brasil y tiene distribución actual en los estados de Bahía, Goiás, Minas Gerais y Distrito Federal (Lírio et al., 2020). La especie ocurre entre 1,000 y 2,400 m de altitud en el bosque Atlántico de Galería bien conservados, ambiente húmedo y siempre asociada a algún arroyo cercano. En este trabajo reportamos la primera ocurrencia de la especie en el estado de Alagoas, en la ciudad de Murici (Fig. 9). La especie se clasifica en su estado de conservación como preocupación menor (LC) (BGCI y UICN, 2019).
Material examinado: Brasil: Alagoas: Murici, Poço d’Anta, somewhere on dirt road to the right off of BR-104 at 17 km from BR-101, past Fazenda Bandaneiras (9°18’36” S, 35º56’31” O) fl., masc., 25 jan. 1993, J.A. Kallunki, J.R. Pirani y R. Lyra-Lemos Viana 377 (NY 454387); ídem: Distrito Federal: Brasília, Jardim Botânico de Brasília, mata de galeria do córrego Cabeça de Veado atrás do viveiro (15°55’26” S, 47º59’15” O, 1,021 m) fl. fem., 29 sep. 2021, D.A. Zavatin 366 (SPF); ídem: Minas Gerais: São Roque de Minas, Parque Nacional Serra da Canastra, interior de grotão de mata Atlântica de altitude atrás da casa do pesquisador (20°15’14” S, 46º25’12” O, 1,315 m) fr., 23 dic. 2019, D.A. Zavatin, A.A. Caetano, W.M. Silva y T.C. Barbosa 180 (SPF).
Fenología: recolectada con flores en el mes de enero.
Comentarios taxonómicos
Macropeplus ligustrinus se reconoce por hojas opuestas, glabras con márgenes dentadas y flores con receptáculo campanulado y tépalos del mismo tamaño que el receptáculo. Además, puede confundirse con M. schwackeanus (Perkins) I. Santos y Peixoto ya que ocurren las veces en el mismo lugar, sin embargo, se diferencia por presentar pecíolos vinosos y hojas cartáceas, oblongas y con 3-7 dientes vs. pecíolos verdes o suavemente vinosos, hojas rígidas-coriáceas, lanceoladas con margen entera o 1-4 diente en M. schwackeanus.
Mollinedia heterantheraPerkins, Bot. Jahrb. Syst. 27: 655. 1900. (Fig. 10A-F).

Figura 10 Mollinedia heteranthera (A-F). A, Flor estaminada; B, hoja; C, ampliación del margen; D, ampliación de la nervadura; E, rama con frutos verdes; F, ampliación del fruto. Mollinedia lamprophylla (G-L). G, Flor estaminada; H, hoja; I, ampliación del margen; J, ampliación de la nervadura; K, rama con frutos verdes y maduros; L, ampliación y exposición de la semilla en el fruto. Mollinedia puberula (M-R). M, Flor estaminada; N, hoja; O, ampliación del margen; P, ampliación de la nervadura; Q, frutos secos; R, ampliación del fruto. Autores de las imágenes: A-D: H.C. de Lima 5932; E, F: U. Gonçalves Fernandes; G-J: J.A. Lombardi 6021; K, L: E. J. de Lírio; M: G. Hatschbach 48618; N-R: J. Rossini 350.
Árbol con 4-10 m de altura, dioica. Hojas opuestas, cartáceas, pecíolo canaliculado, flavescente-tomentoso, 1.9-2.5 cm de largo, láminas 16-21 × 6-12 cm, ovadas, oblongas o elípticas, base cuneada o rotundado‑cuneada y ápice agudo o acuminado en el tierco superior con dientes inconspicuos, cuando adultas glabrescentes en la cara adaxial, excepto a lo largo de las nervaduras, flavescente‑vellosas en la cara abaxial, principalmente en las nervaduras, cicatrices de los tricomas aparentes, semejantes a puntuaciones, nervaduras secundarias 4-7 pares, inconspicuas en la cara adaxial y prominentes en la cara abaxial. Flores estaminadas ca. 3 × 5-6 cm, en crestas trifloras dispuestas en tirsos flavescente-tomentosos, raquis 10-30 (60) mm de largo, pedúnculo 4-8 mm de largo, pedicelo 3-9 mm de largo, brácteas ca. 5 mm de largo, ovadas, ápice agudo, bractéolas ca. 3 mm de largo, ovadas, ápice redondeado, receptáculo plano, tépalos 3/4 del largo de la flor, casi iguales entre sí, externas ovadas con ápice agudo, internas oblongas con ápice deltoide, estambres 22-26, anteras ovadas, lóculos no confluentes en el ápice, sésiles. Flores pistiladas 5-6 cm de largo, unifloras o en fascículos de hasta 3 flores, raquis ca. 10 mm de largo, pedúnculo y pedicelo juntos 8-12 mm de largo, receptáculo cupuliforme, tépalos no observados, carpelos 17-21, flavescente‑tomentosos. Drupeolas ca. 1.5 cm × 1.3 cm, redondeadas, ápice obtuso, estigma persistente, no estipitados, marrón cuando secos, glabrescentes en la maduración, pedúnculo y pedicelo fructífero juntos 2-3.8 cm de largo, receptáculo fructífero ca. 2 cm de largo.
Material examinado: Brasil: Espírito Santo. Ibitirama, Santa Marta, Parque Nacional do Caparaó, parcela 01, individuo 212 (20º29’30” S, 41º44’22” O) feb. 2015, E.A. Araújo 447 (VIES 34779); ídem: São Paulo: Ubatuba, Picinguaba, mata Atlântica de encosta próximo à trilha do corisco, árvore 279 com 17 m de altura, vegetativo, rebrota (23º20’12” S, 44º50’06” O, 120 m) 12 ene. 1997, F. Pedroni 1234 (UEC 173767); idem: Río de Janeiro: Nova Iguaçu, Reserva Biológica do Tinguá, Estrada do Ouro, trilha para o Rancho dos Bobos, mato escuro, vale entre as serras de Tinguá e do Coito (22º34’15” S, 43º28’08” O, 800 m) fl., mas., 14 nov. 2001, H.C. de Lima 5932 (MO 3138001, NY 1018114, RB 221953).
Distribución, hábitat y estado de conservación: Mollinedia heteranthera es endémica del bosque Atlántico en el estado de Río de Janeiro, entre 100 a 1,000 m de altitud, con pocos individuos en los hogares de ocurrencia (Lírio et al., 2020). En este trabajo reportamos nuevos registros en los estados de Espírito Santo y São Paulo (Fig. 11), aumentando la distribución de la especie que actualmente, está categorizada como EN (en peligro) de acuerdo con los criterios de UICN (Moraes et al., 2020).
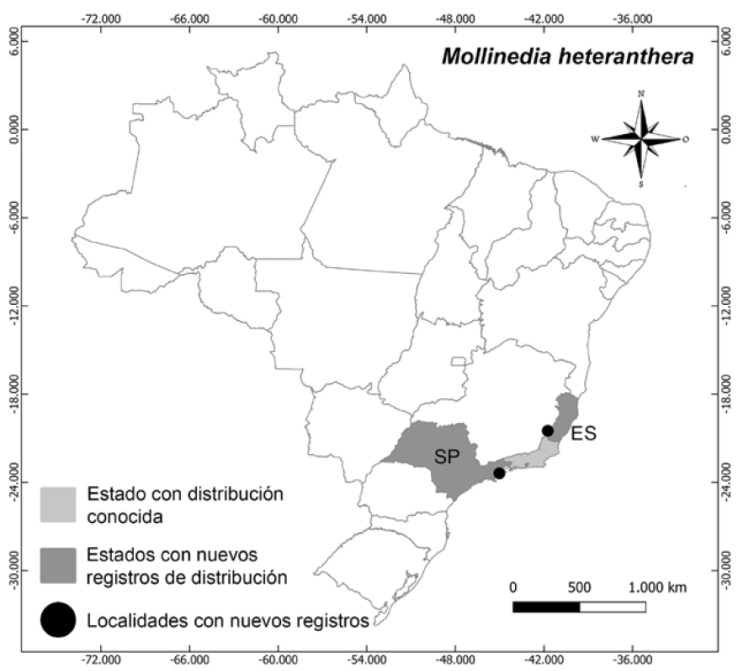
Figura 11 Mollinedia heteranthera, distribución conocida y nuevo registro reportado en este trabajo.
Fenología: recolectada con flores de agosto a noviembre y con frutos de agosto a julio.
Comentarios taxonómicos
La especie se asemeja a Mollinedia lamprophylla Perkins por el indumento flavescente-tomentoso de las partes vegetativas y florales, pero puede ser diferenciada por las hojas sin línea de tricomas en el margen, flores estaminadas con receptáculo plano, estambres 22-26, ovados, lóculos no confluentes en el ápice, conectivo más o menos prolongado en M. heteranthera, en contraposición de M. lamprophylla, a cual presenta hojas con línea de tricomas al margen, flores estaminadas con receptaculo campanulado, 38-48 (80-82), aglomeradas, anteras hipocrepiformes y loculos confluentes en el ápice (Lírio et al., 2020).
Mollinedia lamprophyllaPerkins, Bot. Jahrb. Syst. 27: 656, 1900. (Fig. 10G-L).
Arbustos o árboles 3-15 m de altura, dioica. Hojas opuestas, pecíolo canaliculado, tomentoso, 1-2.4 cm de largo, láminas 14.7-30.5 × 5.1-12.7 cm, elípticas u obovadas, rara vez oblongas, ápice agudo, base obtusa, raro redondeada, margen con 7-30 pares de dientes poco pronunciados desde el tercio proximal o en la mitad distal, coriáceas, buladas, glabra a glabrescente en la cara adaxial, excepto en la nervadura principal y en la margen, que presenta una línea continua de tricomas, flavescente tomentosas en la cara abaxial, nervaduras secundarias 4-11 pares, prominentes en la cara abaxial, hundidas en la cara adaxial. Flores estaminadas amarillas, 5-8 × 6 -10 mm, en crestas trifloras arregladas en tirsos de 9-18 flores, terminales, raro en crestas trifloras aisladas en ramas de crecimiento continuo, ferrugineas a flavescente-tomentosas, raquis 12-15 mm de largo, pedúnculo 5-6 mm de largo, pedicelo 3-5 mm de largo, brácteas oblongas, ápice agudo, ca. 8 mm de largo, bractéolas ovadas, ápice agudo, 3-6 mm de largo., receptáculo campanulado, tépalos 1/2 del largo de la flor, ovadas, externas desiguales, una con ápice redondeado, el otro apéndice corto dentado, internas desiguales, una con apéndice corto, margen irregular, el otro apéndice largo, margen ondulado-dentado, estambres 38-48 (80-82), aglomerados, anteras hipocrepiformes, anteras internas ovadas, externas oblongas, lóculos confluentes en el ápice, sésiles. Flores pistiladas amarillas, ca. 9 mm de largo (caliptra no examinada), solitarias o en fascículos de hasta 4 flores, flavescente-tomentosas, brácteas ovadas, ápice agudo, 7-9 mm de largo, receptáculo cupuliforme, carpelos 16-19, ovario flavescente-piloso, estigma largo, verrucoso. Drupeolas rojizas a atromorados, 1.5-3 × 0.9-1.9 cm, elípticas o subglobosas, ápice redondeado o agudo, estigma persistente, no estipitadas, cuando secas son de color marrón a negruzco, ásperas, velutinas, cuando maduras as veces glabrescentes, pedicelo y pedúnculo frutíferos juntos 1.5-2.4 cm de largo, receptáculo 0.7-1.5 cm de largo, reflejo, viloso, cicatrices de los frutillos salientes.
Material examinado: Brasil: Minas Gerais: Governador Valadares, Usina Hidrelétrica de Baguari, Ilha Bonaparte, local desconocido, fl. mas., 30 jun. 2007, E. Tameirão Neto 4664 (BHCB 10755); ídem: Río de Janeiro: Río de Janeiro, Reserva Florestal da Fábrica Aliança, local desconocido, fl. fem., 14 ago. 1922, J.G. Kuhlmann s.n. (RB 223032); ídem: São Paulo: Ubatuba, Picinguaba, margem do rio da fazenda, Parcela D - Projeto Biota Gradiente Funcional, indivíduo 927, local desconocido, fr., 20 jun. 2008, E.M.B. Prata s.n. (HRCB 51280, HUEFS 178655).
Distribución, hábitat y estado de conservación: Mollinedia lamprophylla es conocida en los estados de Espírito Santo, Río de Janeiro y São Paulo (Campos et al., 2011; Lírio et al., 2020; Prata et al., 2011; Rochelle et al., 2011). En este trabajo presentamos su distribución para el estado de Minas Gerais, en la municipalidad de Governador Valadares (Fig. 12), aumentando su distribución. Fue categorizada como NT (casi amenazado) de acuerdo con los criterios de UICN (CNCFlora, 2012).

Figura 12 Mollinedia lamprophylla, distribución conocida y nuevo registro reportado en este trabajo.
Fenología: recolectada con flores en julio, agosto y septiembre y con frutos en enero, abril, de junio a septiembre y diciembre.
Comentarios taxonómicos
Para comentarios taxonómicos y morfológicos, ver M. heteranthera.
Mollinedia puberulaPerkins, Bot. Jahrb. 27: 668, 1900. (Fig. 10M-Q).
Arbusto o árboles 1.8-13 (20) m de altura, dioicos. Hojas opuestas, pecíolo 0.5-0.8 cm de largo, láminas 5.6-11 × 0.7-3.6 cm, obovadas, oblongo lanceoladas, estrecho-obovadas, estrecho-elípticas, ápice agudo o acuminado, base cuneada, enteras o con hasta 5 pares de dientes irregulares en el tierco superior de la hoja, papiráceas a cartáceas, raramente coriáceas, discolores, cara adaxial más oscura, glabrescente, cara abaxial más clara, gríseo-pubérula, excepto en las nervaduras, nervaduras secundarias 5-8 pares. Flores estaminadas beige a amarillas, 2-2.5 × 2-3 mm, en tirsos de 15-27 cimas trifloras, gríseo-seríceas, raquis 6-25 mm de largo, pedúnculo 2-6 mm de largo, pedicelo 4-8 mm de largo, brácteas ca. 2 mm de largo, oblongas, bractéolas basales ca. 1.5 mm de largo, ovadas, apicales 2-2.5 mm de largo, elípticas, receptáculo campanulado, tépalos ca. 1/2 del largo de la flor, ovadas, externas con ápice obtuso, rectangular, internas con apéndice largo, inflexo, desiguales, una con margen truncada, otra con margen fimbriada, estambres 7-13, anteras hipocrepiformes, sésiles. Flores pistiladas amarillas, ca. 3 × 2 mm, unifloras o en fascículos de hasta 2 flores, gríseo-pubérulas, pedúnculo y pedicelo 3-4 mm de largo, brácteas ca. 2 mm de largo, oblongas, pegadas en la base o en el medio del receptáculo, bractéolas ca. 1 mm de largo, basales ovadas, apical ca. 1 mm de largo, oblongas, receptáculo cupuliforme, tépalos ca. 1/3 del largo de la flor, ovadas, carpelos 13, ovario oblongo, gríseo-piloso, estigma ca. 1/5 del largo del carpelo. Drupeolas rojizas, 1.0-1.2 × 0.7-0.9 cm, orbiculares o elípticas, cuando secas marrones, ásperas, pubérulas a glabrescentes, pedúnculo y pedicelo juntos 0.9-1.6 cm de largo; receptáculo fructífero 0.3-0.6 cm de largo, cicatrices de los frutillos poco salientes.
Material examinado: Brasil: São Paulo: Pindamonhangaba, Fazenda São Sebastião do Ribeirão Grande, trilha da Crista, face N do Talhão 12, local desconocido, fl. fem., fr., 08 oct. 1992, S.A. Nicolau 542 (SP 48146); ídem: Santos, área da Casa de Misericórdia de Santos, trilha 3, fl. mas., 03 oct. 2007, R.J.F. Garcia 3140 (RB 1384182); ídem: Ubatuba, Picinguaba, Parque Estadual da Serra do Mar, Fazenda Capricórnio, parcela J (23º21’55.825” S, 44º05’0.817” O) fl. mas., 12 jun. 2006, J.A.M.A. Gomes 621 (IAC 50500, RB 584738); ídem: Minas Gerais: Lima Duarte, Parque Estadual do Ibitipoca, Mata Grande, local desconocido, fr., 21 sep. 2006, R.C. Forzza 4289 (RB 552387).
Distribución, hábitat y estado de conservación: Mollinedia puberula es conocida en los estados do Espírito Santo y Río de Janeiro, en Bosques Umbrófilos de Montaña y Bosques de Ladera (Lírio et al., 2020), entre 350 a 1,100 m de altitud. En este trabajo reportamos nuevas ocurrencias en los estados de Minas Gerais y São Paulo (Fig. 13), además de también ser reportada para altitudes de hasta 1,220 m. La especie no posee evaluación para su estado de conservación, aunque por sus escasas colectas puede estar amenazada.
Fenología: recolectada con flores en octubre, noviembre y frutos de abril, junio, julio y septiembre.
Comentarios taxonómicos
La especie se parece a Mollinedia triflora (Spreng.) Tul., por la coloración y formato de las hojas, sin embargo, difiere de ésta por las inflorescencias estaminadas multifloras y receptáculo de las flores estaminadas campanulado (inflorescencias estaminadas trifloras y receptáculo plano en M. triflora) (Lírio y Peixoto, 2017).











 nueva página del texto (beta)
nueva página del texto (beta)