Introducción
Los muérdagos enanos son plantas hemiparásitas (parasitismo parcial) del género Arceuthobium; México es centro de diversidad del género, pues alberga 20 de las 42 especies reportadas en el mundo, y de éstas, 12 son endémicas (Geils et al., 2002; Queijeiro-Bolaños y Cano-Santana, 2016); en México parasitan por lo menos a 13 especies del género Pinus, lo cual sugiere una capacidad de infestación alta (Varo-Rodríguez et al., 2016).
Los bosques templados ocupan 15% del territorio mexicano y se distribuyen en 5 regiones principales: Península de Baja California, Sierra Madre Occidental, Sierra Madre Oriental, Sierra Madre del Sur, y Faja Volcánica Transmexicana (FVTM) (Sánchez-González, 2008). El Área de Protección de Flora y Fauna Nevado de Toluca (APFFNT) y el Parque Nacional Izta-Popo Zoquiapan y Anexas (PNIPZA) se localizan en la FVTM; dentro del PNIPZA se encuentra el monte Tláloc (MT), que constituye el séptimo pico más alto del país con una altitud de 4,125 m snm (Iwaniszewski, 1994) y el APFFNT, considerada la cuarta montaña más alta de México, alcanzando una altitud de 4,660 m snm (Montero-García, 2004). Tanto el MT como el APFFNT se caracterizan por la presencia de los bosques del pino de las alturas (Pinus hartwegii Lindl.).
Los bosques de P. hartwegii son de gran importancia ecológica, presentan tolerancia a temperaturas bajas extremas, marcan el límite altitudinal superior arbóreo (4,000-4,200 m snm), contribuyen en la captura de carbono y a la formación de suelo (Rojas et al., 2019), además de que constituyen el hábitat de diferentes especies de fauna endémica, como el teporingo (Romerolagus diazi Ferrari-Pérez) y ajolotes de arroyos de alta montaña (Ambystoma spp.), siendo así proveedores importantes de servicios ambientales e hidrológicos (Endara et al., 2013; Heredia-Bobadilla y Sunny, 2021; Luna-Gil, 2021; Queijeiro-Bolaños y Cano-Santana, 2016). Sin embargo, estos bosques se encuentran sometidos a constante presión antrópica debido a la cercanía con grandes complejos urbanos; esto ocasiona entre otras problemáticas, contaminación de suelo y cuerpos de agua, aumento de la tala ilegal, que reduce la variabilidad genética, además de que, como sugieren algunos estudios, facilita la dispersión de las semillas de muérdago (Endara y Herrera, 2017; Heredia Bobadilla et al., 2018). Las respuestas del bosque ante estos disturbios son cambios en la dinámica de las poblaciones de muérdagos enanos, por ejemplo, el incremento de los niveles de infestación (Endara et al., 2012; Queijeiro-Bolaños et al., 2013). Por otro lado, se conoce que los requerimientos ecológicos de Arceuthobium globosum Hawksworth et Wiens. y Arceuthobium vaginatum Willd. son similares, por lo que, pueden habitar en simpatría en la FVTM (Geils et al., 2002).
Se estima que en México las plantas parásitas se distribuyen en cerca de 1,800,000 ha de zonas forestales (Martínez-Salvador et al., 2015). De acuerdo con Ramírez y Porcayo (2009, 2010), la distribución de muérdagos enanos en el bosque de P. hartwegii es agregada y suele ser más abundante en hospederos jóvenes. En términos de infestación, Queijeiro-Bolaños y Cano-Santana (2016) reportan que A. vaginatum es más agresivo que A. globosum, aunque ambos provocan elevados niveles de infestación y presentan una distribución agregada. Queijeiro-Bolaños et al. (2013) reportan que factores fisiográficos como la altitud están relacionados positivamente con la distribución de A. vaginatum y A. globosum, mientras que los disturbios de origen antropogénico, como el desarrollo de basureros, actividades ganaderas e incendios, favorecen su presencia. La información sobre la distribución espacial de muérdagos en bosques de alta montaña es escasa debido a la complejidad de estos ecosistemas y las grandes superficies de distribución de estas plantas parásitas, por lo que el objetivo de este estudio fue conocer la distribución espacial de de A. vaginatum y A. globosum en los bosques de P. hartwegii del APFFNT y MT e identificar aquellos factores que estén correlacionados directamente con niveles de infestación por muérdagos; en este sentido se plantearon las siguientes preguntas de investigación: 1) ¿qué variables fisiográficas y bióticas influyen en la distribución espacial de los muérdagos enanos? 2) ¿la densidad del bosque influye en el aumento de los niveles de infestación? y 3) ¿la presencia de disturbios de origen antrópico favorece el aumento de los niveles de infestación?
Materiales y métodos
El estudio se realizó en los bosques de P. hartwegii del APFFNT y el MT, esta especie es una de las más representativas en las montañas de la FVTM por las condiciones en las que se desarrolla (Conanp, 2016), ya que tolera bajas temperaturas (hasta -30 °C) y determina el límite superior de la vegetación arbórea (Alfaro-Ramírez et al., 2017; Challenger y Soberón, 2008), siendo el bosque que se establece a mayor altitud en el mundo, en un intervalo de 3,000 a 4,200 m snm (Perry, 1991). En ambas montañas, hacia el límite inferior del bosque de P. hartwegi, se encuentran bosques mixtos de otras especies de pinos (P. montezumae Lamb., P. ayacahuite Ehrenb. ex Schltdl.), encinos (Quercus rugosa Née, Q. laurina Bondpland) y ailes (Alnus acuminata Kunth y A. jorullensis Kunth) (Astudillo-Sanchez et al., 2019; Bolaños-González et al., 2017). El presente estudio se enfocó en los bosques de alta montaña, es decir, aquellos presentes a partir de 3,500 m snm y hasta el límite superior de la vegetación (Endara et al., 2013) y en los que predomina Pinus hartwegii y, ocasionalmente, se pueden encontrar otras especies de coníferas como Abies religiosa Kunth Schltdl. et Cham., Pinus montezumae, P. ayacahuite y P. pseudostrobus Lindl.
El muestreo se realizó durante el periodo de enero 2016 a diciembre 2021. Se establecieron 1,622 sitios de muestreo (SM) en el APFFNT y 634 en el MT (Fig. 1). Se instalaron SM circulares de 0.1 ha (35.6 m de diámetro) utilizando las curvas de nivel (espaciadas a cada 100 m altitudinales) como líneas de acceso al bosque; sobre cada curva se establecieron los SM con una equidistancia de 200 m (APFFNT) y 300 m (MT). La intensidad mínima de muestreo calculada, según Dauber (1995), para el Nevado de Toluca fue de 0.44 y la realizada fue de 1.25, para el monte Tláloc fueron 0.89 y 1.36, respectivamente. Es importante resaltar la importancia del muestreo por curvas de nivel, ya que un incremento en altitud de 100 m implica una reducción de entre 0.6 y 1.2 grados centígrados, es decir, un cambio radical en las condiciones ambientales (Mayer y Ott, 1991).

Fuente: trabajo de campo y Sáenz-Romero et al. (2020).
Figura 1 Distribución de los sitios de muestreo en el Nevado de Toluca (izquierda) y en el monte Tláloc (derecha).
En cada SM se registraron 4 variables fisiográficas, 5 variables correspondientes a características de la vegetación y características que pudieran estar relacionadas con disturbios forestales; en este caso se registró la presencia de 7 tipos de actividades antrópicas (Tabla 1), así como la categoría o edad de las especie arbóreas presentes en el SM, 6 variables dasonómicas y densidad del bosque (Endara et al., 2013; Rojas-García et al., 2019), el nivel de infestación de los árboles con muérdago, según el método de Hawksworth (1983) y también la presencia y nivel de infestación por descortezadores, según Billings y Espino (2005). Esta última requirió la recolecta de individuos adultos, mismos que fueron identificados en el laboratorio de sanidad forestal de la Protectora de Bosques del Estado de México (Probosque).
Tabla 1 Variables de sitio; información colectada en cada Sitio de Muestreo (SM). Se indica entre paréntesis la forma en que se midió cada variable.
| Fisiográficas | Vegetación | Actividades antrópicas (presencia/ ausencia) |
|
|
|
|
Se contabilizaron las plántulas, brinzales y latizales; a las categorías juveniles y fustales se les tomaron medidas dasométricas; con éstas últimas categorías se determinó la densidad del bosque (Endara et al., 2013; Rojas et al., 2019) (Tabla 2).
Tabla 2 Datos obtenidos para Pinus hartwegii a partir de la cuantificación de plántulas, brinzales, latizales, juveniles y fustales.
| Categoría (intervalo de altura-diámetro) | Variables dasonómicas |
|
|
|
Con la información de sitios e individuos se generó una base de datos para visualizarla en el software ArcGIS ver.10.8, en el cual se aplicó la metodología de interpolación de datos del vecino natural (Sibson, 1982), que consiste en la generación de polígonos con base en información de los SM, utilizando el valor del vecino más cercano para formar superficies continuas y así representarlas por condición, sin importar el tipo distribución (Childs, 2004; Declercq, 1996; Lam, 1983; Pirotti y Tarolli, 2010). La generación del mapa de distribución se realizó con base en la presencia-ausencia de cada tipo de muérdago y los diferentes niveles de infestación por sitio.
Se realizaron gráficos descriptivos para analizar si existe una tendencia de establecimiento de muérdago por altitud (Tabla 1) y con una prueba de regresión simple se analizó si la presencia de muérdago está relacionada con factores abióticos (presencia de caminos, extracción, incendios, pastoreo y/o tinas ciegas). Con una prueba de Anova y diferencias mínimas significativas de Fisher (LSD), se analizó si el nivel de infestación difiere por especie de muérdago, se espera que el mayor nivel de infestación sea para A. vaginatum, por ser la especie que tiene mayor distribución y también más hospederos (Queijeiro-Bolaños et al., 2013); para esta prueba se utilizaron los niveles de infestación por muérdago bajo 3 condiciones: muérdago amarillo (A. globosum), muérdago negro (A. vaginatum) y ambos (cuando en un mismo árbol se presentaron las 2 especies de muérdago) (Hawksworth, 1983). Se realizó una prueba de regresión simple para determinar si la densidad del bosque influye en el nivel de infestación por especie de muérdago (Tabla 2). Para realizar esta prueba se utilizaron los valores de porcentaje de cobertura y nivel de infestación por cada una; estas pruebas se realizaron con el programa Statgraphics Centurion XVI v.16.1.03 (StatPoint Technologies Inc., 2009).
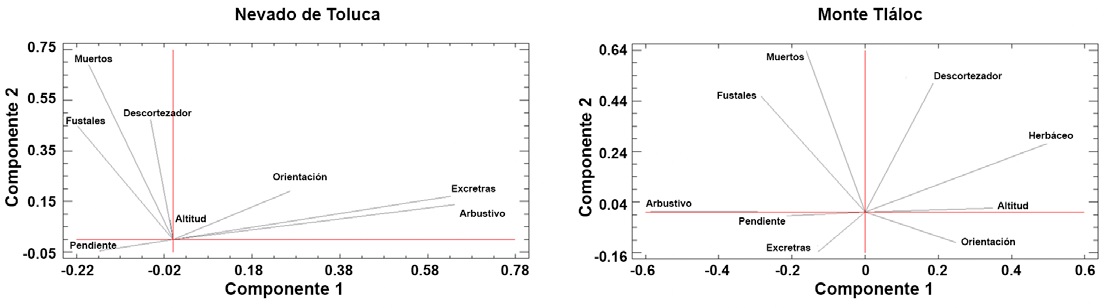
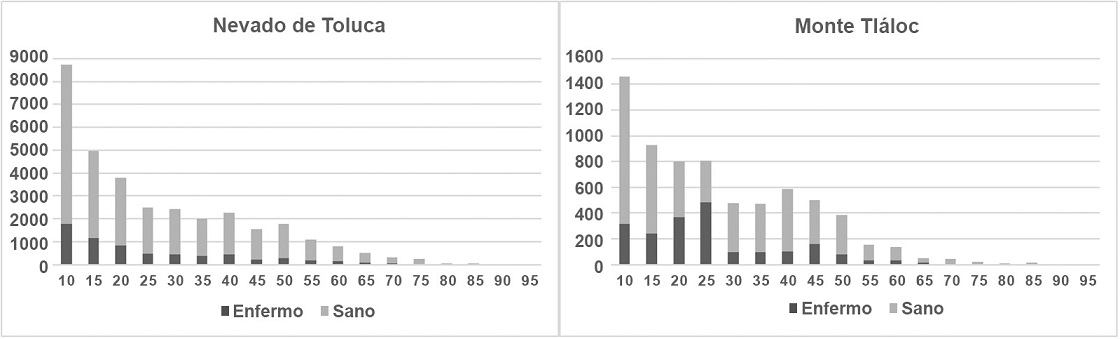
Se estableció qué tipo de variables bióticas -cobertura de copa, porcentaje herbáceo y arbustivo, infestación por descortezador y número de fustale- y abióticas - pendiente, altitud- tuvieron un mayor peso sobre el nivel de infestación por muérdago, con un análisis de componentes principales; se eligió la opción de extraer los componentes principales con base en la matriz de correlaciones, debido a las diferentes unidades en que se midieron las variables consideradas para el análisis. Las comparaciones se hicieron entre grupos de variables (Tabla 1). Se realizaron gráficos de distribución diamétrica por categoría de individuos (fustales y juveniles) y, si éstos eran sanos o enfermos, para establecer qué categoría es más atacada por muérdago según el diámetro normal (DN, 1.3 metros de la base del fuste) (Tabla 2). Para estos análisis se utilizó el programa SPSS Statistics 26 (IBM Corp., 2019).
Resultados
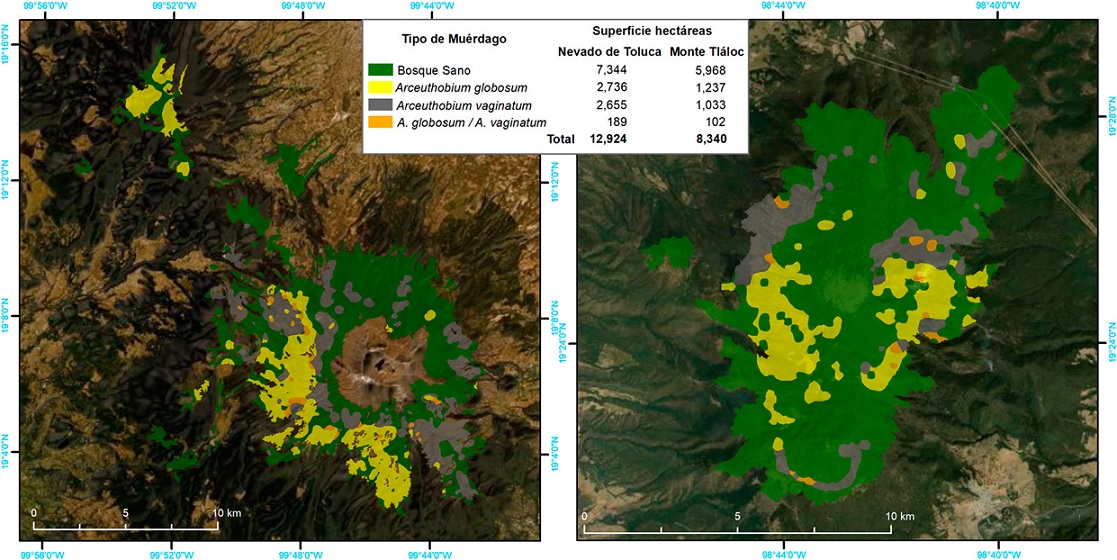
La distribución espacial de Arceuthobium globosum y A. vaginatum en el bosque de Pinus hartwegii de ambas montañas obedece a ciertos patrones: primero, 70% de los SM con muérdago se encuentran entre 3,600 y 3,800 m snm. (Figs. 2, 3); segundo, las mayores infestaciones se concentran en las laderas oeste. La prueba de regresión para determinar si las actividades antrópicas tienen algún efecto sobre la presencia de muérdago no fue estadísticamente significativa para el APFFNT ni para MT (APFFNT: r2 = 0.07%, p = 0.3; MT: r = 0.0%, p = 0.9). En el APFFNT, 43% de la superficie (5,576 ha) presenta algún nivel de infestación de muérdagos enanos, mientras que en MT asciende a 28% (2,373 ha) (Fig. 4). La prueba Anova y la prueba de diferencias mínimas significativas de Fisher (LSD) mostraron diferencias significativas para el nivel de infestación, indicando mayor afectación para infecciones simultáneas (Fig. 5).
Fuente: Trabajo de campo y Sáenz-Romero et al. (2020).
Figura 2 Mapa de la distribución espacial de Arceuthobium globosum y A. vaginatum en el Nevado de Toluca y monte Tláloc.

Figura 3 Distribución altitudinal del muérdago enano en 2 poblaciones de Pinus hartwegii. Los números en el eje Y indican el tipo de muérdago: 2 = Arceuthobium globosum, 3 = A. vaginatum, 4 = individuos con ambos muérdagos, pero donde dominaba A. globosum, 5 = individuos con ambos muérdagos donde dominaba A. vaginatum.

Figura 4 Mapa de los niveles de infestación de Arceuthobium globosum y A. vaginatum en 2 poblaciones de Pinus hartwegii.
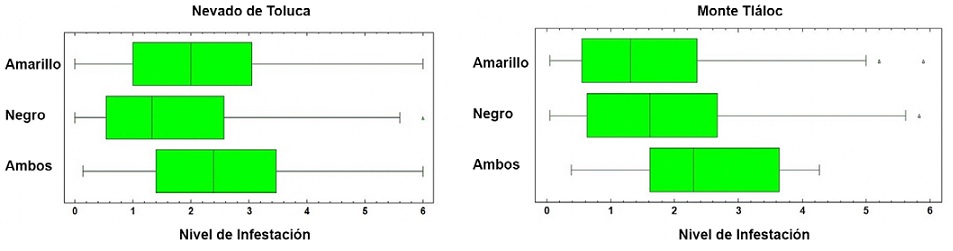
Figura 5 Gráficos de caja y bigotes de la prueba de Anova. Se observan diferencias significativas entre las medias para nivel de infestación por tipo de muérdago en 2 poblaciones de Pinus hartwegii (Nevado de Toluca: F = 15.9, p = 0.000; monte Tláloc: F = 123.17, p = 0.000).
La prueba de regresión entre el valor de infestación del muérdago enano y el porcentaje de cobertura de copa para cada sitio de estudio (APFFNT: r2 = 5.2%, p = 0.000; MT: r = 5.8%, p = 0.000), mostró que para MT los bosques con mayor cobertura forestal presentan menores niveles de infestación (Fig. 6).

Figura 6 Prueba de regresión simple entre el valor de infestación (Hawksworth, 1983) por cobertura forestal (representada como porcentaje de cobertura) en 2 poblaciones de Pinus hartwegii.
El análisis de componentes principales demostró que las variables bióticas tienen una mayor relación con la presencia de muérdago enano en los bosques de P. hartwegii; por otro lado, las actividades antrópicas resultaron no tener incidencia directa con la presencia de muérdago. En el APFFNT, 4 factores explicaron 69% de la variabilidad de los datos, las variables que más contribuyeron al modelo fueron la altitud, orientación, presencia de descortezador y fustales; cada una de estas variables contribuyó con 25.1%, 16.6%, 14.5% y 12.7% de varianza, respectivamente; en el MT, 4 factores explicaron 58% de la variabilidad del modelo, la altitud, el estrato herbáceo, la presencia de descortezador y los fustales, cada uno contribuyó con 18.6%, 14.5%, 13% y 12% de varianza al modelo, respectivamente. La presencia de descortezador y la altitud tuvieron peso sobre la variable muérdago en las 2 áreas de estudio (Fig. 7). Si bien el muérdago enano parasita árboles de todas las categorías diamétricas (Fig. 8), su abundancia es mayor entre los 10 y 25 cm de DN. Los porcentajes de individuos infestados son de 20% para el APFFNT y de 18% para MT, pero en el caso del renuevo (plántulas, brinzales, latizales y juveniles), dicho porcentaje apenas alcanza 4% en ambas montañas, niveles dentro de los límites naturales de parasitismo (Mathiasen, 1998).
Discusión
De las 2 especies de muérdago identificadas Arceuthobium vaginatum y A. globosum, la primera se considera la más agresiva dado que afecta alrededor de 13 hospederos entre ellos P. hartwegii, además de tener mayor presencia de brotes en el fuste de los árboles (Mathiasen et al., 2004; Queijeiro-Bolaños et al., 2011).
Los resultados de las pruebas estadísticas muestran un patrón de correlación entre la altitud y la presencia de muérdago, no así para el nivel de infestación, lo que concuerda con Queijeiro-Bolaños et al. (2013), quienes mencionan que a mayor altitud existe menor presencia de la planta parásita. El trabajo de campo corrobora que la presencia de muérdago sobre P. hartwegii se limita a 4,000 m snm, altitud en la cual el bosque de P. hartwegii parece encontrar el hábitat ideal (Endara et al., 2013). Otro factor que puede influir en la presencia de muérdago es la densidad del bosque, a mayores altitudes la densidad (árboles por hectárea) es baja, lo cual dificulta la dispersión de semillas de Arceuthobium (Hawksworth, 1983), al respecto, se ha reportado que las semillas de estos organismos se desarrollan mejor bajo un dosel forestal denso, estos resultados son similares a lo que reporta Klutsch et al. (2014), quienes encontraron una relación directa entre la densidad forestal y la presencia de muérdago enano y descortezadores (Brunn et al., 2006; Hawksworth, 1983; Queijeiro-Bolaños et al., 2013; Shaw y Weiss, 2000). Esto, a su vez, sugiere una relación directa con la orientación, argumentando que las horas luz, el estrés hídrico y el incremento de la temperatura en las zonas de montaña, pueden afectar a los hospederos y favorecer la presencia y establecimiento del muérdago. A diferencia del APFFNT, en el MT, los bosques de P. hartwegii presentan una menor densidad y los árboles están más separados entre sí, lo cual reduce la capacidad de dispersión de la planta parásita y se refleja en un porcentaje menor de superficies infestadas.
Los mayores niveles de infestación se registraron en individuos con ataques simultáneos de ambas especies de muérdago. Al respecto, se sabe que existe especificidad por ciertos hospederos dentro del género Arceuthobium y que, aunque A. globosum y A. vaginatum suelen encontrarse atacando un mismo hospedero, son factores estocásticos los que determinan la abundancia de éstos, tales como incendios o tala (González-Elizondo et al., 2019; Mathiasen, 2019; Mathiasen et al., 2004; Queijeiro-Bolaños et al., 2011). Por otra parte, es muy probable que estos ataques ocurran en los árboles con mejor constitución fisiológica, y por ende, altos niveles de polimorfismo genético, dados los altos requerimientos de agua y nutrientes por parte de los muérdagos (Bickford et al., 2005; Heredia-Bobadilla et al., 2018).
Respecto a los factores que pueden determinar la presencia del muérdago enano en el bosque, el análisis de componentes principales sugiere que las infecciones por muérdagos predisponen el ataque por descortezadores (Ferrenberg, 2020; Mathiasen, 2019), lo que coincide con Cibrián-Tovar et al. (1995), quienes reportan la pérdida de vigor y reducción en el crecimiento de árboles parasitados, lo cual facilita la infestación por descortezadores. La interacción de descortezadores y muérdago genera más probabilidades de mortalidad (Klutsch et al., 2014), lo cual provoca que el dosel forestal se reduzca facilitando la dispersión de las semillas del muérdago.
La infestación por muérdagos enanos en individuos de menos de 1 m de altura es muy rara, debido que los árboles de estas tallas no son un blanco fácil para las semillas del parásito, además de que agentes externos, como las lluvias, remueven las semillas de estos hospederos (Mathiasen, 1998). Tal como los resultados de este estudio lo corroboran en ambas montañas (4% de infestación), los individuos adultos y seniles enfermos que ocupan el dosel dominante del bosque favorecen la dispersión de semillas, infestando estratos inferiores y la regeneración natural.
Los ataques en la regeneración ocurren cuando las infestaciones en árboles maduros son muy fuertes (Skay et al., 2021). Casos similares se han reportado en Picea engelmani, P. pungens y Pseudotsuga menziesii, afectados por A. microcarpum y A. douglasii, respectivamente (Mathiasen, 1986).
La presencia de muérdagos enanos suele estar relacionada con disturbios de tipo antrópico, tales como el cambio de uso del suelo y los asentamientos humanos (Challenger, 1998; Sánchez et al., 2003). La quema y el pastoreo son fenómenos frecuentes en el APFFNT y en MT, que inciden en el deterioro del bosque de pino (Salinas et al., 2010; Villers et al., 1998), en este caso, no se encontró una correlación estadística significativa de las variables antrópicas con la presencia de muérdago.
Los disturbios de tipo antrópico pueden contribuir en la pérdida de vigor de los hospederos (Ferrenberg, 2020; Fonseca-González et al., 2014; Queijeiro-Bolaños et al., 2013; Rodríguez-Trejo, 2002), predisponiendo al arbolado al ataque de parásitos; aunado a ésto, algunos estudios sugieren que el cambio climático global puede estar influyendo directamente en el desarrollo, ciclos de reproducción, fenología y distribución espacial de los patógenos (Harrington et al., 2001; Sáenz-Romero et al., 2020).
El 37% de los bosques de Pinus hartwegii del APFFNT y el MT están infestados por Arceuthobium globosum y A. vaginatum, distribuidos entre los 3,600 y 3,800 m snm, afectando a todas las categorías de DN, aunque con mayor intensidad a individuos entre 10 a 25 DN. Las mayores infestaciones se concentran en la ladera oeste de ambos edificios volcánicos, por lo que, el complemento de esta evidencia con datos bioclimáticos, así como afectaciones por estrés hídrico y horas luz sobre las diferentes laderas pueden corroborar este supuesto. La presencia de descortezadores del género Dendroctonus ssp. es una variable directamente relacionada con los niveles de infestación de muérdago. Esto implica que, los árboles infestados por muérdagos son más vulnerables al ataque de descortezadores.











 nueva página del texto (beta)
nueva página del texto (beta)