Introducción
Los insectos chupadores de la familia Cercopidae son consumidores estrictos de savia, que obtienen nutrientes del xilema de raíces y hojas de diversas plantas (Cid-Muñoz et al., 2020; Fagan y Kuitert, 1969; Peck, 1998a, b, 2003; Orozco-Restrepo et al., 2017; Thompson, 1999, 2004). La característica más distintiva de estos hemípteros, es que las ninfas mientras se alimentan, secretan una sustancia espumosa, que las protege de agentes externos y enemigos naturales, por lo que comúnmente se les nombra “salivazos” (Castro, 2017; Cryan y Svenson, 2010; Rodríguez et al., 2003; Tonelli et al., 2018).
Los hemípteros de la superfamilia Cercopoidea, durante su alimentación, inyectan saliva y sustancias que degradan el tejido vegetal (Valério y Nakano, 1992), en algunos casos se ha reportado que transmiten bacterias y hongos (Hamilton, 1982), sin embargo, no se ha reportado esta asociación en los miembros de Cercopidae. Debido a ésto, a sus altas capacidades reproductivas y a que actúan como herbívoros generalistas, algunas especies se encuentran en la categoría de plaga de importancia agrícola y forestal (Galindo y Contreras, 2017; Hamilton, 1982; Martínez et al., 2012; Sagarpa, 2017; Wilson, 1991).
El origen de Cercopidae se remonta al Cretácico medio a partir de ancestros de la familia extinta Procercopidae, cuyos integrantes se alimentaban de la vegetación predominante, compuesta por cícadas, helechos y coníferas (Castro-Valderrama et al., 2019; Cryan y Svenson, 2010; Saward, 1992). Los cercópidos actuales se han especializado en su espectro alimenticio, ya que la mayoría se alimenta de angiospermas y tan solo 5 especies, de las 1,500 descritas para la familia (Paladini y Cavichioli, 2015; Soulier-Perkins, 2019), son capaces de obtener nutrientes de gimnospermas (Castro-Valderrama et al., 2019; Cid-Muñoz et al., 2020; Moraal, 1996; Sallé y Battisti, 2016), hábito que se explica como vestigio de sus ancestros (Cryan y Svenson, 2010).
Uno de los géneros de la familia que ha tomado importancia es Ocoaxo, debido a que de sus 32 miembros (Carvalho y Webb, 2005; Castro-Valderrama et al., 2019; Nast, 1950), 3 especies, O. assimilis (Walker, 1858), O. varians (Stål, 1864), y la recientemente descrita O. cardonai (Castro-Valderrama, Carvalho y Valdez-Carrasco, 2018) (Castro-Valderrama et al., 2019), presentan hábitos alimenticios considerados vestigiales. Los adultos de estos 3 miembros de Ocoaxo perforan y succionan acículas de pino, provocando que a partir de cada perforación, el tejido de la hoja muera, se decolore y forme un anillo que la rodea; estos anillos pasan por distintos tonos de color, al principio amarillo, con cambios a tonos rojizo y café, seguido de la defoliación; estos síntomas son más notorios en la época invernal, fenómeno al cual se le nombró “declinación de los pinos” (Castro-Valderrama et al., 2017). Aunque la caída de acículas por sí sola no causa la muerte de los pinos y los árboles recuperan su follaje al comienzo de la siguiente temporada, se ha reportado que cuando el fenómeno ocurre en varios años consecutivos, las plantas pueden llegar a morir (Conafor, 2016, 2017, 2018).
Debido a su semejanza morfológica y sus hábitos, O. assimilis, O. cardonai y O. varians se agrupan en un complejo llamado “Ocoaxo de los pinos”, al cual se le han atribuido daños importantes asociados a la “declinación de los pinos” en grandes extensiones de bosque en Puebla, Veracruz y Oaxaca, desde 2008 (Castro, 2017; Cid-Muñoz et al., 2020; Conafor, 2016, 2017, 2018). Hasta el momento, estas especies solamente se han registrado en territorio nacional (Castro-Valderrama et al., 2017, 2019), con excepción de O. assimilis, cuya presencia en Guatemala se comprueba por una secuencia depositada en el “National Center for Biotechnology Information” (NCBI) (Paladini et al., 2018).
A pesar de que el tipo de alimentación de estas especies de Ocoaxo es contrastante respecto al de los demás cercopoideos y de los efectos que ocasionan en las plantas debido a su alimentación, más allá de la información taxonómica, los escasos registros geográficos promovidos por los recientes brotes, el conocimiento básico de estos insectos, en particular su distribución y biología, están pobremente documentados.
Un estudio integrativo reciente enfocado en la biología de O. assimilis, permitió asociar los estadios inmaduros con los adultos, así como determinar el número de instares ninfales en su ciclo de vida, estimar su abundancia a lo largo del año, su voltinismo, conocer su espectro trófico, así como sus preferencias alimenticias (Cid-Muñoz et al., 2020). Contrastantemente, para las otras especies del complejo de los pinos, no se han descrito las ninfas, se desconoce el número de estadios de esta fase del desarrollo, duración y estacionalidad del ciclo de vida, espectro alimenticio, voltinismo, etc.
La ausencia de información básica en los miembros de este complejo ha llevado a reconsiderar su relación con el decaimiento de los pinos y, por lo tanto, a cuestionar su estatus como especie plaga (Castro-Valderrama et al., 2017). Por tal motivo, el objetivo de la presente investigación es analizar la distribución temporal y espacial de O. assimilis, O cardonai y O. varians, a partir de los registros históricos revelados por especímenes depositados en colecciones entomológicas y bases de datos en línea. Con ello, será posible generar información biológica, de la historia de vida y distribución de las 3 especies, para conocer su espectro alimenticio, épocas de presencia de los adultos, así como evaluar los factores ecológicos que influyen en su distribución, además de establecer nuevos sitios de colecta modelando su distribución potencial. Esta información ayudará a comprender mejor la variación de la biología y el comportamiento de este grupo, sintetizar los patrones de distribución de estas especies de hemípteros, ofreciendo un panorama general de la interacción entre ellos, así como ubicar las zonas donde estos salivazos se han recolectado y sitios potenciales para su monitoreo.
Materiales y métodos
Los registros geográficos de O. assimilis, O cardonai y O. varians se obtuvieron de las etiquetas de los especímenes depositados en 14 colecciones entomológicas de México, EUA e Inglaterra. Las colecciones revisadas fueron las siguientes: Colección Entomológica, Ciencias Agronómicas de Chiapas, Universidad Autónoma de Chiapas (CACH), El Colegio de la Frontera Sur, unidad Tapachula (ECOSUR), Colección Entomológica ECOSUR, unidad San Cristóbal de las Casas (CEFS), Colección de Artrópodos asociados a cultivos de la región del Soconusco (CCFT), Chiapas; Colección Entomológica, Colegio de Postgraduados unidad Tabasco (CECT), Tabasco; Colección del Laboratorio de Parasitología Vegetal, Universidad Autónoma del Estado de Morelos (CLPV), Morelos; Colección Nacional de Insectos Estación Biológica Tropical Los Tuxtlas-UNAM (EBTLT), Colección Entomológica, Instituto de Ecología, Xalapa (IEXA), Veracruz; Colección de Insectos, Colegio de Posgraduados, campus Montecillo, Texcoco (CEAM), Colección de Insectos del Centro de Referencia SENASICA, unidad Tecámac (CECR), División de Ciencias Forestales, Universidad Autónoma Chapingo, Texcoco (DCFUACH), Estado de México; Colección Nacional de Insectos del Museo de Historia Natural de la Ciudad de México (MHNCM), Colección Nacional de Insectos, Instituto de Biología, Universidad Nacional Autónoma de México (CNIN), Colección Nacional de Insectos Dr. Alfredo Barrera Marín (CNIABM), Ciudad de México; North Carolina State University Insect Collection, USA (NCSU) y British Museum of Natural History, London (BMNH).
Además, se descargó la información de las bases de datos en línea “Global Biodiversity Information Facility” (GBIF, 2020) y Naturalista (2021). En estos casos únicamente se tomaron en cuenta aquellos registros que contaron con imágenes claras que mostraran a los especímenes en su hábitat, con el aumento adecuado que permitiera la observación de los patrones de ornamentación de las tegminas, que son diagnóstico para este complejo de especies.
Tanto de las bases de datos en línea, como de los especímenes de colecciones, se tomó información de la localidad, coordenadas geográficas, especie hospedante y fecha de recolecta. Todos los registros se conjuntaron en una base de datos. Los registros sin coordenadas geográficas se geoposicionaron con Google Earth (2020), los datos duplicados se eliminaron. La identificación morfológica de los adultos se realizó utilizando las claves de Castro-Valderrama et al. (2019) a partir de caracteres morfológicos externos del pronoto, escutelo y tegminas, así como de la forma de las estructuras que integran la genitalia masculina.
Con la base de datos obtenida, se estableció la distribución histórica de las 3 especies de Ocoaxo. Para ello, todos los registros se proyectaron sobre un mapa de la República Mexicana con el software ArcGIS 10.8 (ESRI, 2020), y se determinaron los estados en los que se presentaron mayor número de colectas desde 1860, año que corresponde al primer registro de una de las especies en México, hasta 2020. Además, para evaluar si con los datos históricos era posible reconocer periodos de presencia de los adultos a lo largo del año, se analizaron las épocas en que los especímenes se recolectaron por medio de una gráfica de dispersión, usando el mes como abscisa y año como ordenada. La distribución temporal de los registros se comparó con los datos históricos de temperatura anual mínima, promedio y máxima, para saber si su presencia está asociada con alguna de estas variables (Cid-Muñoz et al., 2020).
Para determinar el espectro alimenticio de las especies, se elaboró una tabla de los hospederos registrados en cada especie de Ocoaxo y se graficó de acuerdo con el número de reportes por hospedero y especie.
Para determinar las provincias biogeográficas en las que se distribuyen las especies, así como el tipo de vegetación y de suelo asociado a los sitos dónde se recolectaron, todos los registros se proyectaron sobre la capa de las regiones biogeográficas de México (Morrone et al., 2017), la capa de vegetación (INEGI, 2017) y la capa de tipos de suelo de México (Semarnap, 1998), de las cuales se extrajo la información para cada punto de presencia y se calculó el número de registros por tipo de vegetación y tipo de suelo. El tipo de vegetación y suelo se incluyeron debido a que son variables ecológicas importantes para la sobrevivencia de los huevos y la alimentación de los miembros de la familia Cercopidae (Pires et al., 2000; Sujii et al., 2001).
Debido a que no hay información climática de fácil acceso para antes de 1970, previo a la modelación, se eliminaron del análisis todos los registros anteriores a ese año. Las 19 variables bioclimáticas, más la altitud se descargaron de WorldClim versión 2 (Fick y Hijmans, 2017), éstas se recortaron con la herramienta extraer desde mascara de ArcGIS 10.8 (ESRI, 2020) con resolución espacial de 30’ y un “raster” de la división estatal de México (INEGI, 2019). Para evaluar multicolinealidad entre las 19 variables bioclimáticas, se realizaron pruebas de correlación de Pearson en el programa PAST ver. 2.7 (Hammer et al., 2001); las variables con correlaciones arriba de 0.8 se eliminaron de los modelos (Graham, 2003). De las variables seleccionadas se extrajo el perfil bioclimático para cada especie del complejo, considerando el mínimo, máximo, la media y la desviación estándar de cada variable, estos valores se interpretaron como los límites de idoneidad ambiental de las especies.
Para evitar sobreestimaciones por información redundante en los modelos, se eliminaron los registros duplicados que se encontraron dentro de un área de 30 km2, en el programa ArcGIS 10.8 (ESRI, 2020). Los modelos de distribución potencial se estimaron con el algoritmo de máxima entropía en MAXENT v. 3.2.9 (Phillips y Schapire, 2020), ya que ha demostrado tener una buena eficiencia con datos escasos y especies raras (Phillips et al., 2006). Los modelos se parametrizaron con distintas configuraciones para optimizar su calibración, usando el paquete Kuenm (Cobos et al., 2019) de RStudio (RStudio Team, 2021), para ello se usaron 3 valores de multiplicación (0.5, 1, 2), 2 clases de entidad (linear, linear y cuadrático) y las variables predictoras de cada especie (Cobos et al., 2019; Núñez-Penichet et al., 2021). Los modelos resultantes se evaluaron mediante la prueba parcial de curva de característica operativa del recepto ROC (por sus siglas en inglés, Receiver Operating Characteristic) (Peterson et al., 2008), su capacidad predictiva se analizó considerando la tasa de omisión (E = 5%) y su selección mediante el criterio de Akaike corregido (AICc) para muestras pequeñas, priorizando modelos estadísticamente significativos o con tasas de omisión menores a 5% con valores de AICc < 2 (Warren y Seifert, 2011). De los modelos resultantes, 3 para O. cardonai, 3 para O. varians y 5 para O. assimilis, se seleccionó aquel con los mejores parámetros de omisión y AICc. Una vez seleccionado y calibrado, el modelo fue parametrizado en Maxent con 2 réplicas de boostrap y salida “cloglog” (NúñezPenichet et al., 2021; Phillips et al., 2017). Para analizar la contribución de las variables seleccionadas, se realizó una prueba jackknife en Maxent. Finalmente, los mapas se exportaron a ArcGIS para su edición.
Resultados
Los ejemplares se identificaron a especie utilizando la coloración del tegmen y la genitalia. O. cardonai tiene una mancha basal de color amarillo crema en el tegmen, unida con 2 líneas longitudinales del mismo color, ambas líneas alcanzan el tercio apical y se unen distalmente, formando una elipse (Fig. 1a); los ápices de las espinas dorso laterales del edeago no sobresalen del eje, en vista lateral. El tegmen en O. varians presenta 1 mancha basal de color amarillo crema, unida a una línea longitudinal del mismo color, que distalmente forma una tajamata con borde bien definido (Fig. 1b); espinas dorsolaterales del edeago ligeramente curvas hacia el eje, en vista lateral. En O. assimilis, el tegmen presenta una mancha basal de color amarillo crema, unida a una línea longitudinal del mismo color, que distalmente forma una tajamata con borde difusos (Fig. 1c); las espinas dorsolaterales del edeago rectas y en dirección opuesta al eje, en vista lateral.

Figura 1 Vista dorsal y lateral de adultos de las especies del complejo Ocoaxo de los pinos: a) O. cardonai, b) O. varians, c) O. assimilis. c: Cabeza, p: pronoto, p: tegmen, ap: alas posteriores, mt: mancha basal y líneas en el tegmen.
En total, se obtuvieron 55 registros geográficos de las 3 especies en el territorio nacional, 19 de Naturalista (2021), 2 de GBIF (2020), 3 de la Conafor (2016, 2017, 2018) y 31 de especímenes depositados en colecciones entomológicas (Tabla 1). Las recolectas más antiguas se realizaron por H. H. Smith de 1832 a 1860, cuyo material se encuentra depositado en el BMNH, Londres; estos especímenes corresponden a O. assimilis y fueron obtenidos de diferentes sitios de Guerrero, lo cual evidencia que desde hace 161 años existen antecedentes de este complejo de especies en México. El número de recolectas desde 1860 hasta antes del 2008 fue escaso para las 3 especies, cuantificando 19 registros, del 2008 en adelante las recolectas y avistamientos han ido en aumento; hasta 2020 se han reportado 36 eventos de recolecta (Tabla 1). En los últimos 13 años los esfuerzos de muestreo se incrementaron, principalmente, en Oaxaca, Puebla, Veracruz, Ciudad de México y Nuevo León (Fig. 2b). Con un total de 7, O. varians fue la especie con menos registros, obtenidos de localidades de Guerrero, Oaxaca y Tlaxcala (fig. 2a); el registro más antiguo de esta especie corresponde a Guerrero (torre de microondas, El Tecojote, Guerrero, 18/08/1984, CNIN). O. assimilis cuantificó 21 registros en Guerrero, Chiapas, Oaxaca, Puebla, Veracruz y Tlaxcala (Fig. 2a), el registro más antiguo para el complejo pertenece a esta especie y se encuentra en Guerrero (Parque Ecológico Estatal Omiltepi, Almolonga y Xocomatlán, BMNH). O. cardonai presentó 27 registros, por lo cual es la especie mejor representada, con colectas en Ciudad de México, Oaxaca, Puebla, Estado de México, Michoacán, Guanajuato, Querétaro, San Luis Potosí, Tamaulipas y Nuevo León (Fig. 2a); el primer registro de O. cardonai data de 1963 en Puebla (presa Necaxa, San Miguel, Puebla, 01/08/1963, CNIN).
Tabla 1 Base de datos que documenta la presencia de las especies del complejo Ocoaxo de los pinos en México.
| Fecha | Localidad | Latitud (N) | Longitud (O) | Altitud (m snm) | Hospedante | Número de especímenes | Fuente |
| Mèxico O. assimilis | |||||||
| 7/1832-1860* | Parque Ecológico Estatal Omiltemi, Guerrero | 17°35’39” | 99°38’46” | 1 | BMNH | ||
| 8/1832-1860* | Almolonga (antigua Amula), Guerrero | 17°38’14” | 99°17’07’ | 1 | BMNH | ||
| 7/1832-1860* | Xocomanatlán, Guerrero | 17°32’28” | 99°37’42” | 1 | BMNH | ||
| 10/5/1924 | Maltrata, Altavista, Veracruz | 18°48’41” | 97°16’38” | 1 | MHNCM (GBIF) | ||
| 6/6/1935 | Vergeles, Chiapas | 15°58’06” | 92°10’20” | 1 | CNIABM (GBIF) | ||
| 27/6/1978 | Km. 120 Autopista Puebla-Orizaba, Veracruz | 19°05’52” | 98°13’53” | 2,100 | 1 | CNIN | |
| 19/9/1989 | Km. 40 Carretera Oaxaca-Guelatao, Oaxaca | 18°10’23” | 96°50’44” | 1 | CNIN | ||
| 15/9/1994 | Cd. Mendoza, Veracruz | 18°48’22” | 97°11’04” | 1 | CEAM | ||
| 4/10/2003 | 16 km. SO de Azumbilla, Nicolás Bravo, Puebla | 18°21’40” | 97°10’29” | 2,500 | Pinus sp. | 1 | CEAM |
| 29/8/2006 | 2.5 millas al norte de Nicolás Bravo, Puebla | 18°37’40” | 97°21’27” | 2,160 | Pinus sp. | 1 | CEAM |
| 27/7/2008 | Coacoyunque, Nicolás Bravo, Puebla | 18°39’49” | 97°19’30” | Pinus oaxacana | 1 | Conafor | |
| 29/6/2010 | Carr. Puente de Fierro-Mpio. Santa María Chichotla, Oaxaca | 18°10’23” | 96°50’44” | 1 | CNIN | ||
| 23/7/2012 | Santa Cruz Acatepec, Oaxaca | 18°09’29” | 96°57’51” | 1,338 | 1 | CNIN | |
| 17/9/2016 | Azumbilla, Nicolás Bravo Puebla | 18°38’57” | 97°20’08” | 2,368 | Pinus oxacana | 1 | CEAM |
| 10/9/2016 | Nicolás Bravo, Puebla | 18°38’51” | 97°20’08” | https://www.naturalista.mx/observations/5603746 | |||
| 28/5/2017 | Xoxocotra, Veracruz | 18°39’12” | 97°39’33” | 2,443 | Pinus patula | 1 | Conafor |
| 10/7/2017 | Tianguismanalco, Puebla | 19°02’20” | 98°27’21” | 1 | https://www.naturalista.mx/observations/7008914 | ||
| 15/7/2018 | Tequila, Veracruz | 18°44’16” | 97°06’23” | Pinus patula | 1 | Conafor | |
| 10/8/2018 | Nicolás Bravo, Puebla | 18°37’05” | 97°19’39” | Pinus oaxacana | 1 | https://www.naturalista.mx/observations/44167723 | |
| 2/10/2019 | Ixtlán de Juárez, Oaxaca | 17°20’22” | 96°29’17” | 1 | https://www.naturalista.mx/observations/34607338 | ||
| 12/10/2019 | Tetla de la solidaridad, Tlaxcala | 19°28’20” | 98°05’11” | 1 | https://www.naturalista.mx/observations/34277238 | ||
| O. cardonai | |||||||
| 1/8/1963 | Presa Necaxa, San Miguel, Puebla | 20°13’03” | 98°00’02” | 1 | CNIN | ||
| 26/9/1972 | Pedregal de San Ángel, CDMX | 16°34’05” | 96°55’09” | 2,250 | 1 | CNIN | |
| 16/6/1982 | Pluma Hidalgo, Oaxaca | 15°55’33” | 96°25’12” | 1,326 | 1 | CNIN | |
| 16/9/1987 | Km 126 Carr. Maravatio, Morelia | 19°43’13” | 101°08’57” | 1 | CNIN | ||
| 2/7/1999 | Toluquilla, Querétaro | 16°34’05” | 96°55’09” | 1 | CNIN | ||
| 12/7/2004 | 11 km O de San Martín Lochila, Oaxaca | 16°34’05” | 96°55’09” | 1,814 | 1 | CNIN | |
| 20/8/2008 | Valle de los Fantasmas, San Luis Potosí | 22°03’32” | 100°37’16” | 1 | CNIN | ||
| 23/9/2012 | Bosque de Tlalpan, CDMX | 19°17’41” | 99°11’33” | 1 | https://www.naturalista.mx/observations/515044 | ||
| 23/7/2014 | La Carbonera, Arteaga, Coahuila | 25°16’30” | 100°25’43” | 2,100 | 1 | CNIN | |
| 31/7/2014 | Pinal de Amoles, Querétaro | 21°12’00” | 99°36’00” | 1 | https://www.naturalista.mx/observations/854710 | ||
| 20/7/2015 | Acatlán, Tetela de Ocampo, Puebla | 19°51’30” | 97°50’02” | 1,765 | Pinus pseudostrobus | 1 | CNIN |
| 20/7/2015 | Acatlán, Tetela de Ocampo, Puebla | 19°51’30” | 97°50’02” | 1,765 | Pinus pseudostrobus | 1 | CNIN |
| 20/7/2015 | Acatlán, Tetela de Ocampo, Puebla | 19°51’30” | 97°50’02” | 1,765 | Pinus pseudostrobus | 1 | CEAM |
| 10/8/2015 | Rancho Alegre, Tetela de Ocampo, Puebla | 19°50’34” | 97°51’22” | 2,270 | Pinus patula | 1 | CEAM |
| 10/8/2015 | Km 68 Carr. Fed. Zacatlán- Apizaco, Zacatlán, Puebla | 19°54’07” | 97°57’31” | 2,112 | Pinus sp. | 1 | CEAM |
| 2/7/2017 | Río Mixcoac, CDMX | 19°22’02” | 99°12’51” | 1 | https://www.naturalista.mx/observations/7806746 | ||
| 1/9/2017 | RN El Potosí, San Luis Potosí | 22°00’55” | 100°59’07” | 2,516 | 1 | CCFT | |
| 13/6/2018 | San Pedro, Nuevo León | 25°36’11” | 100°20’59” | 1 | https://www.naturalista.mx/observations/36721319 | ||
| 1/7/2018 | Meseta de Chipinque, San Pedro Garza García, Nuevo León | 25°36’24” | 100°21’27” | 1 | https://www.naturalista.mx/observations/14469401 | ||
| 13/10/2018 | Guanajuato, Guanajuato | 21°03’21” | 101°14’57” | 1 | https://www.naturalista.mx/observations/17481259 | ||
| 5/6/2019 | San Pedro Garza García, Nuevo León | 25°36’26” | 100°21’18” | 1 | https://www.naturalista.mx/observations/26457753 | ||
| 10/6/2019 | Monterrey, Nuevo León | 25°36’07” | 100°19’58” | 1 | https://www.naturalista.mx/observations/26788109 | ||
| 23/6/2019 | San Pedro Garza García, Nuevo León | 25°36’20” | 100°20’53” | 1 | https://www.naturalista.mx/observations/85378014 | ||
| 29/6/2019 | San Pedro Garza García, Nuevo León | 25°35’49” | 100°20’26” | https://www.naturalista.mx/observations/27886942 | |||
| 3/7/2019 | Reserva de la Biosfera El Cielo, San José Tamaulipas | 23°02’40” | 99°13’44” | 1 | https://www.naturalista.mx/observations/28758989 | ||
| 28/6/2020 | Santiago, Nuevo León | 25°22’30” | 100°12’41” | 1 | https://www.naturalista.mx/observations/52033413 | ||
| O. varians | |||||||
| 18/8/1984 | Torre de microondas, el Tecojote, Guerrero | 18°10’23” | 96°50’44” | 2,389 | 1 | CNIN | |
| 1/9/2006 | Km 65 O Apizaco-Tlaxcala, Tlaxcala | 19°21’03” | 98°13’20” | 1,835 | 1 | CEAM | |
| 19/9/2008 | Km 168.5 Carr. Fed. Teotitlán-Oaxaca, Oaxaca | 17°30’36” | 96°56’18” | 2,230 | 1 | CEAM | |
| 20/9/2008 | Km 188.5 Carr. Fed. Teotitlán-Oaxaca, Oaxaca | 17°22’29” | 96°55’16” | 2,230 | 1 | CEAM | |
| 21/9/2008 | Km 190 Carr. Miahuatlán-Puerto Ángel, Oaxaca | 16°04’14” | 96°29’22” | 2,241 | 1 | CEAM | |
| 25/7/2015 | Monte Albán, Oaxaca | 15°03’07” | 96°45’04” | 1 | https://www.naturalista.mx/observations/19706115 | ||
| 28/8/2018 | Carr. Cerezal-San Miguel del Río, Santa Catarina Ixtepeji, Oaxaca | 17°15’56” | 96°33’42” | 1 | https://www.naturalista.mx/observations/16015397 | ||
* Sintipos sin fecha de colecta identificados por Nast en 1950.
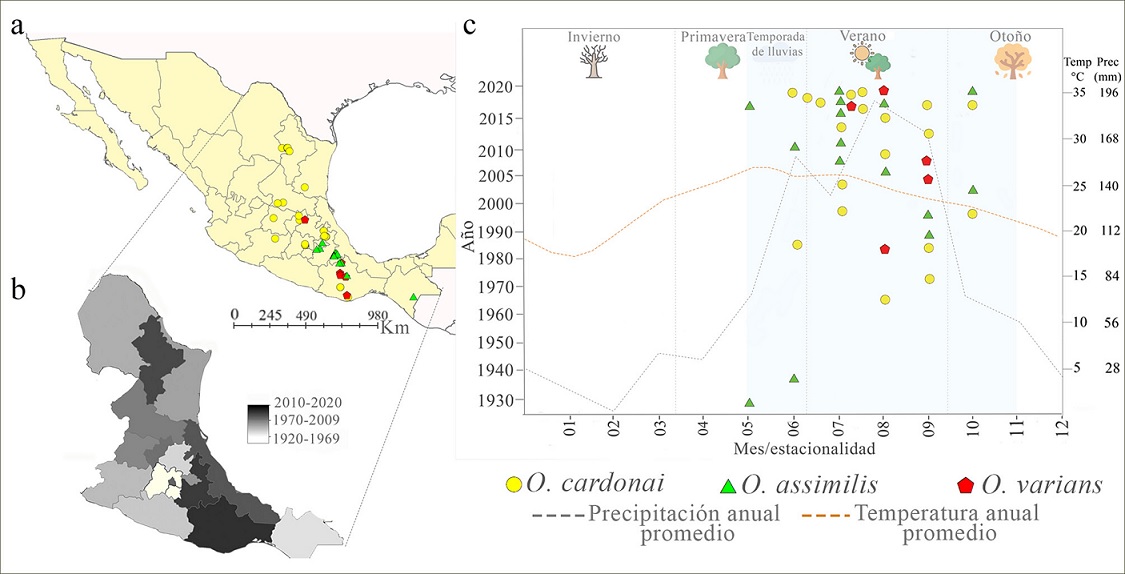
Figura 2 Representación espacial y temporal de los registros de las especies del complejo Ocoaxo de los pinos. a) Mapa de la República Mexicana con los registros geográficos confirmados; b) mapa de calor que representa los periodos en los que se ha realizado un mayor esfuerzo de muestreo por estado, el color negro representa los sitios con mayor muestreo por época; (c) gráfica de los registros geográficos de las 3 especies por mes (x) y por década (y).
Las 3 especies de Ocoaxo se reportaron en el periodo mayo-octubre, con mayor abundancia de colectas en julio. O. cardonai solamente fue registrada desde el mes de junio hasta octubre, O. varians por el número tan bajo de colectas se reportó de julio a septiembre, mientras que O. assimilis desde mayo a octubre. Los registros para las 3 especies se obtuvieron en la temporada de verano e inicios del otoño, estaciones que presentan elevaciones considerables de la temperatura y precipitación, y que corresponden mayormente a la temporada de lluvias en México (Fig. 2c).
Con base en los registros de las colecciones, únicamente fue posible obtener información de las plantas huésped de adultos de Ocoaxo. De los 51 registros obtenidos, 12 incluyeron información del tipo de huésped, correspondientes a los siguientes taxones: Pinus sp., P. patula Schiede ex Schltdl. et. Cham., P. pseudostrobus Lindl. y P. oaxacana Mirov., Ocoaxo assimilis cuenta con 2 reportes en P. patula, 3 en P. oaxacana y 2 en Pinus sp.; O. cardonai fue reportado 1 vez en P. patula, 3 en P. pseudostrobus y 1 en Pinus sp. Mientras que para O. varians, no se contó con registros de huésped (Fig. 3).
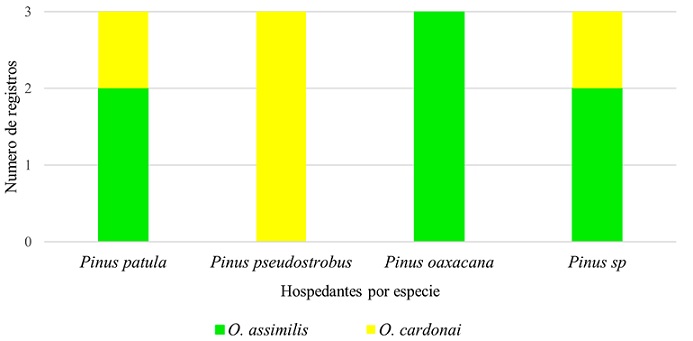
Figura 3 Gráfica de barras que indica las plantas huésped para los integrantes del complejo Ocoaxo de los pinos.
La proyección de los registros sobre la capa de provincias biogeográficas evidenció la presencia de las 3 especies en la Sierra Madre Oriental (PSMOR), Faja Volcánica Transmexicana (PVT), la Sierra Madre del Sur (PSMS). O. varians se presentó en la PSMS y PSMOR, O. assimilis en la PVT, la PSMS y las Tierras Altas de Chiapas (PTC) y O. cardonai en la PSMS, la PSMOR, el Desierto Chihuahuense (PDC) y la PVT (Fig. 4).
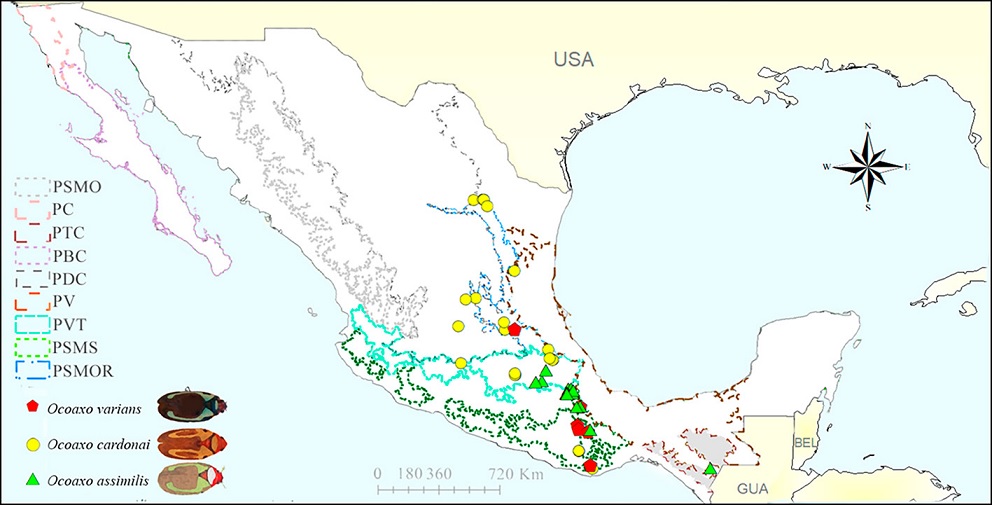
Figura 4 Mapa con la proyección de registros de las especies del complejo Ocoaxo de los pinos en las provincias biogeográficas de México. PSMO: Sierra Madre Occidental, PC: Californiana, PTC: Tierras altas de Chiapas, PBC: Baja California, PDC: Desierto Chihuahuense, PV: Veracruzana, PVT: Faja Volcánica Transmexicana, PSMS: Sierra Madre del Sur y la PSMOR: Sierra Madre Oriental.
Los registros de las 3 especies de Ocoaxo confirman su presencia en 10 tipos de ecosistemas: bosque encino (BE), bosque de pino (BP), bosque de encino-pino (BEP), bosque de pino-encino (BPE), pastizal inducido (PI), bosque urbano (BU), bosque mesófilo de montaña (BMM), selva alta subperennifolia (SAS); bosque de táscate (BT), selva baja caducifolia (SBC) y tierras de uso agrícola (UA). Las 3 especies se documentaron en BPE y BE; O. cardonai y O. varians estuvieron presentes en BEP y PI; O. cardonai y O assimilis tienen registros en BU y UA; O. varians y O. assimilis en BMM; Ocoaxo assimilis en SAS y BT; O. varians tuvo un registro en SBC y O. cardonai en BP (Fig. 5).
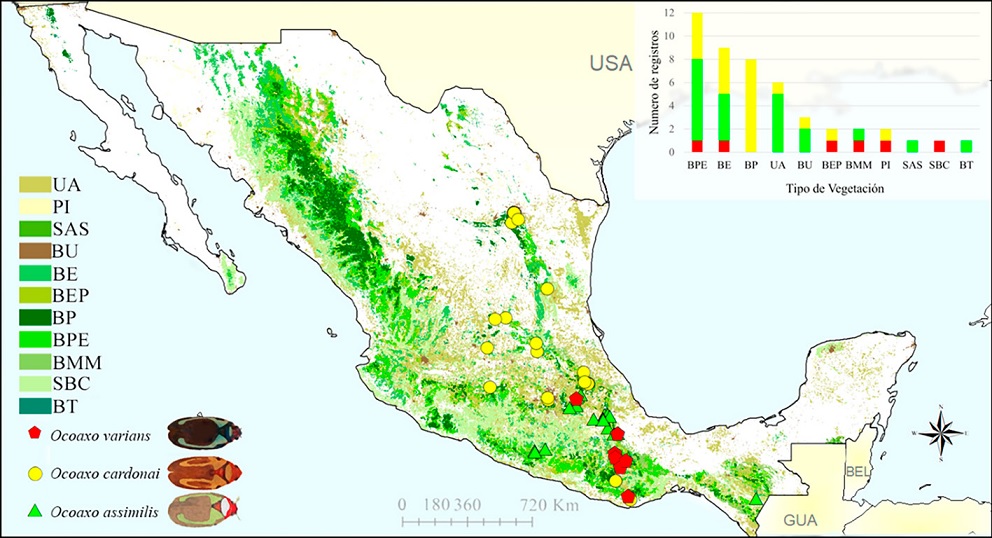
Figura 5 Mapa con la proyección de registros de las especies del complejo Ocoaxo de los pinos sobre la capa de los tipos de vegetación en México. BE: Bosque encino, BP: bosque de pino, BEP: bosque de encino-pino, BPE: bosque de pino-encino, PI: pastizal inducido BU: bosque urbano, BMM: bosque mesófilo de montaña, SAS: selva alta subperennifolia; BT: bosque de táscate, SBC: selva baja caducifolia y UA: tierras de uso agrícola. La grafica superior representa el número de registros por tipo de vegetación de cada especie.
Los insectos se colectaron en 7 tipos de suelo: leptosol (LEP), acrisol (ACRI), regosol (REG), feozem (FEO), vertisol (VER), cambisol (CAM) y alisol (ALI). De ellos, las 3 especies se asociaron con suelo de tipo LE, el cual es característico de zonas de montaña y presenta una capa delgada rica en nutrientes. O. cardonai y O. varians compartieron registros en suelos de tipo ACRI, REG y FEO, los cuales son arcillosos y ricos en nutrientes. Mientras que O. assimilis y O. cardonai se registraron en sitios con suelo de tipo CAM, el cual es arcilloso y muy fértil. O. assimilis fue la única especie que tuvo registros en suelo VER, característico por ser arcillosos de climas subhúmedos (Fig. 6).
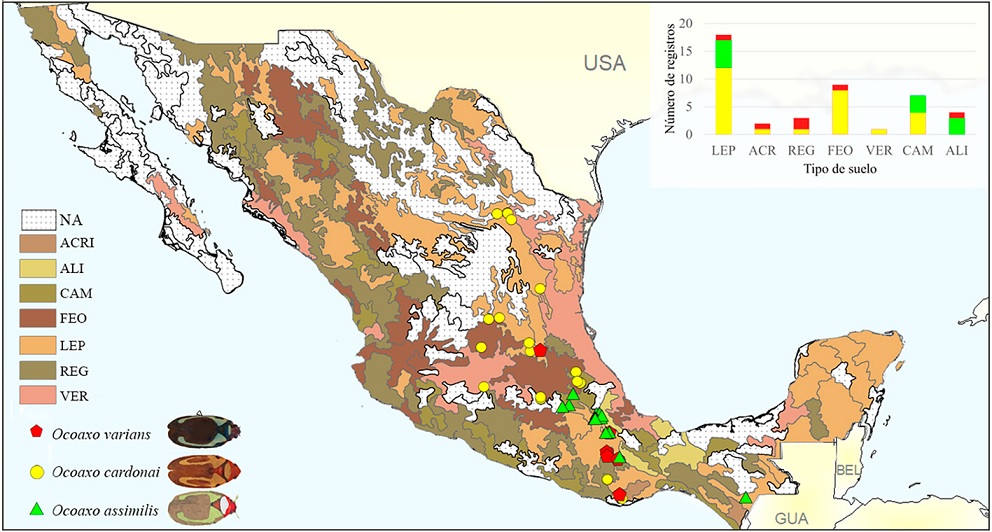
Figura 6 Mapa con la proyección de registros de las especies del complejo Ocoaxo de los pinos sobre la capa de los tipos de suelo en México. LEP: Leptosol, ACRI: acrisol, REG: regosol, FEO: feozem, VER: vertizol, CAM: cambisol, ALI: alisol. Los sitios en blanco muestran las zonas sin registros para las especies (NA). La grafica superior derecha representa el número de registros por tipo de suelo de cada especie.
Para cada especie del complejo se extrajo el perfil bioclimático de las variables sin correlación y que permanecieron importantes en el modelado de distribución potencial (Tabla 2), los resultados sugieren que las especies del complejo habitan áreas con las siguientes características: O. assimilis, estacionalidad de la temperatura (14.23 - 24.34 °C), rango anual de temperatura (16.80 - 24.20 °C) y temperaturas medias del trimestre más cálido de 12.20 - 24.30 °C, con un intervalo altitudinal de 1,362 a 2,630 m snm; O. cardonai, temperatura máxima del mes cálido (24.50 - 30.70 °C), temperatura mínima del mes más frío (3.70 -15.70 °C), un intervalo anual de temperaturas (11.50 a 25.90 °C) y altitudinal de 564 a 2,455 m snm; O. varians, intervalo anual de temperatura (13.50 -21.90 °C), temperatura media del trimestre más cálido (18.20 -24.30 °C), con intervalo altitudinal de 1,418 a 2,285 m snm.
Tabla 2 Perfil bioclimático para cada una de las especies de complejo Ocoaxo de los pinos.
| Especie | Variable climática | Min | Max | Media | Desviación estándar |
| O. assimilis | BIO4: estacionalidad de la temperatura (°C) | 142.23 | 243.34 | 190.92 | 33.80 |
| BIO7: rango anual de temperatura (°C) | 16.80 | 24.20 | 20.50 | 2.50 | |
| BIO10: temperatura media del trimestre más cálido (°C) | 12.20 | 24.30 | 18.04 | 4.20 | |
| Altitud (m snm) | 1,362 | 2,630 | 2,042 | 459 | |
| O. varians | BIO7: rango anual de temperatura (°C) | 13.50 | 21.90 | 19.20 | 2.97 |
| BIO10: temperatura media del trimestre más cálido (°C) | 18.20 | 24.30 | 20.10 | 2.24 | |
| Altitud (m snm) | 1,418 | 2,285 | 1,887 | 369 | |
| O. cardonai | BIO5: temperatura máxima del mes más cálido (°C) | 24.50 | 30.70 | 27.17 | 1.75 |
| BIO6: temperatura mínima del mes más frío (°C) | 3.70 | 15.70 | 6.10 | 2.76 | |
| BIO7: rango anual de temperatura (°C) | 11.50 | 25.90 | 21.1 | 2.7 | |
| Altitud (m snm) | 564 | 2,455 | 1,643 | 619 |
El esquema de evaluación que dio los mejores resultados en el complejo fueron linear y linear cuadrático con un valor de regularización = 1; los valores de la media del radio del AUC oscilaron entre 1.8 y 1.9; por la cantidad de datos usados, la tasa de omisión fue 0 y la complejidad de los modelos no fue mayor a 2. Las variables que contribuyeron al modelo se presentaron de la siguiente manera (Fig. 7): para O. cardonai fueron el trimestre más cálido (BIO10) y la estacionalidad de la intervalo anual de temperatura (BIO7) y la temperatura del temperatura (BIO4). Para O. varians fueron el intervalo mes más cálido (BIO5). En O. assimilis fueron el rango anual de temperaturas (BIO7) y la temperatura media del anual de temperaturas (BIO7), la temperatura media del trimestre más cálido (BIO10) (Fig. 7). En todas las especies, las variables de temperatura fueron las que aportaron más al modelo. A pesar de que se incluyeron variables de precipitación, éstas no contribuyeron, lo cual muestra que la temperatura puede ser el factor con mayor influencia en la distribución de las 3 especies.
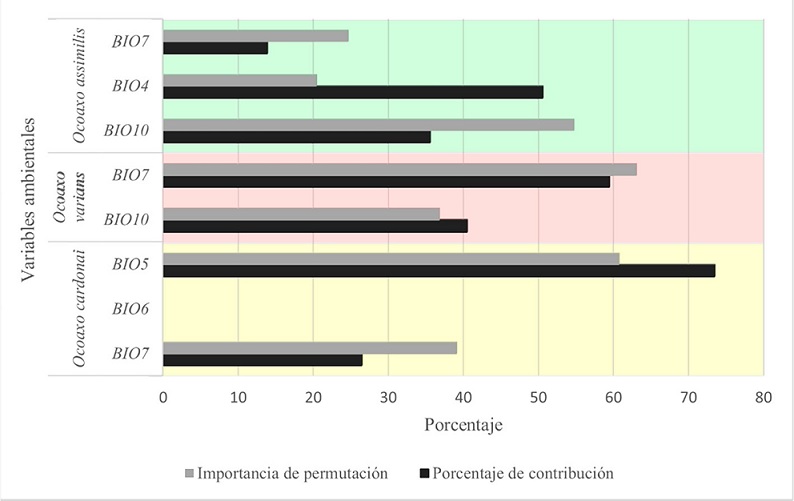
Figura 7 Gráfica de barras que muestra la contribución relativa de las variables en los modelos de distribución potencial de las especies de Ocoaxo de los pinos. BIO4: Estacionalidad de la temperatura, BIO5: temperatura del mes más cálido, BIO6: temperatura del mes más frio, BIO7: rango anual de temperaturas y BIO10: temperatura media del trimestre más cálido.
La prueba jackniffe mostró que la variable ambiental, con mayor ganancia para O. assimilis, fue BIO4 cuando se usó aisladamente, mientras que la BIO10 ocasionó una disminución en la ganancia cuando se omitió. La variable con mayor ganancia en el modelo de O. varians fue BIO7 cuando se usó aisladamente, la misma variable disminuyó la ganancia cuando se omitió en el modelado.
La variable BIO5 mejoró la ganancia del modelo de O. cardonai cuando se usó aisladamente y también disminuyó la ganancia cuando se omitió (Fig. 8). Los mapas de distribución potencial de las 3 especies del complejo Ocoaxo predijeron que las áreas con condiciones favorables para su presencia se encuentran dentro de las provincias fisiográficas que integran el norte de la subregión Caribeña del Neotrópico y el área meridional de la región Neártica, particularmente las que conforman la Zona de Transición Mexicana (Morrone, 2001, 2019).
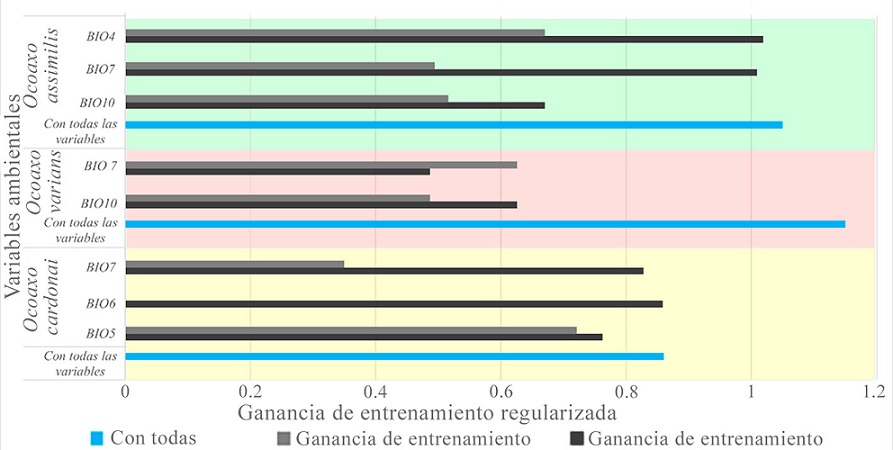
Figura 8 Gráfica de barras que muestra los resultados de la prueba de jackknife para evaluar la importancia de las variables cuando se usan aisladamente o se omiten de los modelos de distribución potencial de las 3 especies de Ocoaxo. BIO4: Estacionalidad de la temperatura, BIO5: temperatura del mes más cálido, BIO6: temperatura del mes más frio, BIO7: rango anual de temperaturas y temperatura media del trimestre más cálido.
El mapa correspondiente a O. varians (Fig. 9) reveló que las zonas más extensas con idoneidad climática excelente se encuentran en las provincias: Sierra Madre Occidental (PSMO), PSMOR, PVT, PSMS y la PTC. En la PSMO se presentaron áreas con probabilidades de muy altas a excelentes en el Distrito Durangueño, una grande y continua en el norte, y otras pequeñas y discontinuas hacia el sur; en la PSMOR se reconocieron 2 zonas con idoneidad excelente, la primera en la región norte que corresponde a la Subprovincia Austro-Oriental, específicamente al Distrito Saltillo-Parras y la segunda en la región sur perteneciente al Distrito Zacualtipán de la Subprovincia Hidalguense; en la PVT se presentó un área grande y continua con probabilidades muy altas dentro de la Subprovincia Este, que se extiende en los Distritos Azteca y Orizaba-Zempoaltepec, además en la Subprovincia Oeste, los modelos estimaron pequeñas áreas discontinuas desde el Distrito Tarasco hasta el Otomí; en la PSMS se reconocen zonas grandes y continuas en la subprovincia Oriental que abarcan los Distritos de la Altiplanicie Oaxaqueña y el Guerrerense y que se conectan hacia el norte con el este de la PVT, en las subprovincias Sur Central y Sur Occidental se presentaron pequeñas áreas discontinuas que van desde el Distrito Michoacano hasta el Jalisciense; en las PTC, el único distrito que no presento una excelente idoneidad fue el Distrito Sierramadrense. Por último, en esta especie también se presentaron áreas muy pequeñas y dispersas con idoneidad alta, en la parte meridional de las provincias de Baja California (PBC), PDC y Veracruzana (PV).
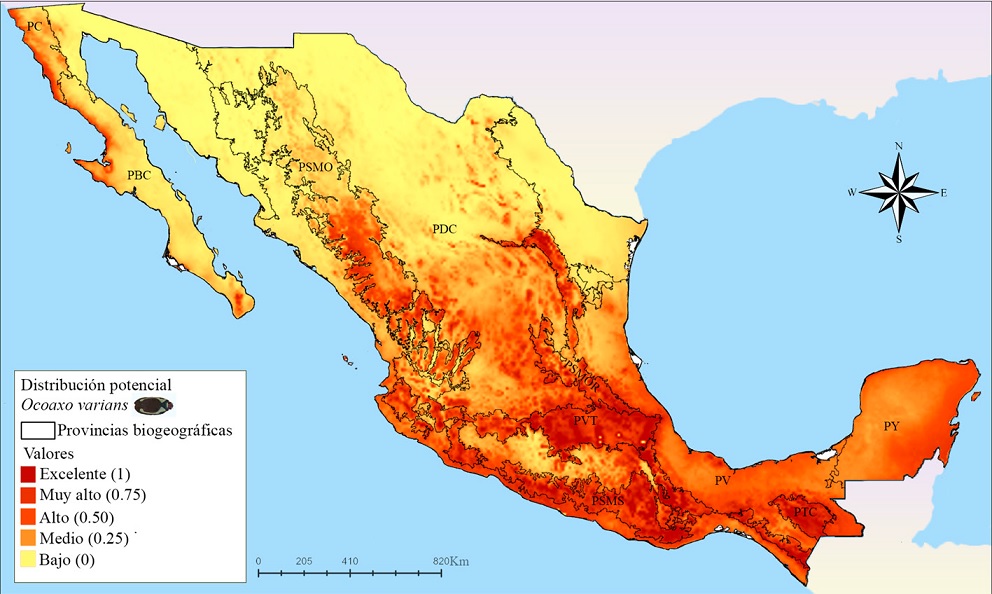
Figura 9 Mapa de distribución potencial de Ocoaxo varians en México. PBC: California Baja California, PC: Californiana, PSMO: Sierra Madre Occidental, PDC: Desierto Chihuahuense, PSMOR: Sierra Madre Oriental, PVT: Faja Volcánica Transmexicana, PV: Veracruzana, PTC: Tierras Altas de Chiapas, PY: Península de Yucatán.
De acuerdo con el mapa obtenido para O. assimilis (Fig. 10), las zonas más extensas con idoneidad ambiental alta y excelente se encuentran en las provincias: PSMO, PSMOR, PVT, PSMS y PTC. En la PSMO se presentó un área grande y continua con probabilidades excelentes en el Distrito Durangueño; en la PSMOR se reconocieron 2 zonas, la primera presenta una idoneidad predominantemente excelente en la región septentrional de la subprovincia Austro-Oriental, específicamente en el Distrito Saltillo-Parras, la segunda zona se ubica en la Subprovincia Hidalguense y está formada por pequeñas áreas discontinuas con idoneidad excelente, todas perecientes al Distrito Zacualtipán; la Subprovincia Este de PVT presentó una zona grande y continua con PTC: Tierras Altas de idoneidad excelente que abarca los Distritos Azteca y Orizaba-Zempoaltepec; mientras que en la Subprovincia Oeste se presentaron zonas más pequeñas desde el Distrito Tarasco hasta el Otomí; la PSMS cuenta con áreas grandes y continuas en la 3 Subprovincias, que se extienden desde el Distrito Jalisciense hasta la Altiplanicie Oaxaqueña; en la PTC los 4 distritos presentaron idoneidad excelente. Por último, en el PDC se estimaron pequeñas zonas dispersas de idoneidad, que va de alta a excelente en la parte sur del Distrito Zacatecano.
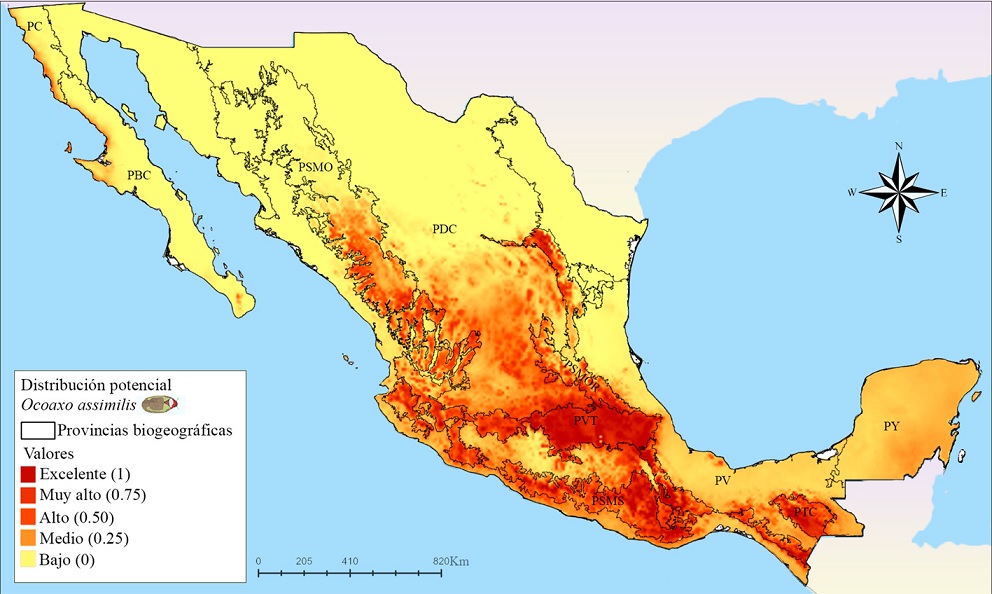
Figura 10 Mapa de distribución potencial de O. assimilis en México. PBC: California Baja California, PC: Californiana, PSMO: Sierra Madre Occidental, PDC: Desierto Chihuahuense, PSMOR: Sierra Madre Oriental, PVT: Faja Volcánica Transmexicana, PV: Veracruzana, PTC: Tierras Altas de Chiapas, PY: Península de Yucatán.
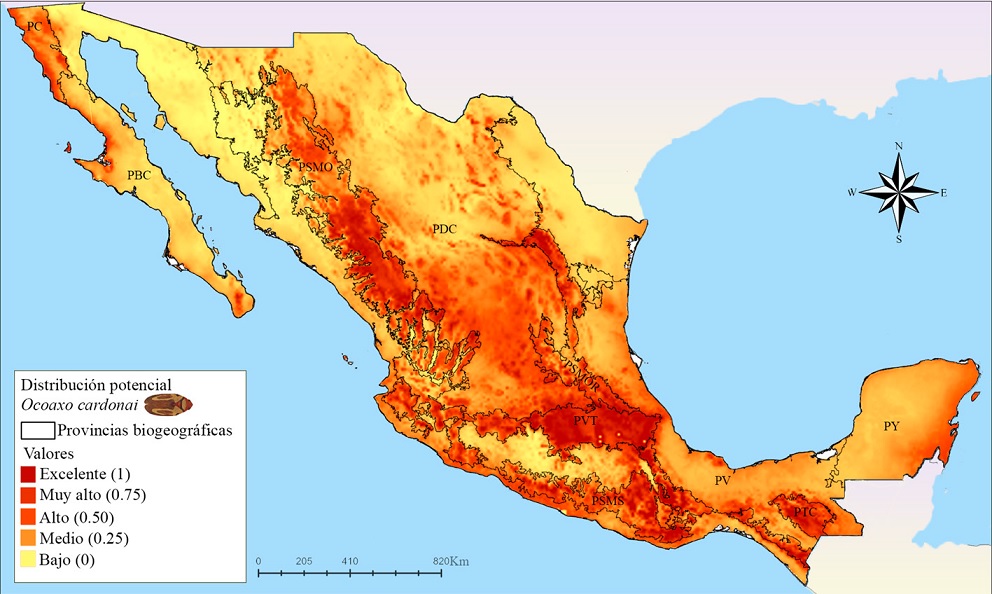
Las zonas más extensas con idoneidad ambiental excelente para O. cardonai (Fig. 11) se localizan en las provincias PSMO, PSMOR, PDC, PVT, PSMS y PTC. En la PSMO se presentó un área continua con probabilidades excelentes en el Distrito Durangueño; en la PSMOR se estimó una zona continua que se extiende de norte a sur en ambas Subprovincias Hidalguense y Austro-Oriental; en la PVT se estimó un zona con idoneidad excelente en el extremo este, justo en el Distrito Orizaba-Zempoaltepec, el cual conecta a la zonas de idoneidad excelente de la PSMOR y el de la PSMS; en la parte meridional del centro y oeste de la PVT también se presentan unas pequeñas zonas discontinuas con idoneidad excelente entre los Distritos Otomí y Azteca; la PSMS cuenta con áreas grandes casi continuas en la Subprovincias, Oriental y Occidental y áreas dispersas en la Subprovincia Central; en la PTC, los Distritos del Soconusco y Lacandón presentaron excelentes condiciones, el Distrito Comitanense presentó un área con condiciones muy altas que inicia cerca de Guatemala y se une al Distrito Sierramadrense; el cual presentó una pequeña área con altas condiciones. Por último, se presentan pequeñas áreas dispersas con idoneidad alta, al oeste y este de la provincia Californiana (PC), y en la parte meridional de la PBC y en la PDC, se estimaron pequeñas zonas dispersas de idoneidad que va de alta a excelente en la en toda la provincia, siendo más evidentes las localizadas en el Distrito Zacatecano.
Discusión
El estudio de los registros de O. assimilis, O. cardonai y O varians, a partir de especímenes depositados en colecciones entomológicas y bases de datos en línea, permitió definir la fracción del espacio geográfico donde estas especies están presentes en interacción con los ecosistemas, conocer el espectro alimenticio de su estadio adulto, identificar los factores que potencialmente están asociados a su presencia o ausencia, así como conocer el periodo de tiempo en el que se encuentran a lo largo del año. Los análisis de estos datos también permitieron generar hipótesis espaciales de su distribución y estimar los límites de las áreas donde se han reportado, así como reconocer áreas potenciales para su monitoreo.
Las ambigüedades taxonómicas y las identificaciones incorrectas son fuentes de error para establecer la distribución de una especie (Soberón y Peterson, 2004; Maciel-Mata et al., 2015). Una hipótesis de distribución estimada a partir de datos que no fueron corroborados taxonómicamente es limitada y debe tomarse con cautela, ya que los modelos generados pueden sobreestimar la distribución, sugiriendo la presencia de la especie en zonas donde nunca se ha registrado o donde no presenta condiciones adecuadas para su establecimiento (Pearman et al., 2010). Para evitar errores en la estimación de las distribuciones de las especies de Ocoaxo, todos los registros incluidos en el presente estudio fueron avalados por especímenes identificados con base en caracteres morfológicos externos y de la genitalia masculina, corroborando a las especies O. cardonai, O. varians y O. assimilis. En todos los casos, los caracteres morfológicos fueron concordantes con las descripciones y las claves propuestas para estos taxones (Castro-Valderrama et al., 2019).
El género Ocoaxo se creó a partir de especímenes de SphenorhinaAmyot y Serville (1843), después de que Fennah (1968) realizara una revisión a las notas hechas por Nast (1950). Al crear el género, Fennah (1968) incluyó 27 especies, pero omitió agregar 2 especies descritas por Nast en su revisión de 1950; no fue hasta 25 años después, que se incluyó una nueva especie (Nast, 1975). Recientemente, se describieron 2 miembros más, uno de ellos O. cardonai (Castro-Valderrama et al., 2019), además, colecciones europeas validan la presencia de las otras 2 especies del complejo en México. O. assimilis se reportó en el siglo XIX en Guerrero de ejemplares colectados por H. H. Smith (Walker, 1858; Nast, 1950), los especímenes se encuentran en el BMNH en Londres, mientras que O. varians fue descrita en 1864 y el sintipo se depositó en el Museo Sueco de Historia Natural, Estocolmo (Stål, 1864).
Es importante resaltar que en la revisión de Carvalho y Webb (2005), una de las más extensas para el norte del continente americano, no se mencionan los hábitos alimenticios de O. assimilis y O. varians, y su distribución se representa únicamente listando las localidades donde fueron encontradas, por lo cual su distribución fue descrita prácticamente a partir de las localidades tipo. Los eventos atípicos de crecimientos poblacionales de estas especies y la descripción de O. cardonai generaron nuevos registros, y se reconoció que los adultos de estos taxones presentan hábitos alimenticios diferentes de otros Cercopidae, ya que perforan y succionan la savia de las acículas de pino, provocando clorosis y su eventual caída (Castro-Valderrama et al., 2017, 2019). El número de recolectas registradas en México es reducido, ya que solamente se integraron 55 registros de colecciones entomológicas y bases de datos en línea, es notable que, a partir del año 2008, los muestreos se intensificaron, debido a los crecimientos poblacionales y los impactos ocasionados en bosques de pinos en los estados de Puebla, Oaxaca y Veracruz (Castro-Valderrama et al., 2017; Cid-Muñoz et al., 2020); situación que causó que se intensificaran los monitoreos en las zonas afectadas, lo que provocó un sesgó de muestreo, dejando de lado otras áreas potenciales de presencia para su estudio.
El análisis temporal de los registros sugiere que estos insectos tienen una marcada estacionalidad, sincronizan su emergencia con la época de lluvias y tienen un ciclo de vida univoltino, puesto que todos los datos de recolecta incluidos estuvieron restringidos a 4 meses del año, desde el comienzo del verano en mayo, hasta principios de otoño en octubre, periodo que corresponde con la época de mayor precipitación en México. Esta tendencia concuerda con lo reportado para O. assimilis (Cid-Muñoz et al., 2020) y para la especie europea Haematoloma dorsatum (Ahrens, 1812) (Hernández et al., 1992; Sallé y Battisti, 2016), que presentan sus primeros estadios ninfales al comienzo de las lluvias y continúan su desarrollo ontogenético hasta final del otoño, en este periodo, ambas especies presentan una sola generación por año.
Los datos sobre la biología de O. assimilis y otros salivazos, sugieren que la marcada estacionalidad de las especies estudiadas está asociada con cambios en la temperatura y humedad en los sitios de recolecta, promovidos por el comienzo de la temporada de precipitación en verano. En O. assimilis, la precipitación y la temperatura son factores importantes para comenzar el ciclo de vida, al parecer 70 mm de precipitación acumulada en la primera quincena del mes de mayo de 2018 fue suficiente para que las ninfas comenzaran su desarrollo en Nicolás Bravo, Puebla (Cid-Muñoz et al., 2020). En otros cercópidos el inicio de las lluvias y el aumento de la temperatura se asocian con el término del periodo de la diapausa y quiescencia posdiapáusica (Sujii et al., 2001), por lo cual se reconocen como factores que promueven la sincronización de las poblaciones (Castro et al., 2005; Fontes et al., 1995; García-García et al., 2006; Martin et al., 1995; Morales, 1993; Oomen, 1975; Peck, 1999; Sujii et al., 2001).
La evolución de Ischnorhininae (Carvalho y Webb, 2005), que incluye a todos los cercópidos americanos, se asocia con el origen y diversificación de las gramíneas (Cryan y Svenson, 2010), hipótesis que refleja que la mayoría de las especies de esta subfamilia se alimentan de pastos y hierbas (Carvalho y Webb, 2005), preferentemente gramíneas fijadoras de nitrógeno (Thompson, 2004). En este contexto, los datos avalan consistentemente que los adultos de las especies del complejo Ocoaxo presentan hábitos alimenticios muy contrastantes dentro de la familia y otros taxones de Cercopoidea (Cryan y Svenson, 2010). Los adultos de las especies de Ocoaxo estudiadas fueron registradas únicamente en 3 especies del género Pinus, las cuales representan 1 subgénero y 2 de las 11 subsecciones reconocidas en este taxón: P. patula (subgénero Pinus; subsección Austraeles), P. pseudostrobus y P. oaxacana (subgénero Pinus; subsección Ponderosae) (Gernandt et al., 2005; Zeb et al., 2019). Al comparar el número de registros por hospedante entre estos salivazos, es notable que los adultos de O. assimilis (P. patula, P. oaxacana, Pinus sp.) y O. cardonai (P. patula, P. pseudostrobus y Pinus sp.) presentaron una dieta más amplia y parecida entre sí, compartiendo P. patula, y especies consideradas sinónimas, P. pseudostrobus y P. oaxacana; en contraste con O. varians que no se reportó en ningún huésped especifico, pero solo la reportaron sobre Pinus sp.
Respecto a otros Cercopoidea que se alimentan de coníferas, los miembros del complejo Ocoaxo de los pinos se alimentan de pocas especies de pinos y presentan un espectro alimenticio estrecho como el caso de Aphrophora flavipes Uhler, 1896, especie perteneciente a la familia Aphrophoridae, que se alimenta de Pinus densiflora Siebold y Zucc. en bosques de Japón (Matsumoto, 1990). Por el contrario, Aphrophora cribrata (Walker, 1851) se alimenta de 15 taxones de Pinus (Pinus nigra J. F. Arnold (= P. nigra var. austriaca (Höss) Badoux), P. strobus L., P. banksiana Lamb., P. thunbergii Parl., P. densiflora, P. flexilis E. James, Pinus kesiya var. langbianensis (A. Chev.) Gaussen ex Bui (= P. taeda), P. contorta Douglas ex Loudon, Pinus radiata D. Don (= P. rigida), P. ponderosa Douglas ex C.Lawson, Pinus hartwegii Lindl. (= P. resinosa Roezl), P. sylvestris L., Pinus mugo Turra (= P. echinata), P. elliottii Engelm., P. virginiana Mill. y P. monticola Douglas ex D. Don), en EUA (Wilson, 1991). Asimismo, en la familia Cercopidae se presenta la especie Haematoloma dorsatum reportada en por lo menos 8 especies de Pinus (P. nigra nigra J.F.Arnold, P. nigra salzmanni (Dunal) Franco, Pinus nigra laricio Maire (= P. nigra italica Herter), P. halepensis Mill., P. sylvestris L., P. ponderosa, P. Jeffreyi A. Murray bis, P. brutia Ten., Pinus hartwegii (= P. resinosa) y P. pinaster Aiton) en Italia, Holanda y España (Cobos, 1995; Covassi et al., 1989; Hernández et al., 1992; Notario et al., 1981).
En un contexto filogenético, dentro de la superfamilia Cercopoidea, este hábito alimenticio resulta homoplásico, ya que se presenta paralelamente en diferentes linajes correspondientes a las familias Aphrophoridae (A. cribrata y A. flavipes) y Cercopidae (Cryan y Svenson, 2010); en esta última, en especies de 2 subfamilias y 2 áreas geográficas distintas: Cercopinae en el viejo mundo (Haematoloma dorsatum) e Ischnorhininae en el nuevo mundo (O. assimilis, O. cardonai y O varians). Aunque los registros en colecciones indican que los adultos de las especies del complejo Ocoaxo de los pinos se alimentan exclusivamente de coníferas, existen un registro de O. cardonai alimentando de Rubus sp. (Castro et al., 2017) y en las fotografías de Naturalista, se pueden observar a las especies del complejo alimentándose de especies vegetales diferentes a los pinos; además, un estudio reciente indica que estos insectos presentan plasticidad en su espectro alimenticio a lo largo de su ontogenia. Las ninfas de O. assimilis se alimentan de raíces de plantas herbáceas como Bidens odorata Cav. (= Bidens pilosa L.), Penstemon barbatus (Cav.) Roth, Tagetes lucida Cav., Bouvardia ternifolia (Cav.) Schltdl, un arbusto Symphoricarpos microphyllus (Humb. y Bonpl. ex Schult.) Kunth, árboles como P. pseudostrobus var. apulcensis (Lindl.) Shaw, Quercus rugosa (Masam.) J. C. Liao (= Quercus spinosa subsp. Miyabei) (Hayata) A. Camus y el pasto Jarava ichu Ruiz y Pav (= Stipa ichu (Ruiz y Pav) Kunth.) a partir del estadio ninfal IV únicamente se alimentan de savia de las raíces de P. pseudostrobus var. apulcensis y al llegar al estado adulto se alimentan de acículas de pino (Cid-Muñoz et al., 2020).
Al igual que la mayoría de las especies de cercópidos que habitan en México (Carvalho y Webb, 2005; Castro, 2018), los datos de presencia de O. assimilis, O. cardonai y O. varians estuvieron circunscritos a la región Neártica y a la zona norte de la región Caribeña del Neotrópico (Morrone, 2001). Los registros respaldan la distribución de estos salivazos en 3 provincias, principalmente: Sierra Madre Oriental, Faja Volcánica Transmexicana y la Sierra Madre del Sur (García-Navarrete y Morrone, 2018; Morrone et al., 2017); considerando el espacio geográfico, las 3 especies estuvieron presentes en bosque de pinoencino y bosque de encino, sitios en donde predominan los leptosoles que se encuentran altamente asociados a bosques (FAO, 2008; Lozano-Rivas, 2016).
Las provincias biogeográficas y los tipos de vegetación en donde habitan estas especies, así como las hipótesis biogeográficas de Ischnorhininae, llevan a sugerir que el patrón de distribución de estos insectos es concordante con el cenocrón Mesoamericano de Montaña (Halffter, 2017). Los taxones que siguen este patrón se distribuyen principalmente en bosques de montaña, mesófilos y de pino-encino, además de que se caracterizan por originarse a partir de linajes sudamericanos, que colonizaron América Central y posteriormente se dispersaron en los sistemas montañosos de la Zona de Transición Mexicana (Juárez-Barrera et al., 2020; Morrone, 2019). De acuerdo con esto, la distribución actual de los géneros de Cercopidae americanos (= Ischnorhininae) ha sido explicada por una combinación de varios eventos de dispersión y vicarianza, a partir de su área de distribución ancestral, que se estima fue el noroeste de Sudamérica, zona que corresponde al límite septentrional de la subregión caribeña del Neotrópico (Carvalho y Webb, 2005; Cryan y Svenson, 2010; Morrone, 2001; Paladini et al., 2015, 2018). Particularmente, para Ocoaxo y otros 4 géneros de Ischnorhininae (Naenus, Huaina inca, Sphenorhina y Prosapia), la distribución actual se explica por eventos de dispersión independientes hacia el norte de la región caribeña, hacía el dominio mesoamericano (Paladini et al., 2015)
Aunque los registros de las 3 especies estudiadas estuvieron circunscritos a 3 provincias biogeográficas, las cuales presentan afinidades ecológicas y ambientales, los modelos de distribución potencial indican que O. assimilis, O. cardonai y O. varians presentan condiciones ambientales favorables en otras provincias de la Zona de Transición Mexicana. Los mapas de distribución potencial del complejo muestran que las áreas más extensas y continuas con idoneidad ambiental excelente se encuentran en la Sierra Madre Oriental, Sierra Madre Occidental, Faja Volcánica Transmexicana, Sierra Madre del Sur y las Tierras Altas de Chiapas. Considerando que se tienen registros de presencia en 3 de las 5 provincias biogeográficas predichas con probabilidad alta de presencia, se debería priorizar el número de colectas y exploraciones en las Tierras Altas de Chiapas, la Sierra Madre Occidental, la zona oeste de la Faja Volcánica Transmexicana y el oeste de la Sierra Madre del Sur. Aunque las provincias Californiana, de Baja California y del Desierto Chihuahuense mostraron probabilidades altas de presencia, los patrones de distribución de las especies, así como la información ecológica de este complejo, indican que es poco probable que las especies hayan colonizado estas provincias. Los resultados sugieren que los límites de la distribución de las especies del complejo Ocoaxo de los pinos, a nivel de macroescala, podrían estar relacionados con las siguientes variables: estacionalidad de la temperatura, rango anual de temperatura, temperatura media del trimestre más cálido, temperatura máxima del mes más cálido y temperatura mínima del mes más frío. Al considerar estas variables, el perfil ambiental indicó que la tolerancia de las especies de Ocoaxo a la temperatura es amplia; además, la adaptación a hábitats templados nos lleva a hipotetizar que las alteraciones ligeras en los patrones de comportamiento estacional podrían promover cambios en la distribución y tamaño poblacional de estos insectos.
En el caso de O. varians, el intervalo anual de tempera- tura y temperatura media del trimestre más cálido fueron relevantes, mientras que para O. assimilis la temperatura media del trimestre más cálido, la estacionalidad de la temperatura y el rango anual, contribuyeron al modelo, y en el caso de O. cardonai, las variables más importantes fueron la temperatura máxima del mes más cálido, la temperatura mínima del mes más frío y el rango anual de temperatura. En las 3 especies, el rango anual de temperatura fue una variable predictora ya que de esta depende su actividad, metabolismo, desarrollo (Jaworski y Hilszczański, 2013; Schöbel y Carvalho, 2019), tasa del crecimiento, comportamiento (Sujii et al., 2001), así como en la sincronización del ciclo de vida (Castro et al., 2005; Fontes et al., 1995; García-García, 2006; Martin et al., 1995; Oomen, 1975; Peck, 1999). Estos resultados son similares a las estimaciones en otros hemípteros como Nysius simulans Stål, 1859 (Silva de Paula y Barreto, 2020), donde la temperatura fue una variable clave para su distribución y en Neophilaenus lineatus (Linnaeus, 1758), especie que puede aumentar su densidad poblacional en 50% con el incremento de un 1 °C en la temperatura ambiente (Schöbel y Carvalho, 2019; Whittaker y Tribe, 1996).
Aunque las variables de precipitación no contribuyeron en el modelado de la distribución potencial de las especies del complejo Ocoaxo de los pinos, en el nivel de escala geográfica utilizado, la información con la que se cuenta de su biología sugiere que en escalas menores la humedad es un factor preponderante para su dinámica poblacional (Sujii et al., 2001), ya que se ha reportado que la producción de espuma evita que las ninfas pierdan agua y su supervivencia se vea comprometida cuando la disponibilidad de este recurso disminuye (Chen et al., 2018; Tonelli et al., 2018; Whittaker, 1970). Sin embargo, también se ha documentado en Notozulia entreriana (Berg, 1879), Deois flavopicta (Stål, 1854), Aeneolamia varia (Fabricius, 1787) y Aeneolamia albofasciata (Lallemand, 1939), que la precipitación tiene un efecto adverso, ya que cuando las lluvias son abundantes se incrementa la frecuencia de huevos inviables y aumenta la mortalidad de las ninfas por ahogamiento (Bustillo et al., 2011; Flores, 1994; Hewitt y Nilakhe, 1986, Gamboa e Hincapié, 2000; Urich, 1913). Por lo anterior, es de esperarse que el cambio o la variación de estos factores ambientales estén relacionados con la dinámica poblacional, tamaño de los picos poblacionales y su distribución en suelos mal drenados.
En resumen, el estudio de la distribución temporal y espacial del complejo Ocoaxo de los pinos permitió evidenciar una plasticidad en su espectro trófico; reconocer patrones en su temporalidad anual y espacial, así como las variables bióticas y abióticas relacionadas con su distribución. La posibilidad de probar diferentes parámetros, así como aumentar los criterios de selección, contribuyeron en modelos más robustos a pesar de la baja cantidad de datos. Los modelos obtenidos predijeron sitios con condiciones ambientales óptimas para las especies del complejo Ocoaxo, por lo que se considera realizar muestreos para su monitoreo y corroboración.











 nueva página del texto (beta)
nueva página del texto (beta)