Introducción
Dentro de los invertebrados de agua dulce, el orden Odonata es muy conspicuo y desempeña un papel importante en estos ecosistemas, debido a que son depredadores tanto en estado adulto como larval, y también son presas de muchos organismos. Por otra parte, se han empleado de manera eficiente como indicadores de la calidad en estos ambientes o bien para asignar valores de conservación y evaluar estrategias de manejo ambiental (Bried y Samways, 2015).
México es un país que alberga alrededor de 6.1% de la fauna mundial de Odonata (González-Soriano y Novelo-Gutiérrez, 2014). Chiapas ocupa una posición muy privilegiada en cuanto a diversidad por poseer 52% de especies registradas, lo que representa un total de 185 especies reconocidas (González-Soriano y Novelo-Gutiérrez, 2014). En México se han determinado sitios de extensión relativamente restringida pero que poseen una alta diversidad de odonatos (hotspots); en Los Tuxtlas, Veracruz, con 139 especies registradas (González-Soriano, 1997) y una zona de la Huasteca Potosina, alrededor del río Pánuco, con 126 especies (González-Soriano et al., 2011). Sin embargo, otras regiones de México, como la selva Lacandona (SL, de aquí en adelante), requieren estudios para determinar si son zonas de alta diversidad de odonatos. Para Chiapas se han reportado 185 especies por González-Soriano y Novelo-Gutiérrez (2014) y el estudio de Gómez-Tolosa et al. (2015) incluye 41 especies en 11 localidades, solamente para la región costa Soconusco, con un nuevo registro a nivel estatal. Por lo que, actualmente, Chiapas cuenta con un registro de 186 especies en total y permanece en el segundo lugar en diversidad respecto a Veracruz que registra un total de 222 especies (González-Soriano y Novelo-Gutiérrez, 2014).
Por otra parte, en Chiapas se han establecido 46 ANP que comprenden una extensión de más de un millón 400 mil hectáreas, de las cuales 20 son de carácter federal y 26 estatales, lo que representa 19.8% de la superficie total del estado, de acuerdo con la Secretaría de Medio Ambiente e Historia Natural de Chiapas. Dentro de las áreas de interés para la conservación, la región de la SL es considerada como una de las áreas de mayor biodiversidad en México.
El tipo de vegetación predominante en la SL es el bosque tropical perennifolio, uno de los ecosistemas más complejos de todas las comunidades vegetales en el mundo (Rzedowski, 2006). Sin embargo, a partir de la colonización campesina de esta zona hacia los años 50 del siglo XX, comenzó un proceso permanente de cambio de uso del suelo, una disminución continua de la cobertura forestal y, por ende, un uso indiscriminado de los recursos naturales. Las consecuencias de dichas acciones fueron la pérdida de fertilidad de suelo agrícola, la deforestación y la falta de alternativas o proyectos económico-ecológicamente sustentables (Hein y Van Der Meer, 2012; Medellín, 1994). Además, el uso del fuego y la demanda de tierras para la expansión de las prácticas agropecuarias han sido causantes de la deforestación, la destrucción de ecosistemas y actualmente constituyen uno de los factores que contribuyen con la extinción de especies (Dirzo et al., 2014; Rautner et al., 2013).
Ante la pérdida acelerada de la biodiversidad, se necesitan estudios enfocados a conocer, registrar y monitorear a las especies presentes en las zonas con bajo y alto impacto ocasionado por las actividades humanas. Por lo anterior, el objetivo del presente trabajo fue identificar la fauna de odonatos adultos dentro de 2 ANP (Puerto Bello Metzabok y Naha) en la SL.
Materiales y métodos
El área de estudio abarca 2 ANP, denominadas de acuerdo con la Comisión Nacional de Áreas Naturales Protegidas como Áreas Especiales para la Conservación de Flora y Fauna "Puerto Bello Metzabok" y "Naha" (Conanp, 2020), las cuales conservan remanentes de vegetación primaria tipo bosque tropical perennifolio (Rzedowski, 2006). De acuerdo con la clasificación de Kõppen, modificada por García (2004), el clima es cálido subhúmedo con lluvias de verano (AW).
La ubicación geográfica de las 2 reservas, comprende las siguientes coordenadas geográficas extremas: 17°09'43.35" N, 91°40'02.60" O, 16°57'25.12" N, 91°33'13.08" O. El área de estudio abarca el río Naha. Este río conecta las 2 ANP a través de un corredor ribereño que dirige su caudal desde el ANP de Naha pasando por el ejido el Tumbo, donde la agricultura y la ganadería son el uso principal de la tierra, y termina en Puerto Bello Metzabok (en adelante Metzabok). De acuerdo con la clasificación de Strahler (1957), en nuestra área de estudio se encuentran cursos de agua de primero, segundo y tercer orden (fig. 1; tabla 1).
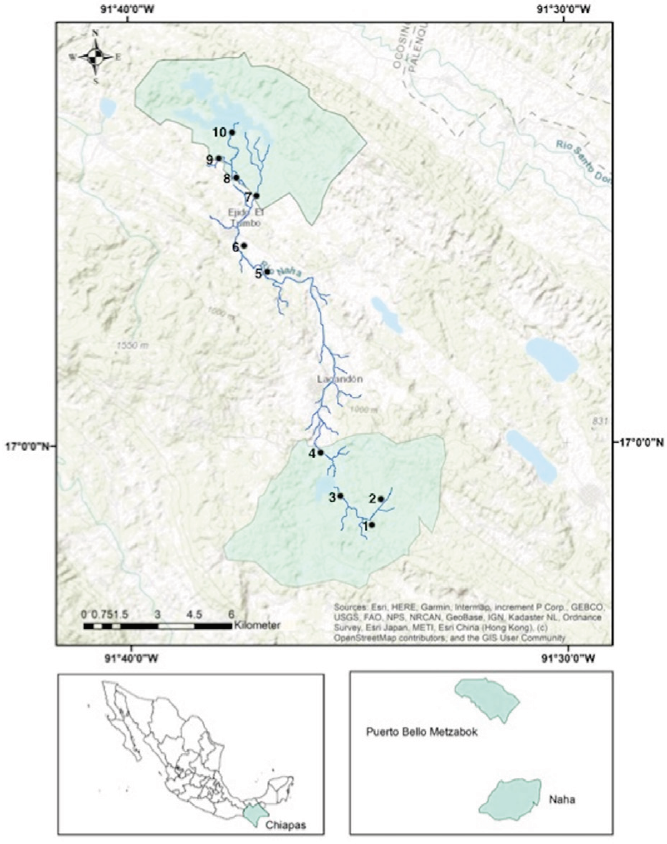
Figura 1 Área de estudio. La poligonal de las áreas naturales protegidas de Naha y Puerto Bello Metzabok está delimitada por el color verde claro. La ubicación geográfica de las 10 unidades de muestreo. Cuatro se encuentran dentro del ANP de Naha (1, 2, 3 y 4), 4 en el ANP de Metzabok (7, 8, 9 y 10). Los sitios 5 y 6 que corresponden al ejido El Tumbo no se consideraron en este trabajo por estar fuera de las ANP.
Tabla 1 Ubicación geográfica de las localidades
| Localidad | Latitud (N) | Longitud (O) | Altitud | Orden del río (Strahler, 1957) |
|---|---|---|---|---|
| Naha 1 | 91°34'37" | 16°50'23" | 896 | 2 |
| Naha 2 | 91°34'11" | 16°58'23" | 886 | 1 |
| Naha 3 | 91°35'11" | 16°58'51" | 836 | 2 |
| Naha 4 | 91°35'38" | 16°59'49" | 854 | 3 |
| Metzabok 7 | 91°37'52" | 17°06'13" | 549 | 3 |
| Metzabok 8 | 91°37'04" | 17°05'27" | 526 | 2 |
| Metzabok 9 | 91°37'52" | 17°06'11" | 551 | 2 |
| Metzabok 10 | 91°37'37" | 17°06'50" | 591 | 3 |
Para determinar a las especies de odonatos se llevó a cabo un muestreo en cuerpos de agua de tipo lótico en 8 puntos de muestreo que corresponden a las siguientes localidades: Naha (1, 2, 3 y 4) y Metzabok (7, 8, 9 y 10). Las localidades de muestreo se encuentran en una altitud de entre 526 y 896 m snm (fig. 1; tabla 1). El muestreo, en cada una de las 8 localidades, se realizó en 2 periodos estacionales, septiembre-octubre del 2018 (lluvias) y marzo-abril del 2019 (sequía), durante 20 días en total (10 días por cada periodo).
Considerando la perspectiva del biomonitoreo en relación al costo-beneficio del nivel taxonómico en cada sitio (Valente-Neto et al., 2016), se trazó un transecto de 150 m y se realizó la captura de adultos mediante una red entomológica entre las 09:30 y las 15:30 hrs, que es la hora con mayor exposición solar. De acuerdo con Ferreira-Peruquetti y Marco Junior (2002) y Brasil et al. (2014), el transecto se recorrió con una velocidad de 1.66 m/min en promedio. Cada ejemplar se colocó en una bolsa y se etiquetó anotando la clave, la localidad, la fecha y para su preservación, se colocaron en una hielera para su transporte al lugar donde fueron procesados. Los especímenes se identificaron tomando en cuenta las claves taxonómicas de Förster (2001) y Garrison et al. (2010). En el caso de dudas, los organismos identificados se compararon con las especies registradas localmente en Ocosingo, que corresponden a Chiapas (González-Soriano y Novelo-Gutiérrez. 2007; González-Soriano y Paulson, 2011) y cotejadas en caso de dudas con el acervo odonatológico incluido en la CNIN (Colección Nacional de Insectos) del Instituto de Biología, UNAM. Posteriormente, se depositaron en el museo de referencia de invertebrados de la UNICACH-OM. El permiso de colecta es el SGPA/DGVS/002775/18 con número de bitácora 97/K5-0096/03/18 y no se recolectó ninguna especie en peligro o amenazada (Conabio, 2022; UICN, 2022).
Resultados
Se obtuvo un total de 437 individuos, que corresponden a 36 especies (tabla 2); 26 de las cuales pertenecen al suborden Zygoptera, de las familias: Calopterygidae, Coenagrionidae, Lestidae, Heteragrionidae y Polythoridae.
Tabla 2 Familias y especies recolectadas en las 2 ANP. Las especies recolectadas en los 2 sitios corresponden a celdas en color negro, las especies recolectadas exclusivamente en un sitio corresponden a las celdas en color gris.
| Suborden | Familia | Especie | Naha | Metzabok |
|---|---|---|---|---|
| Anisoptera | Gomphidae | Progomphus pygmaeus | ||
| Libellulidae | Brechmorhoga rapax | |||
| Brechmorhoga sp. | ||||
| Cannaphila insularis | ||||
| Dythemis nigra | ||||
| Dythemis sterilis | ||||
| Macrothemis delia | ||||
| Macrothemis inequiunguis | ||||
| Macrothemis sp. | ||||
| Micrathyria didyma | ||||
| Zygoptera | Calopterygidae | Hetaerina cruentata | ||
| Hetaerina infecta | ||||
| Hetaerina occisa | ||||
| Hetaerina pilula | ||||
| Hetaerina sempronia | ||||
| Hetaerina titia | ||||
| Coenagrionidae | Acanthagrion quadratum | |||
| Argia anceps | ||||
| Argia cuprea | ||||
| Argia elongata | ||||
| Argia gaumeri | ||||
| Argia oculata | ||||
| Argia oenea | ||||
| Argia pipila | ||||
| Argia pulla | ||||
| Argia sp. | ||||
| Argia translata | ||||
| Argia ulmeca | ||||
| Enacantha caribbea | ||||
| Enallagma novaehispaniae | ||||
| Neoerythromma cultellatum | ||||
| Neoneura amelia | ||||
| Protoneura aurantiaca | ||||
| Heteragrionidae | Heteragrion alienum | |||
| Heteragrion tricellulare | ||||
| Lestidae | Lestes tikalus | |||
| Polythoridae | Cora marina |
Respecto al suborden Anisoptera, está representado por 9 especies repartidas en 2 familias: Gomphidae y Libellulidae. La familia Calopterygidae estuvo representada por 6 especies del género Hetaerina; Coenagrionidae por 17 especies, de las cuales 10 corresponden al género Argia y las 6 restantes pertenecen a los géneros Acanthagrion, Enacantha, Enallagma, Neoerythromma, Neoneura y Protoneura.
Respecto a la familia Heteragrionidae, se encontraron 2 especies; mientras que las familias Lestidae y Polythoridae registraron 1 especie cada una, respectivamente. No se recolectaron individuos de la familia Aeshnidae, que han sido previamente registrados para Chiapas (González-Soriano y Paulson, 2011). Hetaerina occisa fue la especie más abundante y se recolectó en todos los sitios, por lo que representa 26.1% (n = 114 individuos) respecto al total de abundancia de todas las especies recolectadas; en este estudio se considera como la especie dominante.
Argia gaumeri Calvert, 1907 es un nuevo registro para Chiapas. Es importante mencionar que no se recolectaron ejemplares hembras de dicha especie. A. gaumeri ha sido recolectada previamente en México para Campeche, Quintana Roo, Veracruz y Yucatán (González-Soriano y Novelo-Gutiérrez, 2007). Aunque la mayoría de las especies de Argia son habitantes de ríos y arroyos, es común observar a A. gaumeri colonizando sitios de aguas de tipo léntico como lagos con agua de buena calidad (González-Soriano obs. pers.). Esta especie se recolectó en 3 sitios que son: Metzabok número 10 (5 ejemplares), Naha número 3 (1 ejemplar) y número 4 (7 ejemplares) durante los meses de muestreo. Con esta adición, el número de especies registradas para Chiapas se eleva a 187 especies (Gómez- Tolosa et al., 2015; González-Soriano y Novelo-Gutiérrez, 2014).
Discusión
Con base en el listado de especies de Odonata y su distribución para Chiapas, se han reportado 35 especies para el municipio de Ocosingo. En este trabajo se registraron 36 especies que corresponden al área de estudio, que se localiza en el mismo municipio. Dentro de esas 36 especies, 9 han sido registradas para otras localidades y municipios del estado, pero no se habían registrado anteriormente dentro de la región SL: Neoneura amelia (Ocozocuatla y Tapachula), Argia oenea (Arriaga, Ocozocuautla, Pijijiapan, Ángel Albino Corzo y Tapachula), A. pipila (La Concordia y Tapachula), Enacantha caribbea (Ixhuatán), Enallagma novaehispaniae (Arriaga, Tuxtla Gutiérrez, Escuintla, Tapachula, Huixtla y Tonalá), Neoerythromma cultellatum (Tapachula), Progomphus pygmaeus (Cintalapa), Brechmorhoga rapax (Ángel Albino Corzo, Ixhuatán, Rayón y Trinitaria) y Dythemis sterilis (Tapachula, Ocozocuatla, Tuxtla Chico, Pichucalco, límite con Tabasco, Villaflores). En este trabajo no se encontraron las siguientes 8 especies reportadas previamente por González-Soriano y Paulson (2011) para el municipio de Ocosingo: Hetaerina americana, Fabricius, 1798; Argia frequentula Calvert, 1907; Leptobasis vacillans Hagen, 1877; Telebasis collopistes, Calvert, 1902; Coryphaeschna viriditas, Calvert, 1952; Erythrodiplax fervida, Erichson, 1848; Micrathyria hagenii, Kirby, 1890 y Tramea darwini Kirby, 1889 (Lorenzo-Carballa et al., 2021).
Respecto a las familias de Anisoptera, para Libellulidae se registraron 8 especies, esta familia tiene amplia distribución y se caracteriza por colonizar cuerpos de agua estacionales y habitar en ríos y lagos, se les encuentra durante todo el año, aunque las distintas especies tienen variados patrones de estacionalidad (Ramírez, 2010). Además, es un grupo dominante pero fundamentalmente de aguas lénticas (González-Soriano obs. pers.). Dentro de la familia Gomphidae solamente se registró a la especie Progomphus pygmaeus. En contraste, es evidente un mayor número de especies de las familias Coenagrionidae y Calopterygidae, que están representadas por los géneros Argia y Hetaerina en este estudio (tabla 2). Para el género Argia registramos 10 especies, lo que concuerda con otros trabajos realizados en México, en los que se reportó a este género como el de mayor riqueza de especies en ambientes lóticos (Alonso-Eguía Lis, 2004; Bond et al., 2006; Gómez-Anaya et al., 2011; Gómez-Tolosa et al., 2015; Novelo-Gutiérrez y González-Soriano, 1991) e incluso también en los humedales de montaña de Chiapas (López-Díaz et al., 2021). La especie Argia oculata presentó mayor abundancia (n = 82 y 18.8% del total), en comparación con la especie Argia pulla (n = 15 y 3.4% del total) que se reporta como la más dominante en la región costa Soconusco de Chiapas (Gómez-Tolosa et al., 2015).
Con relación al género Hetaerina, H. occisa se encontró en los 8 sitios muestreados, destacando como especie dominante (n = 114 y 26.1% del total). De acuerdo con lo reportado por Gómez-Tolosa et al. (2015), para la región costa Soconusco de Chiapas, H. occisa se registró en 8 de 11 localidades muestreadas en ese estudio, lo que sugiere que es una especie de distribución amplia y que se adapta a diferentes condiciones de deterioro ambiental. En contraste, Hetaerina americana se ha reportado como una especie común y de amplia distribución (Conabio, 2022). Sin embargo, en este estudio no se registró, aunque había sido reportada previamente para el área por González-Soriano y Paulson (2011). Es posible que el efecto de la pérdida de cobertura forestal afecte a H. americana, como lo señala un estudio realizado por Córdoba-Aguilar y Rocha-Ortega (2019), en el que mostraron que la disminución en la cobertura forestal, durante un periodo de 14 años, tiene un impacto negativo en la abundancia de los individuos adultos.
Por otra parte, dentro de las 2 ANP que comprenden el área de estudio, se resguardan 6 especies de Hetaerina en comparación con lo observado para la región costa Soconusco de Chiapas (Gómez-Tolosa et al., 2015), en donde se registraron solo 4 especies. Es posible que estos registros se deban a la presencia de la cobertura forestal de bosque tropical perennifolio, y por lo tanto en la región SL se encuentran más especies de este género. Además, Heteragrionidae y Polythoridae son familias ligadas a bosques o selvas tropicales (UICN, 2022). Aunque también falta información de registros a nivel local; por ejemplo, Heteragrion tricellulare no se encuentra reportada para áreas conservadas y en este estudio únicamente se localizó en Naha; mientras que Heteragrion alienum se registró en las 2 ANP. Por otra parte, la lista roja de especies (UICN, 2022) menciona que Cora marina está presente en áreas conservadas, lo cual se corroboró en este estudio al presentarse tanto en Naha como en Metzabok.
Dentro de la familia Lestidae, encontramos a Lestes tikalus que prefiere estanques poco profundos en zonas boscosas, típicamente aquellos que se secan en la estación seca y se vuelven a inundar en la próxima estación húmeda. Se ha registrado en Belice, Costa Rica, Guatemala, Honduras, México (Yucatán, Guerrero, Quintana Roo, Chiapas, Colima, Jalisco, Oaxaca, Veracruz), Nicaragua y Panamá (UICN, 2021).
La especie Argia gaumeri constituye un nuevo registro para Chiapas, solamente se había reportado para los estados de Campeche, Quintana Roo, Veracruz y Yucatán (González-Soriano y Novelo-Gutiérrez, 2007). Este género no solo es de los más diversos dentro de México (González-Soriano y Novelo-Gutiérrez, 2014), sino que también es el más frecuente de encontrar a la orilla de cuerpos de agua, principalmente lóticos y tanto permanentes como temporales; así como también en caminos y áreas abiertas como potreros, claros naturales de bosque, entre otros hábitats de acuerdo con el SNIB (Sistema Nacional de Información sobre Biodiversidad; 2022). Es importante resaltar que se localizó con una mayor abundancia de individuos en sitios recreativos de las ANP (Naha 4 y Metzabok 10), utilizados por los habitantes locales y los turistas.
Consideramos que los listados faunísticos incrementan el conocimiento de la distribución de la fauna a través de nuevos registros, permiten establecer qué especies en un espacio y tiempo determinado continúan o no, detectan la falta de esfuerzo de muestreo o la pérdida de hábitat y el desplazamiento de las especies por cambios en el ambiente.
Por otra parte, los resultados muestran que las ANP son valiosas como áreas de resguardo de la biodiversidad, por el número de especies registradas en este trabajo. Sin embargo, sería recomendable implementar programas de educación ambiental que resalten el vínculo entre los habitantes de las ANP y el beneficio que aportan los odonatos, desde la perspectiva de los servicios ambientales, los indicadores biológicos y el valor para la conservación.











 nueva página del texto (beta)
nueva página del texto (beta)


