Introducción
El género Auricularia fue propuesto por Bulliard (1780), quien describió 7 especies; sin embargo, debido a que la delimitación que hizo del género era demasiado ambigua, actualmente varias de las especies originalmente descritas han sido transferidas a otros géneros. Lowy (1951, 1952) realizó la definición actual de los caracteres morfológicos más importantes usados para la delimitación y taxonomía del género y reconoció 10 especies para todo el mundo.
Las referencias de especies de Auricularia en México se encuentran en inventarios micobióticos, en trabajos donde se incluyen otros géneros de hongos gelatinosos o en trabajos etnomicológicos (Herrera-Fonseca et al., 2002; Lowy, 1971; Mendiola y Guzmán, 1973; Ruan-Soto et al., 2004; Sierra y Cifuentes, 1993; Sierra et al., 2008). El trabajo más exhaustivo del género en el país lo realizó Rodríguez-Gutiérrez (2011), quien reconoció 8 especies morfológicas, A. auricula-judae (Bull.) Quél., A. cornea Ehrenb., A. delicata (Mont. ex Fr.) Henn., A. fuscosuccinea (Mont.) Henn., A. mesenterica (Dicks.) Pers., A. peltata Lloyd, A. polytricha (Mont.) Sacc. y A. tenuis (Lév.) Farl.; así como 3 formas diferentes a las típicas, A. delicata f. alba Kobayasi, A. fuscosuccinea f. "blanca" y A. polytricha f. leucochroma (Kobayasi) Kobayasi.
Boa (2005), en su compendio sobre los hongos silvestres comestibles, registró 7 especies comestibles para este género: A. auricula-judae, A. cornea, A. delicata, A. fuscosuccinea, A. mesenterica, A. polytricha y A. tenuis, a partir de información recopilada de 85 países. De los países analizados, México es donde se consume la mayor diversidad, con las 7 especies mencionadas, seguido de Hong Kong, Nepal y la República Democrática del Congo, con 4 especies cada uno.
Looney et al. (2013) demostraron que A. auricula-judae s. str. y A. polytricha s. str. no se distribuyen en América y que los materiales identificados bajo esos nombres, en realidad corresponden con A. americana Parmasto et I. Parmasto ex Audet, Boulet et Sirard para A. auricula-judae y A. nigricans (Sw.) Birkebak, Looney et Sánchez-García para A. polytricha. Este y otros estudios basados en secuencias de ADN encontraron que algunos taxones de Auricularia se tratan en realidad de complejos de especies. Por ejemplo, Looney et al. (2013) demostraron que A. delicata es un complejo de 3 especies (A. delicata s. str., A. subglabra Looney, Birkebak et Matheny y A. scissa Looney, Birkebak et Matheny); Wu, Yuan, Rivoire et al. (2015) comprobaron que A. mesenterica es un complejo de 3 especies (A. mesenterica s. str., A. orientalis Y. C. Dai et F. Wu y A. brasiliana Y. C. Dai et F. Wu); Wu, Yuan, He et al. (2015) mostraron que A. auricula-judae es un complejo de 7 especies (A. auricula-judae s. str. , A. americana s. str., A. angiospermarum Y. C. Dai et F. Wu, A. tibetica Y.C. Dai et F. Wu, A. heimuer F. Wu, B. K. Cui et Y. C. Dai, A. minutissima Y. C. Dai, F. Wu et Malysheva y A. villosula Malysheva). Por lo tanto, es fundamental que el estudio taxonómico de este género esté apoyado con datos morfológicos y análisis filogenéticos de secuencias de ADN. El objetivo de este trabajo fue realizar un estudio taxonómico y filogenético para determinar las especies de Auricularia presentes en México.
Materiales y métodos
Se revisaron y tomaron muestras de especímenes de las especies estudiadas por Rodríguez-Gutiérrez (2011) depositados en las siguientes colecciones biológicas: Herbario del Colegio de Posgraduados campus Montecillo (COLPOS), Herbario del Colegio de la Frontera Sur, Unidad San Cristóbal de Las Casas (ECO-SH-H), Herbario del Colegio de la Frontera Sur, Unidad Tapachula (ECO-TA-H), Herbario de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional (ENCB), Herbario de la Facultad de Ciencias de la Universidad Nacional Autónoma de México (FCME), Herbario de la Universidad de Ciencias y Artes de Chiapas (HEM), Herbario de la Universidad Autónoma del Estado de Hidalgo (HGOM), Herbario del Centro de Investigación en Biodiversidad y Conservación de la Universidad Autónoma de Morelos (HUMO), Herbario del Instituto de Botánica de la Universidad de Guadalajara (IBUG), Herbario del Instituto Tecnológico del Valle de Oaxaca (ITVO), Herbario de la Universidad Autónoma de Querétaro (QMEX), Herbario de la Universidad Autónoma de Tlaxcala (TLXM), Laboratorio de Colecciones Biológicas de la Universidad del Mar campus Puerto Escondido (UMAR) y el Herbario del Instituto de Ecología A.C. (XAL).
Se revisaron 191 especímenes de Auricularia siguiendo las técnicas de microscopía recomendadas para el grupo: disposición y tamaño de la estructura interna del basidioma (fig. 1), basidios, basidiosporas, base de los pelos, entre otras (Looney et al., 2013; Lowy, 1951, 1952). Los reactivos utilizados fueron KOH a diferentes concentraciones (3, 5 y 10%), así como floxina para la tinción de las estructuras hialinas. La determinación de las especies se realizó utilizando claves taxonómicas y descripciones de especies como las de Bandara et al. (2015), Looney et al. (2013), Lowy (1951, 1952), Malysheva y Bulakh (2014), Wu, Yuan, Rivoire et al. (2015) y Wu, Yuan, He et al. (2015).
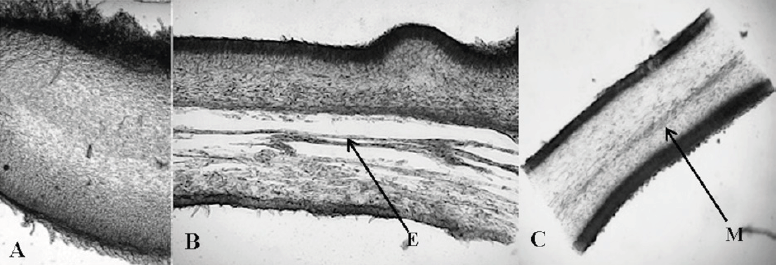
Figura 1 Diferencias en el arreglo del tejido interno del basidioma de Auricularia. A) A. americana sin médula (Montañez 38), B) A. scissa con esquizomédula (E) presente (López-Cortés 37) y C) A. tremellosa con médula (M) presente (Villegas R. M. 2471). Las fotos fueron tomadas con el objetivo 10x.
Se hizo la extracción de ADN a 30 especímenes que representan todas las morfoespecies citadas para México. La extracción de ADN se realizó usando el kit Extract-N-AmpTM Plant PCR Kit (SIGMA-ALDRICH®), para lo cual se colocaron 25 μl de la solución de extracción en tubos Eppendorf de 0.5 ml, se agregó 1 cm2 de cada muestra y se incubó a 95° C por 10 minutos. Finalmente, se agregaron 25 nl de la solución de dilución (Garibay-Orijel et al., 2013; Kennedy et al., 2011). Las extracciones de ADN se diluyeron con agua (grado de pureza HPLC) a una concentración de 50 ng/μl y se almacenaron a -20 °C.
Se amplificó la región de los interespaciadores ribosomales del ADNr (ITS) utilizando los cebadores ITS1F e ITS4 (Gardes y Bruns, 1996; White et al., 1990) y la mezcla maestra Redextract-N-Amp (Sigma-Aldrich). La PCR y la purificación de los productos de PCR se llevó a cabo de acuerdo con los protocolos de Garibay-Orijel et al. (2013) y Argüelles-Moyao et al. (2016), excepto para el caso de los ejemplares del QMEX, en donde la purificación de los productos de PCR se hizo con el QIAquick PCR Purification de QIAGEN® siguiendo las instrucciones del fabricante. Una vez limpios, los productos de PCR se secuenciaron en ambos sentidos con los mismos cebadores empleados en la PCR. Los productos de PCR de los especímenes de QMEX se enviaron a secuenciar al Laboratorio Nacional de Genómica para la Biodiversidad (LANGEBIO) en Irapuato, Guanajuato; el resto fueron secuenciados en el Laboratorio de Secuenciación Genómica de la Biodiversidad y de la Salud, en el Instituto de Biología de la Universidad Nacional Autónoma de México.
Las secuencias fueron editadas en el programa Chromas Pro 1.41 (Technelysium Pty, Ltd, Tewantin, Qld, Australia) y convertidas a archivos fasta. Las secuencias fueron alineadas con el programa MacClade 4.0 (Maddison y Maddison, 2000), utilizando como referencia secuencias de Auricularia previamente publicadas (tabla 1). Las regiones ambiguas fueron eliminadas de la matriz. Las secuencias alineadas se depositaron en TreeBase (http://purl.org/phylo/treebase/phylows/study/28944).
Tabla 1 Lista de especies y especímenes de Auricularia y grupo externo usados en los análisis filogenéticos.
| Especie | Código | País | GenBank | Fuente |
|---|---|---|---|---|
| Exidia recisa | Suecia | AF291276 | Looney et al., 2013 | |
| Exidiopsis sp. | Alemania | AF291282 | Looney et al., 2013 | |
| Auricularia americana | EUA, Oregon | DQ200918 | Looney et al., 2013 | |
| A. americana | EUA, Idaho | JX065154 | Looney et al., 2013 | |
| A. americana | Rusia | KJ698429 | Wu, Yuan, He et al., 2015 | |
| A. americana | Rusia | KJ698431 | Wu, Yuan, He et al., 2015 | |
| A. americana | IRG456 | México, Hidalgo | MW721084 | Este trabajo |
| A. americana | IRG458 | México, Michoacán | MW721085 | Este trabajo |
| A. americana | JJZsn1 | México, Querétaro | MW721086 | Este trabajo |
| A. angiospermarum | EUA | JX065151 | Wu, Yuan, He et al., 2015 | |
| A. angiospermarum | EUA | JX065152 | Wu, Yuan, He et al., 2015 | |
| A. angiospermarum | EUA | KT152096 | Wu, Yuan, He et al., 2015 | |
| A. angiospermarum | EUA | KT152097 | Wu, Yuan, He et al., 2015 | |
| A. angiospermarum | IRG478 | México, Guerrero | MW721087 | Este trabajo |
| A. angiospermarum | IRG480 | México, Chihuahua | MW721088 | Este trabajo |
| A. auricula-judae | Alemania | DQ520099 | Looney et al., 2013 | |
| A. auricula-judae | Reino Unido | KT152099 | Wu, Yuan, He et al., 2015 | |
| A. auricula-judae | Reino Unido | KT152100 | Wu, Yuan, He et al., 2015 | |
| A. australiana* | Australia, Queensland | JX065168 | Looney et al., 2013 | |
| A. australiana* | Australia, Queensland | JX065169 | Looney et al., 2013 | |
| A. brasiliana | Brasil | KP729274 | Wu, Yuan, Rivoire et al., 2015 | |
| A. brasiliana | Brasil | KP729275 | Wu, Yuan, Rivoire et al., 2015 | |
| A. brasiliana | IRG462 | México, Morelos | MW721089 | Este trabajo |
| A. brasiliana | IRG464b | México, Campeche | MW721090 | Este trabajo |
| A. cornea | Puerto Rico | JX065149 | Bandara et al., 2015 | |
| A. cornea | Australia, Queensland | JX065164 | Bandara et al., 2015 | |
| A. cornea | JJZsn6 | México, San Luis Potosí | MW721091 | Este trabajo |
| A. cornea | JJZ39 | México, San Luis Potosí | MW721092 | Este trabajo |
| A. fuscosuccinea | México, Tamaulipas | JX065138 | Looney et al., 2013 | |
| A. fuscosuccinea | EUA, Tennessee | JX065173 | Looney et al., 2013 | |
| A. fuscosuccinea | JJZsn3 | México, San Luis Potosí | MW721095 | Este trabajo |
| A. fuscosuccinea | JJZsn4 | México, San Luis Potosí | MW721096 | Este trabajo |
| A. fuscosuccinea | V01863 | México, Oaxaca | MW721097 | Este trabajo |
| A. heimuer | China, Jilin | KM396790 | Bandara et al., 2015 | |
| A. heimuer | China, Jilin | KM396796 | Bandara et al., 2015 | |
| A. mesenterica | Isla Cook | AB615233 | Looney et al., 2013 | |
| A. mesenterica | Alemania | AF291271 | Looney et al., 2013 | |
| A. mesenterica | Costa Rica, San José | JX065170 | Looney et al., 2013 | |
| A. mesenterica | Suecia | KP729280 | Wu, Yuan, Rivoire et al., 2015 | |
| A. mesenterica | Suecia | KP729281 | Wu, Yuan, Rivoire et al., 2015 | |
| A. minor | Rusia | KJ698434 | Bandara et al., 2015 | |
| A. nigricans | Costa Rica, San José | JX065167 | Looney et al., 2013 | |
| A. nigricans | EUA, Luisiana | JX065172 | Looney et al., 2013 | |
| A. nigricans | ALG25 | México, Oaxaca | MW721098 | Este trabajo |
| A. nigricans | ALG26 | México, Oaxaca | MW721099 | Este trabajo |
| A. nigricans | IRG460 | México, Chiapas | MW721100 | Este trabajo |
| A. nigricans | IRG461 | México, Morelos | MW721101 | Este trabajo |
| A. nigricans | IRG467b | México, Morelos | MW721102 | Este trabajo |
| A. nigricans | IRG473b | México, Veracruz | MW721103 | Este trabajo |
| A. nigricans | VO1761 | México, Oaxaca | MW721104 | Este trabajo |
| A. nigricans | VO1768 | México, Oaxaca | MW721105 | Este trabajo |
| A. orientalis | China, Hebei | KP729270 | Wu, Yuan, Rivoire et al., 2015 | |
| A. orientalis | China, Beijín | KP729271 | Wu, Yuan, Rivoire et al., 2015 | |
| A. scissa | República Dominicana, La Vega | JX065160 | Looney et al., 2013 | |
| A. scissa | EUA, Florida | JX065175 | Looney et al., 2013 | |
| A. scissa | IRG543 | México, Oaxaca | MW721106 | Este trabajo |
| A. scissa | JJZsn2 | México, San Luis Potosí | MW721107 | Este trabajo |
| A. scissa | JJZ33a | México, San Luis Potosí | MW721108 | Este trabajo |
| A. scissa | JJZ58 | México, San Luis Potosí | MW721109 | Este trabajo |
| A. scissa | VO1819 | México, Oaxaca | MW721110 | Este trabajo |
| A. scissa | VO1886 | México, Oaxaca | MW721111 | Este trabajo |
| A. scissa | VO1921 | México, Oaxaca | MW721112 | Este trabajo |
| A. subglabra | Costa Rica, Puntarenas | JX065142 | Looney et al., 2013 | |
| A. subglabra | Costa Rica, Alejuelas | JX524199 | Looney et al., 2013 | |
| A. thailandica | Tailandia, Chiang Mai | KR336690 | Bandara et al., 2015 | |
| A. thailandica | Tailandia, Chiang Mai | KR336691 | Bandara et al., 2015 | |
| A. tibetica | China, Tíbet | KT152105 | Wu, Yuan, He et al., 2015 | |
| A. tibetica | China, Tíbet | KT152106 | Wu, Yuan, He et al., 2015 | |
| A. tremellosa* | México, Veracruz | JX065158 | Looney et al., 2013 | |
| A. tremellosa* | México, San Luis Potosí | JX065162 | Looney et al., 2013 | |
| A. tremellosa | JJZsn5 | México, San Luis Potosí | MW721093 | Este trabajo |
| A. tremellosa | JJZ19 | México, San Luis Potosí | MW721094 | Este trabajo |
| A. villosula | China, Shan'd | KM396811 | Wu, Yuan, Rivoire et al., 2015 | |
| A. villosula | China, Jiagxi | KM396812 | Wu, Yuan, Rivoire et al., 2015 | |
| A. villosula | China, Jiagxi | KM396813 | Bandara et al., 2015 | |
| A. villosula | China, Chongqing | KM396814 | Bandara et al., 2015 |
* En GenBank como A. delicata
El árbol filogenético fue construido a través de los métodos bayesiano y máxima verosimilitud empleando como grupos externos a Exidia y Exidiopsis, 2 géneros que también fueron utilizados por Looney et al. (2013). Para el análisis bayesiano se utilizó el programa MrBayes 3.2.5 (Ronquist y Huelsenbeck, 2003) con los parámetros ngen = 3 millones, samplefreq = 100 y nruns = 4, desviación estándar inferior a 0.01. El modelo evolutivo que se aplicó fue GTR+G+I, el cual fue determinado con el programa jModelTest 3.7 (Posada y Crandall, 1998). Para obtener el árbol y las probabilidades posteriores (PP) de las ramas se desechó el 25% de las generaciones, que es el porcentaje que recomiendan Ronquist et al. (2011). Mientras que el análisis de máxima verosimilitud se construyó con el programa RAxML 7.2.6 (Stamatakis, 2006), usando el modelo evolutivo GTR+G y para el soporte de las ramas se realizó un bootstrap (BMV) de 1,000 réplicas. Los árboles se visualizaron en FigTree v1.4.4 (Rambaut, 2018).
Resultados
Se revisaron 191 ejemplares deAuricularia provenientes de diferentes regiones de México e identificadas previamente bajo el concepto de especie morfológica. Se generaron 30 secuencias de ITS que correspondieron a 8 especies de Auricularia: A. americana, A. angiospermarum, A. brasiliana, A. cornea, A. fuscosuccinea, A. nigricans, A. scissa y A. tremellosa. El análisis filogenético (fig. 2) mostró 3 grandes clados: I) incluye a las especies A. americana, A. angiospermarum, A. auricula-judae, A. heimuer, A. minor, A. tibetica y A. villosula, con un soporte de 0.95 PP y 63% de BMV; II) incluye a las especies A. australiana, A. cornea, A. delicata, A. fuscosuccinea, A. nigricans, A. scissa, A. subglabra y A. thailandica, con un soporte de 0.90 de PP y 50% de BMV; y III) incluye a las especies A. brasiliana, A. mesenterica y A. orientalis, con un soporte de uno de PP y 93% de BMV.

Figura 2 Árbol filogenético de Auricularia construido con el principio bayesiano usando el ITS del ADNr. Los soportes arriba de las ramas representan las probabilidades posteriores por arriba de 0.9 y el bootstrap de máxima verosimilitud mayor de 50%. Las secuencias con asterisco son las que utilizó Looney et al. (2013) con el nombre de A. mesenterica. Las secuencias en negritas corresponden con ejemplares mexicanos.
Para México se confirman los reportes de A. cornea, A. fuscosuccinea, A. nigricans y A. tremellosa; además, se registran por primera vez A. americana, A. angiospermarum, A. brasiliana y A. scissa. A continuación, se mencionan las especies que se reconocen para México de acuerdo con el clado al que pertenecen en el análisis filogenético.
Clado I: Auricularia americana y A. angiospermarum. Ambas especies corresponden al complejo de A. auricula-judae. Auricularia angiospermarum solo se distribuye en América; los ejemplares mexicanos provienen de Chihuahua y Guerrero. Su clado tiene un buen soporte (1 PP / 77% BMV). Auricularia americana es una especie que está presente en América y Asia, los especímenes mexicanos provenientes de Hidalgo, Michoacán y Querétaro formaron un clado con buen soporte junto con los especímenes provenientes de Norteamérica y Asia (1 PP / 79% BMV). Las secuencias de EUA, México y Rusia se separaron en clados internos de acuerdo con su lugar de procedencia.
Clado II: Auricularia cornea, A. fuscosuccinea, A. nigricans, A. scissa y A. tremellosa. Morfológicamente los ejemplares mexicanos de A. cornea, provenientes de San Luis Potosí, presentaron las características distintivas de la especie y molecularmente formaron un clado con un soporte de una PP y 97% de BMV con las secuencias provenientes de Australia y Puerto Rico.
En el caso de A. fuscosuccinea, los ejemplares mexicanos de San Luis Potosí y Oaxaca, más 1 secuencia de Tamaulipas formaron un clado con una secuencia proveniente de EUA con una PP de 0.90 y 93% de BMV.
Las secuencias mexicanas de A. nigricans de ejemplares provenientes de Campeche, Chiapas, Oaxaca y Tlaxcala formaron un clado con 0.90 de PP y 73% de BMV con las secuencias provenientes de Costa Rica y USA.
Los ejemplares mexicanos de A. scissa, provenientes de Oaxaca y San Luis Potosí, coincidieron en la morfología y en lo molecular con el tipo de la especie (JX065160) de República Dominicana, con una similitud nucleotídica del 100% al comparar las secuencias y se agruparon en el clado con uno de PP y 96% de BMV.
Auricularia tremellosa es una especie morfológicamente idéntica a la descripción tipo de A. delicata, no obstante, esa especie tiene su distribución en África, los especímenes mexicanos son provenientes de Veracruz y San Luis Potosí (ver Discusión).
Clado III: Auricularia brasiliana. Los especímenes mexicanos de A. brasiliana, provenientes de Campeche y Morelos, presentaron una similitud nucleotídica del 100% y formaron un clado con el soporte más alto, de una PP y del 100% de BMV con los ejemplares de Brasil.
Descripciones
Auricularia americana Parmasto et I. Parmasto ex Audet, Boulet et Sirard, Les Champignons des Arbres de l'Est de l'Amérique du Nord: 287 (2003). Fig. 3A, B.

Figura 3 Diversidad de especies de Auricularia en México. A, B) A. americana (A: J. Jiménez-Zárate s/n 1, QMEX; B: J. Jiménez-Zárate); C) A. angiospermarum (Rodríguez-Gutiérrez I. 2008-3, FCME); D, E) A. brasiliana, con abhimenio zonado e himenóforo sulcado (ambas fotos son del mismo espécimen, Rodríguez-Gutiérrez I. 2008-47, FCME); F) A. cornea (J. L. Villarruel-Ordaz s/n, UMAR); G, H) A. tremellosa (G: J. Jiménez-Zárate 19, QMEX; H: S. Sierra); I) A. tremellosa (a la derecha) y A. fuscosuccinea (a la izquierda, J. Jiménez-Zárate s/n 3, QMEX); J) A. fuscosuccinea (Rodríguez-Gutiérrez I. 2009-XVI, FCME) y K) A. nigricans (Rodríguez-Gutiérrez I. 2008-45, FCME). Barra = 1 cm. Los datos de colecta de los especímenes de las fotos están entre paréntesis, solo cuando la foto no está asociada a un ejemplar de herbario se anotó el nombre del autor de la foto.
Macromorfología. Basidioma de hasta 90 mm de diámetro, 1-7 mm de grosor, solitario a cespitoso, sésil a subestipitado, convexo a auriculado, algunas veces con el margen lobado, redondo a subredondo, marrón, marrón claro a oscuro a marrón vináceo, himenóforo liso a ligeramente sulcado, abhimenio velutinoso a viloso, con pelos blanquecinos. Micromorfología: médula ausente, zona pilosa de 70-120 μm de grosor, zona compacta de 40-90 μm de grosor, zona subcompacta superior de 35-75 μm de grosor, zona laxa intermedia de 350-700 μm de grosor, zona subcompacta inferior de 100-350 μm de grosor, himenio de 65-120 μm de grosor, pelos del abhimenio de 60-180 x 4.5-6 μm, de pared gruesa, hifas con fíbulas, basidios de 50-78 x 4-6.5 μm, basidiosporas hialinas, alantoides, de 13-16 x 4.5-6 μm, Q = 2.4-3.2.
Resumen taxonómico
Materiales estudiados: Baja California, al norte del observatorio de San Pedro de la UNAM, Sierra de San Pedro Mártir, 24 febrero 1984, Guzmán 24239-A (XAL). Chihuahua, Arroyo norte de Gorachic y Bocoyna, 24 agosto 1994, Montañez 38 (FCME 7844), alrededor de Yéhuachi, 27 julio 1997, Sánchez-Espinosa 27 (FCME 9880). Ciudad de México, Cuajimalpa, Parque Nacional Desierto de los Leones, 16 septiembre 1977, Ramírez R. (FCME 850), 4 octubre 1964, Rojas Granados 469 (FCME 805), 26 septiembre 2008, Rodríguez-Gutiérrez I. 200842 (FCME 27510). Durango, Reserva de la Biosfera La Michilia, 12 julio 1981, Morales García (FCME 1734); entre el Potrero Mesa Larga y Arroyo de la Presa Los Altares, 12 noviembre 1983, R. Valenzuela 2991 (ENCB). Estado de México, Amecameca, Parque Nacional Izta-Popo, 28 julio 1982, Acosta Camacho (FCME 14878); Isidro Fabela, Presa Iturbide, 25 enero 1981, L. Dávalos 231 (ENCB); Zempoala, Laguna Quila, 26 septiembre 1996, Sierra 626 (FCME 27511), km 13 de la carretera Tres Marías, Chalma, 19 agosto 1978, Gutiérrez N. (FCME 506). Guerrero, Atlixco de Guerrero, km 76 de la carretera Chilpancingo-Tlapa, 16 julio 1982, Antonio Silva (FCME 12184). Hidalgo, Mineral El Chico, Valle de los Enamorados, 4 octubre 2008, Rodríguez-Gutiérrez I. 2008-38, 2008-39, 2008-40 (FCME 27512, 27513, 27514), 6 octubre 2007, Libertad-Puga y Guzmán-Sánchez (FCME 27515), 7 septiembre 2001, Sierra 893 (FCME 19801); Pachuca, Ejido de San Miguel, km 8 carretera Pachuca-Mineral El Chico, 14 septiembre 1990, Sánchez Islas (FCME 3699), Las Ventanas, norte de Pachuca, 25 junio 1967, Guzmán 5790 (ENCB), 16 agosto 1966, Georgina Bush 33 (ENCB). Michoacán, Angangueo, km 3.5 de la desviación a Tlalpujahua, carretera El Oro-Angangueo, 5 agosto 1999, Sierra 735, 7 octubre 1999, Sierra s/n, 26 agosto 1999, Sierra s/n (FCME 17211, 17199, 17151); Reserva de la Biosfera Mariposa Monarca, Llano de las Papas, 11 septiembre 1998, Hernández y Sánchez 79 (FCME 15031), Llano Villalobos, 26 septiembre 1998, Sierra 707, 18 agosto 2000, Sierra 794, 22 septiembre 2000, Sierra 828 (FCME 15502, 17476, 17724); Uruapan, Parque Nacional Lic. Eduardo Ruiz, 5 octubre 1993, A. Montoya y A. Kong 1393 (FCME 27516). Tlaxcala, Taxco, Parque Recreativo El Rodeo, 16 julio 1992, Sierra 77, 14 agosto 1992, Sierra 90 (FCME 4855, 4747); Ixtenco, Fractura Central, ladera este del volcán La Malintzin, 13 junio 1987, A. Kong 194 (TLXM), 27 mayo 1988, Estrada-Torres 2052, 8 julio 1988, Estrada-Torres 2128, 10 febrero 19889, Estrada-Torres 2301, 24 enero 1989, Estrada-Torres 2490 (TLXM), 12 agosto 1988, Montoya-Esquivel 188, 21 junio 1989, Montoya-Esquivel 283, 18 agosto 1989, Montoya-Esquivel 460 (TLXM). Querétaro, Colón, cerro El Zamorano, 29 agosto 2015, J. Jiménez-Zárate s/n 1 (QMEX).
Hábitaty distribución: en bosques de Abies, Cupressus, Juniperus y Pinus, así como en mesófilo de montaña, de los 2,100 a los 3,900 m snm. En Baja California Norte, Ciudad de México, Chihuahua, Durango, Estado de México, Hidalgo, Michoacán, Querétaro y Tlaxcala.
Comentarios taxonómicos
Las características distintivas de A. americana son su himenóforo liso con una capa cortical velutinosa a pubescente y basidiosporas de 13-16 μm de longitud. En México se ha citado previamente como A. auricula-judae; sin embargo, esta especie solo se distribuye en Europa, presenta basidiosporas ligeramente más grandes (15-22 x 5-7 μm) y crece sobre troncos de árboles deciduos (Wu, Yuan, He et al., 2015). Otra especie con la que puede confundirse es A. angiospermarum, pero esta es exclusiva de angiospermas (Wu, Yuan, He et al., 2015), mientras que A. americana solo crece en madera de gimnospermas; por lo tanto, el tipo de vegetación y substrato son la clave para la distinción de estas especies. Se registra por primera vez para México.
Auricularia angiospermarum Y.C. Dai, F. Wu et D.W. Li, Mycological Progress 14(95): 8 (2015). Fig. 3C.
Macromorfología. Basidioma de hasta 80 mm de diámetro, 0.5-1 mm de grosor, solitario a cespitoso, sésil, cupulado a auriculado, algunas veces con el margen lobado a redondo, marrón, marrón claro a oscuro a marrón vináceo, himenóforo liso a ligeramente sulcado, abhimenio velutinoso a viloso, con pelos blanquecinos, cambian a grisáceos al secarse. Micromorfología: Médula ausente, zona pilosa de 75-130 μm de grosor, zona compacta de 50-90 μm de grosor, zona subcompacta superior de 30-75 μm de grosor, zona laxa intermedia de 300-750 μm de grosor, zona subcompacta inferior de 100-300 μm de grosor, himenio de 60-120 μm de grosor, pelos del abhimenio de 80-100 x 4.5-6 μm, de pared gruesa, hifas con fíbulas, basidios de 50-80 x 4-6.5 μm, basidiosporas hialinas, alantoides, de 13-16 x 4.5-6 μm, Q = 2.4-3.2.
Resumen taxonómico
Materiales estudiados: Chiapas, Palenque, Zona Arqueológica de Palenque, 22 septiembre 2008, Rodríguez-Gutiérrez I. 2008-3 (FCME 27517); Tuxtla Gutiérrez, Ejido Mixcum, 18 octubre 1997, Cifuentes 4017 (FCME 9434); Rayón, cabecera municipal, 5 febrero 2005, Alvarado-Rodríguez 1, (HEM 871); Tapachula, finca Génova, 55 km al NO de Tapachula-Nueva Alemania, 20 agosto 1993, R. Andrade 134, 28 septiembre 1993, R. Andrade 493 (ECO-TA-H); Huehuetán, finca Irlanda, km 63 al NO de Tapachula por la carretera Tapachula-Nueva Alemania, 17 agosto 1993, R. Andrade 130 (ECO-TA-H); Ocozocoautla de Espinosa, 4 km al NO de Emilio Rabasa, 1.5 km al NE de El Cielo, 11 octubre 1991, S. Ochoa G. 3745, 3745a (ECO-SH-H). Chihuahua, Bocoyna, brecha km 3, 6 agosto 2000, Moreno-Fuentes y Montoya-Campos 814 (HGOM 674). Coahuila, Arteaga, La Siberia, 15 agosto 1973, G. Mendiola 325 (ENCB). Durango, Pueblo Nuevo, El Mil Diez el Salto, 22 septiembre 2008, Rodríguez-Gutiérrez I. 2008-31, 2008-28, 2008-29, 2008-32 (FCME 27518, 27519, 27520, 27521); alrededores de la Residencia de La Reserva de la Biosfera La Michilia, 30 agosto 1983, R. Valenzuela 2168, (ENCB). Guerrero, Atixtla de Guerrero, carretera Chilpancingo-Tlapa, 3 km antes de la desviación a Zapotitlán, 23 agosto 2000, Pérez-Ramírez 409 (FCME 12484); Chichihualco, El Carrizal y Atoyac, 21 octubre 1982, Aranda (FCME 12644), 1 km antes de la desviación a Filo de Caballo, carretera Chilpancingo-México, 13 julio 1980, ALIR (FCME 10024). Morelos, Tepoztlán, El Texcal Santa Catarina, s/f, L. López 334 (HUMO). Tabasco, Centro, Parque Yumka, 28 octubre 2001, Sierra (FCME 18948). Tlaxcala, Tlaxco, El Rodeo, N del Rosario, 14 junio 1984, Kong 1894 (TLXM). Veracruz, Actopan, Reserva Ecológica del Morro de La Mancha, 25 agosto 1983, S. Chacón 1402 (XAL).
Hábitat y distribución: en selva mediana caducifolia, selva alta perennifolia, cafetales, en lugares con Alnus, Arbutus y Quercus, de los 1,050 a 2,750 m snm. En Chiapas, Chihuahua, Coahuila, Durango, Guerrero, Morelos, Tlaxcala y Veracruz.
Comentarios taxonómicos
Auricularia angiospermarum puede confundirse con A. auricula-judae; sin embargo, esta última tiene basidios más grandes, de 64-85 x 4-5.5 μm, y basidiosporas de 15-22 x 5-7 μm, además de que es exclusiva de Europa (Wu, Yuan, He et al., 2015). Otra especie con la que puede confundirse es A. americana, la cuál crece exclusivamente en madera de gimnospermas y A. angiospermarum se presenta solo en madera de angiospermas (Wu, Yuan, He et al., 2015). Se registra por primera vez para México.
Auricularia brasiliana Y.C. Dai et F. Wu, Mycological Progress 14(42): 6 (2015). Fig. 3D, E.
Macromorfología. Basidioma de hasta 60 mm de ancho, 1-1.5 mm de grosor, gregario o imbricado, resupinado a efuso-reflejo, margen ondulado, himenóforo sulcado a venoso, marrón a casi negro, abhimenio viloso, con zonas concéntricas distintivas, alternando bandas marrón claro con marrón obscuro, borde color crema a amarillo claro, centro marrón. Micromorfología: médula ausente, zona pilosa de 400-950 μm de grosor, zona compacta de 10-49 μm de grosor, zona subcompacta superior de 70-130 μm de grosor, zona laxa intermedia de 600-746 μm de grosor, zona subcompacta inferior de 100-140 μm de grosor, himenio de 100-130 μm de grosor, pelos del abhimenio de 375-870 x 2.5-3.5 μm, de pared gruesa, se agrupan en mechones densos, hifas con fíbulas, basidios de 45-55 x 3-4.5 μm, basidiosporas hialinas, alantoides, de 12-16.5 x 5.5-6.4 μm.
Resumen taxonómico
Materiales estudiados: Campeche, Calakmul, Zona Arqueológica de Calakmul, 28 octubre 2022, Sierra-Galván 1039 (FCME 19526), 9 noviembre 2005, González-Ávila 39 (FCME 22021), km 26 desviación a la Zona Arqueológica de Calakmul, carretera X-Pujil Escárcega, 1 noviembre 2001, Sierra-Galván 983, 25 septiembre 2003, Cappello 2056 (FCME 18812, 20174), km 25.5 Zona Arqueológica de Calakmul, 25 octubre 2002, Villegas R. M. 2278 (FCME 19430), 28 octubre 2002, Sierra-Galván 1039 (FCME 19470), km 21 desviación a Calakmul, carretera Escárcega-Chetumal, 26 octubre 2002, Sierra-Galván 1026 (FCME 19496). Morelos, Tepoztlán, alrededor de San Andrés de la Cal, 17 octubre 2008, Rodríguez-Gutiérrez I. 2008-47 (FCME 27522).
Hábitat y distribución: sobre madera de angiospermas como el guayabo (Psidium guajava), en selva baja caducifolia y selva mediana, de los 390 a 2,000 m snm. En Campeche y Morelos.
Comentarios taxonómicos
Auricularia brasiliana se ha confundido en México con A. mesenterica; sin embargo, esa especie solo se distribuye en Europa. Morfológicamente, el tamaño de los basidios y de las basidiosporas sirven para distinguir ambas especies. Auricularia brasiliana tiene basidios y basidiosporas más pequeños que A. mesenterica, que tiene basidios de 4868 x 4-6.5 μm y basidiosporas de 14-17 x 4.7-5.2 μm (Wu, Yuan, Rivoire et al., 2015). Aunque los ejemplares mexicanos son genéticamente idénticos (en la región de los ITS del ADNr) al tipo de A. brasiliana, difieren de esta en que los pelos del abhimenio son más pequeños, ya que Wu, Yuan, Rivoire et al. (2015) los reportaron de 1,000-1,500 x 2-3.5 μm. Se registra por primera vez para México.
Auricularia cornea Ehrenb., Horae Physicae Berolinenses: 91, t. 19:9 (1820). Fig. 3F.
Macromorfología. Basidioma de 30-90 mm de diámetro, de 1-2 mm de grosor, solitario algunas veces cespitoso, es decir, pueden crecer de manera individual o bien crecer a partir de una base común, sésil o subestipitado, cupulado a auriculado, unido al sustrato en la parte lateral o excéntrica, con los bordes libres, margen ondulado himenóforo liso, de color violáceo a rojo púrpura, abhimenio hirsuto, con pelos densos, a menudo agregados en mechones, de color marrón claro a oscuro. Micromorfología: médula presente, de 413-498 μm grosor, zona pilosa de 100-500 μm de grosor, zona compacta de 42-85 μm de grosor, zona subcompacta superior de 31-106 μm de grosor, zona laxa superior de 165-498 μm de grosor, zona laxa inferior de 130-400 μm, zona subcompacta inferior de 40-120 μm, himenio de 80-130 μm de grosor, pelos del abhimenio de 80-400 x 5.5-8.5 μm, de pared gruesa, hifas con fíbulas, basidios de 55-60 x 4.5-5.5 μm, basidiosporas hialinas, alantoides, de 14.8-16.9 x 5.5-6.5 μm.
Resumen taxonómico
Materiales estudiados: Guerrero, Quechultenango, a 10 km de Colotlipa, vía Tlanepelulco, 2 julio 1981, Villegas R. M. 132 (FCME 10842). Morelos, Tepoztlán, alrededor de San Andrés de la Cal, 17 octubre 2002, Rodríguez-Gutiérrez I. 2008-50, 17 octubre 2008, Rodríguez-Gutiérrez I. 2008-45b (FCME 27523, 27524). Nayarit, Tepic, La Capilla, cerro San Juan, 4 julio 1991, Sierra-Galván 4 (FCME 3856). Oaxaca, Santa María, San Isidro Lachigushé, 15 marzo 2004, Salvador Morelos B. 14 (ITVO 1445). San Luis Potosí, Matlapa, mercado municipal de Matlapa, 5 octubre 2016, Torres-Anaya D.A. y J. Jiménez-Zárate s/n 6, (QMEX); Tlaxco, 24 septiembre 2015, J. Jiménez-Zárate 39 (QMEX). Tlaxcala, Tlaxco, Parque Recreativo El Rodeo, 16 julio 1992, Sierra-Galván 72, (FCME 4752). Veracruz, Totutla, El Mirador, 15 marzo 1971, F. Ventura 5067 (ENCB).
Hábitat y distribución: bosque de Pinus-Abies, bosque mesófilo de montaña, selva mediana y alta, de los 690 a 2,900 m snm. En Guerrero, Morelos, Nayarit, Oaxaca, San Luis Potosí y Tlaxcala.
Comentarios taxonómicos
Auricularia cornea puede confundirse con A. nigricans; sin embargo, esta última tiene pelos más grandes (5001,500 μm de longitud) y la médula más delgada (Looney et al., 2013).
Auricularia fuscosuccinea Mont. Henn. [como 'fuscosuccinea'], Botanische Jahrbücher für Systematik Pflanzengeschichte und Pflanzengeographie 17: 19 (1893). Fig. 3I, J.
Macromorfología. Basidioma de 100-105 mm de diámetro, de 1-3.5 mm de grosor, solitario o agregado, sésil a subestipitado, auriculado, himenóforo liso a poco sulcado, marrón oscuro o marrón rojizo, vináceo a rosáceo, abhimenio velutinoso a viloso, con pelos marrón grisáceos. Micromorfología: médula presente, de 105-372 μm de grosor, zona pilosa de 27-382.5 μm de grosor, zona compacta de 26-85 μm de grosor, zona subcompacta superior de 54-138 μm de grosor, zona laxa superior de 191-487 μm de grosor, zona laxa inferior de 118-517 μm de grosor, zona subcompacta inferior de 55-109 μm de grosor, himenio de 52.5-63 μm de grosor, pelos del abhimenio de 270-382.5 x 4-7.5 μm, de pared gruesa, hifas con fíbulas, basidios de 40-63 x 3.5-6 μm, basidiosporas hialinas, elipsoides, de 11.2-16.8 x 4.2-6.3 μm, Q = 1.4-2.0.
Resumen taxonómico
Materiales estudiados: Chiapas, La Trinidad, cafetal de Juan Solís Morales, 9 julio 2009, Rodríguez-Gutiérrez I. 2009-XVI (FCME 27526); Malpaso, km 21.7 de la carretera Ocozocuautla, 24 marzo 1979, Pérez-Ramírez 107 (FCME 579); Ocozocuautla, Laguna Bélgica, km 18.5 de la carretera a Ocozocuautla, 2 septiembre 1979, Gutiérrez-Núñez R. 31 (FCME 876); Palenque, Ruinas Arqueológicas, 14 septiembre 1997, Cappello y Pérez-Ramírez 2380 (FCME 9158); Ocosingo, Lacanja Chansayab, s/f, Ruán-Soto 156 (FCME 22561); Tejapan, 1050 m al SE de la escuela José López Portillo, 14 octubre 1999, Lucia Robles Porras 396 (ECO-SH-H); Unidad Juárez, km 37 de la carretera Tapachula, 25 agosto 1995, Andrade-Gallegos 237a (ECO-TA-H), El Águila Cacaotal, 8 septiembre 1995, Gabriela Huerta 352 (ECO-TA-H), finca Monte Perla, 17 noviembre 1995, Nieto L. 110 (ECO-TA-H), Ejido 11 de Abril, 22 septiembre 1995, Andrade-Gallegos 259A, 259B (ECO-TA-H); Tapachula, finca Génova 55 km al NO de Tapachula, 5 agosto 1993, Andrade-Gallegos 30, 11 agosto 1993, Andrade-Gallegos 87, 92, 96, 171, (ECO-TA-H); Cacahuatlán, Mixcom, s/f , Nieto L. 52 (ECO-TA-H); Laguna de Tziscao, 6 junio 1989 (HEM); San Fernando, colonia Cuauhtémoc, 29 agosto 2007, Maza Cruz (HEM); San Cristóbal de Las Casas, 6 junio 1989, P.J.H.M. (HEM); Ixhuatán, 14 septiembre 1992, Pérez-Segura (HEM). Chihuahua, Bocoyna, camino a la comunidad La Laguna, 8 agosto 2006, Moreno-Fuentes 861 (HGOM). Guerrero, 3 km antes de la desviación a Zapotitlán, carrera Chilpancingo-Tlapa, 14 julio 1983, Pérez-Ramírez 409 (FCME 12484). Hidalgo, Huehuetla, Paraíso, cerro Mirador de La Luna, 17 agosto 2007, Paula-Mejía 16 (HGOM); Huautla, Santa Domingo, 17 octubre 2004, Rodríguez-Gutiérrez I. 4 (HGOM). Morelos, Cuernavaca, calle Cerrito, colonia Buena Vista, 29 junio 1982, Víctor M. Mora 382A (HEM); Tepoztlán, S de la carretera Cuernavaca-Tepoztlán, El Texcal Santa Catarina, 1 julio 1982, Portugal-Portugal 404 (HEM). Oaxaca, Santiago La Chiguiri, Arroyo del Agua, 10 septiembre 2009, Rodríguez-Gutiérrez I. (FCME 27527); San Gabriel Mixtepec, rancho El Sagrado, 20 septiembre 2019, Villarruel-Ordaz 1863 (UMAR). Quintana Roo, carretera nueva Xcan a Coba, aproximadamente 20 km de la Nueva Xcan, 12 noviembre 1981, Guzmán 21106 (ENCB). San Luis Potosí, Axtla de Terrazas, Coatzontitla, 26 junio 2015, J. Jiménez-Zárate 20 (QMEX); Matlapa, mercado municipal de Matlapa, 4-5 octubre 2016, Torres-Anaya D.A. y J. Jiménez-Zárate s/n, San José Barrio Arriba, 1 agosto 2016, J. Jiménez-Zárate s/n 3 (QMEX). Tabasco, Teapa, Puyacatengo, 23 febrero 2007, Vicente Mendoza (HEM), 22 julio 1962, B. Lowy 1289 (MEXU), s/f, Sierra-Galván 47 (FCME 4536). Tamaulipas, Gómez-Farías, camino de Gómez Farías a La Gloria, cerca del Ejido Alta Cima, 16 agosto 1961, R. Valenzuela 1169 (ENCB). Veracruz, Jilotepec, Esquilón, 22 julio 1974, Ventura 10366, (ENCB); San Andrés Los Tuxtlas, Estación Biológica Los Tuxtlas, s/f, Sierra-Galván 57, s/f, Sierra-Galván 58 (FCME 4547, 4549), 9 julio 1972, Guzmán 10212 (ENCB); Coatepec, Loma Escondida #1bis, La Pitaya, Congregación Zoncuantla, 7 junio 2006, E. Gándara 1670, (XAL); Xalapa, Jardín Botánico Francisco X. Clavijero, 29 febrero 1992, M. Palacios Ríos 3479 (XAL).
Hábitat y distribución: selva mediana subcaducifolia, selva alta perennifolia, selva baja subperennifolia, selva baja caducifolia, bosque mesófilo de montaña, cafetales, bosque de Quercus y bosque de Pinus-Quercus, de los 750 a 2,180 m snm. En Chiapas, Chihuahua, Guerrero, Oaxaca, Hidalgo, Quintana Roo, San Luis Potosí, Tamaulipas y Veracruz.
Comentarios taxonómicos
Auricularia fuscosuccinea puede confundirse morfológicamente con A. americana y A. angiospermarum; sin embargo, estas 2 últimas no tienen médula y sus basidiosporas miden más de 13 um de longitud (Looney et al., 2013; Wu, Yuan, He et al., 2015).
Auricularia nigricans (Sw.) Birkebak, Looney et Sánchez-García, North American Fungi 8(6): 12 (2013). Fig. 3K.
Macromorfología. Basidioma de 10-40 mm de diámetro, de 1-2 mm de grosor, agregado, sésil, campanulado, irregularmente lobulado, himenóforo liso, negro a marrón-rojizo, algunos ejemplares con una capa gris, abhimenio hirsuto, con pelos de marrón amarillento a gris casi blanco. Micromorfología: médula presente, de 106-281 μm de grosor, zona pilosa de 200-1,000 μm de grosor, zona compacta de 25.5-41 μm de grosor, zona subcompacta superior de 42-85 μm de grosor, zona laxa superior de 153-360 μm de grosor, zona laxa inferior de 106-277 μm grosor, zona subcompacta inferior de 85-191 μm de grosor, himenio de 95-138 μm de grosor, pelos del abhimenio de 200-1,000 x 5-7 μm, de pared gruesa, hifas con fíbulas, basidios de 55-69 x 4-5.5 μm, basidiosporas hialinas, alantoides, de 12.7-14.5 x 5.5-6.5 μm, Q = 2.1-3.0.
Resumen taxonómico
Materiales estudiados: Baja California Sur, 28 km al este de San Juan del Aserradero, Sierra de La Laguna, s/f, C. Ochoa 97 (XAL). Chiapas, Ocozocuautla, Parque Educativo Laguna Bélgica, km 21.7 de la carretera Ocozocuautla-Malpaso, 18 marzo 1989, Cifuentes 22 (FCME 552), km 21.7 de la carretera Ocozocuautla-Malpaso, s/f, Pérez-Ramírez 89 (FCME 568), 9 km NE de Emilio Rabasa, 1 km al SE de El Aguajito, 3 marzo 2003, S. Ochoa G. 3880, 3880A (ECO-SH-H); Tejejapa, 14 octubre 1999, Lucia Robles Porras 398 (ECO-SH-H); Tapachula, finca Genoveva, 55 km al NE de Tapachula, carretera Tapachula-Nueva Alemania, 11 agosto 1993, Andrade-Gallegos 79, 26 octubre 1993, Andrade-Gallegos 760, 19 octubre 1993, Andrade-Gallegos 688, 5 noviembre 1993, Andrade-Gallegos 857 (ECO-TA-H), finca Guatimoc, falda del volcán Tacana, septiembre 1956, Guzmán 551 (ENCB), Reserva de la Biosfera El Triunfo, 29 diciembre 1996, Jiménez (HEM); Tapilula, 10 septiembre 1993, Guzmán-Hernández, (HEM), Rayón, 12 junio 2006, Alvarado-Rodríguez 46 (HEM); Guerrero, Tierra Colorada, km 8-11 carretera Tierra Colorada-Tabacal, 29 agosto 1995, Morelos-Torres 33 (FCME 6984); Quechultenango, 1 km de la carretera Quechultenango-Jocutla, 16 septiembre 1981, Cappello 224, (FCME 10889); Guerrero, Rincón Viejo (cerca de Chilpancingo), 13 julio 1963, Hubert Kruse 1654 (MEXU); Chichihualco, El Carrizal y Atoyac, 12 julio 1982, Muñóz Maura (FCME 10015); Hidalgo, Mineral El Chico, Parque Nacional El Chico, 15 octubre 1950, Dr. M. Ruíz y T. Herrera 1038, (MEXU), 4 agosto 1979, E. Tovar y E. Aguirre (MEXU). Jalisco, Autlán, 1 km al NE de Las Playitas, predio Las Joyas, Sierra de Manantlán, s/f, E. Fanti 516 (IBUG); Zapopan, 3 km al SE del poblado La Primavera, 3 julio 1999, A. Robles (IBUG), Bosque Los Colomos, 21 junio 1999, A. Rita Colón (IBUG); Coquimatlán, rancho Tierra Partida, 3 km al sur de El Alcomán, s/f, P. Carrillo-Reyes 18113 (IBUG); Arandas, San Ignacio Cerro Gordo, s/f, M. Herrera 811 (IBUG); San Sebastián del Oeste, brecha La Cuadrilla, 21 septiembre 1995, J. Curiel (IBUG), Guadalajara, km 1-2 del camino al Puente Arcediano, barranca de Huentitán, 6 julio 1988, I. Álvarez 207 (IBUG). Morelos, Tepoztlán, alrededor de San Andrés de La Cal, 17 octubre 2008, Rodríguez-Gutiérrez I. 2008-52, 2008-48, 2008-46, 2008-49 (FCME 27528, 27529, 27530, 27531), San Juan Tlacoteco, 19 agosto 1977, Luis López Eustaquio 5 (HUMO); Cuernavaca, dentro del campus de la Universidad Autónoma del Estado de Morelos, 14 octubre 2008, Rodríguez-Gutiérrez I. 2008-45, 4 octubre 2008, Rodríguez-Gutiérrez I. 2008-43 (FCME 27532, 27533, 27534), cerca del centro de Cuernavaca, 30 octubre 1908, C.G. Pringle 15533 (ENCB), cerca de la cueva de Los Amantes, carretera Cuernavaca-Yautepec, 7 km al este de Cuernavaca, 7 mayo 1977, J. Pérez Ortiz 571 (ENCB), 2 km al norte de Santa María, 13 junio 1982, Lourdes Acosta U. 18 (HUMO); Jiutepec, El Texcal Santa Catarina, 27 septiembre 1980, Portugal-Portugal, 30 junio 1982, Portugal-Portugal 231, 12 julio 1981, Portugal-Portugal 343, 17 julio 1981, Portugal-Portugal 360 (HUMO). Nayarit, Xalisco, El Cuarenteño, 24 septiembre 1991, Villarruel-Ordaz 114 (FCME 4170). Oaxaca, Distrito de Juquila, San Pedro Mixtepec, Universidad del Mar, campus Universitario Puerto Escondido, 31 mayo 2019, Villarruel-Ordaz 1761 (UMAR), 1 de junio de 2019, Villarruel-Ordaz 1768 (UMAR); San Miguel Panixtlahuaca, 15 septiembre 2003, Olivera-Ramos F. 1 (ITVO 1419); San Pedro Pochutla, 2 km al sur de San Miguel Suchitepec, 23 junio 1977, A. Téllez V. 11955 (MEXU); San Juan Bautista Tuxtepec, s/f, Guadalupe Martínez s/n (MEXU); Santiago Lachiguiri, Piedra Grande, 26 junio 2009, Rodríguez-Gutiérrez I. 2009-XIII, 26 junio 2009, Rodríguez-Gutiérrez I. 2009-XVIII, 09 julio 2009, Rodríguez-Gutiérrez I. 2009-VIII (FCME 27535, 27536, 27537); Tuxtepec, ladera norte del cerro de Sebastopol cerca de Sebastopol, 24 mayo 1973, G. Mendiola 251, (ENCB); La Esperanza, septiembre 2018, Alexanders López García 25, (COLPOS), septiembre 2018, Alexanders López García 26, (COLPOS). Puebla, Venustiano Carranza, Ajengible, 11 agosto 1950, T. Herrera 1696 (MEXU). Tabasco, Teapa, Puyacatengo, 23 febrero 2007, sin datos de colector (UNICACH 1105), 23 febrero 2007, Guzmán-Hernández, (HEM). Veracruz, San Andrés Los Tuxtlas, Balzapote, 4 enero 1978, Cifuentes (FCME 534), 34 km delante de Rancho Viejo, 12 octubre 2005, E. Gándara 1557 (XAL); Amatlán de Los Reyes, Ejido Cuauhtémoc, 29 julio 1988, Rosa Elena Sánchez Mantilla 2 (TLXM); Teocelo, 17 febrero 1973, Gustavo Pineda de la Cruz (MEXU).
Hábitat y distribución: en selva baja caducifolia, selva alta perennifolia, bosque mesófilo de montaña, bosque de Abies-Pinus, o sobre Jacaranda spp., Erythrina coralloides, Juglans spp., de los 540 a 2,650 m snm. En Baja California Sur, Chiapas, Guerrero, Hidalgo, Jalisco, Morelos, Nayarit, Oaxaca, Tabasco y Veracruz.
Comentarios taxonómicos
Looney et al. (2013) concluyeron que lo considerado en el continente americano como A. polytricha corresponde a A. nigricans y que A. polytricha s. str. solo se distribuye en Asia; por lo tanto, A. polytricha en el sentido americano es un sinónimo de A. nigricans. Auricularia nigricans puede confundirse morfológicamente con A. cornea; sin embargo, esta última presenta una médula de 413 a 498 um de grosor, así como pelos de 80 a 400 um de largo (ver arriba en descripción de esta especie).
Auricularia scissa Looney, Birkebak et Matheny, North American Fungi 8(6): 14 (2013).
Macromorfología. Basidioma de 40-60 x 38-63 mm, solitario o gregario, sésil, auriculado, himenóforo reticulado, marrón, abhimenio marrón vináceo, ligeramente velutinoso a pubescente. Micromorfología: esquizomédula presente, de 40-60 μm de grosor, zona pilosa de 40-137 μm de grosor, zona compacta de 15-45 μm de grosor, zona subcompacta superior de 10-45 μm de grosor, zona laxa superior de 65-128 μm de grosor, zona laxa inferior de 50-135 μm de grosor, zona subcompacta inferior de 42-92 μm, himenio de 35-67 μm de grosor, pelos del abhimenio de 30-142 x 2-5.5 μm, de pared gruesa, hifas con fíbulas, basidios de 34-46 x 3.8-5 μm, basidiosporas hialinas, alantoides, de 9.2-13 x 3.9-5.9 μm, Q = 1.8-3.1.
Resumen taxonómico
Materiales estudiados: Hidalgo, Tianguistengo, 8 km de la desviación a Tianguistengo, 24 junio 1978, Cercado-García 40, (FCME 45), km 168 carretera Pachuca-Tampico, 4 julio 1978, López-Cortés 37, (FCME 44); Tenango de Doria, Santa María, 20 septiembre 2008, Bautista-Nava 224 (HGOM); Tlanchinol, 10 septiembre 1993, Baños-Sánchez 6 (HGOM). Morelos, Tepoztlán, El Texcal Santa Catarina, 7 octubre 1980, Portugal-Portugal 258 (HEM). Oaxaca, San Gabriel Mixtepec rancho El Sagrado, 27 noviembre de 2019, Villarruel-Ordaz 1886, 8 de noviembre de 2019, Villarruel-Ordaz 1921 (UMAR); cerro de La Olla, camino a la finca La Aurora, 17 de agosto 2019, Villarruel-Ordaz 1819 (UMAR); San Pedro Pochutla, Buena Vista Loxicha, 14 septiembre 2003, Martínez-Almaraz M.J. 10 (ITVO). San Luis Potosí, Matlapa, mercado municipal, comprado a personas que colectan en los alrededores de San José Barrio Arriba y Tamala, 23 septiembre 2015, J. Jiménez-Zárate 33a (QMEX); San José Barrio Arriba, 28 junio 2016, J. Jiménez-Zárate 58 (QMEX); 1 agosto 2016, J. Jiménez-Zárate s/n 2 (QMEX).
Hábitat y distribución: selva alta perennifolia, selva mediana subcaducifolia, bosque de Pinus-Quercus, de los 150 a 1,450 m snm. En Hidalgo, Morelos, Oaxaca y San Luis Potosí.
Comentarios taxonómicos
Debido a su himenio reticulado, puede confundirse con A. delicata, que presentan médula, mientras que A. scissa tiene esquizomédula, la cual se divide o se disocia en la zona laxa superior o en la zona laxa inferior cuando se monta un corte transversal delgado (Looney et al., 2013). Se registra por primera vez para México.
Auricularia tremellosa (Fr.) Pat. (1888). Fig. 3G-I.
Macromorfología. Basidioma de 30-60 mm de diámetro, de 1-1.5 mm de grosor, solitario, gregario a cespitoso, sésil a subestipitado, cupulado a auriculado, unido al sustrato lateralmente o en la parte central con los bordes libres, margen ondulado, himenóforo poroide-reticulado, marrón anaranjado a marrón violeta, abhimenio amarillo grisáceo a color rosáceo, velutinoso a viloso, pelos densos, a menudo agregados en mechones, blanquecinos. Micromorfología: médula presente en todos los ejemplares revisados, de 187-309 μm de grosor, zona pilosa de 92-147 μm de grosor, zona compacta de 20-34 μm de grosor, zona subcompacta superior de 52-65 μm de grosor, zona laxa superior de 112-228 μm de grosor, zona laxa inferior de 94-228 μm de grosor, zona subcompacta inferior de 90107 μm de grosor, himenio de 60-102 μm de grosor, pelos del abhimenio de 30-170 x 4-7 μm, de pared gruesa, hifas con fíbulas, basidios de 40-60 x 3.5-5 μm, basidiosporas hialinas, alantoides, de 11.8-13.5 x 5.2-6.5 μm, Q = 1.9-2.5.
Resumen taxonómico
Materiales estudiados: Campeche, Calakmul, Zona Arqueológica de Calakmul, 23 septiembre 2003, Villegas R. M. 2417 (FCME 20102), 28 octubre 2002, Sierra-Galván 1038 (FCME 19516); km 25 hacia la Zona Arqueológica de Calakmul, 22 septiembre 2003, Villegas R. M. 2410 (FCME 20184); km 39.5 hacia la Zona Arqueológica de Calakmul, 29 octubre 2022, Villegas R. M. 2305 (FCME 19447). Chiapas, Cacahoatán, Mixcum, 11 agosto 1995, C. Nieto L. 52 (ECO-TA-H), La Trinidad, San Antonio, 28 julio 2005, Alvarado-Rodríguez 11 (HEM). Michoacán, Uruapan, Parque Nacional Lic. Eduardo Ruiz, 4 octubre 1993, Montoya-Esquivel y Kong Luz 1391 (FCME 27525). Querétaro, Landa de Matamoros, 10 km al sur de Agua Zarca, 16 mayo 1987, R. Fernández 3831 (ENCB). San Luis Potosí, Matlapa, mercado municipal de Matlapa, 5 octubre 2016, Torres-Anaya D.A. y J. Jiménez-Zárate s/n 5, (QMEX); San José Barrio Arriba, 25 junio 2015, J. Jiménez-Zárate 19 (QMEX). Veracruz, Amatlán de los Reyes, Peñuela, 13 julio 1983, López-López 13 (TLXM); San Andrés Los Tuxtlas, Estación Biológica de Los Tuxtlas, 25 febrero 1998, Garibay-Orijel 136 (FCME 22977), Balzapote, 4 julio 1979, Cifuentes 266, 286 (FCME 11158, 11133), 25 enero 1979, Quintanilla M. 4 (FCME 466).
Hábitat y distribución: bosque mesófilo de montaña, selva alta perennifolia, selva mediana subperennifolia y cafetal con sombra, de los 350 a 850 m snm. En Campeche, Chiapas, Querétaro, San Luis Potosí y Veracruz.
Comentarios taxonómicos
Looney et al. (2013) distinguían 2 especies de A. delicata, "A. delicata clado I" con distribución en Australia y "A. delicada clado II" con distribución en América, sin embargo, Wu et al. (2021) mencionan que A. delicata está distribuida en África, por lo que nombraron a "A. delicata clado I" como A. australiana y a "A. delicata clado II" como A. tremellosa, una especie que había sido descrita de México (Fries, 1849), pero que Kobayasi (1981) y Lowy (1952) la consideraron un sinónimo de A. delicata, por lo cual Wu et al. (2021) recuperan el nombre de A. tremellosa. Debido a su himenóforo reticulado-poroide se puede confundir con A. scissa, la cual presenta esquizomédula (Looney et al., 2013).
| Clave taxonómica para las especies de Auricularia presentes en México. | ||
| 1a Himenóforo venoso o reticulado | 2 | |
| 1a Himenóforo liso | 4 | |
| 2a Esquizomédula presente | Auricularia scissa | |
| 2b Esquizomédula ausente | 3 | |
| 3a Médula presente | A. tremellosa | |
| 3b Médula ausente | A. brasiliana | |
| 4a Abhimenio tomentoso, híspido a hirsuto, con pelos de 500-1100 μm de longitud | A. nigricans | |
| 4b Abhimenio velutinoso a pubescente, con pelos de 30-500 μm de longitud | 5 | |
| 5a Basidiosporas usualmente < 13 μm de longitud | A. fuscosuccinea | |
| 5b Basidiosporas usualmente > 13 μm de longitud | 6 | |
| 6a Pelos abhimeniales usualmente de 200-500 μm de longitud | A. cornea | |
| 6b Pelos abhimeniales menos de 200 μm de longitud | 7 | |
| 7a Crece sobre angiospermas | A. angiospermarum | |
| 7b Crece sobre gimnospermas | A. americana | |
|
| ||
Discusión
La determinación taxonómica con caracteres morfológicos del género Auricularia es muy compleja. Las evidencias moleculares han demostrado que especies como A. auricula-judae s. str. y A. mesenterica s. str., que se pensaba tenían distribución global, en realidad tienen distribuciones restringidas a Europa.
En este trabajo se reportan por primera vez para México 4 especies de Auricularia: A. americana, A. angiospermarum, A. brasiliana y A. scissa. Auricularia americana y A. angiospermarum se determinaron con base en ejemplares nombrados anteriormente como A. auricula-judae. Estas 2 especies se distinguen por el sustrato en el que crecen. Nuestro análisis mostró 3 subclados dentro de A. americana. Aunque los ejemplares de los 3 subclados se desarrollan en madera de coníferas, los clados de EUA y Rusia crecen en madera de Pinus mientras que los del clado mexicano lo hacen en madera de Abies. Por lo tanto, estos 3 genotipos aislados geográficamente y con substratos diferentes podrían tratarse como variedades dentro de A. americana.
Looney et al. (2013) encontraron que los especímenes que estudiaron identificados como A. delicata se distribuían en 2 clados diferentes en su árbol, motivo por el cual llamaron a uno A. delicata "clado I" y al otro como A. delicata "clado II". Wu et al. (2021) nombraron al "clado II", con los especímenes de México, Perú y Brasil, como A. tremellosa, nuestros especímenes secuenciados se agrupan con A. tremellosa. Con respecto a A. delicata sensu Lowy (Lowy, 1952) los ejemplares presentan médula, mientras que para Lonney et al. (2013) esta característica es variable. Los especímenes mexicanos que estudió Lonney et al. (2013) de A. delicata "clado II" (= A. tremellosa), el espécimen JX065158, proveniente de Veracruz, lo refiere con médula sólo está presente en una parte de la muestra, mientras que en el ejemplar JX065162, de San Luis Potosí, describe que no presenta médula. Las muestras mexicanas de A. tremellosa estudiados en la presente investigación (MW721093, MW721093) presentan siempre una médula bien definida. Probablemente esta variación en la médula se deba al estado de desarrollo del ejemplar o bien a una mala deshidratación.
Gran parte de los especímenes mexicanos depositados en los herbarios con el nombre de A. mesenterica corresponden potencialmente a A. brasiliana, la cual solo se conocía para Brasil (Wu, Yuan, Rivoire et al., 2015). Cabe mencionar que es necesario revisar ejemplares provenientes de otras localidades para confirmar la ausencia de A. mesenterica en México y el continente, ya que como se muestra en la figura 2 (con un asterisco), los ejemplares utilizados por Looney et al. (2013) se encuentran en clados diferentes, por lo que es necesario confirmar cuál de éstos corresponde realmente a A. mesenterica.
Las especies cosmopolitas registradas en este trabajo son A. cornea, A. fuscosuccinea y A. nigricans. Los ejemplares mexicanos estudiados aquí coincidieron en morfología y evidencia molecular con las descripciones de estas especies en tratamientos filogenéticos profundos, por ejemplo, del complejo de A. auricula-judae (Wu, Yuan, He et al., 2015). Nuestros datos confirman que A. auricula-judae s. str. no se distribuye en el continente americano.
Actualmente, se reconocen 37 especies de Auricularia en el mundo. En la figura 4 se presentan las especies citadas por región geográfica. Asia es el continente con la mayor riqueza, con 20 especies, de las cuales 16 son endémicas. Le sigue América con una riqueza de 10 especies, de las cuales 8 son endémicas. Europa es el continente con menos especies registradas, sólo tiene 3, una de las cuales es endémica. La única especie de amplia distribución es A. cornea, presente en 4 continentes.
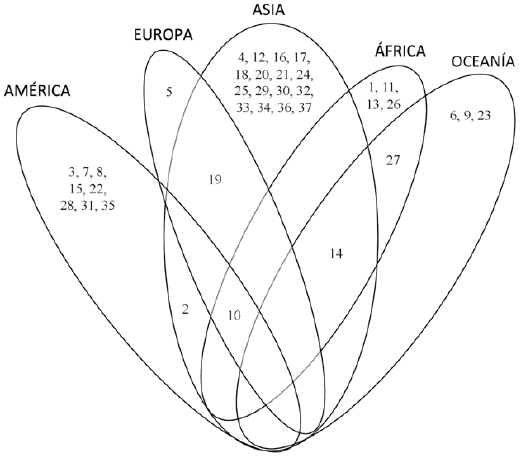
Figura 4 Distribución continental de las 37 especies de Auricularia reconocidas. Cada número corresponde a una especie: 1 - A. africana, 2 - A. americana, 3 - A. angiospermarum, 4 - A. asiatica, 5 - A. auricula-judae, 6 - A. australiana, 7 - A. brasiliana, 8 - A. camposii, 9 - A. conferta, 10 - A. cornea, 11 - A. delicata, 12 - A. eburnea, 13 - A. eminii, 14 - A. fibrillifera, 15 - A. fuscosuccinea, 16 - A. hainanensis, 17 - A. heimuer, 18 - A. lateralis, 19 - A. mesenterica, 20 - A. minor, 21 - A. minutissima, 22 - A. nigricans, 23 - A. novozealandica, 24 - A. orientalis, 25 - A. papyracea, 26 - A. pilosa, 27 - A. pusio, 28 - A. scissa, 29 - A. sinodelicata, 30 - A. srilankensis, 31 - A. subglabra, 32 - A. submesenterica, 33 - A. thailandica, 34 - A. tibetica, 35 - A. tremellosa, 36 - A. villosula y 37 - A. xishaensis.
La diversidad de Auricularia en México es sobresaliente, debido a que se registran 8 de las 10 especies citadas para América. En gran medida esta diversidad es el resultado de la historia biogeográfica del país, pues al igual que en muchos otros grupos, en México habitan especies de Auricularia características tanto del Neártico como del Neotrópico, así como cosmopolitas. La mayor riqueza de especies de Auricularia se encuentran en la zona centro-sur de México, que es donde están las zonas tropicales y subtropicales en el país (fig. 5), que son los lugares en México menos explorados en comparación con las zonas templadas, lo que pudiera significar que aún queden especies nuevas de Auricularia por describir para nuestro país. El mapa de la distribución de las especies en México (fig. 5) no es un reflejo completo de la realidad de la riqueza de especies por estado de la república, debido a que esto está asociado a la intensidad de muestreo diferencial y a la escasez de taxónomos y colecciones en algunos estados. Por ejemplo, en Jalisco, en este trabajo solo se registra 1 especie, pues cuando se consultó el herbario IBUG solo se revisaron especímenes de A. nigricans, por lo que es muy probable que prosperen más especies en esa entidad. Sin embargo, aún con estas limitaciones, pensamos que esta contribución está entre una de las más completas para un género de macromicetos en México.











 nueva página del texto (beta)
nueva página del texto (beta)



