Introducción
El término geodiversidad fue utilizado por primera vez en 1993 como un equivalente del concepto de biodiversidad para describir la variedad de la naturaleza no viva (Fragoso et al., 2014). La geodiversidad comprende la variedad natural de la superficie de la Tierra, y abarca aspectos geológicos, geomorfológicos, climáticos, suelo y agua, así como otros sistemas generados por procesos naturales (endógenos y exógenos), además de cambios antropogénicos (Kozlowski, 1999; Kozlowski et al., 2004; Parks y Mulligan, 2010). Todos los elementos anteriores, se encuentran intrínsecamente relacionados con la biodiversidad (Kozlowski et al., 2004), por lo que en la última década, el concepto de geodiversidad ha cobrado relevancia no solo como soporte de la biodiversidad, sino también por su relación e influencia recíproca con la presencia de especies y cambios en la dinámica de ocupación del hábitat a nivel de nicho ecológico (Dolédec et al., 2000; Fragoso et al., 2014; Karasiewicz et al., 2017; Tukiainen et al., 2017).
Diversos estudios señalan que los elementos de la geodiversidad interactúan unos con otros a diferentes escalas temporales y espaciales (Fragoso et al., 2014), y su efecto en la biodiversidad puede ser modificado por la latitud o el régimen de perturbación, incluida la ocasionada por factores antrópicos (Kozlowski et al., 2004; Lawler et al., 2015; Tukiainen et al., 2017). De los elementos bióticos, la vegetación es la que se encuentra estrechamente vinculada a la influencia del medio en el cual se desarrolla (Duval et al., 2015), por lo que existe un consenso sobre la influencia del clima en la existencia y delimitación de un tipo particular de vegetación a una escala continental o regional (Gutiérrez y Trejo, 2014; Lawler et al., 2015). Aunque también se señala la influencia del clima a nivel de paisaje (Salas y Williams, 2019; Zacarías y Del Castillo, 2010).
A una escala regional y de paisaje los factores más influyentes son la altitud, la orientación, el suelo y la geomorfología (Díaz et al., 2012; Duval et al., 2015; Lawler et al., 2015; Romero et al., 2014). No obstante, Fragoso et al. (2014) sugieren que los elementos geológicos y geomorfológicos no interactúan de forma directa con la vegetación a este nivel, como si ocurre con los elementos topográficos y climáticos. Además, a partir de una escala de paisaje hasta el nivel local, las perturbaciones naturales o antrópicas tienen gran efecto en la presencia e interacciones de las especies (Salas y Williams, 2019; Tukiainen et al., 2017).
En México, los estudios sobre vegetación de zonas templadas son escasos, comparados con los desarrollados en zonas tropicales y de bosque mesófilo de acuerdo con Huerta et al. (2014) y Zacarías et al. (2011); son aún más escasos, aquellos que estudian la relación de la geodiversidad con la vegetación (Huerta et al., 2014). Investigaciones recientes en zonas templadas del estado de Oaxaca sobre la relación de la vegetación con elementos de la geodiversidad señalan que la altitud y elementos climáticos, como temperatura y precipitación, asociada con los efectos de perturbación antrópica, influyen significativamente sobre atributos de diversidad, estructura y distribución de especies (Aguilar y Del Castillo, 2013; Ríos et al., 2016; Salas y Williams, 2019; Salas et al., 2015; Zacarías y Del Castillo, 2010). Estos estudios se han llevado a cabo principalmente en las sierras Norte y Sur, y en forma más escasa en la región de la Mixteca Alta (Aguilar y Del Castillo, 2013).
Ante la actual crisis de biodiversidad debida al cambio climático y pérdida de hábitat que aumenta la vulnerabilidad a la extinción de las especies (Bellard et al., 2012; Foley et al., 2005), contar con información acerca de los factores que inciden sobre la vegetación y sus características se ha vuelto cada vez más relevante para el diseño de planes de conservación, manejo y restauración (Aguilar y Del Castillo, 2013; Díaz et al., 2012; Gutiérrez y Trejo, 2014), sobre todo a escala regional o de paisaje, que es donde generalmente ocurre la implementación de estos planes (Lawler et al., 2015).
Considerando lo anterior, el objetivo de este trabajo fue determinar los elementos de la geodiverdidad que influyen en las características de la vegetación leñosa a escala de paisaje; información que podrá ser utilizada en proyectos locales de conservación y restauración de la vegetación en el Geoparque Mundial UNESCO Mixteca Alta, Oaxaca (GMA). Como hipótesis se planteó lo siguiente: a) los elementos de la geodiversidad influyen en la vegetación del GMA y sus especies asociadas. Los tipos de vegetación forestal (Bosque de encino-BE y Bosque de pino-encino-BPE) se encuentran más relacionados con factores climáticos y topográficos; mientras que el matorral xerófilo (ME) está más asociado con el grado de perturbación de origen antrópico; b) los elementos de la geodiversidad, como la unidad geológica y la unidad geomorfológica, son menos relevantes para la presencia de la vegetación leñosa y sus especies asociadas; c) las especies que conforman la vegetación leñosa presentan un patrón generalista, dado su carácter de pioneras y de especies adaptadas a la perturbación.
Materiales y métodos
El área de estudio corresponde al Geoparque Mundial UNESCO Mixteca Alta (GMA) que se encuentra al noroeste del estado de Oaxaca, es de gran relevancia por su geodiversidad y biodiversidad por lo que es 1 de los primeros 2 geoparques mexicanos ratificados con esta categoría por la UNESCO, el 5 de mayo de 2017. Se localiza entre las coordenadas 17°25’2” y 17°39’2” N, 97°11’53” y 97°27’40” O (fig. 1), su altitud oscila entre los 2,100 y los 2,800 m snm, el punto más alto se encuentra en la cima del cerro Yucudaa (2,880 m snm). Su superficie es de 415 km2. Está conformado por 9 municipios: Santo Domingo Yanhuitlán (sede del geoparque), Santa María Chachoapam, San Bartolo Soyaltepec, Santiago Tillo, San Juan Teposcolula, Santa María Tiltepec, San Andrés Sinaxtla y Santo Domingo Tonaltepec. Fisiográficamente, corresponde a la provincia de la Sierra Madre del Sur (SMS) y a la subprovincia denominada Sierras Centrales de Oaxaca (INEGI, 2001). El relieve es predominantemente montañoso, existe un desnivel altitudinal de 800 m lo cual se manifiesta en la distribución climática y de la vegetación, aunque actualmente no tan marcada debido a la gran fragmentación de la vegetación, consecuencia de los cambios de uso del suelo. Asimismo, destaca el valle o llanura intramontana de Yanhuitlán, que junto con los valles de Chachoapan y Nochixtlán conforman la planicie regional más amplia de la Mixteca Alta (Oropeza et al., 2016).
Oaxaca se caracteriza por la complejidad de su geología (Centeno, 2004), el geoparque no es la excepción, se identifican 3 sistemas geológicos principales: Cretácico (formaciones San Isidro -calizas, areniscas, limolitas y lutitas- y caliza Teposcolula), Terciario (Formación Yanhuitlán -arcillas estratificadas con arenas, areniscas, ceniza volcánica y conglomerados-, depósitos Teotongo-areniscas y tobas líticas-, toba Llano de Lobos, andesita Yucudaac y cuerpos hipabisales - rocas ígneas intrusivas) y Cuaternario (depósitos aluviales y caliches) (Ferrusquía, 1970, 1976; Santamaría, 2009). Se observa una distribución preferencial de los bosques donde predomina la andesita Yucudaac, la caliza Teposcolula y la Formación Llano de Lobos.
Por su parte, las condiciones climáticas muestran la predominancia de un tipo templado subhúmedo; con 3 subtipos: C (w0), C (w1) y C (w2), el primero es el más seco, el segundo intermedio y el tercero el más húmedo. La temperatura media anual es entre 12 y 18 °C. Además, se presenta un sector hacia el sureste con un clima semiárido templado (BS1kw) (Conabio, 1998). Todos los subtipos climáticos tienen un régimen pluvial de verano, espacialmente, la humedad aumenta hacia el poniente donde se encuentran las mayores elevaciones y los bosques mejor conservados.
En la cima del cerro Verde (Nudo Mixteco, 2,892 m snm), próximo al límite norte del geoparque, convergen las cabeceras de 3 grandes cuencas del país, las de los ríos Balsas y Verde que desembocan en el océano Pacífico y la del Papaloapan, al oriente, que vierte sus aguas en el golfo de México. Los principales tributarios inician sus escurrimientos a los 2,892 m de altitud, la red hidrográfica está conformada por corrientes perennes como el río Verde, el río Negro o el Grande de Yanhuitlán y su afluente, el Yusatiagua, así como de numerosas corrientes intermitentes que se activan durante la temporada de lluvias de verano.
Si bien, aún no existen estudios detallados sobre los suelos del GMA, de manera general, se argumenta que la distribución geográfica de los suelos de la Mixteca Alta está determinada en gran medida por la litología (Krasilnikov et al., 2011). Predominan suelos someros que tienen limitaciones para el desarrollo de las plantas debido a la presencia de la roca que los origina, son del tipo leptosol, además de suelos formados sobre materiales no consolidados con poco o ningún desarrollo del perfil como los regosoles, pueden presentar altos contenidos de carbonatos de calcio, exceptuando los suelos que se desarrollan sobre andesitas y tobas andesíticas en las partes altas (Oropeza et al., 2016). Los luvisoles tienen un contenido importante de arcilla en el subsuelo y muestran un mayor desarrollo que los anteriores. Por observaciones en campo, estos 3 tipos de suelos se asocian con la distribución de los bosques del GMA. También se reportan suelos de tipo feozem, igual, con altos contenidos de carbonatos de calcio (Contreras-Hinojosa et al., 2005), se encuentran sobre las laderas bajas de las montañas y lomeríos. En los valles es frecuente encontrar suelos con propiedades vérticas y con alto potencial agrícola. El conjunto de características del medio físico del área de estudio y sus interrelaciones se reflejan de distintas maneras en la geodiversidad y, particularmente, en la biodiversidad de las leñosas, como se verá más adelante.
Los tipos de vegetación analizados en este estudio fueron los propuestos por Ramírez et al. (2021). El muestreo de la vegetación leñosa se llevó a cabo en 8 de los 9 municipios del geoparque y se aplicó un diseño de muestreo aleatorio simple, estableciéndose 70 sitios temporales de 500 m2 (10 × 50 m) (Mostacedo y Fredericksen, 2000). Los sitios quedaron distribuidos de la siguiente manera: 24 sitios para el bosque de encino; 22 sitios para el bosque de pino y encino y 24 sitios para la vegetación de matorral xerófilo (fig. 1).
Dentro de cada transecto se registraron todos los árboles y arbustos iguales o mayores a un metro de altura, de los cuales se recolectaron muestras botánicas para su posterior identificación mediante claves taxonómicas; también se hicieron consultas al portal en línea del Herbario Nacional de México [MEXU] de la Universidad Nacional Autónoma de México. Con excepción de los ejemplares recolectados en encinos, que quedaron depositados en la Facultad de Ciencias de la UNAM, el resto quedó bajo resguardo del herbario local del GMA.
Por otra parte, en el centro de cada sitio se tomaron datos de geolocalización, tipo de vegetación, altitud, orientación, pendiente del terreno (en grados), unidad geológica y grado de perturbación. La unidad geológica fue definida con la ayuda de expertos de la UAET y verificada con la Carta Geológica-Minera: E 14-9. Escala 1:250000 del Servicio Geológico Mexicano (SGM, 2000). De esta manera, los sitios se ubicaron en 7 unidades geológicas: Andesita Yucudaac, Formación San Isidro, Deposito Teotongo, Formación Yanhuitlán, Hipabisal, Toba Cerro Verde y Toba Llano de Lobos.
Por otra parte, el grado de perturbación se calificó en forma cualitativa con base en la siguiente escala (Clark-Tapia et al., 2011): grado de perturbación 0: ninguna o escasa perturbación. Sin evidencias recientes de actividades antrópicas (extracción de leña madera, pastoreo, incendios, etc.). Sin evidencias de erosión. Cobertura vegetal relativamente bien conservada. Grado de perturbación 1 (hasta 40%): escasa evidencia de extracción de leña o pastoreo. Áreas relativamente distantes de pastizales, caminos, asentamientos humanos o terrenos de agricultura. Pocas evidencias de erosión o ninguna. Grado de perturbación 2 (40 a 80%): con cobertura vegetal poco densa o perturbada. Exposición del suelo o presencia de afloramientos rocosos, evidencias de erosión (aunque no acelerada); evidencias de actividades humanas como pastoreo, extracción de leña, incendios; cercanía a caminos, a terrenos de agricultura de temporal y a asentamientos humanos. Grado de perturbación 3 (más de 80%): cobertura vegetal abierta o escasa. Sitio Inmerso en una matriz agrícola o de pastizal, evidencias altas de erosión, pastoreo, extracción de leña, evidentemente cercano a asentamientos humanos.
Además, con el dato de ubicación geográfica de cada sitio se identificaron los paisajes geomorfológicos al que corresponden, utilizando para ello el mapa elaborado por Rosado (2016). Los sitios se ubicaron en 5 tipos de paisaje: laderas de montañas y cimas denudativas en rocas ígneas (extrusivas o intrusivas), laderas de montañas y cimas denudativas-erosivas en rocas sedimentarias, laderas de montañas y cimas erosivas en rocas ígneas, laderas de montañas y cimas erosivas en rocas sedimentarias, y laderas medias y bajas de elevaciones erosivas en rocas ígneas.
De cada sitio muestreado se obtuvo la abundancia relativa de las especies. Para comparar las abundancias entre especies y sitios, ésta fue normalizada a proporciones antes de graficar con el paquete ggplot2 en el software R versión 3.0.3 (R Core Team, 2014). Para conocer diferencias en la abundancia de especies entre sitios se realizó un análisis de Kruskal-Wallis a partir de correcciones múltiples al logaritmo de la abundancia relativa con el paquete reshape y ggplot2 en el software R versión 3.0.3 (R Core Team, 2014).
Para evaluar el efecto de variables abióticas en la vegetación se generaron 2 matrices: la primera, con datos sobre la abundancia de cada especie en las filas y los sitios en columnas; la segunda incluyó los datos abióticos (climáticos y de geodiversidad), donde los valores de las variables abióticas se ubicaron en las filas y los sitios en las columnas. Las variables climáticas utilizadas fueron obtenidas de la base de datos WorldClim (http://www.worldclim.org) (Hijmans et al., 2005): temperatura media anual (TMA); rango de temperatura diurno medio (RTM); isotermalidad (Isoth), estacionalidad de la temperatura (ET), temperatura máxima del mes más caluroso (TMWM); temperatura mínima del mes más frío (TMCM); rango de temperatura anual (RTA), temperatura media del trimestre más húmedo (TMH); temperatura media del trimestre más seco (TMtS); temperatura media del trimestre más frío (TMtF); temperatura media del trimestre más caluroso (TMtC); precipitación total anual (PMA); precipitación del mes más húmedo (PWM); precipitación del mes más seco (PDM); estacionalidad de la precipitación (PS); precipitación del trimestre más húmedo (PtH); precipitación del trimestre más seco (PtS).
Posteriormente, se efectuó un análisis de multicolinealidad con la finalidad de obtener las variables con menor correlación entre sí (Graham, 2003). Para ello, se realizó un análisis de correlación entre las variables predictoras (no se presenta correlograma) y se hizo el cálculo del Variance Inflation Factors (VIF) siguiendo un procedimiento secuencial donde se excluyen las variables con un VIF superior a 5 (James et al., 2013) con los paquetes car, sp y corrplot en el software R versión 3.0.3 (R Core Team, 2014). De todas las variables predictoras, se seleccionaron 14: orientación, altitud, latitud, unidad geológica y geomorfológica, grado de perturbación, así como 8 variables climáticas (TMA- temperatura media anual, Isoth- isotermalidad, TMWM- temperatura máxima del mes más caluroso, TMCM-temperatura mínima del mes más frío, PMA-precipitación media anual, PWM, precipitación del mes más húmedo, PDM-precipitación del mes más seco y PS- estacionalidad de la precipitación). Con las variables predictoras seleccionadas, primero se realizó un análisis exploratorio de diferencias entre variables abióticas y la abundancia a nivel de género, a través de correlación de Kendall con el paquete ggplot2 en el software R versión 3.0.3 (R Core Team, 2014).
Para explorar el efecto de las 14 variables seleccionadas en la distribución de especies por tipo de comunidad vegetal, se utilizó un análisis de correspondencia canónica (ACC) con el paquete vegan (R Core Team, 2014). Previo al análisis de las ordenaciones, la matriz de abundancia de especies presentes en cada sitio de muestreo fue transformada (raíz cuadrada), mientras que la matriz de variables abióticas fue estandarizada con el método “standarize” de vegan que resta la media y divide por la desviación estándar de cada variable.
Se exploró el nicho ecológico de las especies en el área de estudio a través de un análisis de marginalidad media (OMI; Dolédec et al., 2000), a partir del cual se calculó el índice de marginalidad periférica (WitOMI, Karasiewicz et al., 2017) que descompone el nicho realizado de las especies del área total en subnichos realizados por tipo de vegetación (aquellos que se encuentran dentro de subconjuntos de condiciones abióticas dentro del geoparque) para estimar el impacto de las limitaciones biológicas de las especies. El análisis OMI proporciona la posición de cada grupo taxonómico en un espacio euclidiano bidimensional mediante la descomposición de los patrones de distribución de especies en marginalidad, tolerancia y tolerancia residual. La marginalidad de una especie se define como la distancia euclidiana al cuadrado entre las condiciones medias utilizadas por la especie y las condiciones abióticas medias. Las especies con altos valores de marginalidad indican que se encuentran en hábitats menos comunes en comparación con el resto de la comunidad. Por el contrario, los valores de marginalidad bajos expresan una presencia común de las especies dentro del medio estudiado. Además, la tolerancia, o amplitud del nicho, representa la variación de la condición del medio utilizado por la especie. Una especie puede ser considerada generalista o especialista en el medio estudiado por tener un valor de tolerancia alto o bajo respectivamente. La tolerancia residual es la cuantificación de la variabilidad del nicho de especies no incorporada en los ejes de marginalidad. La significancia estadística de nicho se prueba usando permutaciones de Monte Carlo comparando la marginalidad observada con 1,000 marginalidades simuladas (Dolédec et al., 2000; Karasiewicz et al., 2017). Para los análisis se utilizaron los paquetes ADE4, stats y vegan en el software R versión 3.0.3 (R Core Team, 2014). Adicionalmente, los cambios entre tipos de vegetación (encino, pino y encino y matorral xerófilo) se detectaron mediante el cálculo de los índices medios periféricos (WitOMI, paquete de “subnicho” en la versión R 3.5.1, Karasiewicz et al., 2017). Los índices WitOMI utilizan el espacio creado por el análisis OMI e integran las características del análisis K-select (Calenge et al., 2005), lo que permite la división de nichos en subnichos vinculados con subconjuntos conformado por cada tipo de vegetación (Karasiewicz et al., 2017).
Resultados
Se registraron en total 31 familias, distribuidas en 55 géneros y 90 especies, de las cuales 61 son arbustos, 28 corresponden a especies de árboles y una especie de palma del género Brahea (apéndice 1), para mayores detalles sobre la composición florística de cada tipo de vegetación se puede consultar a Ramírez et al. (2021). La abundancia relativa a nivel de género se reporta en la figura 2 visualizada de mayor a menor contribución. Se encontraron diferencias significativas en la contribución de géneros entre tipos de vegetación (c2 = 23.41, p < 0.05). De manera general, el género Quercus fue más abundante en los sitios de bosque de encino en el estrato arbóreo. Sin embargo, en 8 sitios (33%) establecidos en áreas de mayor perturbación, Quercus mostró codominancia con otros géneros como Pinus, Dodonaea, Juniperus, Comarostaphylis y Cercocarpus. En el bosque de pino y encino la abundancia se repartió en diversos géneros: Pinus, Quercus, Dodonaea, Juniperus, Comarostaphylis, Cercocarpus, Garrya y Dalea. Caso similar fue observado en la vegetación de matorral xerófilo donde diversos géneros fueron abundantes, entre ellos destacaron Dodonaea, Juniperus, Comarostaphylis, Cercocarpus, Garrya, Dalea y Mimosa. Con frecuencia los géneros mencionados incluyen únicamente de 1 a 2 especies, con excepción de Quercus (apéndice 1). De los 57 géneros encontrados, solo 9 (Arbutus, Dalea, Dodonaea, Juniperus, Malacomeles, Pinus, Quercus, Rhus y Salvia) mostraron diferencias significativas en la abundancia entre tipos de vegetación (c2 = 35.25, p < 0.001), además se encontró una correlación media entre la abundancia de las especies y el nivel de perturbación (0.87).
En cuanto a los resultados del ACC, el eje canónico 1 (46.7%) y el eje 2 (14.3%) capturaron una proporción significativa alta de la varianza en las relaciones especies-sitios muestreados-geodiversidad con un efecto de los elementos de esta última sobre la abundancia de especies y una alta asociación con cada tipo de vegetación (fig. 3).
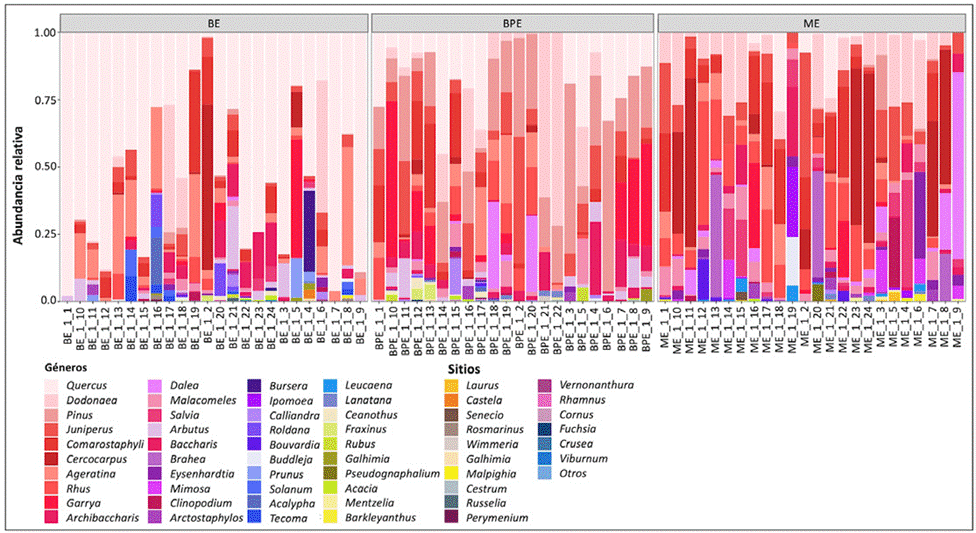
Figura 2 Abundancia relativa a nivel de género en los sitios analizados en cada tipos de vegetación; BE: Bosque de encino, BPE: Bosque de pino y encino y ME: Matorral xerófilo.

Figura 3 Análisis de Correspondencia Canónica para los sitios de muestreo en los tres tipos de vegetación y su asociación con variables abióticas (flechas) que tienen efecto en la abundancia de especies (círculos azul). La longitud de las flechas describe la importancia relativa de cada variable analizada y la dirección de la fecha indica la correlación entre variables. Las variables son: Orl-orientación, Alt- altitud, Lat- latitud, FG- unidad geológica, Gm-unidad geomorfológica, Dt-disturbio, TMA-temperatura media anual, Isoth-isotermalidad, TMWM- temperatura máxima del mes más caluroso, TMCM-temperatura mínima del mes más frío, PMA-precipitación media anual, PWM, precipitación del mes más húmedo, PDM-precipitación del mes más seco y PS- estacionalidad de la precipitación). Tipo de vegetación en el área de estudio: BE- Bosque de encino (cuadro rojo); BPE- Bosque de pino y encino (cuadro verde); ME- Matorral xerófilo (cuadro amarrillo).
En general, los sitios y especies asociadas al bosque de encino fueron agrupados en torno a la altitud en el eje 1, mostrando una correlación positiva con la misma. Mientras que en el eje 2, los sitios de bosque de pino y encino, así como algunos sitios de bosque de encino, y las especies que los conforman fueron agrupados en torno a las variables climáticas de precipitación (PMA, PWA, PDM y PS) y temperatura (TMA, TMCM y TMWM). Por otra parte, los sitios y especies relacionadas con el matorral xerófilo se asociaron en forma positiva al factor perturbación (Dt) y en menor medida a la estacionalidad de la precipitación (PS).
Los resultados de nicho ecológico son proporcionados en los apéndices 1 y 2. En el análisis se encontró que los 2 primeros ejes del OMI representaron el 77.6% de la variabilidad explicada, donde el 56.2% de la varianza fue para el eje 1 y un 21.4% se encontró en el eje 2 (fig. 4a). La marginalidad promedio de las especies ubicuas teóricas fue significativa (p < 0.05; 1,000 permutaciones de Monte Carlo). Además, se obtuvo una agrupación de las comunidades vegetales dentro del GMA, donde cada comunidad mostró asociación con especies particulares a cada tipo de vegetación, así como elementos de la geodiversidad que marginan la existencia y distribución de las especies (fig. 4b, apéndice 1). Se encontró, que la orientación (p <0.05), la altitud (0.01), TMA (p < 0.05), TMWM (p < 0.01), PS (p < 0.001), PMA (p < 0.05) y grado de perturbación (p < 0.05) fueron las variables ambientales descriptoras más influyentes en los nichos realizados para los taxones en los 3 tipos de vegetación (fig. 4c).

Figura 4 Análisis OMI y WitOMI de la comunidad vegetal del GMA. (a) Gráfico de barras de los valores propios, midiendo la marginalidad media explicada por cada eje factorial. Las barras negras son el eje factorial elegido, OMI1 (56.2%) y OMI2 (21.4%). (b) Pesos canónicos de las variables abióticas en el nicho realizado dentro de GMA (ver apéndice 1 para nombres). (c) Representación de las posiciones de nicho realizadas de las especies estadísticamente significativas en los dos primeros ejes factoriales (apéndice 1). El polígono en color azul claro (EA) representa el espacio dentro de GMA mientras que en color azul oscuro (Nsub) representa el nicho realizado de las especies presentes en cada tipo de vegetación (BPE- pino y encino, BE-encino y ME- matorral) con condiciones de hábitat particulares. El punto central marrón (Pca) indica el promedio de las condiciones abióticas dentro de cada subnicho. Los círculos anaranjados representan posición promedio de especies y las flechas representan la marginalidad de WitOMI desde el punto medio del subnicho (apéndice 2).
Los subconjuntos de las condiciones ambientales asociadas con tipos de vegetación fueron estadísticamente diferentes del origen (el espacio ambiental realizado) (BPE: p < 0.001; BE: p < 0.001; ME: p < 0.001; después de 1,000 permutaciones Monte Carlo (apéndices 1, 2). En general, las especies de plantas mostraron distribuciones menos dispersas dentro del bosque de encino en comparación con el bosque de pino y encino y el matorral xerófilo (fig. 4c). Además, las especies mostraron valores diferenciados (rango alto a bajo) de OMI indicando un uso diferenciado del hábitat y presencia de especies generalistas y especialistas dentro del área de estudio (apéndice 1).
Del total de especies, solo 20 (30%) mostraron un nicho significativo (OMI, p <0.05, apéndice 1). Las especies con nicho significativo y que tuvieron la mayor marginalidad (OMI > 40) y baja tolerancia (TOL < 0.001) fueron Acalypha sp., Solanum sp., Viburnum sp., Bursera sp., y Laurus nobilis (TOL = 3.06); mientras que las especies que tuvieron una marginalidad baja y tolerancia cercana a la media (TOL=1.06) fueron Dodonaea viscosa, Ageratina petiolaris, Rhus standleyi, Quercus rugosa, Cercocarpus fothergilloides, Pinus oaxacana, Leucaena esculenta y Quercus deserticola. Otras especies que también mostraron marginalidad alta, pero una tolerancia superior a la media fueron Juniperus flaccida, Ageratina tomentella, Baccharis heterophylla, Comarostaphylis polifolia, Ceanothus caeruleus, Clinopodium mexicanum, Quercus castanea, entre otras.
Discusión
Para el área de estudio se reporta que la composición y estructura de la vegetación responde a un proceso de sucesión secundaria, debido a los cambios en los medios de vida locales como resultado de la migración, la disminución de la actividad agropecuaria y a las acciones de conservación emprendidas por las comunidades locales (Lorenzen et al., 2020; Ramírez et al., 2021). No obstante, la composición florística es similar a la de otras zonas templadas de México y a la reportada para la región, así como a la de regiones circundantes (Aguilar y Del Castillo, 2013; Almazán et al., 2016; Guízar et al., 2010; Oropeza et al., 2016; Torres, 2004; Valiente-Banuet et al., 1998; Zacarías y Del Castillo, 2010).
En cuanto a la presencia, la abundancia de algunas de las especies y géneros con mayor dominancia en la zona, como C. fothergilloides, C. polifolia, D. viscosa, Garrya laurifolia, J. flaccida, entre otros (Rhus, Malacomeles, Ceanothus, Leucaena, etc.) se ha relacionado con tipos de clima secos (tipo Bs y Cw) y con áreas sometidas a un régimen de perturbación antrópica, principalmente al sobrepastoreo (Acosta et al., 2014; Almazán et al., 2016; Granados et al., 2014; Torres, 2004; Valiente-Banuet et al., 1998).
Hay que destacar que en este estudio solo se evaluó el nivel y tipo de perturbación y su asociación indirecta con especies con base en su presencia, por lo que a futuro se recomienda analizar el efecto de cada tipo de perturbación, su intensidad, frecuencia, así como la tolerancia y efectos ecológicos en las especies de plantas presentes.
La interacción entre los elementos de la geodiversidad a escala de paisaje influye en la existencia y distribución de la vegetación (Díaz et al., 2012; Duval et al., 2015; Fragoso et al., 2014; Lawler et al., 2015; Romero et al., 2014). Los resultados obtenidos confirman la primera hipótesis planteada en este estudio (hipótesis a); además, revelan una separación entre tipos de vegetación forestal con el matorral xerófilo debida a la influencia de los elementos de la geodiversidad analizados (elementos del clima y grado de perturbación).
La influencia de las variables climáticas en la vegetación leñosa ha sido reportada en otros estudios a nivel de paisaje (Ríos et al., 2016; Romero et al., 2014; Salas y Williams, 2019; Toledo y Williams, 2014). Sin embargo, sus efectos deben analizarse considerando las interacciones con otros elementos de la geodiversidad, como la topografía, ubicación geográfica, y altitud (Fragoso et al., 2014; Lawler et al., 2015; Salas y Williams, 2019). En el caso particular del GMA, las condiciones climáticas que prevalecen y la forma en que éstas influyen en la vegetación están dadas por la posición geográfica y las condiciones topográficas que imperan en la Mixteca Alta.
En esta región, la continentalidad y la sombra orográfica afectan la cantidad de humedad y precipitación que recibe, que es menor a la de otras regiones del estado de Oaxaca (Trejo, 2004), además de que presenta una estacionalidad marcada y variaciones de temperatura a lo largo del año asociadas a la altitud (Trejo, 2004). Estos elementos climáticos influyen en la composición florística arbórea y arbustiva encontrada en el GMA, particularmente en la presencia y abundancia de Comarostaphyllis, Cercocarpus, Quercus, Garrya, Arbutus, Malacomeles, Leucaena, Quercus y Rhus, géneros comunes en las laderas menos húmedas de las montañas de Oaxaca (Valiente-Banuet et al., 1998). Asimismo, el bosque de encino y las especies que lo componen reflejaron una tendencia positiva con respecto a la altitud, como se ha reportado para otras áreas de bosque de encino (Meave et al., 2006; Rodríguez-Rivera et al., 2017; Sosa et al., 2011). La altitud, es un elemento que afecta la biodiversidad a nivel de paisaje (Salas y Williams, 2019) y esta tendencia para el área de estudio, puede en parte deberse, a una asociación positiva entre altitud y precipitación como ha sido señalado por Díaz et al. (2012), Sosa et al. (2011) y Zacarías y Del Castillo (2010) para otros encinares de México.
No obstante, la tendencia del bosque de encino a ubicarse en zonas de mayor altitud, además del clima, también está asociada al factor perturbación antrópica (Díaz et al., 2012; Sosa et al., 2011). Los efectos de los factores antrópicos inciden en la existencia y abundancia de plantas (Foley et al., 2005; Kozlowski et al., 2004; Tukiainen et al., 2017). De manera particular, dentro del GMA, el pastoreo y otras actividades humanas son más frecuentes en las zonas bajas de la montaña, específicamente desde la zona de pie de monte hasta la planicie y ello se asocia con una menor presencia del bosque de encino o pino y encino, y con la predominancia de especies arbustivas.
Por lo tanto, el tipo de vegetación de matorral xerófilo se encuentra preferentemente en sitios con mayor grado de perturbación y coincide con lo señalado por Oropeza et al. (2016), quienes sugieren que esta vegetación se ha establecido en las áreas de mayor erosión en el GMA, donde con frecuencia se sigue practicando el pastoreo de ganado ovino y caprino. El desarrollo de matorral xerófilo, como comunidad secundaria luego de la eliminación de la cobertura forestal, ha sido reportada por varios autores en zonas templadas de México, principalmente en aquellas donde se practica el pastoreo (Encina et al., 2009; González et al., 2009; Granados et al., 2014).
Por otra parte, otros elementos de la geodiversidad como la unidad geológica y la unidad geomorfológica no fueron relevantes para explicar la existencia de los tipos de vegetación leñosa y sus especies asociadas, lo que respalda la segunda hipótesis planteada (hipótesis b). Este resultado es consistente con lo que señalan Fragoso et al. (2014), respecto a que la interacción de la geología y la geomorfología con la vegetación es escasa, en comparación con otros elementos de la geodiversidad. Ello puede deberse al dinamismo o escala temporal en el que ocurren los cambios en estos elementos, por lo que la vegetación tiende a interactuar de forma más dinámica con los elementos topográficos y climáticos (Fragoso et al., 2014), aunque es necesario llevar a cabo más investigaciones al respecto, que además consideren el factor edafológico.
En este contexto, si bien, algunas variables presentan mayor importancia relativa que otras, no se debe perder de vista que todos los elementos que integran la geodiversidad, así como sus interacciones, contribuyen a la formación del hábitat e influyen en las características de la vegetación, por lo que deben ser considerados en forma conjunta, sobre todo en los programas de conservación y restauración (Fragoso et al., 2014; Kozlowski et al., 2004; Lawler et al., 2015; Salas y Williams, 2019; Tukiainen et al., 2017).
Los elementos que integran la geodiversidad no solo afectan la presencia y distribución de las especies de plantas (Díaz et al., 2012; Duval et al., 2015; Fragoso et al., 2014; Lawler et al., 2015; Romero et al., 2014), sino que pueden influir en su nicho ecológico, sobre todo a nivel espacial y temporal (Dolédec et al., 2000; Karasiewicz et al., 2017). En este trabajo, el cálculo del OMI y la ocupación del nicho de la especie dentro de condiciones del hábitat en subconjuntos, permitieron comprender cómo el medio ambiente influye en los nichos realizados de las especies en los 3 tipos de vegetación analizados en el GMA. De manera particular, los resultados sugieren que los tipos de vegetación y sus especies asociadas muestran nichos ecológicos específicos en función de los elementos de la geodiversidad analizados, que afectan en su conjunto el establecimiento y desarrollo de la vegetación (Díaz et al., 2012; Lawler et al., 2015; Salas y Williams, 2019).
Diversos estudios han reportado una mayor presencia de especies generalistas, aquellas con mayor amplitud y tolerancia, que especies especialistas dentro de una comunidad (Dolédec et al., 2000; Karasiewicz et al., 2017; Rodríguez-Rivera et al., 2017). En el GMA, más de 70% de la composición de la vegetación leñosa está conformado por especies generalistas, lo que concuerda con la tercera hipótesis planteada (hipótesis c). Este porcentaje es elevado en comparación con otras zonas de montaña de Oaxaca y Veracruz reportado por Salas y Williams (2019), siendo el resultado del grado de perturbación que ostenta la zona, cuya condición promueve la colonización de dichas especies, también llamadas pioneras, que conforman estadios de sucesión temprana o secundarios (Alday et al., 2012; Almazán et al., 2016; Bongers et al., 2009). La presencia de estas especies generalistas presenta ventajas sucesionales, ya que facilitan el proceso de sucesión para el posterior establecimiento de especies de sucesión tardía, como lo son algunas especies de encinos (Almazán et al., 2016).
Por otro lado, la distribución más dispersa de las especies en el bosque de pino y encino y, principalmente, en el matorral xerófilo, en comparación con el bosque de encino, se debe a que las áreas que ocupan estos tipos de vegetación son las de mayor erosión y perturbación con tipos de suelo someros que representan una limitación para el desarrollo de las plantas (Oropeza et al., 2016). Por lo que en dichas condiciones existe una mayor competencia por los recursos de agua y nutrientes, además, de que la vegetación dispersa también se relaciona a la presencia de climas secos (Girado, 2019; Maestre et al., 2003; Moreno et al., 2017).
Los resultados de este estudio proporcionan un mayor entendimiento de los elementos de la geodiversidad que influyen en la vegetación leñosa del GMA, y sus especies asociadas. Con base en lo anterior, se emiten algunas recomendaciones y sugerencias que pueden ser usadas como referencia para el diseño de programas de conservación y restauración en el GMA.
Sin perder de vista la importancia de otros elementos de la geodiversidad, como primer punto, debe considerarse que la existencia de la vegetación leñosa del GMA se debe principalmente a las condiciones climáticas que presenta la región, así como a la historia de la perturbación del área, la cual se encuentra muy relacionada con el pastoreo de ganado ovino y caprino (Lorenzen et al., 2020; Ramírez et al., 2021)
Debido a lo anterior, para actividades de restauración y/o reforestación, se sugiere utilizar especies generalistas adaptadas a estas condiciones, como por ejemplo, Q. rugosa, C. fothergilloides, P. oaxacana, L. esculenta, D. viscosa, J. flaccida y B. heterophylla, algunas de las cuales ya han sido recomendadas por otros autores para establecer plantaciones o reforestaciones mixtas (Acosta et al., 2014; Hernández-Aguilar et al., 2021; Royero et al., 2019). Sin embargo, hay que considerar que con excepción de P. oaxacana, el resto de las especies señaladas no son producidas en viveros y para la mayoría se desconocen los requerimientos de sustrato, por lo que existe la necesidad de generar información al respecto.
En este sentido, se sugiere desarrollar investigaciones más amplias sobre la colonización vegetal de áreas erosionadas o de suelo desnudo, específicamente sobre el establecimiento del matorral xerófilo, para obtener información de las condiciones en que las especies generalistas o pioneras se desarrollan en estos ambientes, de manera que las acciones de restauración o reforestación que se implementen emulen el proceso de sucesión ecológica que ocurre en dichas áreas. De manera particular, se recomienda llevar a cabo estudios dirigidos con especial énfasis en las especies especialistas, ya que los cambios ocasionados por el régimen de perturbación antrópica, que caracteriza a la región, las hace vulnerables a procesos de extinción local (Mendoza, 1994), tal es el caso de Rhamnus calderoniae, especie catalogada como endémica (Fernández, 1996).
Por otra parte, el porcentaje elevado de especies generalistas que conforman los tipos de vegetación leñosa confirma lo que otros estudios han señalado respecto a que el principal mecanismo de restauración en el GMA ha sido mediante el proceso de sucesión ecológica, más que por la implementación de reforestaciones, que apenas cubren 1% de la superficie, contra 47% que ocupa actualmente la vegetación leñosa (Lorenzen et al., 2020; Ramírez et al., 2021).
Por lo que en el caso del GMA, se sugiere combinar ambos mecanismos, estableciendo reforestaciones con especies nativas en las áreas más degradadas, pero dando una mayor atención a la restauración por medio del proceso de sucesión ecológica; por lo que se recomienda continuar con las acciones que las comunidades locales ya implementan en las áreas con vegetación leñosa (combate de incendios, regulación de la extracción de recursos naturales, regulación del pastoreo, entre otras) y aplicar otras que generen incentivos económicos para su conservación, mediante el aprovechamiento sustentable de recursos naturales (p.ej. aprovechamiento de productos forestales no maderables), el pago de servicios ambientales, turismo de naturaleza, etc., que al final, también tendrán repercusiones en las poblaciones locales y sus medios de vida.











 nueva página del texto (beta)
nueva página del texto (beta)



