Introducción
Las macroalgas bentónicas son un componente esencial en el ecosistema marino, juegan un papel importante en el equilibrio y mantenimiento de los arrecifes coralinos, brindan refugio a peces e invertebrados, modifican los fondos marinos al contribuir a fijar el sustrato por medio de sus rizoides, enriquecen el agua con oxígeno disuelto, y aportan macro y micronutrientes al medio circundante (Barrios et al., 2003; González-Gándara et al., 2007; Mateo-Cid et al., 2013; Santos et al., 2011). Así mismo, éstas son altamente sensibles a cambios ambientales y a la degradación del ambiente al depender de hábitats bentónicos específicos para su crecimiento y propagación (Pellizzari et al., 2014; Santos et al., 2011). Aparte de factores como la radiación luminosa y la temperatura del agua, las macroalgas dependen del sustrato para su desarrollo, ya sea abiótico (arena, roca, esqueleto de coral, restos de conchas de moluscos) o biótico (macroalgas y pastos marinos). El sobrecrecimiento de macroalgas bentónicas en la superficie de otras macroalgas constituye una asociación epifita (Hensley et al., 2013; Sahayaraj et al., 2014), la cual depende de la disponibilidad de sustrato adecuado, en términos de área basal, rugosidad y textura de la superficie, de la producción de sustancias alelopáticas, como el mucilago, y de la tasa de crecimiento del talo (Diez-García et al., 2013). La epibiosis en los hábitats marinos es tan frecuente como poco estudiada; específicamente, los estudios de epifitismo en macroalgas son escasos (Ramírez et al., 2011). Entre éstos podemos citar 2 de ellos realizados en Baja California, costa pacífica de México, involucrando a Padina concrescens (Ortuño-Aguirre y Riosmena-Rodríguez, 2007) y a Sargassum sinicola (Mateo-Cid et al., 2014); otro en Nayarit involucrando a Padina durvillei y a P. crispata (Álvarez-Álvarez et al., 2020); en Veracruz, costa del golfo de México, un estudio de revisión sobre trabajos previos realizados en el área sobre algas epífitas presentes en sustrato rocoso y arrecifal (Ramírez et al., 2011); y en Isla Mujeres, Quintana Roo, un censo de algas epífitas creciendo sobre algas hospederas desprendidas del sustrato rocoso por el oleaje (Quan-Young et al., 2006).
En los arrecifes de coral, las macroalgas son los mayores competidores por luz, nutrientes y sustrato (espacio) de los corales escleractinios. Cuando se reduce la tasa de herbivoría sobre las macroalgas, éstas son capaces de invadir a los corales, afectando la estructura y función de los arrecifes y ser las que dominen la cobertura bentónica de los mismos (Acosta-González et al., 2013; Hughes, 1994). Los arrecifes entran entonces en un proceso de cambio de fase que se caracteriza por la reducción en la cobertura coralina, la proliferación de macroalgas bentónicas y la disminución de la diversidad local de especies (Acosta-González et al., 2013; Arias-González et al., 2017; Ortegón-Aznar et al., 2013). La diversidad de macroalgas es un indicador que puede ser usado en programas de monitoreo, ya que los inventarios permiten detectar la desaparición de algunos taxones, la aparición de otros y los cambios en la composición y distribución de las especies (Pellizzari et al., 2014).
En el océano Atlántico occidental, tropical y subtropical, se tiene un registro aproximado de 1,553 especies de macroalgas bentónicas: 215 Ochrophyta (Pelagophyceae, Phaeophyceae y Xanthophyceae), 1,014 Rhodophyta y 324 Chlorophyta (Wynne, 2017). De esta diversidad, en Quintana Roo (mar Caribe oeste), se ha registrado un total de 587 especies, 68 Ochrophyta, 348 Rhodophyta, y 171 Chlorophyta (Cetz-Navarro et al., 2008; García-García et al., 2020). En esta región se han realizado varios estudios sobre composición de macroalgas (Cetz-Navarro et al., 2008; Dreckmann, 1998; Dreckmann et al., 1996; Mateo-Cid et al., 2006; Ortega et al., 2001; Quan-Young et al., 2006); sin embargo, en el sur de Quintana Roo, específicamente en Xcalak, solo se cuenta con registros florísticos de Huerta-Múzquiz y Garza-Barrientos (1980), Cetz-Navarro et al. (2008) y Conanp (2004) y, en el canal de Zaragoza, de Espinoza-Ávalos et al. (2009), quienes obtuvieron registros de vegetación sumergida desde la bahía de Chetumal hasta la zona de mezcla en el mar Caribe.
El objetivo de este trabajo fue determinar la diversidad alfa, beta y gama de especies de macroalgas bentónicas del sur del Parque Nacional Arrecifes de Xcalak, e identificar las clases de sustrato usadas para la colonización del ambiente bentónico.
Materiales y métodos
El área marina protegida del Parque Nacional Arrecifes de Xcalak (PNAX) constituye el sitio Ramsar 1320 y forma parte del Sistema Arrecifal Mesoamericano. Se localiza al sur del estado de Quintana Roo; sus límites norte y sur están definidos por los paralelos 18°30’00”N y 18°11’00”N, mientras que sus límites este y oeste están definidos por el mar Caribe en la isobata de 100 m y el umbral que define la zona federal marítimo terrestre, respectivamente (Camarena-Luhrs, 2003; Conanp, 2004).
El trabajo se realizó al sur del PNAX en donde se ubica el canal de Zaragoza (Fig. 1), vía marítima artificial construida en el año de 1900 para permitir a las embarcaciones, particularmente militares, un paso directo a través de aguas nacionales desde el mar Caribe hacia la bahía de Chetumal (Romero, 2010). El arrecife de coral en el PNAX es de tipo marginal con 25 km de longitud. La zonificación de este arrecife consiste en laguna, frente, pendiente y terraza arrecifal, cada zona con características de complejidad, estructura, diversidad de corales y composición bentónica propias (Arias-González, 1998; Núñez-Lara et al., 2003).
La recolecta de macroalgas se realizó en julio de 2012. Se estableció una red de muestreo de 10 estaciones en 4 zonas: canal de Zaragoza (C) con 2 estaciones y profundidad promedio de 1.5 m; laguna arrecifal con 2 subzonas, laguna arrecifal 1 (LA1) con 2 estaciones localizadas cerca del margen de la costa y profundidad promedio de 0.75 m y laguna arrecifal 2 (LA2) con 4 estaciones y profundidad promedio de 2.5 m; y arrecife frontal (AF) con 2 estaciones y profundidad promedio de 12 m (Fig. 1).
En cada estación se trazó un transecto de 20 m paralelo a la costa y en los metros 0, 10 y 20 se tomaron fotografías con ayuda de un cuadrante de 50 × 50 cm. En cada cuadrante se recolectaron manualmente las macroalgas con ayuda de una espátula (Riosmena-Rodríguez et al., 2005). Las muestras de macroalgas se colocaron en botes de polietileno y se fijaron para su preservación con formol al 4% diluido con agua de mar para ser transportadas al laboratorio para su identificación (Florez-Leiva et al., 2010).
Las macroalgas fueron identificadas a la menor categoría taxonómica posible, idealmente especie, con ayuda de literatura especializada (Humann, 1993; Littler y Littler, 1997, 2000; Littler et al., 1989). La revisión de sinonimia y nomenclatura se basó en Guiry y Guiry (2020). La identificación se apoyó en caracteres morfológicos y anatómicos, observados al microscopio a partir de cortes histológicos; estos se efectuaron en regiones del talo, longitudinales o transversales, dependiendo del desarrollo celular de cada grupo (Sánchez-Molina et al., 2007). El sustrato donde las macroalgas fueron recolectadas fue identificado y clasificado en abiótico (esqueletos de coral, roca, arena) y biótico (macroalgas).
Para evaluar la representatividad del muestro en términos de diversidad de especies, se analizó el esfuerzo de muestreo (n = 10 estaciones). Se realizó una curva de acumulación de especies (Chao 2). La curva se construyó con 9,999 aleatorizaciones con el programa EstimateS (v.9; Colwell, 2012; Colwell et al., 2012; Soberón y Llorente, 1993) y para determinar la existencia de diferencias entre lo observado y lo esperado, se aplicó una prueba de Chi2 (χ2).
En las 4 zonas de muestreo se determinó la heterogeneidad del ambiente. Esto se realizó por medio de la cobertura relativa (CR) del sustrato bentónico en las 10 estaciones de muestreo, para lo cual se analizaron las fotografías de los cuadrantes por medio de una serie de 13 puntos distribuidos sistemáticamente sobre la fotografía. Se registraron 9 grupos estructurales (arena, esqueleto de coral, sustrato calcáreo, roca, pasto marino, macroalgas, coral vivo, gorgonias y esponjas); los puntos registrados por cada grupo fueron transformados en porcentaje de CR mediante la fórmula CR = (número de puntos por grupo/13 puntos) × 100 (Acosta-González et al., 2013). Para identificar los tipos de hábitat en el área de estudio, se realizó un análisis de agrupamiento empleando el algoritmo jerárquico, utilizando las coberturas de los diferentes grupos estructurales de cada sitio de muestreo (Boesch, 1977; Sneath y Sokal, 1973). La ordenación de los sitios se realizó mediante el análisis “escalamiento multidimensional no métrico” (MDS) (Clarke y Warwick, 2001; Kruskal y Wish, 1978). El MDS se basó en el cálculo del coeficiente de similitud/disimilitud entre muestras; en este caso, el coeficiente de similitud de Bray-Curtis (Bray y Curtis, 1957).
Se calculó el índice de Shannon (H’) como diversidad alfa (α), con logaritmo base 10 (decits/ind); la diversidad beta (β) se calculó con el índice de Whitaker para determinar el recambio de especies (Magurran, 2004). La diversidad gamma (γ) se determinó como el número total de especies para el conjunto de sitios muestreados que integran el área de muestreo (Halffter et al., 2005). El análisis de diversidad de especies se realizó mediante el programa R (v. 3.6.1).
Para conocer las características de los hábitats bentónicos que influyen en la diversidad de macroalgas, se aplicó el análisis de árboles de regresión y clasificación (CART, por sus siglas en inglés) (Breiman et al., 1984; Pittman et al., 2007). Los CART son una técnica no paramétrica de clasificación que genera árboles binarios (los nodos padres se dividen en 2 nodos hijos) mediante particiones iterativas, lo cual es un proceso que se puede repetir tratando, a su vez, a cada nodo hijo como padre. El algoritmo encuentra los valores óptimos de corte entre todas las variables independientes para obtener una serie de divisiones binarias, de forma que la varianza se minimice dentro de cada nodo y se maximice entre nodos. Es posible, sin embargo, que existan variables que no se utilicen. Una vez obtenido el árbol que mejor clasifica los casos, sin límite de complejidad, el algoritmo lo poda o simplifica para evitar el sobreajuste de los datos (Olden y Jackson, 2002; Olden et al., 2008).
Resultados
Se obtuvieron registros de 61 taxones de macroalgas, 56 especies, 4 géneros y un morfotipo (diversidad gama), pertenecientes a 13 órdenes, 22 familias y 39 géneros. De ellas, 29 especies y un morfotipo fueron Rhodophyta (algas rojas), de las cuales 4 se identificaron hasta género, 22 Chlorophyta (algas verdes) y 9 Ochrophyta (algas pardas, Clase Phaeophyceae). Del total de estas especies, se obtuvieron 17 registros nuevos para el PNAX y 1 para Quintana Roo. Del total de la diversidad, 72.1% fue compartido entre el golfo de México, el Caribe mexicano (CMX) y el PNAX. El 21.3% se compartió entre el CMX y el PNAX, y el porcentaje restante (6.56%) correspondió a ejemplares que solo se identificaron hasta género (Tabla 1).
Tabla 1 Composición de especies de macroalgas en el PNAX, por zona (C= canal, LA1= laguna arrecifal 1, LA2= laguna arrecifal 2, FA= frente arrecifal) y relación con el sustrato.
| Especie | Registros por región | C | LA 1 | LA2 | FA | ||
|---|---|---|---|---|---|---|---|
| Sustrato | |||||||
| Chlorophyta | |||||||
| Anadyomenaceae | |||||||
| Anadyomene stellata (Wulffen) C. Agardh, 1823 Cladophoraceae | CMX | PNAX | R | EC | |||
| Chaetomorpha clavata Kützing, 1847 ** | CMX | Ho Ht | |||||
| Chaetomorpha aerea (Kützing) Kützing, 1849 | CMX | PNAX | Hi | EC | |||
| Cladophora serícea (Hudson) Kützing, 1843 ** Derbesiaceae | GM | CMX | EC | ||||
| Derbesia marina (Lyngbye) Solier, 1846 ** Dichotomosiphonaceae | CMX | Ht | Ho Ht | ||||
| Avrainvillea longicaulis (Kützing) G. Murray y Boodle, 1889 Halimedaceae | GM | CMX | PNAX | A | EC | ||
| Halimeda copiosa Goreau y E.A.Graham, 1967 | CMX | PNAX | A | A | |||
| Halimeda discoidea Decaisne, 1842 | GM | CMX | PNAX | EC | |||
| Halimeda incrassata (J.Ellis) J.V.Lamouroux, 1816 | GM | CMX | PNAX | A | EC A | EC | |
| Halimeda monile (J.Ellis y Solander) J.V.Lamouroux, 1816 | GM | CMX | PNAX | A | A | ||
| Halimeda opuntia (Linnaeus) J.V.Lamouroux, 1816 | GM | CMX | PNAX | A | R A | EC | |
| Halimeda scabra M.A.Howe, 1905 | GM | CMX | PNAX | EC | EC | ||
| Halimeda tuna (J.Ellis y Solander) J.V.Lamouroux, 1816 Udoteaceae | GM | CMX | PNAX | R EC A | EC | ||
| Udotea dixoniiD.S. Littler y Littler, 1990 ** | GM | CMX | EC | ||||
| Udotea flabellum (J.Ellis y Solander) M.Howe, 1904 | GM | CMX | PNAX | R | |||
| Penicillus capitatus Lamarck, 1813 | GM | CMX | PNAX | A | EC A | EC | |
| Rhipocephalus phoenix (J.Ellis y Solander) Kützing, 1843 Polyphsaeae | GM | CMX | PNAX | A | A | EC | |
| Acetabularia calyculus J.V.Lamouroux, 1824 ** | CMX | EC | |||||
| Parvocaulis polyphysoides (P.Crouan y H.Crouan) S.Berger, U.Fettweiss, S.Gleissberg, L.B.Liddle, U.Ritcher, H.Sawitzky y G.C.Zuccarello, 2003** Siphonocladaceae | CMX | EC Ht | |||||
| Dictyosphaeria cavernosa (Forsskål) Børgesen, 1932 | CMX | PNAX | R Hi | Ht | |||
| Dictyosphaeria ocellata (M.Howe) Olsen- Sotojkovich, 1985 | CMX | PNAX | R Hc Hm | Hi | Ho | Ho Ht | |
| Valoniaceae | |||||||
| Valonia utricularis (Roth) C.Agardh, 1823 Ochrophyta Sargassaceae | CMX | PNAX | R Hc Hm | Hi Ho Ht | EC | ||
| Turbinaria turbinata (Linnaeus) Kuntze, 1898 Dictyotaceae | GM | CMX | PNAX | R EC A | EC | ||
| Dictyopteris delicatula J.V.Lamouroux, 1809 | GM | CMX | PNAX | Ht | EC | ||
| Dictyopteris justii J.V.Lamouroux, 1809 | GM | CMX | PNAX | EC | |||
| Dictyota menstrualis (Hoyt) Schnetter, Hörning y Weber-Peukert, 1987 | GM | CMX | PNAX | R Ho Ht Lv | At Ho Ht Ud | ||
| Dictyota mertensii (C.Martius) Kützing, 1859 | GM | CMX | PNAX | Ht | |||
| Dictyota pinnatifida Kützing, 1859 | GM | CMX | PNAX | R Ht | EC | ||
| Lobophora variegata (J.V.Lamouroux) Womersley ex E.C.Oliveira, 1977 | GM | CMX | PNAX | EC Hi Hs Ht | EC | ||
| Padina sanctae-crucis Børgesen, 1914 | GM | CMX | PNAX | Hi | EC A Ht | ||
| Stypopodium zonale (J.V.Lamouroux) Papemfuss, 1940 Rhodophyta Ceramiaceae | GM | CMX | PNAX | A | |||
| Centroceras gasparrinii (Meneghini) Kützing 1849 *, ** | GM | EC Dmn Ht Lv | Ud | ||||
| Ceramium brevizonatum H.E.Petersen, 1918 ** | GM | CMX | EC Dmn Ht | EC Cp | |||
| Ceramium cimbricum H.E.Petersen, 1924 | GM | CMX | PNAX | Lv | |||
| Ceramium cimbricum f. flaccidum (H.E.Petersen) G.Furnari y Serio, 1996 | GM | CMX | PNAX | Lv | |||
| Ceramium cruciatum Collins&Hervey, 1917 ** | GM | CMX | EC Lv | Dp | |||
| Gayliella flaccida (Harvey ex Kützing) T.O.Cho y L.J. McIvor 2008 Champiaceae | GM | CMX | PNAX | Dmn | |||
| Champia parvula (C.Agardh) Harvey, 1853 Corallinaceae | GM | CMX | PNAX | EC | |||
| Amphiroa beauvoisii J.V.Lamouroux, 1816 ** | GM | CMX | EC Hi Ho Ht Lv | EC Dmr Ht | |||
| Amphiroa rigida J.V.Lamouroux, 1816 | GM | CMX | PNAX | Hs | |||
| Amphiroa tribulus (J.Ellis y Solander) J.V.Lamouroux, 1816 | CMX | PNAX | EC | ||||
| Hydrolithon sp. | EC Ht | EC | |||||
| Jania capillacea Harvey, 1853 | GM | CMX | PNAX | Hc | Hm | Ho Ht Lv | Hs |
| Jania pumila J.V.Lamouroux, 1816 ** | GM | CMX | Ho | Ho | |||
| Porolithon antillarum (Foslie y M. Howe) Foslie y M Howe 1909 ** | GM | CMX | EC | ||||
| Titanoderma sp. | Dmr Hi Ho Ht Lv Tt | Dp Dj Ho Ht | |||||
| Cystocloniaceae Hypnea spinella (C.Agardh) Kützing, 1847 | GM | CMX | PNAX | Hc | Ht | ||
| Galaxauraceae Dichotomaria obtusata (J.Ellis y Solander) Lamarck, 1816 ** | GM | CMX | Hc | Ht | EC | ||
| Gracilariaceae Gracilaria cylindrica Børgesen, 1920 ** | GM | CMX | Ht | ||||
| Hapalidiaceae Mesophyllum sp. | Hi Hm | EC Hi Ho Ht | EC At | ||||
| Lomentariaceae Ceratodictyon planicaule (W.R.Taylor) M.J.Wynne, 2011 ** | GM | CMX | EC Ho Ht | ||||
| Peyssonneliaceae Peyssonnelia sp. | EC | EC | |||||
| Rhodomelaceae Herposiphonia bipinnata M.Howe, 1920 | CMX | PNAX | Hc | EC Dmn Uf | EC | ||
| Herposiphonia secunda (C.Agardh) Ambronn, 1880 | GM | CMX | PNAX | Dmn Lv | Vu | ||
| Herposiphonia tenella (C.Agardh) Ambronn, 1880 | GM | CMX | PNAX | Dmr Dmn Lv | |||
| Laurencia intricata J.V.Lamouroux, 1813 | GM | CMX | PNAX | Hc | Ht | Ho Ht | |
| Laurencia filiformis (C.Agardh) Montagne, 1845 ** | CMX | Ht | |||||
| Melanothamnus gorgoniae (Harvey) Diaz-Tapia y Maggs 2017 ** | GM | CMX | Dmn | ||||
| Wilsonosiphonia howei (Hollenberg) D.Bustamante, Won y T.O.Cho 2017 | GM | CMX | PNAX | R Ht Lv | Yp | ||
| Yuzurua poiteaui (J.V.Lamouroux) Martin-Lescanne, 2010 | GM | CMX | PNAX | Hc | R EC Hi Ho Ht | EC Ho Ht Ud | |
| Wrangeliaceae Griffithsia globulifera Harvey ex Kützing, 1862 | GM | CMX | PNAX | EC | |||
| Total por zona | 44 | 56 | 40 | 12 | 11 | 49 | 41 |
*Nuevo registro para el Caribe mexicano; **Nuevo registro para PNAX. Registro por región: GM = golfo de México, CMX = Caribe mexicano, PNAX = Parque Nacional Arrecifes de Xcalak. Sustrato abiótico: R = roca, EC = esqueleto de coral, A = arena. Sustrato biótico: Hc = Halimeda copiosa, Hi = Halimeda incrassata, Hm = Halimeda monile, Ho = Halimeda opuntia, Hs = Halimeda scabra, Ht = Halimeda tuna, Ud = Udotea dixonii, Uf = Udotea flabellum, Vu = Valonia utricularis, Dj = Dictyopteris justii, Dmn = Dictyota menstrualis, Dmr = Dictyota mertensi, Dp = Dictyota pinnatifida, Lv = Lobophora variegata, Tt = Turbinaria turbinata, At = Amphiroa tribulus, Cp = Ceratodictyon planicaule, Yp = Yuzurua poiteaui.
El esfuerzo de muestreo fue de 94.6% de la riqueza de especies estimada para las cuatro zonas. El valor máximo esperado de riqueza fue de 69 especies y, de acuerdo con la prueba no paramétrica de Chao2, no hubo diferencias significativas entre lo observado y lo esperado (χ2= 6.3, gl = 9, p = 0.70) (Fig. 2).

Figura 2 Curva de acumulación de especies de macroalgas observadas (S obs) y curva de riqueza de especies estimada mediante la prueba no paramétrica Chao2, jackknife2.
Con base en la cobertura relativa (%) de los 9 grupos estructurales, se diferenciaron las zonas u hábitats arrecifales: canal = C (sitios E1 y E2), laguna arrecifal 1 = LA1 (sitios E3 y E4), laguna arrecifal 2 = LA2 (sitios E5, E6, E7 y E8) y frente arrecifal = FA (sitios E9 y E10). El análisis MDS presentó un valor de estrés de 0.07 (Fig. 3), indicando que 2 dimensiones fueron suficientes para una buena ordenación. En la zona C dominó la arena, en LA1 dominó el pasto marino. A proximidad de la cresta arrecifal, los grupos estructurales cambian y por ende el paisaje, dominando el sustrato calcáreo, pasto y macroalgas en LA2. En la zona FA también dominaron macroalgas, sustrato calcáreo y gorgonias. El ambiente bentónico fue más heterogéneo en LA2, siendo esta la zona más diversa en macroalgas, con 49 registros.
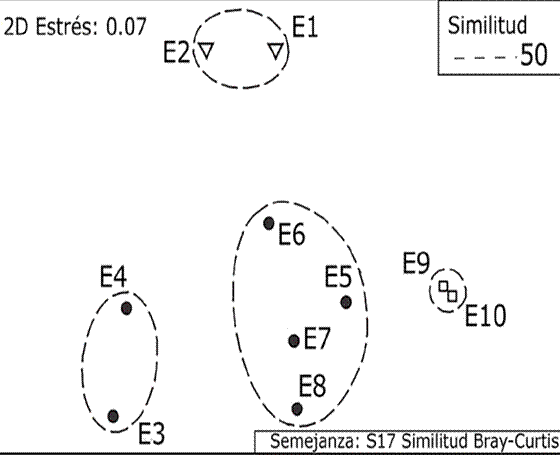
Figura 3 Análisis de heterogeneidad del ambiente, dividiendo el área de estudio en cuatro zonas. Los círculos con líneas discontinuas son resultado del análisis de ordenación MDS.
Se registraron roca, esqueleto de coral y arena como clases de sustrato abiótico y 9 especies de algas verdes, 6 pardas y 3 rojas como clases de sustrato biótico. Se reconoció que 23 especies crecen fijas a sustratos abióticos (esqueleto de coral, arena y roca), entre éstas se encuentran 15 especies de algas verdes, todas pertenecientes a las familias Halimedaceae, Udoteaceae y Anadyomenaceae, 5 especies de algas rojas y 3 especies de algas pardas (Tabla 1). En las zonas LA2 y FA se obtuvieron las mayores frecuencias de estos sustratos. En cuanto a macroalgas epífitas, se encontraron 17 especies que solo crecen sobre otras macroalgas (sustrato biótico), de las cuales 14 registros fueron rojas (incluido el morfotipo), 2 verdes y 1 parda. El resto de las especies (21) crecen tanto en sustrato abiótico como biótico. La zona de FA obtuvo una mayor frecuencia de macroalgas epífitas y de especies que crecen en ambas clases de sustrato (Tabla 1).
En las zonas C y LA1 se registraron sustratos bióticos del género Halimeda. En la zona C se registraron Halimeda copiosa Goreau y E.A.Graham, 1967, Halimeda monile (J.Ellis y Solander) J.V. Lamouroux, 1816, Halimeda opuntia (Linnaeus) J.V. Lamouroux, 1816, y en la zona LA1 se registraron Halimeda monile y Halimeda incrassata (J.Ellis) J.V. Lamouroux, 1816. En ambas zonas se registraron 2 tipos de sustrato abiótico (arena y roca). En la zona LA2 se registraron 12 sustratos, 3 abióticos y 9 bióticos. De las 9 clases de sustrato biótico, 4 fueron del género Halimeda, una Udotea y 4 algas pardas (Tabla 1). En la zona FA se registraron 12 sustratos, 1 abiótico (esqueleto de coral) y 11 bióticos. De los sustratos bióticos, 5 fueron algas verdes (Halimeda [3 spp.], Udotea y Valonia), 3 algas pardas (Dictyopteris [1 sp.] y Dictyota [2 spp.]) y 3 rojas (Amphiroa, Ceratodictyon y Yuzurua). En este hábitat, el esqueleto de coral fue el sustrato abiótico preferido por 30 especies de macroalgas (Tabla 1).
La Chlorophyta Dictyosphaeria ocellata (M. Howe) Olsen-Sotojkovich, 1985 y la Rhodophyta Jania capillacea Harvey, 1853 se registraron en las 4 zonas arrecifales, y tuvieron preferencia de sustrato por el género Halimeda (Tabla 1). La especie Yuzurua poiteaui (J.V. Lamouroux) Martin-Lescanne, 2010 se registró en 3 de las zonas arrecifales (canal, LA2 y FA) y está relacionada con 2 sustratos abióticos y 5 bióticos. Amphiroa beauvoisii J.V. Lamouroux, 1816 se registró en 2 zonas (LA2 y FA) y se relacionó con 6 sustratos bióticos (principalmente del género Halimeda) y 1 sustrato abiótico (esqueleto de coral). En este estudio se evidenció que las algas verdes (género Halimeda) y pardas (género Dictyota) son más propensas a ser sustrato para otras macroalgas, principalmente para las rojas. Solo 3 especies de algas rojas (Amphiroa tribulus (J.Ellis y Solander) J.V. Lamouroux, 1816; Ceratodictyon planicaule (W.R. Taylor) M.J. Wynne, 2011, Yuzurua poiteaui) fueron sustrato para otras algas rojas. Las zonas arrecifales LA2 y FA registraron un mayor número de sustratos de macroalgas (biótico) usados por las epífitas.
La diversidad de Shannon (alfa) permitió determinar que la zona arrecifal más diversa fue LA2 (3.89 decits/ ind), seguido de la zona FA (3.71 decits/ind). Las zonas arrecifales C y LA1 registraron una diversidad relativa más baja (2.40 decits/ind).
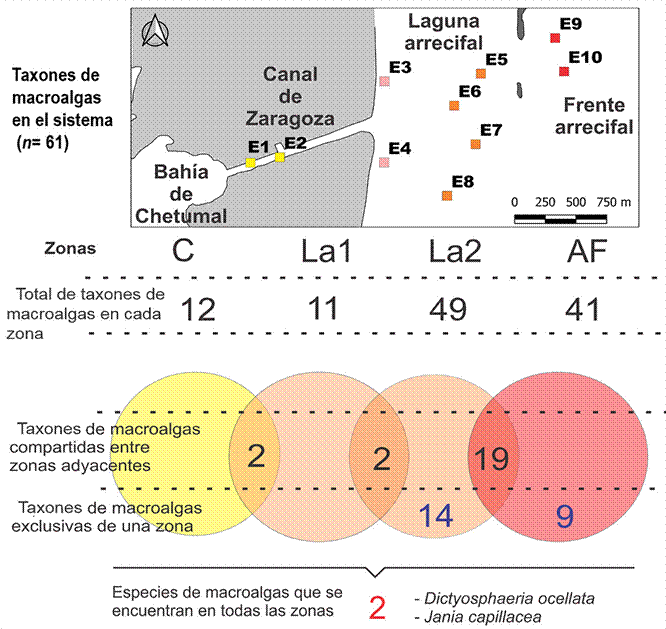
La diversidad β (índice de Whitaker) evidenció que el mayor recambio de especies se produjo entre las zonas arrecifales LA2 y FA (0.31). De los 61 registros, la mayor riqueza de especies se obtuvo en la zona LA2 (49 taxones) y la zona arrecifal FA (41 taxones), compartiendo 19 registros entre ellas. Catorce taxones fueron exclusivas de la zona arrecifal LA2 y 9 de la zona FA (Fig. 4).
Se determinó que cuando se presenta un alto porcentaje de arena (> 26.9%), la diversidad de macroalgas es menor y cuando existe un porcentaje de cobertura de coral vivo menor a 3.85%, la cobertura de macroalgas fue mayor (análisis CART). El 56% de los sitios tuvieron valores altos de diversidad (Fig. 5).
Discusión
El primer estudio realizado en el área del PNAX fue realizado por Huerta-Múzquiz y Garza-Barrientos (1980), en el que reportaron 108 algas para Xcalak (53 rojas, 17 pardas y 38 verdes). De ese número, 24 especies, 8 rojas, 5 pardas y 11 verdes, son comunes a las reportadas en este estudio. Para el área de la Poza del PNAX, ubicada al norte del canal de Zaragoza (~ 4.5 km), la Conanp (2004) reportó 56 especies de macroalgas, de las cuales 38 especies fueron registradas en este estudio. En conjunto, los estudios de Huerta-Muzquiz y Garza-Barrientos (1980) y de la Conanp (2004), comparten con el presente estudio un total de 40 especies de algas, contribuyendo con 17 registros nuevos, 11 rojas y 6 verdes. Para el Caribe mexicano se tuvo un registro nuevo de alga roja, Centroceras gasparrinii (Meneghini) Kützing, la cual está reportada para el golfo de México y para la localidad de la bahía de Akumal en un estudio no publicado (García-García et al., 2020). Cetz-Navarro (2008), quien recolectó algas en la parte basal del tejido vivo de corales (Acropora palmata y Diploria strigosa) en la cresta arrecifal de Xcalak, reportó 4 nuevos registros para el área (no se comparten especies con este estudio). Del total de especies registradas para Quintana Roo, las reportadas aquí representan 10.4% de ellas. Por grupo, Ochrophyta representó 13.2%, Chlorophyta 12.9% y Rhodophyta 8.6% del total de especies bentónicas (Cetz-Navarro et al., 2008; García-García et al., 2020).
Las algas rojas estuvieron presentes en las 4 zonas del arrecife. Como un referente sobre este grupo de algas, en Cuba (mar Caribe) se han registrado 53 especies (Diez-García et al., 2013). En aguas mexicanas, en Isla Mujeres, se han registrado 152 especies (Mendoza-González y Mateo-Cid, 1992; Quan-Young et al., 2006) y en Cozumel 118 (Mateo-Cid et al., 2006). Sin embargo, en el plan de manejo del PNAX realizado por Conanp (2004), se reporta que las macroalgas verdes (40 spp.) constituyen el grupo dominante. Como aún no existen inventarios exhaustivos, lo anterior debe tomarse con cautela, ya que los datos enunciados pueden estar influenciados por la temporada climática o el esfuerzo diferencial de muestreo entre zonas de estudio (Briones-Fourzán y Lozano-Álvarez, 2001; Mateo-Cid et al., 2013).
Las familias Halimedaceae y Udoteaceae mostraron afinidad por la arena como sustrato en las zonas arrecifales C y LA1; sin embargo, conforme la profundidad se incrementa en dirección de la zona FA, las especies del género Halimeda crecen sobre esqueleto de coral. Las algas pardas se registraron principalmente sobre esqueleto de coral, roca, arena y sobre el género Halimeda. Mateo-Cid et al. (1996) registraron en el golfo de México, isla Verde, Veracruz, crecimiento de Halimeda en arena. En las costas de Brasil, se encontró que hay praderas de Halimeda incrassata que crecen en depósitos de arena (de Macêdo-Carneiro y de Morais, 2016); en el presente trabajo se registró que crecen sobre arena y esqueleto de coral. Los sustratos con superficie irregular como esqueleto de coral y roca favorecen el asentamiento de macroalgas. En aguas someras y con arena, el crecimiento de Halimeda y de Udotea se ve favorecido (González-Gándara et al., 2007), lo que fue registrado en el presente estudio. Estas macroalgas se caracterizan por ser cenocíticas, con estructura de fijación rizoidal filamentosa de forma masiva y compacta, que se adhiere a sustratos arenosos y, ocasionalmente, rocosos (Aguilar-Rosas et al., 2001).
La composición de especies de macroalgas en las 4 zonas arrecifales, sugiere que su presencia y distribución están determinadas por factores ambientales como el sustrato biótico y abiótico. Las especies epífitas de macroalgas registradas en este estudio (38), constituyen un número menor al publicado por otros trabajos en la misma área. Diez et al. (2013) reportaron en Cuba 102 especies de macroalgas epífitas y en el Caribe (Isla Mujeres) 96 especies (Quan-Young et al., 2006). Sin embargo, es mayor comparado con el trabajo de Mateo-Cid et al. (1996) en el golfo de México (isla Verde, Veracruz) en donde se registraron 29 macroalgas epífitas, la mayoría pertenecientes a algas rojas. Un resultado análogo se presentó en este estudio.
En la zona C se observó que las algas rojas se encontraron adheridas a Halimeda copiosa y en la zona LA2 se registraron en 4 sustratos como H. tuna, H. opuntia, Lobophora variegata y Dictyota menstrualis. En el estudio de Quan-Young et al. (2006) se registró que las rodofitas tienen preferencia por estas 2 últimas especies de Ochrophyta. El epifitismo en macroalgas puede tener beneficios para ambas partes; por ejemplo, participa en la red trófica, constituyen refugio para especies herbívoras o en etapa reproductiva de invertebrados y peces (Álvarez-Álvarez et al., 2020). Las epífitas funcionan como un obstáculo para el movimiento de las masas de agua, las cuales reciben el impacto del flujo reduciendo el riesgo de que el hospedero se desprenda de su sustrato (Anderson y Martone, 2014). La mayoría de las epífitas se encontraron creciendo sobre el talo de las macroalgas (sustrato), lo que puede estar ayudando que estas epífitas no se desprendan cuando las condiciones dinámicas cambian debido a eventos ciclónicos en las diferentes temporadas climáticas del año.
Mateo-Cid et al. (1996) mencionan que en temporada de secas (marzo-junio) encontraron el mayor número de macroalgas epífitas y que puede deberse a que las poblaciones de macroalgas, en esa temporada, se encontraban en senescencia, y por lo tanto, más susceptibles a ser colonizadas. Por otro lado, Mateo-Cid et al. (2006) registraron 118 especies de las cuales solo 4 de ellas (3%) estuvieron presentes durante todo el año, de lo que se deduce que el número y composición de macroalgas epífitas varía sobre una base estacional.
Las especies de Chlorophyta en aguas someras (zonas C y LA1) se registraron en arena y conforme la profundidad fue mayor (zonas LA2 y FA), en esqueleto de coral. Ochrophyta y Rhodophyta se presentaron en las zonas arrecifales LA2 y FA, creciendo tanto sobre sustrato abiótico como biótico. Las macroalgas epífitas mostraron afinidad por las macroalgas como sustrato (familias Halimedaceae y Dictyotaceae). Se observó una relación directa entre la heterogeneidad del sustrato y el número de especies de macroalgas presentes, así como con la presencia de macroalgas epífitas; sobre la base de esta característica del sustrato, la zona arrecifal LA2 fue el ambiente más propicio para el establecimiento de macroalgas epífitas.











 nueva página del texto (beta)
nueva página del texto (beta)