Introducción
Muchos aspectos que integran la biología de las lagartijas se enfocan en partes del ciclo de vida que contemplan estadios postoviposición como la ecología o características de historia de vida (Andrews et al., 2017; Granados-González et al., 2020; Woolrich-Piña et al., 2020). El desarrollo embrionario es un proceso que inicia con la fecundación y finaliza con el nacimiento (Andrews, 2002). Muchas investigaciones han estudiado cómo la temperatura afecta el desarrollo embrionario, la capacidad de retención embrionaria e incluso las estrategias ecológicas y variaciones filogenéticas en los escamados (Andrews et al., 2013; Andrews y Rose, 1994; Braña et al., 1991; García-Collazo et al., 2012). Dichos estudios han modelado hipótesis sobre el desarrollo embrionario y, particularmente, sobre el origen de la viviparidad en reptiles a partir de sus conspecíficos ovíparos (Andrews et al., 2013). La hipótesis del surgimiento de la viviparidad ha sido apoyada por estudios sobre la retención embrionaria, estrés hídrico, grosor del cascarón, temperatura y, con menor énfasis, el estadio embrionario en la oviposición (Andrews y Mathies, 2000; Andrews y Rose, 1994; Andrews et al., 2017; Calderón-Espinosa et al., 2006; Heulin et al., 2002; Meza-Lázaro, 2004; Rafferty y Reina, 2012; Shine, 1983).
El desarrollo embrionario ha sido descrito y dividido para su estudio siguiendo los rasgos morfológicos que presenta el embrión. Se han generado tablas de desarrollo embrionario que permiten seguir y definir los estadios durante el desarrollo (Py-Daniel et al., 2017). Tradicionalmente, la tabla de desarrollo más utilizada en estudios experimentales para comparación embriológica y para determinar el estadio del desarrollo embrionario en lacertilios (Andrews et al., 2008; Hopwood, 2007; Py-Daniel et al., 2017) es la descrita por Dufaure y Hubert (1961). Esta tabla incluye 40 estadios e inicia desde el clivaje (estadio 1), culminando con el embrión formado completamente, previo a la eclosión o nacimiento (estadio 40).
El proceso de oviposición involucra una transición de la embriogénesis dentro del oviducto de la madre y el nido (Andrews y Mathies, 2000). En reptiles ovíparos existe una variación considerable en el desarrollo embrionario que alcanzan los huevos al momento de la oviposición (Heulin et al., 2002). Por ejemplo, la oviposición en estadios tempranos de desarrollo es común en Crocodylia (néurula, Ferguson, 1985), Testudines y Rhyncocephalia (ambos en gástrula, Ewert, 1985; Moffat, 1985). En lacertilios existen especies que ovipositan tempranamente (Chamaeleo lateralis, estadio 8, Blanc, 1974) y otros que lo hacen cuando el embrión ha alcanzado un desarrollo prácticamente completo (estadio 39.5, DeMarco, 1993; García-Collazo et al., 2012; Mathies y Andrews, 1996). También se han observado variaciones intraespecíficas y entre nidadas en el estadio embrionario en la oviposición (Braña et al., 1991; Calderón-Espinoza et al., 2006). Pese a esta variación, la mayoría de los lacertilios ovipositan en el estadio 30 (basados en la tabla de desarrollo embrionario de Dufaure y Hubert [1961]), el cual es considerado el más frecuente al momento de la oviposición en reptiles (Mathies y Andrews, 1999). En el estadio 30, el embrión está al inicio del segundo tercio del desarrollo embrionario completo y se encuentra entre el intervalo de estadios 26 a 32, donde ocurre la deposición de calcio para formar por completo el cascarón, además de la incorporación de proteínas como el albumen para que el huevo pueda continuar su desarrollo expuesto al medioambiente (Andrews y Mathies, 2000; Shine, 1983).
Un aspecto importante al realizar estudios experimentales en huevos de reptiles es conocer el estadio normal de oviposición, como en el trabajo de Rodríguez-Díaz y Braña (2012). Este trabajo describe que al analizar nidadas de Zootoca vivipara en el mismo estadio en la oviposición (33) se puede observar una eclosión más temprana (días de incubación) como consecuencia de experimentar con elevación y temperatura de incubación. Entonces, el estadio embrionario en la oviposición permite tener un control y un panorama amplio de los efectos experimentales resultantes, así como de las hipótesis a explorar. La ausencia de esta información en diversos experimentos de incubación puede generar sesgos que podrían sobre-estimar efectos experimentales (e.g., térmicos, hídricos, retención embrionaria) al que los huevos y hembras grávidas son sometidos, forzando la detección de similitudes o diferencias no existentes o que no son apoyadas metodológicamente (Andrews, 2004). Entonces, el conocimiento del estadio embrionario en la oviposición debe ser una característica necesaria de análisis para poner a prueba diversas hipótesis como el origen de la viviparidad. Por ejemplo, en tortugas, cocodrilos y tuátaras dados los tempranos estadios embrionarios en la oviposición que presentan se puede inferir por qué en estos grupos no surgió la viviparidad, mientras que en escamados, a pesar de las variaciones existentes en el desarrollo embrionario, la viviparidad ocurrió en múltiples ocasiones (Andrews, 1997; Qualls et al., 1997; Shine, 1983).
En el trabajo de Andrews y Mathies (2000), se conocía el estadio en la oviposición de aproximadamente 1.1% de las especies de escamados (i.e., 63 especies de las ~ 5,500 especies de escamados ovíparos descritos en aquel momento). Desde entonces se ha incrementado el número a 25 especies adicionales para alcanzar solo 1.3% de las especies de escamados (i.e., 88 especies de las 6,905 especies de lacertilios descritos en la actualidad; Uetz et al., 2021). Asimismo, se han descrito diversos factores que pueden afectar el estadio en la oviposición, éstos incluyen aspectos morfológicos, fisiológicos y ecológicos. Dentro de los factores morfológicos más importantes se encuentra el grosor y estructura del cascarón, la vascularización de membranas extraembrionarias y del oviducto (Andrews, 1997; Masson y Guillette, 1987; Packard y DeMarco, 1991). Entre los factores fisiológicos, se encuentra la disponibilidad de oxígeno y de agua en el oviducto (Mathies y Andrews, 1996; Smith et al., 2015). Ambos factores promueven variaciones en la difusión de gases y, por consiguiente, en la cantidad de oxígeno disponible para los huevos en el oviducto (Masson y Guillette, 1987). Finalmente, existen factores ecológicos que afectan el estadio en la oviposición, como la retención de los huevos en el oviducto por periodos más largos de tiempo para aumentar la sobrevivencia de la descendencia o, por el contrario, ovipositar tempranamente para reducir las tasas de mortalidad de las hembras grávidas al disminuir el exceso de carga y aumentar su capacidad de escape ante un depredador (Andrews y Mathies, 2000; Sinervo y Licht, 1991).
Basiliscus vittatus es una lagartija ovípara que presenta un modo de forrajeo pasivo (Cooper et al., 2013); no obstante, se ha sugerido que al mostrar características como altas velocidades de escape, cuerpos cilíndricos y valores de masa relativa de la nidada (MRN) comparables con especies de forrajeo activo (e.g. Aspidoscelis), pueda encontrarse en una posición intermedia entre ambos extremos de forrajeo (Suárez-Varón et al., 2019). Por otra parte, aunque recientemente se dieron a conocer diversas características de la nidada y de las crías (Suárez-Varón, 2017; Suárez-Varón et al., 2019), no hay información disponible del estadio embrionario al momento de la oviposición para esta lagartija. En el presente estudio aportamos información, por primera vez para la familia Corytophanidae, del estadio embrionario en la oviposición de B. vittatus. Este trabajo, a diferencia de estudios previos (Hernández-Gallegos et al., 2011; Manríquez-Morán et al., 2005), incluye un tamaño de muestra significativo. El estadio en la oviposición de B. vittatus podría ser de gran utilidad para entender el papel de la temperatura en el desarrollo embrionario y en la determinación del sexo en B. vittatus.
Materiales y métodos
Se recolectaron hembras grávidas de B. vittatus durante la temporada reproductora de 2019, la cual corresponde a los meses desde abril a julio en la Selva del Marinero localizada en el municipio de Catemaco, Veracruz (18°26’36.3" N, 94°37’81.9" O, 177 m snm) (Suárez-Varón et al., 2019). La captura se llevó a cabo bajo el permiso de colecta científica SEMARNAT-08-043. La zona de estudio presenta selva alta perennifolia como vegetación y un clima cálido-húmedo con una marcada estacionalidad que comprende una estación lluviosa de junio a febrero y un periodo de sequía de marzo a mayo (Ibarra-Manríquez y Sinaca, 1987; Urbina-Cardona et al., 2006). Las hembras fueron capturadas manualmente y, en ocasiones, con una caña de pescar en sitios donde es común observarlas.
La condición reproductora se valoró al recolectar las hembras mediante una palpación abdominal (Cuellar, 1984). A las hembras que presentaron huevos se les registró la fecha de colecta, la longitud hocico-cloaca (LHC; precisión 0.01 mm) y la masa corporal (MC; precisión 0.1 g). Las hembras fueron trasportadas al Laboratorio de Herpetología en la Universidad Autónoma del Estado de México, donde fueron mantenidas individualmente en terrarios de 1 m × 50 cm × 50 cm (largo, ancho y alto), provistos de suelo proveniente del área de estudio y lámparas incandescentes de 75 watts en un extremo del mismo para crear un gradiente térmico entre 20 y 40 °C. Las hembras se alimentaron cada tercer día con larvas de tenebrio (Tenebrio molitor) y se les proporcionó agua ad libitum. Los terrarios se revisaron diariamente cada 3 horas (8:00 a 20:00 h) a través de un orificio lateral que ocultaba la presencia del observador, para determinar la flacidez abdominal de las hembras como señal de oviposición o la observación in situ de los huevos.
Los huevos fueron colectados el día de la oviposición, esta fecha se utilizó para determinar el número de días preoviposición (DPO) como los días transcurridos desde la colecta de la hembra grávida hasta la oviposición de cada hembra. Se tomó un huevo aleatoriamente de cada nidada y se registró su masa (MH), así como largo y ancho máximo (LM y AM, respectivamente) y su volumen al momento de la oviposición (VH) estimado por la ecuación: V = 4/3 π (1/2 LM) (1/2 AM)2. Posteriormente, los huevos fueron fijados en formaldehído (10%) para preparar las muestras y poder determinar el estadio de desarrollo embrionario en la oviposición basados en la tabla de desarrollo embrionario propuesta por Dufaure y Hubert (1961). Adicionalmente, algunos valores de las variables de la masa relativa de la nidada (MRN), AM y LM fueron tomados de Suárez-Varón et al. (2019) y complementados con nueva información generada de las variables medidas en el presente estudio.
Con los datos obtenidos se realizaron pruebas de normalidad para todas las variables y se aplicaron regresiones lineales para comprobar si existe alguna relación entre las características de las hembras (LHC, MC, DPO, MRN) y de los huevos (AM, LM y VH) respecto al estadio embrionario en la oviposición (EO). Por otra parte, se realizó una prueba de Chi cuadrada con la finalidad de determinar si existe un estadio embrionario en la oviposición seleccionado con mayor frecuencia en el proceso de oviposición de B. vittatus (Zar, 1999). Todos los análisis fueron realizados con un alfa de 0.05 en el software SPSS.
Resultados
Fueron colectadas un total de 37 hembras grávidas. Los datos sobre su morfología y la de los huevos se muestran en la tabla 1. Los estadios embrionarios en la oviposición de B. vittatus fueron: 29 (n = 3), 30 (n = 14), 31 (n = 14) y 32 (n = 6) con una media que corresponde al estadio 30.6 ± 0.14 EE. Durante el estadio 29 se observó el inicio de la diferenciación de las extremidades con forma de muñón y 40 pares de somitas. Mientras que en el estadio 30 se observó un muñón más desarrollado con una cresta pequeña, ligera pigmentación del ojo y las 5 hendiduras branquiales se encontraron abiertas (fig. 1A). Durante el estadio 31 las extremidades en forma de muñón comenzaron a aplanarse en la zona más distal formando el autopodio, ojos prominentes y más pigmentados (fig. 1B). En el estadio 32 los embriones tenían diferenciados el zeugopodio y estilopodio en las extremidades (fig. 1C).
Tabla 1 Estadística descriptiva de la morfología corporal de las hembras: longitud hocico cloaca (LHC), masa corporal (MC), días preoviposición (DPO), masa relativa de la nidada (MRN) y huevos al momento de la oviposición: estadio embrionario (EO), largo máximo (LM), ancho máximo (AM) y volumen (VH) de Basiliscus vittatus de la Selva del Marinero, Catemaco, Veracruz.
| Característica | Media | EE | Min | Max | CV % | N |
|---|---|---|---|---|---|---|
| Estadio embrionario | 30.6 | 0.14 | 29 | 32 | 2.8 | 37 |
| HC (mm) | 126.9 | 1.2 | 106 | 139.1 | 6.07 | 37 |
| MC (g) | 57.4 | 1.9 | 37 | 87 | 20.2 | 37 |
| MRN | 0.18 | 0.006 | 0.06 | 0.27 | 21.8 | 37 |
| M (mm) | 19.43 | 0.21 | 16.4 | 22.27 | 6.57 | 37 |
| AM (mm) | 11.25 | 0.12 | 9.74 | 12.72 | 6.69 | 37 |
| VH (mm3) | 1,284.22 | 31.6 | 899.17 | 1,745.74 | 14.9 | 37 |
| DPO | 41.18 | 3.11 | 8.0 | 95.0 | 45.9 | 37 |
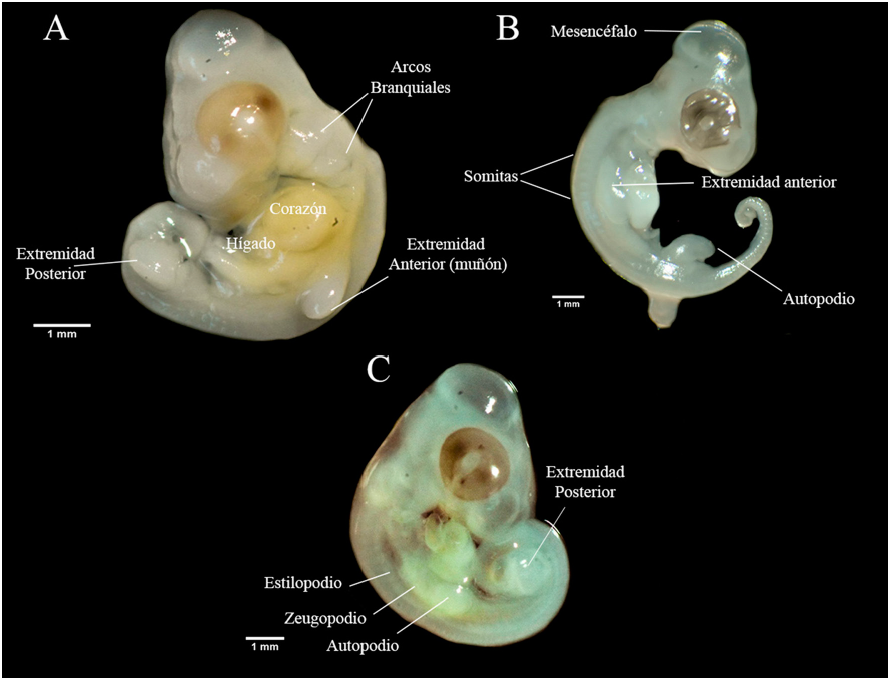
Figura 1 Estadios embrionarios al momento de la oviposición de Basiliscus vittatus de la Selva del Marinero, Catemaco, Veracruz. A) Estadio 30, B) estadio 31 y C) estadio 32.
La prueba de Chi cuadrada se utilizó para probar el modelo correspondiente a ovipositar en estadios intermedios (30 y 31) o extremos (29 y 32), de acuerdo con los estadios embrionarios obtenidos. Dicha prueba mostró que existe una preferencia por ovipositar en estadios embrionarios intermedios (i.e., 30-31; X2 = 9.7, g.l. = 1, p = 0.001). Adicionalmente, los análisis de regresión lineal señalaron que el estadio embrionario en la oviposición se asocia con el largo máximo del huevo (EO = 23.3864 + 0.372561 * LM, r = 0.54, p = 0.005), pero no con la MRN u otras características (tabla 2), mientras el volumen del huevo se correlaciona positivamente con el ancho máximo (VH = -1172.87 + 219.13 * AM, r = 0.86, p = 0.0001).
Tabla 2 Regresiones lineales entre características de la hembra: longitud hocico cloaca (LHC), masa corporal (MC), días preoviposición (DPO), masa relativa de la nidada (MRN) y de los huevos: largo máximo (LM), ancho máximo (AM) y volumen (VH) del estadio embrionario de Basiliscus vittatus al momento de la oviposición (EO) en la Selva del Marinero, Catemaco, Veracruz.
| Característica | r2 | p |
|---|---|---|
| HC vs EO | 0.97 | 0.56 |
| MC vs EO | 0.10 | 0.54 |
| M vs EO | 0.29 | 0.005 |
| AM vs EO | 0.01 | 0.94 |
| VH vs EO | 0.74 | 0.61 |
| MRN vs EO | 0.07 | 0.871 |
| DPO vs EO | 0.07 | 0.875 |
Discusión
Si bien, el grado del desarrollo embrionario alcanzado en la oviposición varía entre reptiles, un patrón común para escamados es ovipositar en el estadio 30 (Andrews y Mathies, 2000). Los resultados del presente estudio indican que, aunque el estadio a la oviposición es variable en B. vitattus (29-32), las hembras ovipositan preferencialmente en los estadios 30 y 31. Estos estadios parecen ser un aspecto recurrente en la mayoría de las lagartijas que dejan una nidada anual, como ocurre en Lampropholis delicata (Andrews y Mathies, 2000; Andrews et al., 2017; Shine, 1983). Estadios embrionarios más allá del 32 requieren la capacidad de las hembras para retener sus huevos en el oviducto por largos periodos y, en consecuencia, se esperaría que un estadio embrionario más avanzado al momento de la oviposición sea reflejo de una duración mayor en el tiempo (días) de retención de los huevos en el oviducto (Heulin et al., 2002; Shine, 1983). Los días preoviposición (DPO) no mostraron relación con el estadio embrionario en la oviposición, esto explica que la variación embrionaria es debida a la influencia de factores fisiológicos y ambientales y no al estrés del cautiverio. Y, aunque se ha documentado variación intranidada en algunas especies de lagartijas (Calderón-Espinoza et al., 2006), en B. vittatus la evidencia de 2 nidadas que fueron encontradas en campo (misma zona de estudio) y cuyos embriones se encontraron en el mismo estadio embrionario (n = 5, estadio 38, n = 6, estadio 39, Suárez-Varón, obs. pers.), sugiere que los huevos son ovipositados en el mismo estadio embrionario. De este modo, B. vittatus posee la capacidad de retener huevos más allá de la moda del estadio normal de desarrollo embrionario (30), pero no después del intervalo máximo (32). Esto implica una retención de 14.4 días que corresponden al tiempo del desarrollo embrionario desde el estadio 29 al 32 (Suárez- Varón, datos no publicados) respecto a un nido de reciente oviposición encontrado en campo con una temperatura de 28 °C (Suárez-Varón et al., 2016). Entonces, aunque en esta población es poco probable que las hembras tengan más de una nidada, como sucede en poblaciones de B. vittatus que se distribuyen más al sur y donde las condiciones ecológicas permiten que la reproducción ocurra durante todo el año, la evidencia actual indica que en la población estudiada existe una sola nidada que se extiende de marzo a julio (Hirth, 1963; Suárez-Varón, 2015). Esta característica favorece la presencia de estadios embrionarios en la oviposición que rondan el estadio 30, contrario a aquellas especies con múltiples nidadas por año, donde los huevos pueden ser ovipositados en estadios más tempranos de desarrollo (Andrews y Mathies, 2000).
La oviposición de los huevos en estadios embrionarios más tempranos a los que presenta B. vittatus se ha relacionado con una disminución en los costos asociados al modo de forrajeo activo, ya que, retener por más tiempo los huevos dentro los oviductos representa mayor riesgo de depredación para la hembra e incluso compromete la sobrevivencia de la descendencia (Braña et al., 1991; Vitt y Congdon, 1978; Vitt y Price, 1982). Por ello, probablemente la presión selectiva debió favorecer aquellas especies con forrajeo activo para que desarrollaran una oviposición tan pronto como la formación del cascarón estuviera completa, aunque esto implicara dejar huevos en un estadio embrionario temprano (Mathies y Andrews, 1999). Por ejemplo, como consecuencia de un forrajeo activo, varias especies de teiidos dejan sus huevos más tempranamente que B. vittatus, 21-22 como ocurre en Aspidoscelis uniparens (Billy, 1988), 18 para Aspidoscelis sacki (Hernández-Gallegos et al., 2011), 18 Aspidoscelis costatus costatus (López-Moreno, 2011). Esto es contrario a lo que ocurre en algunas especies con forrajeo pasivo, donde la capacidad de retención embrionaria permite llegar a estadios de desarrollo tardíos (e.g., como sucede en Sceloporus scalaris, 39.5 [Mathies y Andrews, 1996] y Sceloporus aeneus 39 [García-Collazo et al., 2012]).
Por otra parte, el máximo estadio embrionario en la oviposición de B. vittatus debe estar limitado por las demandas de oxígeno del embrión en el oviducto al presentar un estadio mayor de desarrollo, ya que después del estadio 30 comienza una fase de crecimiento exponencial del embrión, durante el cual los tractos reproductores no pueden continuar la embriogénesis como sucede en otras lagartijas (Andrews, 2002; Braña et al., 1991; Shine, 1983). Por lo tanto, se ha sugerido que valores bajos de oxígeno (hipoxia) en los oviductos limitan el intercambio gaseoso; siendo la hipoxia una de las condiciones que mejor explican las limitantes del desarrollo y metabolismo embrionario (Andrews, 2002; Andrews y Mathies, 2000; Rafferty et al., 2013). Además, la concentración de oxígeno en el oviducto también ha sido ligada a temperaturas ambientales que favorecen aquellas especies distribuidas en climas fríos y con forrajeo pasivo (García-Collazo et al., 2012; Mathies y Andrews, 1996). Por lo que, el máximo estadio a la oviposición es producto del tiempo que las hembras pueden retener los huevos dentro el oviducto (Shine y Bull, 1979).
Los análisis de regresión lineal mostraron que un incremento en el largo máximo de los huevos proporciona un desarrollo embrionario más avanzado. Esto implica una distención abdominal de las hembras para permitir el mantenimiento de los huevos durante un lapso mayor que en el caso de B. vittatus, correspondería a máximo 2 estadios embrionarios pasando la fase normal de oviposición. Mientras que el volumen y el ancho máximo permanecen estables dado que no se asociaron con el estadio embrionario en la oviposición, pero sí entre ellas. El aumento en estas características (AM y VH) por la adición de agua y crecimiento del embrión incrementaría los costos (e.g., mortalidad, fisiológicos) relacionados con la retención de huevos, reduciendo así la cantidad y presión del oxígeno disponible e induciendo a la hipoxia (Braña et al., 1991; Rafferty et al., 2013). Parece ser que la morfología de B. vittatus limita el tamaño de los huevos (e.g., especialmente su ancho y volumen), dado que su volumen está en función del ancho máximo; es decir, el ancho máximo limita el incremento del volumen. Como consecuencia, mantener los huevos por más tiempo dificultaría el proceso de oviposición debido a la pequeña apertura cloacal que poseen las hembras (Suárez-Varón et al., 2019).
Un estudio previo ha registrado cómo en B. vittatus la MRN se correlaciona con el tamaño de nidada (media = 6.2 huevos) y cómo el tamaño de la nidada y el volumen de los huevos están limitados por la LHC de las hembras (ver figs. 2, 3 en Suárez-Varón et al. [2019]). En el presente estudio, la ausencia de correlación de la MRN con EO sugiere que la energía que las hembras destinan a la reproducción no influye sobre el estadio embrionario en la oviposición, contrario a los hallazgos en diferentes especies de Lacerta, donde valores mayores en MRN corresponden a estadios embrionarios más avanzados (Braña et al., 1991). Además, las limitaciones impuestas en el volumen y ancho máximo de los huevos son un indicativo de que el crecimiento, tamaño del huevo, y por tanto, el estadio embrionario en la oviposición, son limitados por la morfología corporal de las hembras y los requerimientos fisiológicos dentro de los oviductos para continuar el desarrollo embrionario (Andrews, 2002).
Adicionalmente, características como la velocidad de escape, las tasas de depredación y las conductas asociadas al forrajeo pasivo reflejarían altos valores en la MRN y, por tanto, la capacidad de una mayor retención embrionaria (Braña et al., 1991; Vitt y Price, 1982). Estas condiciones favorecerían encontrar estadios en la oviposición avanzados en el desarrollo embrionario, contrario a lo que ocurre con B. vittatus y en la mayoría de las especies, que no muestran una prolongada retención embrionaria.
La familia Corytophanidae incluye 3 géneros, Corytophanes + Laemanctus y Basiliscus como el género hermano, siendo Corytophanes percarinatus la única especie vivípara dentro del género y la familia (Townsend et al., 2004; Vieira et al., 2005). La viviparidad en C. percarinatus podría ser una adaptación a las deficiencias térmicas de las zonas frías con alta elevación y latitud donde habita (McCoy, 1968; Townsend et al., 2004), así como se ha sugerido para algunas especies del género Sceloporus (Mathies y Andrews, 1995; Andrews, 2000). La divergencia entre Corytophanes + Laemanctus y Basiliscus se estima que ocurrió hace 61.7 millones de años, quedando el género Basiliscus filogenéticamente alejado de C. percarinatus (Taylor et al., 2017). Son necesarios más estudios que involucren información sobre características de la historia de vida y particularmente del estadio en la oviposición de la familia Corytophanidae, ello para inferir la evolución de la viviparidad en la familia.
La variación en el estadio embrionario en la oviposición puede estar moldeada por características de historia de vida que promueven ventajas selectivas a las hembras para modificar el momento de la oviposición y, por tanto, del desarrollo embrionario al responder a fluctuaciones ambientales y fisiológicas (Andrews y Mathies, 2000; Rafferty y Reina, 2012). Es importante conocer el estado embrionario en la oviposición de B. vittatus, ya que permite completar huecos dentro de su historia natural, además, permite entender mejor si la temperatura de incubación afecta la proporción de sexos (Suárez-Varón, 2017), puesto que nidadas de B. vittatus incubadas a 28 °C dieron como resultado 100% de hembras (Suárez- Varón, datos no publicados); mientras que Acosta et al. (2019), descubrieron un nuevo sistema cromosómico XY en la especie. Estos hallazgos podrían indicar que, a pesar de que B. vittatus es una especie con presencia de cromosomas sexuales, la temperatura de incubación podría estar anulando el sistema cromosómico sesgando las proporciones sexuales como ocurre en Pogona vitticeps (Holleley et al., 2015). Entonces, estudiar el estadio en la oviposición permite ver los efectos directos que produce la temperatura sobre el desarrollo embrionario y en el mecanismo de determinación sexual de la especie.
En conclusión, tanto los aspectos morfológicos como los fisiológicos, así como la posible influencia del modo de forrajeo, aparentemente determinan el estadio en la oviposición en aquellas especies donde la retención embrionaria no ha sido favorecida. Adicionalmente, es necesario realizar comparaciones de este estudio con poblaciones de B. vittatus que presentan nidadas múltiples, donde se esperarían estadios embrionarios en la oviposición más tempranos. Son necesarios más esfuerzos para conocer esta característica y generar mejores aproximaciones de las variaciones y factores que afectan el estadio embrionario en la oviposición en lagartijas.











 nova página do texto(beta)
nova página do texto(beta)


