Introducción
La Amazonía peruana viene experimentando un rápido cambio en la cobertura de bosques debido a la expansión de agricultura y actividades extractivas (Nicolau et al., 2019). Una de estas actividades es la minería, considerada importante en la economía y desarrollo de las sociedades humanas (Cherlet et al., 2018). La minería artesanal y a pequeña escala (ASGM) se encuentra distribuida de forma dispersa alrededor del mundo y es considerada como un componente importante de la economía local de países en desarrollo. Madre de Dios (capital de la biodiversidad del Perú) es una de las zonas mejor conservadas de la Amazonía (Joshi, 2016). Sin embargo, esta mega diversidad está siendo amenazada por actividades forestales, agrícolas y minería aurífera, además de que la ASGM es señalada como la fuente principal de emisiones de mercurio antropogénico a nivel mundial, generando riesgos a la salud pública de las poblaciones locales (Moody et al., 2020; Soto-Benavente et al., 2020). La minería aurífera remueve toda la vegetación y degrada severamente la estructura del suelo (Asner y Tupayachi, 2016; Walker y del Moral, 2003; apéndice 1). Este tipo de degradación, ocasionado por la minería, puede en el corto plazo limitar el establecimiento natural de la cobertura vegetal debido a los impactos severos en la calidad del suelo (estructura y propiedades químicas; Borges et al., 2019; Rocha-Nicoleite et al., 2018).
Esta situación también ha permitido el incremento de la inmigración de otras regiones del Perú, de esta manera contribuye al incremento de la agricultura, la explotación forestal y los impactos socioambientales indirectos que derivan de ello, movimientos migratorios desordenados, conflictos sociales, riesgo a la salud pública por contaminación con mercurio (agua, suelo y aire), inseguridad alimentaria, explotación y trata de personas, delincuencia, drogadicción, aculturación, entre otros aspectos.
En Madre de Dios, la minería aurífera es responsable de la deforestación de aproximadamente 100,000 ha en el periodo 1984-2017 (Csillik y Asner, 2020), 53% de esta deforestación ocurrió desde 2011 (Caballero et al., 2018). El incremento de la deforestación debido a la actividad minera en Madre de Dios está relacionado con: 1) el incremento en el precio internacional del oro (Caballero et al., 2018; Swenson et al., 2011); 2) una elevada dependencia de la economía local en la minería; 3) mayor accesibilidad a otras áreas debido a la construcción de la carretera interoceánica (Moreno-Brush et al., 2016); 4) los mineros informales representan 51% del total de la actividad minera en Madre de Dios (Asner y Tupayachi, 2016), y 5) la migración humana de las regiones altoandinas del Perú en búsqueda de trabajo de subsistencia (Cortés-McPherson, 2019). A pesar de la elevada tasa de deforestación y altos niveles de degradación de los ecosistemas, después de la actividad minera, son escasos los intentos para recuperar su productividad. Actualmente, como experiencias de reforestación se tienen los estudios de Román-Dañobeytia et al. (2015), Huayllani-Enríquez (2016), Ancco-Mamani (2017) y Lefebvre et al. (2019).
El presente estudio es importante porque reporta el primer experimento de reforestación que tuvo éxito en recuperar la cobertura vegetal de las áreas más severamente degradadas por actividad minera aurífera en la Amazonía sur del Perú. El proyecto piloto de reforestación de áreas degradadas por la minería aurífera en el distrito de Huepetuhe (Madre de Dios, Perú) inició en 1999, con una inversión de 185,000 dólares para 20 ha (Bulnes et al., 2004). Fue una iniciativa del Ministerio de Energía y Minas peruano (MINEM) en convenio con la Universidad Agraria la Molina y la Agencia Brasileña de Cooperación (ABC).
El objetivo del presente estudio fue analizar la diversidad y composición florística en áreas reforestadas luego del abandono por minería aurífera en la Amazonía peruana, 20 años después del establecimiento.
Materiales y métodos
El presente estudio se desarrolló en el distrito de Huepetuhe (Madre de Dios), localizado en la Amazonía sur del Perú, entre las coordenadas geográficas 13º0’21.79” y 13º0’1601” S, 70º31’57.75” y 70º33’8.81” O (Fig. 1A, C). En el área de estudio, la minería aurífera ha sido causa de la deforestación de aproximadamente 15,000 ha, generando una fuerte fragmentación del paisaje (Fig. 1B). Debido a esta actividad esta zona presenta una fisiografía e hidrografía compleja debido a la extrema intervención antrópica (apéndice 1C). Estas áreas abandonadas por la minería aurífera en Huepetuhe tienen un intervalo altitudinal entre 380 a 500 m snm. Considerando el periodo 1980-2016, la temperatura media anual es 25.4 ºC, mientras que la precipitación anual es 2,120 mm. El área de estudio presenta una estación seca de junio a septiembre, cuando la precipitación es menor a 100 mm.
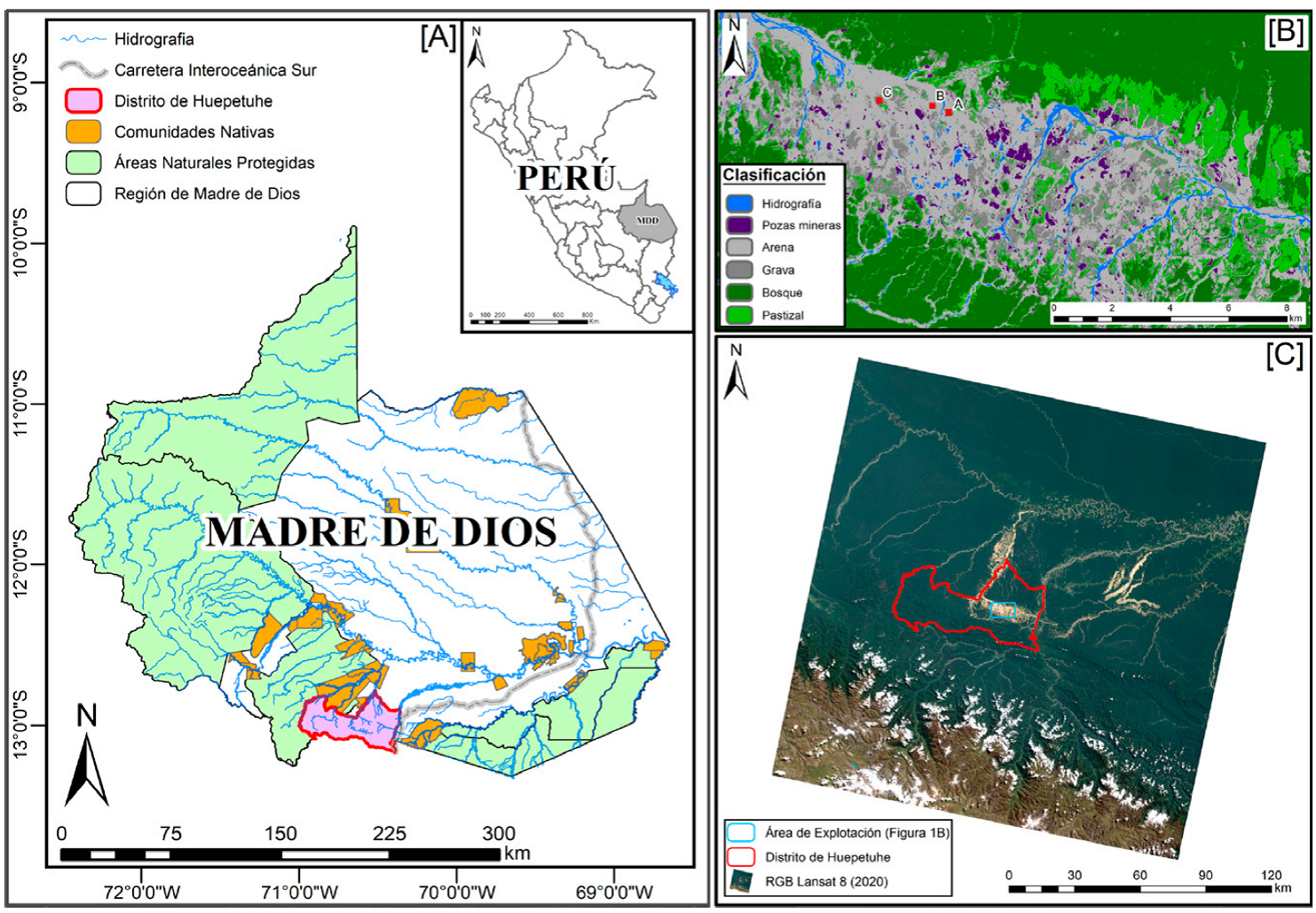
Figura 1 Ubicación del área de estudio, reforestación en áreas abandonadas por minería aurífera la Amazonía peruana. A) Ubicación del área de estudio en Madre de Dios y en el Perú; B) clasificación supervisada de imagen satelital Planet (3 m de resolución) de junio 2020 y ubicación del área reforestada en Huepetuhe. Se observa el paisaje fragmentado, bosque de referencia y los cuerpos de agua generados por la minería aurífera; C) imagen satelital Landsat 8 OLI (30 m de resolución) de junio 2020 del área de estudio y ubicación del distrito de Huepetuhe en Madre de Dios.
El proyecto de reforestación de áreas degradadas por la minería aurífera en 3 sitios del distrito de Huepetuhe se realizó en 1999 (sitio A) y 2002 (sitios B y C). Los criterios aplicados durante la plantación de 13.6 ha fueron: 1) nivelación del terreno utilizando maquinaria pesada, 2) hoyos de 30 cm × 30 cm, 3) se utilizaron 15 especies arbóreas de rápido crecimiento (en su mayoría leguminosas exóticas) y un cultivo de cobertura (Pueraria phaseoloides) (Tabla 1), 4) adición de suelo autóctono con abundante materia orgánica (colectado de bosques cercanos), y 5) adición de roca fosfórica (Bulnes et al., 2004). El criterio de selección de especies fue que tuvieran un carácter rustico y que se hayan utilizado previamente en otros estudios de reforestación de áreas degradadas en la Amazonia (Tabla 1).
Tabla 1 Especies utilizadas en la reforestación en Huepetuhe, obtenida a partir de Bulnes et al. (2004). † = Plantadas inicialmente y ‡ = especies en reposición.
| Especies | Zona 1 (1999) | Zona 2 (2002) | Zona 3 (2002) | |||
| Acaciella angustissima (Mill.) Britton et Rose | 140 | † ‡ | 1,088 | † ‡ | 5,390 | ‡ |
| Acacia holosericea Cunn. ex Don | 209 | † ‡ | 1,427 | † ‡ | 2,030 | ‡ |
| Acacia mangium Willd. | 108 | † | 957 | † | 1,008 | † |
| Mimosa caesalpiniifolia Benth. | 252 | † | 557 | † | ||
| Inga spectabilis (Vahl) Willd. | 361 | † | 1,005 | † | 1,620 | † |
| Croton sp. 1 | 118 | † | 161 | † | ||
| Senna reticulata (Willd.) H.S. Irwin et Barneby | 198 | † | 1,431 | † | ||
| Tachigali sp. 1 | 182 | † | 911 | † | ||
| Ochroma pyramidale (Cav. ex Lam.) Urb. | 122 | † | ||||
| Schizolobium amazonicum Ducke | 743 | † | 550 | |||
| Dalbergia monetaria L. f. | 575 | ‡ | 1,887 | ‡ | 407 | † ‡ |
| Gliricidia sepium (Jacq.) Kunth ex Walp. | 2,225 | ‡ | 424 | † | ||
| Leucaena leucocephala (Lam.) de Wit | 515 | ‡ | 600 | ‡ | ||
| Acacia horrida (L.) Willd. | 110 | ‡ | 20 | ‡ | 2,800 | ‡ |
| Tecoma stans (L.) Juss. ex Kunth | 100 | ‡ | ||||
| Pueraria phaseoloides (Roxb.) Benth. | 70 | ‡ | ||||
Entre 2002 y 2003 se realizó el monitoreo y reposición de especies en zonas donde hubo una elevada mortalidad de los individuos (Tabla 1). Para determinar el porcentaje de supervivencia se realizó una evaluación de 100% de los individuos plantados.
Para el presente estudio se realizaron evaluaciones del desarrollo florístico y estructural de la vegetación de estas áreas, luego de 10 (2009) y 20 años (2019), utilizando parcelas de 20 m × 20 m. En la evaluación del 2009, en el sitio A se establecieron 2 parcelas y en el sitio B una parcela. En la evaluación del 2019, en los sitios A y C se establecieron 3 parcelas, no se evaluó el sitio B debido a que fue deforestado. En cada una se evaluaron todos los individuos leñosos con un diámetro a la altura del pecho > 2.5 cm (DAP > 2.5 cm). Se realizaron recolectas botánicas para todas las especies para su posterior identificación y depósito en el Herbario Alwyn Gentry (HAG) de la Universidad Nacional Amazónica de Madre de Dios (UNAMAD). A todos los individuos inventariados se les midió el DAP utilizando una cinta diamétrica (283D/5M Forestry Suppliers) y se estimó su altura utilizando un clinómetro SUUNTO PM-5.
Para calcular la biomasa de las áreas reforestadas, se estimó la biomasa de la hojarasca mediante recolectas realizadas en campo y la biomasa de la vegetación sobre el suelo (AGB) se estimó mediante ecuaciones alométricas.
Para evaluar la hojarasca y detrito fino se utilizaron cuadrantes de 25 × 25 cm en las que se recogió toda la hojarasca, raíces, ramas de diámetro menor a 2 cm y materia descompuesta que se encontró, posteriormente se secaron en una estufa a 65 ºC hasta obtener peso constante (Castellanos-Barliza y León, 2011; Honorio y Baker, 2010). Se calculó la biomasa de los individuos con DAP ≥ 5cm utilizando la ecuación propuesta por Chave et al. (2014) (ecuación 1). Para estimar la biomasa de los individuos con DAP < 5 cm se utilizó la ecuación de Nelson et al. (1999) (ecuación 2), la cual es recomendada para individuos de menor DAP provenientes de bosques sucesionales (Nascimento y Laurance, 2002). La biomasa total se obtuvo de la sumatoria de la biomasa de hojarasca y la biomasa de la vegetación sobre el suelo (AGB1+ AGB2):
Donde DAP es el diámetro a la altura del pecho (cm), H es la altura (m) y (ρ) es la densidad de madera (g cm-3).
Para determinar y comparar la diversidad de especies entre los sitios evaluados se utilizaron los índices de Shannon (ln) y α-Fisher. Este análisis se realizó con el software PAleontological STatistics (PAST v. 4) y se realizó una representación en dimensión reducida de la composición florística mediante el análisis de coordenadas principales (PCoA), utilizando una matriz de distancia de Bray-Curtis. A los datos de abundancia se les aplicó la transformación raíz cuadrada, para evitar la influencia de las especies más abundantes (Kindt y Coe, 2005). En el PCoA se representó a las especies mediante un biplot utilizando la estandarización de Hellinger (Borcard et al., 2018). Los análisis se realizaron utilizando el paquete Vegan, disponible en R (Oksanen et al., 2019; R Core Team, 2019). Para analizar el síndrome de dispersión, todas las especies espontáneas registradas fueron clasificadas en 3 categorías de dispersión: zoocoria, anemocoria y autocoria.
Para diferenciar entre grupos se utilizó en función a la composición florística a través de un análisis de conglomerados jerárquicos mediante el algoritimo UPGMA (group average). Se utilizó la prueba SIMPROF (Similarity Profile) para evaluar la significancia estadística de los conglomerados generados. Además, se utilizó la prueba SIMPER (Similarity Percentage) para identificar a las especies que explicarían las diferencias entre los conglomerados diferenciados. Para evaluar la diferencia significativa en la composición florística entre los sitios A y C evaluados en 2019, se utilizó la prueba Permanova (Permutational multivariate analysis of variance). Los análisis se realizaron utilizando el paquete estadístico PRIMER 7 (Anderson et al., 2008).
Resultados
La supervivencia inicial de los individuos en la reforestación fue alta (> 70%), a excepción de Croton sp. 1 (Fig. 2). En el sitio A, la supervivencia promedio luego de 4 años (2003) fue de 71%, siendo Acacia holosericea (94%), Tachigali sp. 1 (86%), Senna reticulata (85%) y Ochroma pyramidale (85%) las que tuvieron los mayores porcentajes. Croton sp. 1 fue la especie con mejor porcentaje de supervivencia (Fig. 2A). En el sitio B, el porcentaje de supervivencia luego de 1 año (2003) fue de 88%. Los mayores porcentajes de supervivencia fueron para S. reticulata (95%), Acaciella angustissima e Inga spectabilis (93%) (Fig. 2B). En el sitio C, luego de 1 año de establecimiento, el porcentaje de supervivencia global fue de 92%. Las especies exóticas A. mangium, Gliricidia sepium y A. angustissima fueron las que presentaron los mayores porcentajes de supervivencia (Fig. 2C). El crecimiento inicial de estas especies fue muy variable, las exóticas presentaron un mayor crecimiento en altura (0.5 m año-1 a 1.4 m año-1) en comparación con las nativas (< 0.4 m año-1). Las especies exóticas tuvieron un mayor desarrollo vertical inicial, A. mangium (1.7 m, en promedio) y Tachigali sp. 1 (1.6 m), mientras que de las nativas lo tuvo O. pyramidale (1.4 m). Las especies con menor crecimiento vertical fueron I. spectabilis (< 0.7 m), A. angustissima (< 0.4 m) y M. caesalpiniifolia (< 0.4 m).
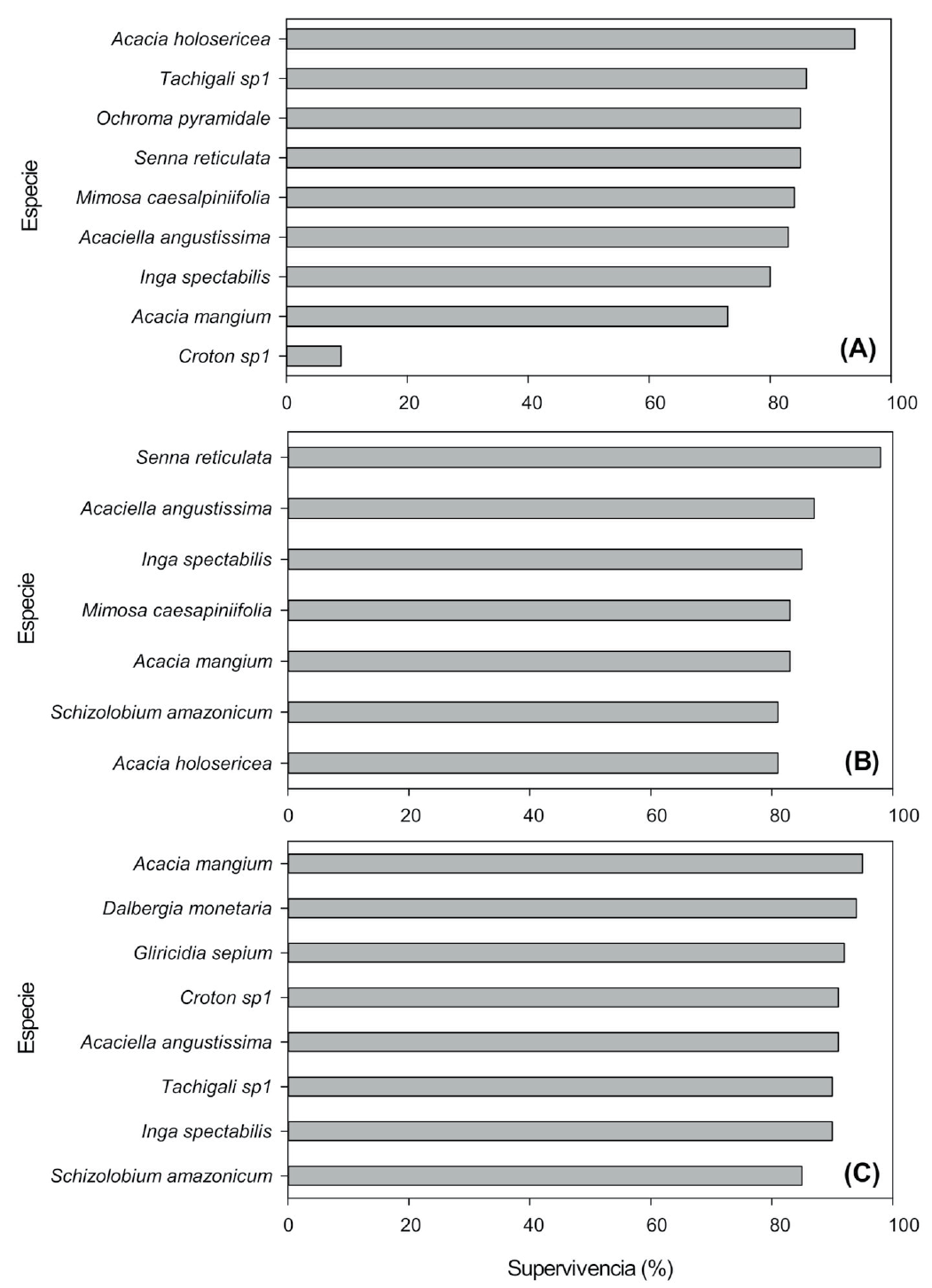
Figura 2 Porcentaje de supervivencia inicial de los individuos luego de la reforestación en áreas degradadas por minería aurífera en Huepetuhe, Madre de Dios Perú. Las letras diferencian a las zonas evaluadas (A, B y C), la supervivencia de los individuos corresponde a 4 años después de la plantación, mientras que en los sitios B y C, corresponde a 1 año luego de la plantación.
Sobre el desarrollo de la vegetación luego de 20 años, se registraron 25 especies arbóreas en los 2 periodos de evaluación (2009 y 2019). En 2009 se encontró un menor número se especies que en 2019, 13 y 20, respectivamente (Tabla 2). En 2009, la mayoría de las especies encontradas fueron las plantadas inicialmente (54%) en comparación con las espontáneas. Sin embargo, 20 años después de la plantación (2019) la mayoría de las especies (85%) fueron espontáneas, mientras que solo se encontraron 3 (15%) de las plantadas inicialmente (Tabla 2). La riqueza y diversidad de especies (Shannon y α-Fisher) fue superior en el sitio 2019-A (Tabla 3). Aunque, el sitio 2019-C presentó una mayor densidad de individuos que los otros sitios evaluados (Tabla 3).
Tabla 2 Especies registradas y síndrome de dispersión de las especies espontáneas en áreas abandonadas con aprovechamiento de minería aurífera en Madre de Dios (Perú), después de 20 años de reforestación. † = Plantadas inicialmente. Zoo = Zoocoria y Ane = anemocoria.
| Especie | Síndrome dispersión | Abundancia según sitio | ||||||||
| 2009 | 2009 | 2009 | 2019 | 2019 | 2019 | 2019 | 2019 | 2019 | ||
| A-1 | A-2 | B-1 | A-1 | A-2 | A-3 | C-1 | C-2 | C-3 | ||
| Acaciella angustissima (Mill.) Britton et Rose † | - | 2 | ||||||||
| Acacia mangium Willd. † | - | 1 | 4 | 1 | ||||||
| Alchornea triplinervia (Spreng.) Müll. Arg. | Zoo | 1 | 1 | 2 | ||||||
| Cecropia membranacea Trécul | Zoo | 1 | 1 | |||||||
| Cinchona micrantha Ruiz et Pav. | Ane | 2 | 3 | 1 | ||||||
| Clidemia capitellata (Bonpl.) D. Don | Zoo | 3 | 5 | 4 | 1 | |||||
| Clusia sp. 1 | Zoo | 1 | 16 | 8 | 2 | |||||
| Dalbergia monetaria L.f. † | - | 10 | ||||||||
| Graffenrieda limbata Triana | Zoo | 3 | 4 | |||||||
| Inga spectabilis (Vahl) Willd. † | - | 1 | ||||||||
| Jacaranda glabra (DC.) Bureau et K. Schum. | Ane | 2 | ||||||||
| Miconia poepigii Triana | Zoo | 7 | ||||||||
| Miconia sp. 1 | Zoo | 8 | 2 | 7 | 3 | 5 | ||||
| Miconia tomentosa (Rich.) D. Don ex DC. | Zoo | 2 | ||||||||
| Mimosa caesalpiniifolia Benth. † | - | 10 | 1 | 8 | ||||||
| Ochroma pyramidale (Cav. ex Lam.) Urb. | Ane | 5 | 2 | 4 | ||||||
| Piper aduncum L. | Zoo | 1 | ||||||||
| Piper sp. 1 | Zoo | 1 | ||||||||
| Senna reticulata (Willd.) H.S. Irwin et Barneby † | - | 5 | 1 | |||||||
| Tachigali sp. 1 † | - | 12 | 6 | 6 | 9 | 6 | 5 | |||
| Tibouchina sp. 1 | Ane | 2 | ||||||||
| Tococa guianensis Aubl. | Zoo | 10 | 56 | 8 | 12 | 5 | 1 | 39 | 17 | 33 |
| Tococa sp. 1 | Zoo | 6 | ||||||||
| Vismia baccifera (L.) Planch. et Triana | Zoo | 14 | 3 | 4 | 10 | 7 | 18 | 10 | 17 | |
| Vismia macrophylla Kunth | Zoo | 2 | 1 | |||||||
Tabla 3 Abundancia, riqueza y diversidad de especies arbóreas en las áreas de 20 años después de haber sido reforestadas. MDD = Valores de abundancia, riqueza y diversidad florística en arbórea en parcelas de 0.1 ha en Madre de Dios (Dueñas et al., 2019).
| Riqueza de especies/parcela | Riqueza de especies (por sitio) | Abundancia | Shannon | α-Fisher | ||
| 2009 | A-1 | 7 | 10 | 48 | 1.63 | 2.26 |
| 2009 | A-2 | 6 | 75 | 0.85 | 1.54 | |
| 2009 | B-1 | 6 | 6 | 28 | 1.61 | 2.34 |
| 2019 | A-1 | 9 | 15 | 53 | 1.93 | 3.11 |
| 2019 | A-2 | 10 | 50 | 2.11 | 3.76 | |
| 2019 | A-3 | 12 | 35 | 2.17 | 6.45 | |
| 2019 | C-1 | 7 | 11 | 76 | 1.39 | 1.88 |
| 2019 | C-2 | 7 | 45 | 1.61 | 2.32 | |
| 2019 | C-3 | 5 | 61 | 1.17 | 1.29 | |
| MDD (0.1 ha) | 82.7 ± 13 (61-125) | 215 ± 51 (129-323) | 3.9 ± 0.4 (2.4-4.5) | 53.3 ± 16 (24.5-90.8) | ||
Sobre la estructura de la vegetación luego de 20 años. La estructura horizontal en los bosques estudiados estuvo conformada por 9 clases diamétricas (Fig. 3A) y ésta mostró una distribución en jota invertida. De esta manera se encontró a la mayoría de los individuos en la categoría inferior de diámetro (< 10 cm), entre 81% y 90% de total de individuos registrados en cada sitio. Además, se observó una disminución drástica de individuos en las categorías superiores de diámetro (Fig. 3A). En el sitio A, la proporción de individuos en las categorías inferiores de diámetro (< 10 cm) disminuyeron significativamente (-30%) (Fig. 3A).
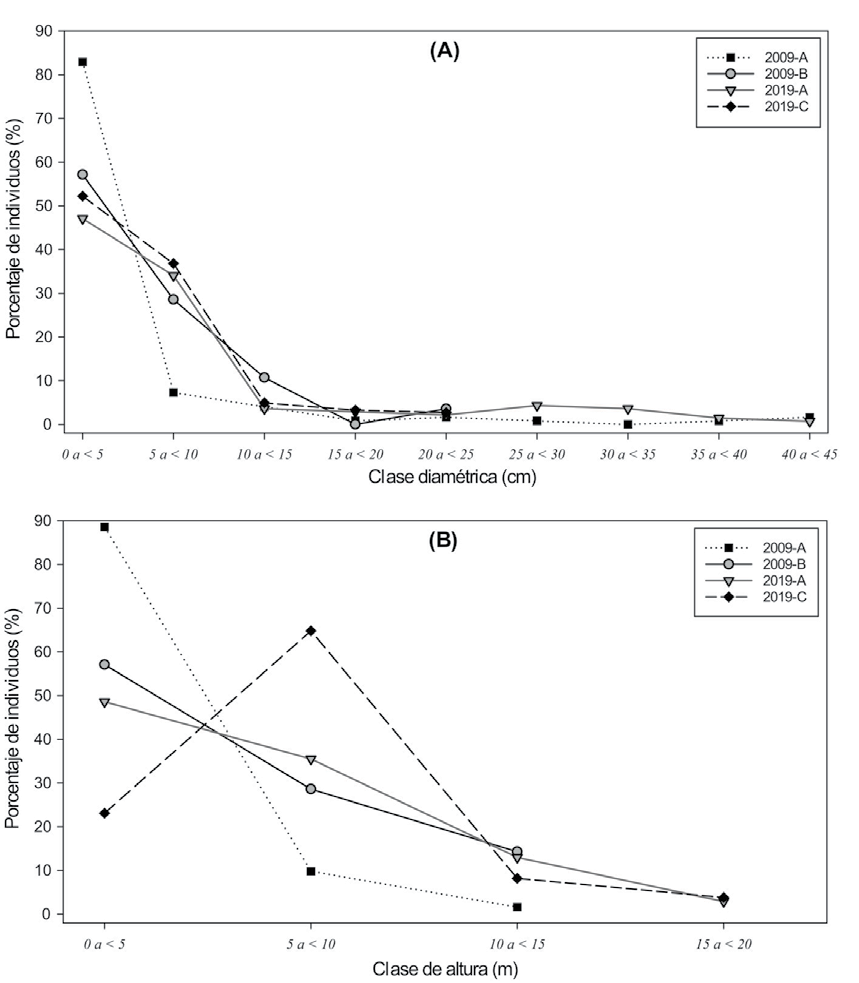
Figura 3 Estructura horizontal y vertical de la vegetación en sitios reforestados en áreas abandonadas por minería aurífera en la Amazonía peruana, evaluaciones después de 10 y 20 años. A = Clases diamétricas de 5 cm de rango; B = clases de altura de 5 m de rango.
La estructura vertical estuvo constituida por 4 clases de altura. Después de 10 años del establecimiento de la plantación la primera clase (0 a < 5 cm) representa a la mayoría de los individuos (entre 57% y 89%) (Fig. 3B). Veinte años después la proporción que representa esta clase disminuyó (< 50%), incluso en el sitio 2019-C el porcentaje de individuos fue superior en la segunda clase altimétrica (5 a < 10 cm). En el 2019 se encontraron individuos con una altura > 15 m (Fig. 3B) superior a los encontrados en el 2009 (todos los individuos < 15 m). Vismia baccifera, Tachigali sp. 1 y Miconia poepigii fueron las especies registradas con una altura > 15 m. Se encontró que el estrato arbóreo en el sitio 2019-A está aún dominado por Tachigali sp. 1 (exótica), pero algunas especies que se establecieron de forma espontánea (V. baccifera y Cinchona micrantha) están emergiendo y se encontraron en el estrato arbóreo. El sotobosque está dominado por especies oportunistas, principalmente de la familia Melastomataceae (Clidemia, Graffenrieda, Miconia, Tibouchina y Tococa) y otras como Cinchona, Jacaranda y Vismia, que se están estableciendo debido a que las condiciones ambientales se han favorecido. El estrato inferior es dominado por Tococa guianensis (Tabla 2).
La similitud florística dentro de los sitios fue superior luego de 20 años de la plantación, mayor a 0.5 del índice de Bray-Curtis entre los sitios 2019-A y 2019-C. A diferencia de la evaluación a los 10 años de plantación, en esta se encontró una baja similitud florística entre los sitios 2009-A y 2009-B (Fig. 4). La prueba SIMPROF en el dendrograma reveló la existencia de 2 conglomerados de sitios estadísticamente significativos (p < 0.001). El primero (en azul, Fig. 4) formado por 2 sitios de la evaluación de 2009; el segundo formado por los sitios evaluados en 2019 (en rojo Fig. 4). Las especies que generaron esta diferencia fueron M. caesalpiniifolia, Tachigali sp. 1, T.guianensis, V. baccifera y D. monetaria, que explicaron 53% de ella (apéndice 2). La diferencia entre los conglomerados también está relacionado a una mayor abundancia de las especies exóticas y abundancia mínima de especies espontáneas en el primer conglomerado (parcelas 2009-A 1 y 2009-B). Mientras que en el segundo conglomerado la presencia de las especies espontáneas es mayor y las especies exóticas plantadas inicialmente disminuyeron su abundancia (Tachigali sp. 1 y A.mangium) o desaparecieron (D. monetaria, M. caesalpinifolia y A. angustissima). La presencia de la parcela 2009 A-2 en el conglomerado de las parcelas de 2019 se debe a la presencia de C. micrantha y Tachigali sp. 1, las cuales solo se encontraron en esta parcela durante la evaluación de 2009.
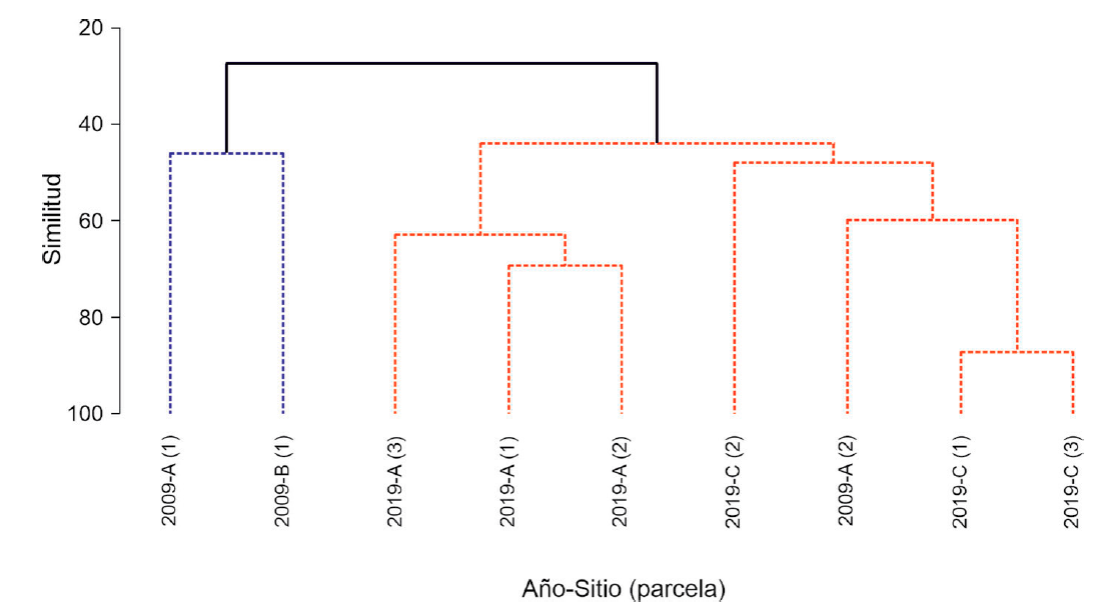
Figura 4 Análisis de conglomerado jerárquico (UPGMA) obtenido a partir de una matriz de similitud de Bray-Curtis entre los periodos evaluados (2009 y 2019) y sitios (A, B y C). Se muestran los sitios agrupados en 2 conglomerados con significación estadística (SIMPROF).
El PCoA mostró una representación en dimensión reducida (2-D) de la composición florística de los sitios evaluados y la afinidad y abundancia de las especies encontradas (Fig. 5). El PCoA muestra que a los 10 años después de la reforestación, las especies más frecuentes y abundantes corresponden con las plantadas (Fig. 5). Mientras que en la evaluación de 20 años, las más frecuentes fueron las que se establecieron de forma espontánea, a diferencia de Tachigali sp. 1 que se encuentra como especie dominante aun en el sitio A (Fig. 5). Asimismo, el resultado con PCoA muestra una ligera diferenciación en la composición florística entre los sitios A y C durante la evaluación de 2019, aunque la diferencia no fue significativa (Permanova, p = 0.10).
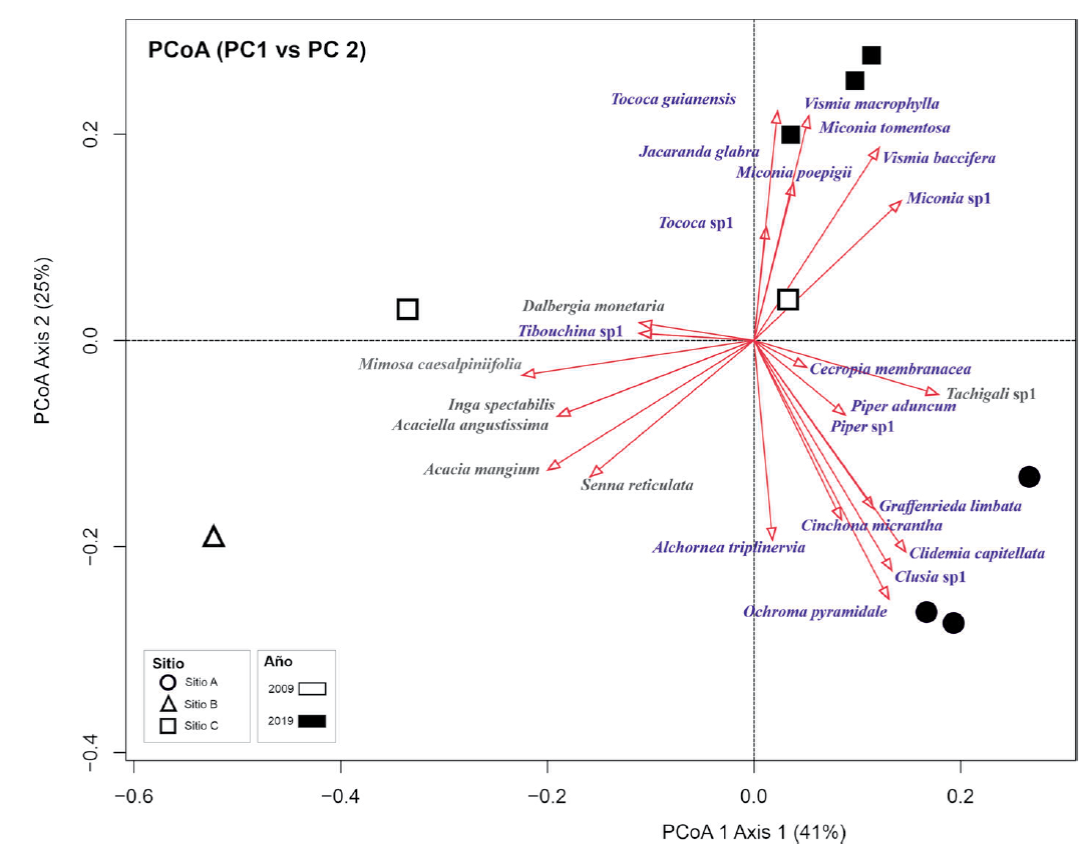
Figura 5 Diagrama del análisis de coordenadas principales (PCoA) indicando la similitud en la composición florística de los sitios reforestados en áreas abandonadas por minería aurífera en la Amazonía peruana. En gris se encuentran las especies plantadas inicialmente y en azul, las especies espontáneas o colonizadoras del área.
A los 20 años de la plantación se observó que en los sitios A y C, las especies espontáneas son las más abundantes, con excepción de la exótica plantada, Tachigali sp. 1 presente en el sitio A. En el sitio A, destacan M. poepigii y V. macrophylla dominando el estrato superior de estos bosques, mientras que T. guianensis y M. tomentosa dominan el sotobosque. En el sitio C, Tachigali sp. 1, C. micrantha y O. pyramidale están presentes en el estrato superior del bosque, mientras que Clidemia capitellata y Graffenrieda limbata dominan el sotobosque.
Se estimó que los sitios con 10 años de plantación almacenaron una biomasa en promedio de 20 Mg ha-1, siendo el sitio 2009-A el que almacenó más (27 Mg ha-1) (Fig. 6). Luego de 20 años de la plantación, los sitios 2019-A y 2019-C almacenaron en promedio 43 Mg ha-1de biomasa, presentando el sitio 2019-A el mayor almacenamiento (60 Mg ha-1) (Fig. 6).
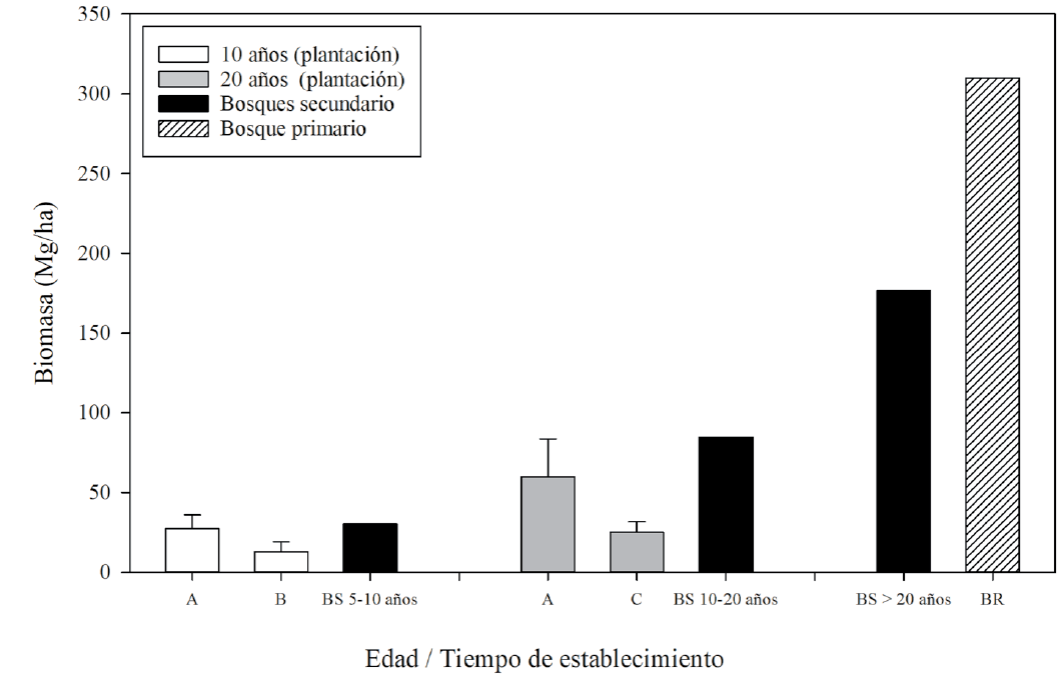
Figura 6 Acumulación de biomasa aérea en sitios reforestados en áreas abandonadas por minería aurífera en la Amazonía peruana y comparación con valores promedio de biomasa de bosques secundarios y primarios de Madre de Dios, Perú. Las barras blancas representan los sitios a los 10 años (2009) de plantación y las barras grises a los 20 años de plantación (2019). Los valores promedio de biomasa de los bosques secundarios y primarios se obtuvieron de Asner et al. (2014), Baker y Aguilar-Amuchastegui (2014) y Gutiérrez et al. (2014).
Discusión
El establecimiento inicial de leguminosas arbóreas de rápido crecimiento (A. magium y Tachigali sp. 1) favoreció la colonización de especies provenientes de bosques cercanos bajo sus propias copas (Tabla 2). Resultados similares fueron reportados por Ahirwal y Maiti (2018) en una evaluación de 16 años en áreas degradadas por minas de carbón en India. Las especies arbóreas plantadas inicialmente funcionarían como plantas nodrizas creando microclimas favorables, acelerando así la sucesión en las áreas estudiadas y contribuyendo a una mayor conectividad entre los bosques fragmentados (De La Peña-Domene et al., 2016). Asimismo, el recambio de hojas y el desarrollo radicular, produjo una mejora en las propiedades físico-químicas del suelo, formando agregados y reduciendo el nivel de compactación del suelo (Fig. 7). El espesor de hojarasca y raíces finas estuvo entre 3 y 7 cm, similar al bosque de referencia. Los mecanismos sugeridos para explicar la influencia de los árboles en la regeneración natural son: la modificación a microescala de las condiciones medioambientales y la influencia sobre agentes dispersores (Derroire et al., 2016), principalmente aves (alimento, nidificación, percha, etc.).

Figura 7 Fotografías de la hojarasca bajo las copas de los árboles en áreas reforestadas después de 20 años de que cesó la minería aurífera en la Amazonía peruana. A) Abundante hojarasca y regeneración natural de especies nativas; B) colchón de hojarasca y raíces a una profundidad entre 5 - 7 cm en la zona A y de 3.5 -6.3 cm en la zona C; C y D) se observan la formación de agregados en el suelo y las gravas producto de la explotación minera.
En la reforestación, el uso de leguminosas (Acacia, Inga y Tachigali) resistentes a las condiciones adversas en áreas degradadas fue un acierto debido a las ventajas que ofrecen ante la asociación con microorganismos (Franco y Campello, 2001). Así, estas plantas con la posibilidad de ser noduladas y micorrizadas pueden adquirir la capacidad de incorporar carbono y nitrógeno al suelo, una mayor capacidad de absorción de nutrientes y ser más tolerante al estrés ambiental (Franco y Campello, 2001).
Después de 10 años, la proporción de especies espontáneas colonizadoras corresponde a 16-60% del total, inferior al reportado por Parrotta et al. (1997) (entre 32 y 60%) en 10 años de una restauración en áreas degradadas por la minería de bauxita en la Amazonia brasileña. Esta diferencia estaría relacionada con las diferencias en la degradación del ecosistema entre la minería de bauxita y la aurífera, y con una densidad menor de plantación 2 × 2 m y uso del topsoil de 15 cm (Parrotta et al., 1997).
Después de 20 años, de las 16 especies utilizadas en la reforestación, solo se encontraron a A. magium y S. reticulata en bajas densidades y algunos individuos de Tachigali sp. 1 (> 5 individuos por parcela). Las especies nativas se establecieron espontáneamente, actualmente representan más de 80% de las especies arbóreo-arbustivas registradas y de éstas, la mayoría tiene dispersión por aves. La mayoría de estas especies presentan frutos en bayas y drupas de colores vistosos como evidencia del síndrome de dispersión para aves (Fig. 8), debido a que los frutos rojos y negros son consumidos más que otros colores en áreas restauradas en bosques tropicales (Gagetti et al., 2016). El análisis del síndrome de dispersión de las especies espontáneas evidenció una mayor contribución de la zoocoria (78%) en la dispersión de especies espontáneas del bosque de referencia, principalmente aves, en comparación con las dispersadas por el viento (22%; Tabla 2). Según Parrotta et al. (1997), las aves junto con los murciélagos contribuyen más en la dispersión de semillas en bosques fragmentados, como se evidencia por la mayoría de las especies encontradas que reforestan áreas abandonadas por la minería.

Figura 8 Especies en floración o fructificación encontradas en áreas reforestadas 20 años después de que cesó la minería aurífera en la Amazonía peruana. A) Vismia baccifera, B) Psychotria sp., C) Clidemia capitellata, D) Clusia sp., E) Miconia tomentosa y F) Tococa guianensis.
Se compararon los atributos florísticos encontrados en el presente estudio con el promedio para los bosques de Madre de Dios reportados por Dueñas et al. (2019). Encontramos que los valores de riqueza, abundancia y diversidad de especies arbóreas son inferiores a los valores promedio de Madre de Dios, representando 18%, 34% y 50%, respectivamente (Tabla 3). Las diferencias en la riqueza de especies entre los sitios A y C (Tabla 3) estaría relacionado con la proximidad al bosque de referencia, el sitio A (800 m) está más próximo al bosque de referencia que el sitio C (1,200 m). Estos resultados se ratifican con el PCoA (Fig. 5), en el cual se observó una diferenciación en la composición florística entre los 2 sitios, aunque ésta no fue significativa (Permanova, p = 0.10), ésto se debería a las especies en común que son abundantes en ambos sitios, por ejemplo C. capitellata, T. guianensis y V. baccifera. Estos resultados son consistentes con otros estudios sobre la influencia de la proximidad en la riqueza y diversidad de especies colonizadoras de áreas degradadas (Cubiña y Aide, 2001; Norman et al., 2006; Novianti et al., 2018; Parrotta et al., 1997). Es decir, la regeneración natural tiende a ser más lenta cuanto mayor es la distancia al bosque de referencia en combinación con una reducida dispersión causada por la fragmentación (Cubiña y Aide, 2001; Günter et al., 2007).
Las especies espontáneas de Alchornea, Inga, Miconia y Piper que se establecieron en el área reforestada, coinciden con el estudio de regeneración natural en una reforestación después de la explotación minera de bauxita en Minas Gerais (Brasil) (Miranda-Neto et al., 2014). Mientras que solo Jacaranda y Vismia concuerda con el estudio de Rodrigues et al. (2004) en la regeneración natural de un área degradada por minería aurífera en Mato Grosso (Brasil). La presencia de Vismia, luego de 20 años, coincide con los resultados de Fernandes-Neto et al. (2019) en la Amazonia brasileña, estos autores encontraron a especies de Vismia en pastizales luego de 20 años de abandono. Rodrigues et al. (2004) encontraron otras especies típicas de bosques secundarios en Madre de Dios, como Trema micrantha, Schizolobium amazonicum y Apeiba tibourbou que no se encontraron en el presente estudio.
La aclimatación es un factor crítico en la reforestación, por lo tanto, se debería realizar una buena selección de especies a utilizar y sería lógico seleccionar especies nativas de adaptabilidad comprobada en la región. Aunque se usan comúnmente especies exóticas debido a su confiabilidad basada en resultados previos (Ruiz, 2002). Sin embargo, en Madre de Dios, otros estudios utilizaron exitosamente especies nativas en la recuperación de áreas degradadas por minería aurífera. Román-Dañobeytia et al. (2015) utilizaron 2 especies pioneras (Apeiba membranacea y O. pyramidale) y 2 especies de sucesión intermedia (Ceiba pentandra y Erythrina ulei), estos autores encontraron una tasa de supervivencia superior a 70% y reportaron que estas especies tuvieron un lento crecimiento durante el primer año (0.2-4 cm de altura). Lefebvre et al. (2019) utilizaron 2 especies nativas no pioneras, Terminalia amazonia y Guazuma crinita, y encontraron una tasa de supervivencia entre 68 y 75%. Las tasas de crecimiento reportadas por Lefebvre et al. (2019) son superiores (> 1 cm mes-1) a los de Román-Dañobeytia et al. (2015), estas diferencias estarían relacionadas con el biocarbón utilizando por Lefebvre et al. (2019) debido a sus efectos positivos en el crecimiento.
La estructura de la vegetación, luego de 20 años del establecimiento de la reforestación, presentó un patrón de tipo jota invertida, típico de los bosques naturales tropicales y que sugiere un buen potencial de reclutamiento de la regeneración natural en estas áreas luego del abandono (Astudillo-Sánchez et al., 2019; Mensah et al., 2020). Las especies espontáneas están dominando el estrato arbóreo en el sitio 2019-C M. poepigii (> 15 m altura) y en el sitio A Tachigali sp. 1 (< 15 m), además de otras especies como C. micrantha, Jacaranda glabra, Alchornea triplinervia y V. macrophylla. Mientras que a menor densidad, se encontraron individuos plantados inicialmente (Fig. 3; Tabla 2). El estrato medio e inferior de las clases de altura está dominado por especies típicas de sucesión temprana en este tipo de comunidades vegetales, como V. baccifera y T. guianensis. La drástica disminución en la proporción de individuos en las categorías inferiores de diámetro se debería a una alta mortalidad de las especies introducidas (D. monetaria, M. caesalpinifolia, D. monetaria y A. mangium), a que Tachigali sp. 1 cambió de categoría hacia las categorías superiores de diámetro (> 15 cm), y finalmente, a una mayor diversidad de especies y menor dominancia de T. guianensis en este estrato. Por lo tanto, los resultados sugieren que Tachigali sp. 1 funcionaría como una buena nodriza para acelerar el proceso de recuperación del bosque.
En promedio, los bosques tropicales primarios albergan entre 200 y 400 Mg ha -1 de biomasa y en Madre de Dios, entre 230 y 310 Mg ha-1(Asner et al., 2014; del Valle et al., 2011; Gutiérrez et al., 2014). Los sitios reforestados luego de 10 años tienen entre 10-57% menos biomasa que los bosques secundarios de edad similar (AIDER, 2012; Fig. 6). La reforestación de 20 años almacenó entre 30-69% menos biomasa que los bosques secundarios de edad similar (AIDER, 2012). Sin embargo, la capacidad de recuperación de la funcionalidad y de los servicios ecosistémicos después de los impactos severos ocasionados por la minería, debería ser considerada para futuros proyectos de reforestación. Esto es importante considerando que en Madre de Dios, en 2 años (2017-2018), la actividad minera ha sido responsable de la deforestación de más de 23,000 ha y de emisiones de 1.12 Tg C (Csillik y Asner, 2020).
El monitoreo a mediano y largo plazo permitirá demostrar cambios en el ecosistema, si ha cambiado en la dirección esperada hacia un estado ideal o de referencia y qué tan cerca está de ese estado (Aguilar-Garavito y Ramírez, 2015; Ferraro y Pattanayak, 2006). Es importante utilizar parámetros estructurales y florísticos como indicadores de una restauración exitosa en el monitoreo (Londe y de Sousa, 2017). Suganuma y Durigan (2015) sugieren que los mejores indicadores para monitorear las comunidades que han sido restauradas son: área basal, densidad de latizales, riqueza del sotobosque y la cobertura de dosel. Por lo tanto, las actividades de siembra son tan importantes como el monitoreo, debido a que incrementan la probabilidad de éxito en la reforestación (Aguilar-Garavito y Ramírez, 2015).











 nueva página del texto (beta)
nueva página del texto (beta)



