Introducción
Los moluscos bivalvos son uno de los principales recursos pesqueros en México con alto valor comercial. Sin embargo, la sobreexplotación de algunas especies ha originado que los bancos naturales disminuyan considerablemente sus poblaciones (Casas-Valdez et al., 1996; Garzón-Favela, 2011; Ramírez-Castillo, 2003). Este es el caso de la almeja Nodipecten subnodosus (mano de león) en la laguna Ojo de Liebre, Baja California Sur, cuyas poblaciones se han visto drásticamente mermadas, de tal manera que, en la actualidad, su recolección solo es autorizada por medio de un permiso de fomento y de cuota para la extracción del recurso, otorgado por la Comisión Nacional de Acuacultura y Pesca, Conapesca (Inapesca, 2012). La explotación de la almeja mano de león en la laguna Ojo de Liebre es relativamente reciente, ya que a partir de 1995 se implementó su captura para substituir a la almeja catarina (Argopecten ventricosus), cuya sobreexplotación produjo su colapso a fines de la década de 1980. A pesar de que la almeja mano de león puede alcanzar los 20 cm de largo, la talla mínima de captura es de 14 cm, y su extracción se incrementó gradualmente, de 5 toneladas en 1995 hasta su captura récord de 320 toneladas en 2009 (Garzón-Favela, 2011; Inapesca, 2012). Sin embargo, 2010 fue el último año de buena producción capturándose 280 toneladas, ya que en el año siguiente se presentó una elevada mortandad que colapsó su pesquería, al capturarse solo 80 toneladas (Crespo-Guerrero y Jiménez-Pelcastre, 2016).
A pesar de que hasta el momento no se conoce con certeza el motivo que produjo el colapso de esta pesquería, las causas de la reducción de estas poblaciones podrían ser atribuidas no solo a su explotación comercial sino también a diversos factores como el cambio climático, la influencia de ciertas variables ambientales, o a enfermedades provocadas por organismos perforadores patógenos (Carver et al., 2010; Duckworth y Peterson, 2013). En términos generales, los pectínidos son poco tolerantes a los cambios repentinos de temperatura, salinidad y oxígeno disuelto, que pueden alterar sus procesos de alimentación, excreción, crecimiento y reproducción (González-Estrada, 2003; Uriarte et al., 2001). A su vez, el efecto de estos factores está directamente relacionado con la edad, talla, estado reproductivo, nivel de actividad y condición fisiológica del organismo, siendo la temperatura uno de los factores más importantes que regulan el crecimiento de los moluscos. En particular, bajo condiciones de laboratorio, Nodipecten subnodosus puede tolerar un intervalo de temperatura de aclimatación entre 15 y 22 °C; sin embargo, a 26 y 30 °C se ha registrado hasta 27 y 91% de mortalidad, respectivamente (González-Estrada, 2003). Al parecer, la almeja mano de león presenta una tolerancia a temperaturas menos cálidas, debido a que es una especie que ocurre en la zona submareal (usualmente a menos de 5 m), bajo la acción moderada del oleaje y sin estar expuesta al aire ni a una intensa radiación solar (González-Estrada, 2003). Precisamente, las costas occidentales de Baja California están bajo la influencia de las aguas templadas (13-20 °C) de la corriente de California, con salinidades de 33.3-34.5 ups y concentraciones de oxígeno disuelto usualmente superiores a 4 mg/L, cercanos al nivel de saturación, aunque se desconoce el efecto de estas variables ambientales en el crecimiento y desarrollo de la almeja mano de león (Freites et al., 2011).
Por otra parte, la infestación producida por las esponjas perforadoras, particularmente las pertenecientes a la familia Clionaidae, también puede constituir un serio problema para estos bivalvos, tanto en el medio natural como en las actividades de acuicultura (Alagarswami y Chellam, 1976; Carver et al., 2010; Fromont et al., 2005; Rosell et al., 1999). Los miembros de esta familia de esponjas desempeñan un papel importante en la bioerosión de los sustratos calcáreos marinos. Su impacto ha sido documentado principalmente en arrecifes coralinos, aunque tienen la habilidad de alterar otros substratos de carbonato de calcio, como las conchas de moluscos, al construir galerías conectadas por túneles o cavidades (Calcinai et al., 2004; Díaz y Rützler, 2011; Hoeksema, 1983; Rützler, 1975). Las cliónidas afectan a las conchas, haciéndolas frágiles y quebradizas, produciendo un olor desagradable por su descomposición, hasta provocar la muerte del molusco (Pomponi, 1980; Rützler y Rieger, 1973; Warburton, 1958a). Esto origina una disminución significativa del valor comercial de los moluscos debido a la alteración de la calidad de la concha (Guida, 1976), como ha sido documentado en pectínidos (Evans, 1969; Uribe et al., 2001) y, específicamente, en Nodipecten subnodosus (Cáceres-Martínez, 2011), ostras perleras (Fromont et al., 2005), abulones (Haliotis tuberculata) (Clavier, 1992) y ostiones como Ostrea edulis (Rosell et al., 1999), Crassostrea gigas (Snowden, 2007) y Crassostrea virginica (Guida, 1976).
El proceso de bioerosión de las esponjas incluye una fase química y una mecánica, en la primera se involucran células especializadas (arqueocitos) que secretan anhídrido carbónico y fosfatasa, permitiendo a las células extraer partículas de carbonato de calcio y disolver una parte significativa de carbonato durante el proceso. Posteriormente, la remoción de los fragmentos desprendidos del sustrato principal propicia alteraciones mecánicas, durante las cuales los restos del material calcáreo son transportados por el sistema acuífero de la esponja y posteriormente expelidos al exterior a través de sus papilas excurrentes (Pomponi, 1980; Rützler y Rieger, 1973). Particularmente, al perforar la región donde se sujeta el músculo abductor, también disminuye la efectividad del mecanismo de cierre de la concha, aumentando la posibilidad de que el bivalvo sea depredado (Guida, 1976; Pomponi y Meritt, 1990; Thomas, 1979). El resultado final de la bioerosión es la formación de un complejo sistema de galerías y cámaras interconectadas dentro del sustrato calcáreo, donde habita la esponja (Cáceres-Martínez, 2011). El contacto con el ambiente externo se mantiene a través de las papilas inhalantes y exhalantes que se extienden desde las cavidades internas hasta la superficie del sustrato (Rützler y Rieger, 1973).
Numerosos estudios han examinado la infestación de cliónidos en conchas de la ostra perlera Pinctada fucata (Alagarswami y Chellam, 1976), del ostión Crassostrea virginica (Carver et al., 2010), de las ostras Pinctada maxima (Daume et al., 2010) y Saccostrea commercialis (Wesche et al., 1997) y de la almeja Nodipecten subnodosus (Hoeksema, 1983; Warburton, 1958b). Aunque, en términos generales, hay poca información sobre su impacto en la condición de los moluscos y sus procesos de crecimiento (Rosell et al., 1999; Schleyer, 1991). En las regiones templadas de EUA, Cliona celata es la esponja perforadora que ha causado daños considerables a las poblaciones de Crassostrea virginica provocando elevadas pérdidas económicas. Si bien esta esponja perforadora podría causar una mayor mortalidad en los ostiones más grandes y longevos, la mayor pérdida económica se debe a la reducción del valor comercial de los bivalvos debido a la fragilidad de sus conchas (Rosell et al., 1999; Thomas, 1979; Warburton, 1958c). En particular, la relación de la esponja perforadora con el crecimiento y la condición de las conchas no ha sido suficientemente documentada, aunque se ha observado que el incremento de la infestación producida por la esponja perforadora en ostras silvestres de la bahía Saint Simón, New Brunswick, Canadá, podría estar relacionado con las variaciones estacionales de la salinidad (Carver et al., 2010).
A pesar de que la forma en que las esponjas afectan a la almeja mano de león (Nodipecten subnodosus), como el ataque a la charnela (que afecta su capacidad para abrirse o cerrarse), o al sitio de inserción del músculo abductor (que altera el proceso de cierre de las valvas), ha sido previamente documentada (Hoeksema, 1983; Warburton, 1958b), la relación entre la presencia de la esponja Cliona californica y el desarrollo del bivalvo aún no es bien conocida. En este sentido, el objetivo del presente estudio fue examinar las variaciones espaciales y temporales del porcentaje de almejas mano de león (Nodipecten subnodosus) infestadas por la esponja Cliona californica en la laguna Ojo de Liebre, oeste de la Península de Baja California, evaluando la presencia de esta esponja perforadora y su relación con el largo de las almejas provenientes de poblaciones silvestres de 4 bancos almejeros dentro de la laguna.
Materiales y métodos
La laguna Ojo de Liebre (27°55’N - 27°35’ N, 114°20’ 113°50’ O) se localiza dentro de la Bahía Sebastián Vizcaíno, en la porción centro-occidental de la península de Baja California (Fig. 1) y es parte de la Reserva de la Biosfera El Vizcaíno, catalogada como Patrimonio de la Humanidad por la UNESCO. Tiene una superficie de 366 km2 con 5 a 12 m de profundidad y, presenta un complejo sistema de canales ramificados que están separados por grandes áreas de “bajos” donde abundan los pastos marinos (Reinecke-Reyes, 1996). En general, el sedimento es de fino a muy fino, con arenas en los canales y limos y arcillas en el interior de la laguna (Phleger y Ewing, 1962).
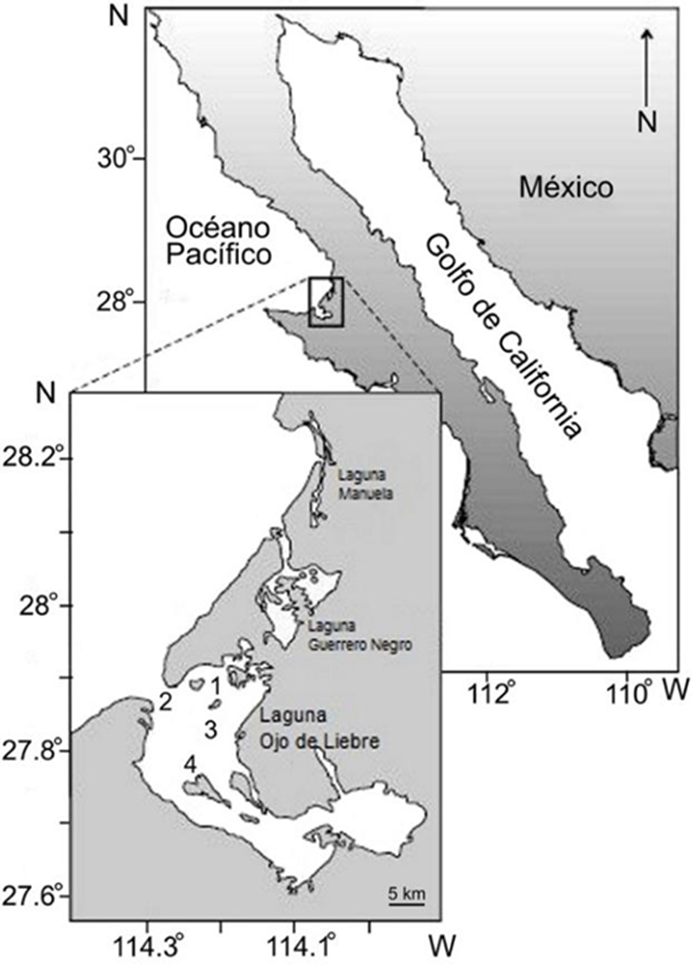
Figura 1 Área de estudio y ubicación de los bancos almejeros en la laguna Ojo de Liebre, Baja California Sur: 1 = Zacatoso; 2 = Chocolatero; 3 = La Concha; 4 = El Dátil.
El clima es de tipo desértico, seco y árido, con una precipitación anual de 180 mm, ocasionada principalmente por lluvias asociadas con tormentas tropicales de verano y otoño. La evaporación anual es de 215 mm, que excede la precipitación anual. La temperatura varía entre 16 y 24 °C y se presentan marcados gradientes hipersalinos, con hasta 47 ups en la parte interna de la laguna (Contreras, 1985). En el margen oriental de esta laguna existen estanques de evaporación para la recolección de sal, algunas salinas grandes y, otras barreras y canales construidos para inundar de salmuera zonas poco profundas.
Con la autorización y apoyo de la Dirección de la Reserva de la Biosfera El Vizcaíno, Conanp-Semarnat (RBV/430/2015), la recolección de las almejas se llevó a cabo en 4 bancos de la laguna Ojo de Liebre: Chocolatero, Zacatoso, El Dátil y La Concha (Fig. 1). Estos bancos almejeros se ubican en diferentes zonas de la laguna y son las localidades donde se ha detectado la presencia de un mayor número de ejemplares. Además, son sitios en los que, hasta hace algunos años, las cooperativas pesqueras explotaban la almeja mano de león con fines comerciales. De acuerdo con las condiciones climáticas, la logística del muestreo y la disponibilidad del personal de apoyo por parte de la Cooperativa Pesquera BIOSFERA 2000 para las actividades de buceo y la extracción de las almejas, se realizaron 11 muestreos, en enero, noviembre y diciembre de 2013, en mayo y agosto de 2014, y en marzo, abril, mayo, julio, agosto y octubre de 2015.
La recolección de las almejas se llevó a cabo por medio de buceo autónomo; alrededor de 25 almejas vivas por banco almejero y en cada uno de los meses de muestreo se recolectaron aleatoriamente a lo largo de transectos lineales en el fondo de la laguna. Las almejas fueron colocadas en bolsas de plástico con agua de mar, añadiendo una solución relajante de sulfato de magnesio (sales de epsom) para su transporte (Knudsen, 1972). En el laboratorio, las almejas fueron lavadas con agua dulce para remover la esponja epibionte, evaluando la presencia/ ausencia de la esponja perforadora Cliona californiana en cada almeja; el nivel de infestación fue estimado como el porcentaje de las almejas que fueron colonizadas por la esponja en cada uno de los bancos y en cada uno de los 11 muestreos realizados. La identificación de la esponja fue realizada con el apoyo de la literatura especializada (Fig. 2a, b; Carballo et al., 2004; Laubenfels, 1932; Pacheco et al., 2018). La longitud del largo de las almejas fue medida con un vernier (± 0.1 cm) y fue determinada como la distancia entre el extremo anterior y posterior de las valvas de cada almeja (Osuna-García, 2004).
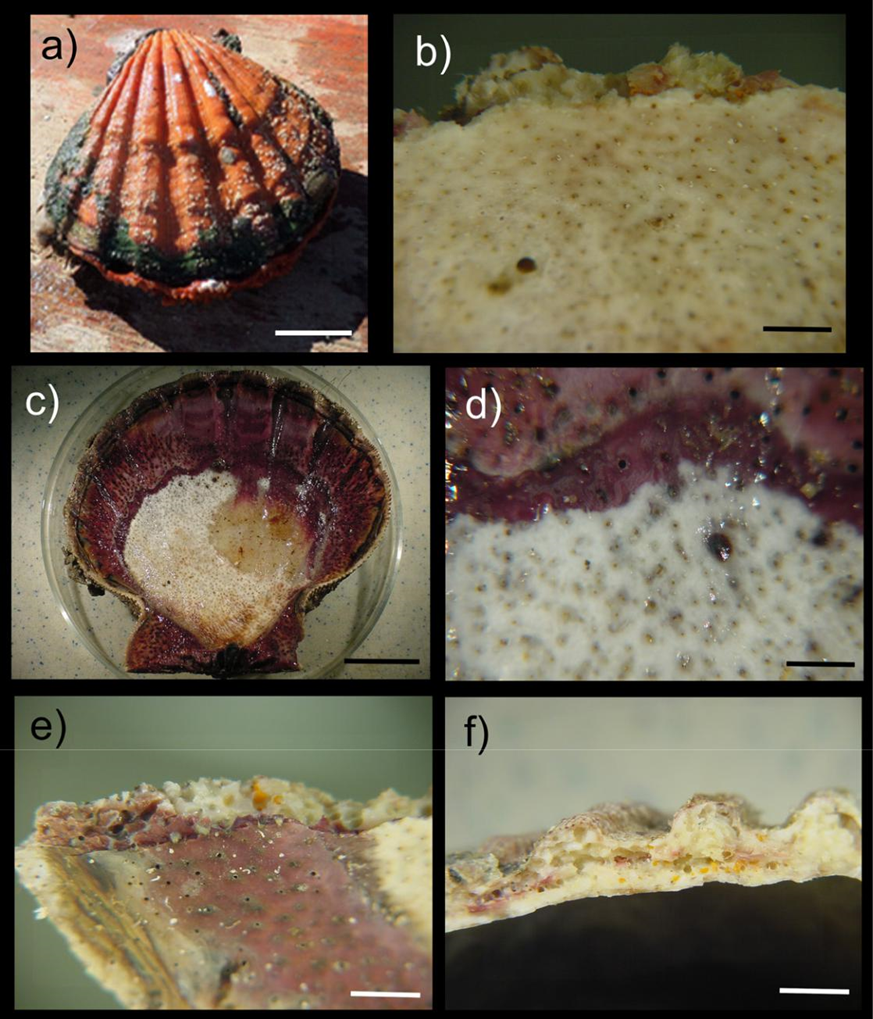
Figura 2 a) Cara externa de la almeja Nodipecten subnodosus colonizada por la esponja Cliona californiana; b) perforaciones producidas por la esponja; c) y d) cara interna de la concha, las pequeñas manchas oscuras son resultado de la perforación de la esponja y la coloración es debida a la cubierta quitinosa que secreta la almeja para sellar la perforación; e) y f) galerías producidas por la esponja en la concha. Escala: a), c) 3 cm; b) 5 mm; d) 3 mm; e) 2 mm; f) 3.5 mm.
Con la información correspondiente al largo de cada una de las almejas recolectadas en cada banco y en cada mes de muestreo, se calculó la media y la desviación estándar de los datos. Se construyeron las matrices correspondientes para cada banco almejero a lo largo de los 11 muestreos realizados, incluyendo los datos asociados con el largo de las almejas y la presencia/ausencia de la esponja perforadora en las almejas examinadas. Las variaciones en el promedio del largo de las almejas durante los meses de muestreo, en cada uno de los bancos almejeros, fueron analizadas por medio de regresiones lineales simples. La estimación del modelo de regresión lineal simple fue realizada por medio del método de mínimos cuadrados, el contraste de la regresión probando la hipótesis nula de que la pendiente de la recta es cero, es decir, no hay dependencia lineal entre las variables, fue realizado por medio de un análisis de varianza (Anova), donde el estadístico F de Fisher permite estimar dicho contraste; el valor de significancia del modelo de regresión lineal fue incluido en los resultados correspondientes. Se analizaron los valores residuales que indican las diferencias entre los valores observados y los explicados por el modelo para evaluar la independencia por medio del método Durbin-Watson, la homocedasticidad por medio de diagramas de dispersión de las estimaciones estandarizadas y los residuos estandarizados, y la normalidad por medio del método de Kolmogorv-Smirnov (Freund y Walpole, 1990; Marqués de Cantú, 1991). Estos análisis fueron realizados con los programas Microsoft Excel 2016 y Statistica v.8.0.
Debido a la amplia variabilidad observada en los niveles de infestación a lo largo del periodo estudiado, se realizó un análisis de escalamiento multidimensional no métrico (nmMDS) basado en distancias euclidianas, para representar las relaciones entre los bancos almejeros, incluyendo para cada banco el porcentaje de infestación registrado en cada uno de los 11 meses de muestreo (Clarke et al., 2014). El nmMDS fue generado con el programa PRIMER v. 7 (Clarke y Gorley, 2015).
Las variaciones y diferencias en el número total de almejas y el porcentaje de almejas infestadas a lo largo de los meses muestreados, entre cada uno de los bancos, fueron examinadas por medio de gráficos, mientras que la relación entre el promedio del largo de las almejas por mes de muestreo y sus porcentajes de infestación, en cada uno de los bancos, fueron analizadas por medio de regresiones lineales (Freund y Walpole, 1990; Marqués de Cantú, 1991).
Resultados
En total, se recolectaron y examinaron 1,082 almejas en los 4 bancos almejeros. En términos generales, en los bancos Chocolatero (8 ± 1.6 cm; n = 238) y Zacatoso (9.4 ± 1.6 cm; n = 283) se recolectaron las almejas más pequeñas, pero sus longitudes registraron una mayor variación. Por el contrario, en La Concha (10.2 ± 1.2 cm; n = 294) y El Dátil (11.7 ± 1.1 cm; n = 267) el largo de las almejas fue mayor y su desviación estándar se redujo.
Las variaciones en el promedio del largo de las almejas durante los meses de muestreo mostraron que, en todos los bancos almejeros, las longitudes de las almejas disminuyeron gradualmente a lo largo del tiempo (Fig. 3). Sin embargo, esta reducción temporal en el largo promedio de las almejas fue distinta en los bancos Chocolatero y Zacatoso, donde el largo de las almejas fue menor y sus intervalos de variación fueron los más amplios del estudio, 6.8-12 cm y 7.6-12.2 cm, respectivamente. En contraste, las almejas con mayor longitud fueron recolectadas en La Concha (8.3-11.8 cm) y El Dátil (9-13.2 cm) y presentaron un menor intervalo de variación a lo largo del tiempo.
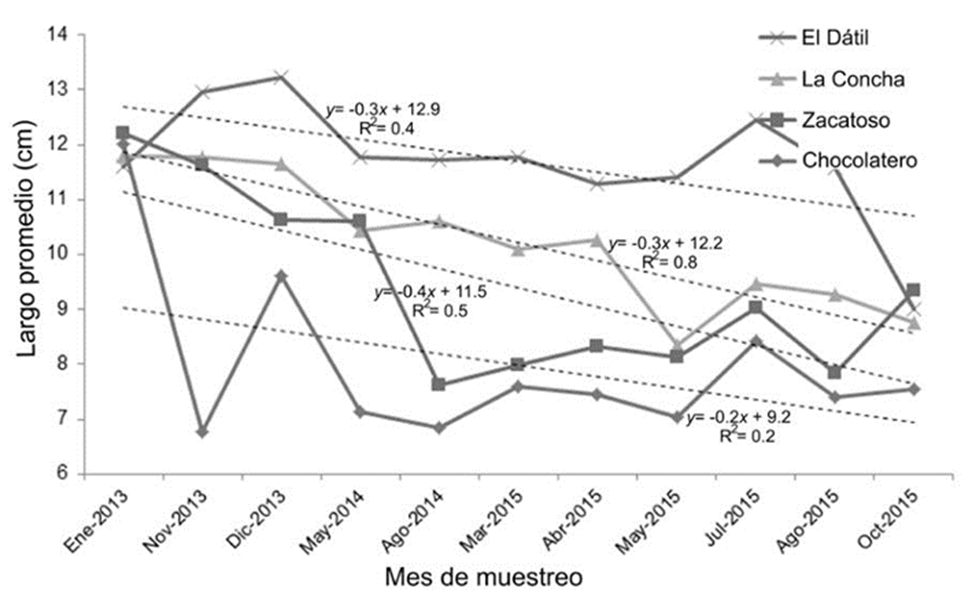
Figura 3 Variación del largo promedio de las almejas en el tiempo por cada banco almejero. Se incluyen las líneas de regresión por banco y las ecuaciones correspondientes.
A pesar de esta reducción general en el largo promedio de las almejas con el tiempo, los bancos registraron variaciones muy irregulares: en La Concha (y = -0.3x + 12.2; R2 = 0.8; p < 0.01) y Zacatoso (y = -0.4x + 11.5; R2 = 0.5; p = 0.02) la disminución del largo de las almejas durante el periodo de muestreo siguió una tendencia lineal. En cambio, y a pesar de las claras diferencias en el largo promedio de sus almejas, en Chocolatero (y = -0.2x + 9.2; R2 = 0.2; p = 0.17) y El Dátil (y = -0.3x + 12.9; R2 = 0.4; p = 0.06), sus variaciones fueron muy amplias y sus cambios a lo largo del tiempo no se ajustaron a un modelo lineal (Fig. 3). En general, las almejas con mayor longitud se recolectaron en todos los bancos durante el primer mes de muestreo (enero 2013), mientras que en el último mes estudiado (octubre 2015) el largo de las almejas fue menor (Fig. 3).
Alrededor de la mitad de las almejas recolectadas en cada uno de los bancos durante el periodo de estudio, estuvieron colonizadas por esponjas (45.7-60.1%). Las diferencias entre los 4 bancos almejeros, de acuerdo con el porcentaje de infestación que presentaron a lo largo de los meses de muestreo, fueron analizadas por medio del escalamiento multidimensional (nmMDS). La representación gráfica de este análisis mostró que El Dátil y La Concha se ubicaron en la parte superior izquierda, cercanos espacialmente entre sí (Fig. 4), debido a que presentaron en promedio porcentajes de infestación de 60.1%/mes y 54.8%/mes, respectivamente y, como se indicó previamente, en estos bancos se recolectaron las almejas de mayor longitud (x = 10.2 cm de largo y 11.71 cm de largo, respectivamente). Por el contrario, Chocolatero y Zacatoso quedaron ampliamente separados en el gráfico, tanto entre ellos como con los otros bancos, y aunque en Zacatoso se registró una ligera reducción en sus niveles de infestación (45.7%/mes), sus diferencias estuvieron básicamente relacionadas con la amplia variación de sus porcentajes de infestación a lo largo de los meses de muestreo, entre 0% y 100%/mes en Chocolatero y, entre 16.13% y 80.65%/mes en Zacatoso. En estos 2 últimos bancos, además, se recolectaron las almejas con menor longitud (x = 7.8 cm de largo y 9.4 cm de largo, respectivamente) (Fig. 4).
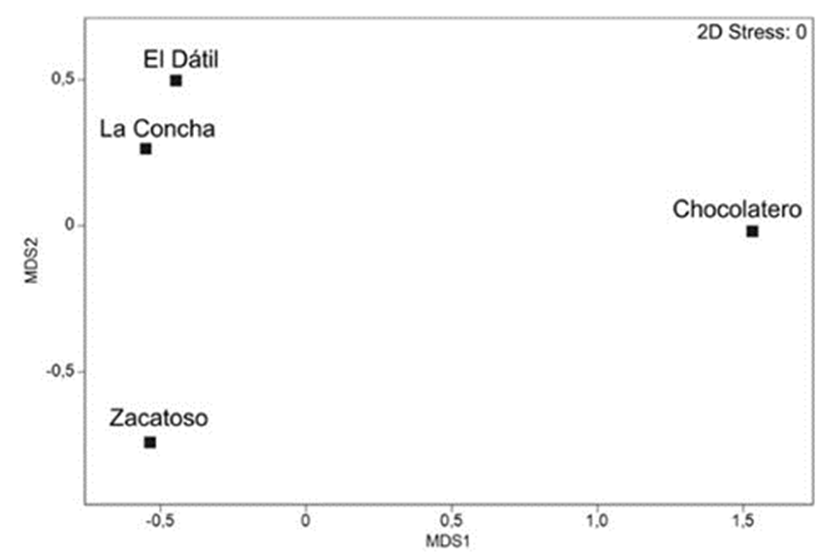
Figura 4 Escalamiento multidimensional no métrico (nmMDS), representando la relación entre los 4 bancos almejeros, de acuerdo con el porcentaje de infestación que en promedio presentaron durante los meses de muestreo.
En particular, Chocolatero registró un patrón en sus porcentajes de infestación distinto al resto de los bancos almejeros, debido a que presentó la mayor variabilidad (0-100%) y a que, en la mitad de los meses de muestreo, al menos el 60% de las almejas estuvieron infestadas. El incremento en los niveles de infestación se presentó, sobre todo, al inicio del estudio (enero 2013) y en marzo 2015, ya que 85% y 100% de las almejas estuvieron colonizadas por esponjas (Fig. 5a). A pesar de esta variabilidad, fue a partir de marzo 2015 y hasta el final del estudio que el número de almejas infestadas se incrementó, alcanzando aproximadamente 75% cada mes. Por el contrario, en los primeros muestreos, noviembre y diciembre de 2013 y en agosto 2014, los niveles de infestación fueron menores (< 6% infestación) (Fig. 5a).
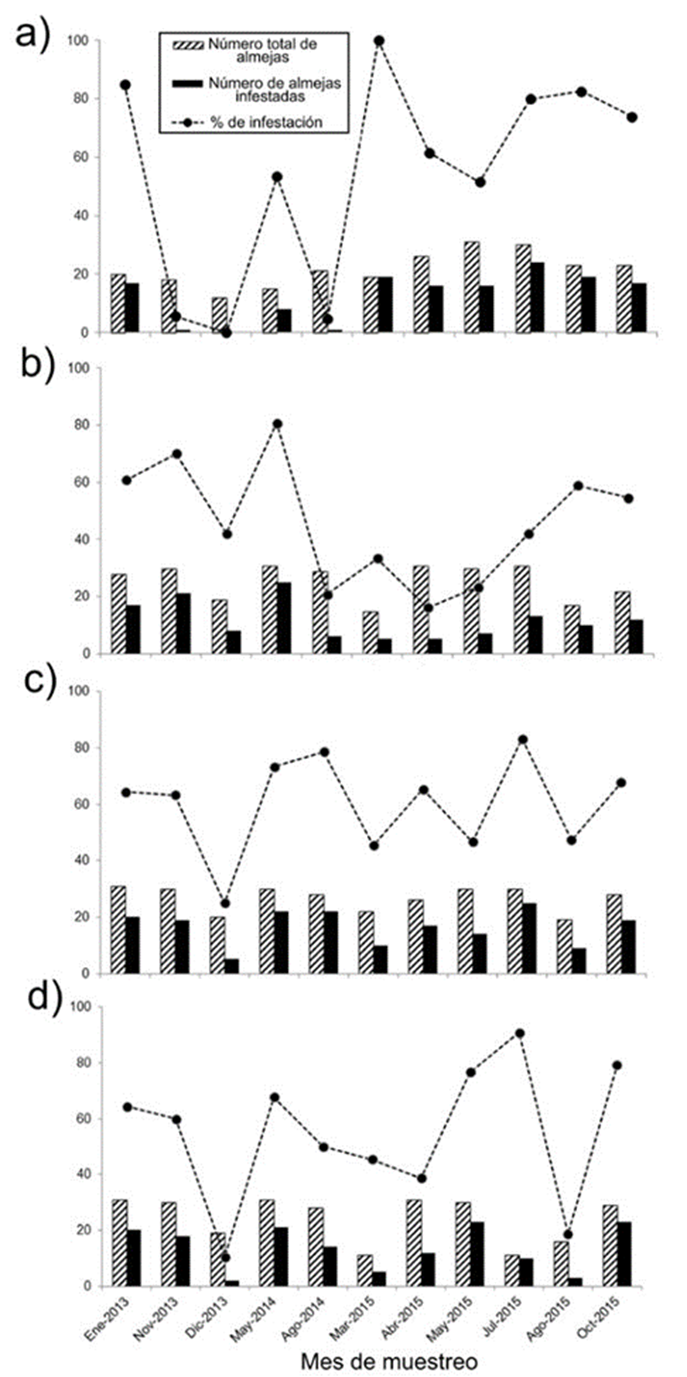
Figura 5 Número total de almejas recolectadas (barra con líneas), número de almejas infestadas (barra negra) y porcentaje de infestación (línea punteada) por banco almejero: a) Chocolatero; b) Zacatoso; c) La Concha; d) El Dátil.
En el otro banco donde las almejas con menor longitud fueron dominantes, Zacatoso, las variaciones de los niveles de infestación fueron diferentes a los observados en Chocolatero, ya que el porcentaje de almejas con esponjas fue menor (16.1-80.7%) y sus valores registraron una menor variabilidad a lo largo del tiempo (Fig. 5b). En este banco se detectó un incremento en los niveles de infestación al inicio y al final del periodo de estudio: entre enero 2013 y mayo 2014 (42.1-80.7%), y entre agosto y octubre 2015 (54.6-58.8%), pero sobre todo en noviembre 2013 y mayo 2014, donde más de 70% de las almejas estuvieron infestadas. Por el contrario, entre agosto 2014 y julio 2015 se observó una reducción en los niveles de infestación y menos de 40% de las almejas fueron colonizadas por la esponja perforadora (Fig. 5b).
En los bancos donde el largo de las almejas fue mayor, La Concha y El Dátil, los niveles de infestación a lo largo del tiempo fueron similares, ya que solo en 3 muestreos del periodo primavera-verano, más de 70% de las almejas presentaron esponjas, mientras que, en los restantes meses de muestreo, solo la mitad de las almejas estuvieron infestadas (Fig. 5c, d). A pesar de que, en La Concha, durante diciembre 2013, 25% de las almejas presentaron esponjas, y en El Dátil, en diciembre 2013 y agosto 2015, 11% y 19% de las almejas estuvieron infestadas, en estos 2 bancos la colonización por esponjas fue superior a 40% a lo largo del periodo de estudio.
Durante el periodo de estudio, el banco El Dátil, en comparación con La Concha (25-83.3%), presentó una mayor amplitud de variación en sus niveles de infestación (10.5-90.9%), ya que en diciembre 2013 y agosto 2015 solo 10.5% y 18.8% de las almejas, respectivamente, presentaron esponjas, pero en julio 2015 este valor se incrementó hasta el 90.9% (Fig. 5d).
La relación entre el promedio del largo de las almejas por mes de muestreo y el porcentaje de infestación se muestra en la Figura 6. En Chocolatero, las almejas con menor longitud, entre 7 y 8 cm de largo, presentaron un porcentaje de infestación muy variable entre los meses de muestreo: 4.8% en agosto 2014 y 5.6% en noviembre 2013, pero 82.6% en agosto 2015 e incluso 100% en marzo 2015. Por tanto, la relación entre el largo de las almejas por mes y la presencia de esponjas no fue significativa (y = 4.7x + 17.8; R2 = 0.02; p = 0.67): en noviembre 2013 y agosto 2014 se recolectaron las almejas con menor longitud (< 7 cm de largo), pero solo alrededor de 5% de ellas fueron colonizadas por esponjas, mientras que en enero 2013 y diciembre 2013, en general, las almejas tuvieron mayor longitud (alrededor de 10 cm de largo), pero su porcentaje de infestación fue distinto, 85% y 0%, respectivamente (Fig. 6a).
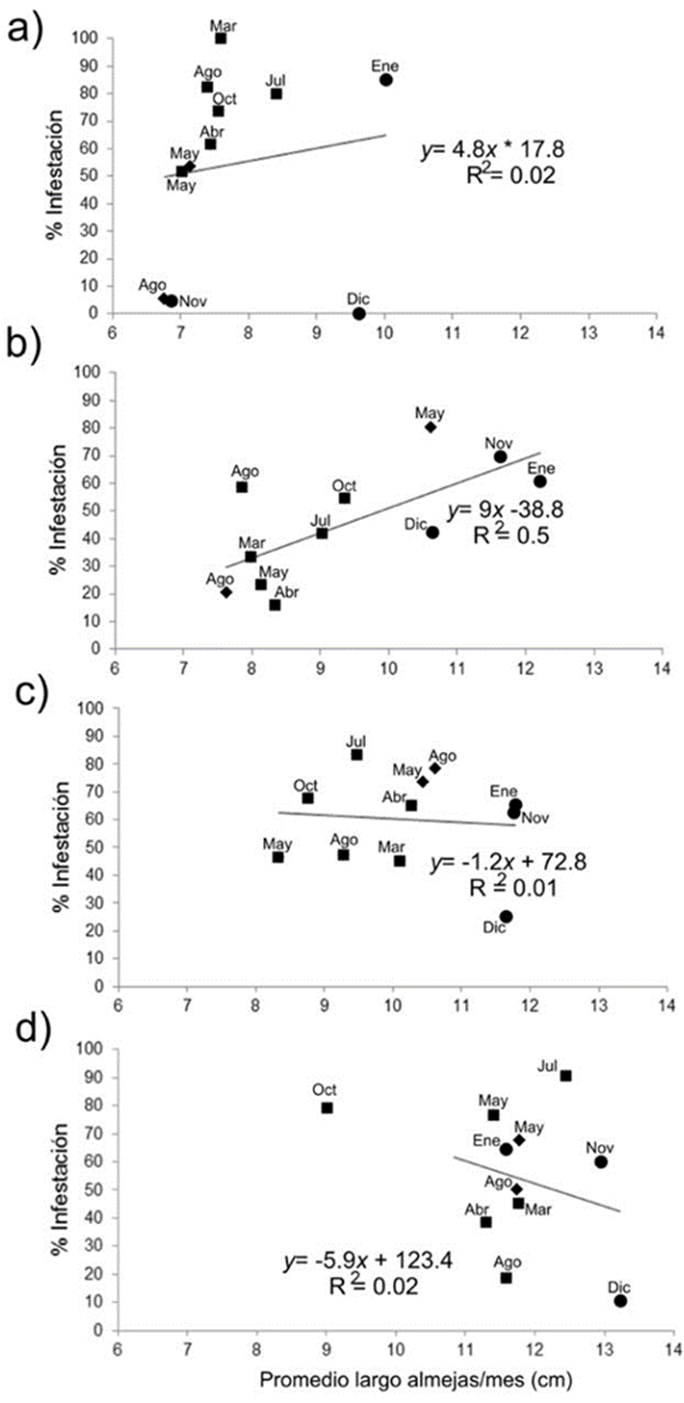
Figura 6 Relación entre el promedio del largo de las almejas por mes de muestreo y su porcentaje de infestación, para cada banco almejero: a) Chocolatero; b) Zacatoso; c) La Concha; d) El Dátil. Los meses de muestreo están abreviados con las 3 primeras letras de su nombre (2013 = círculos; 2014 = rombos; 2015 = cuadros).
En Zacatoso, al aumentar el promedio del largo de las almejas por mes de muestreo, también se incrementó su porcentaje de infestación (y = 9x - 38.8; R2 = 0.5; p = 0.02). Aproximadamente 30% de las almejas de 8-9 cm de largo, recolectadas entre los meses de marzo y agosto, presentaron esponjas, pero en las almejas con mayor longitud (10.6-12.2 cm), recolectadas en el invierno de 2013 y en mayo 2014, más de 40% de los ejemplares estuvieron infestados (Fig. 6b).
A pesar de que en La Concha y El Dátil se recolectaron las almejas de mayor longitud (> 10 cm largo, en promedio), en ninguno de los 2 bancos se observó una relación significativa entre el promedio del largo de las almejas por mes y su nivel de infestación (Fig. 6c, d). En La Concha, el porcentaje de almejas infestadas a lo largo de los meses de muestreo fue muy variable, entre 20 y 80%; sin embargo, la presencia de esponjas no estuvo relacionada con el promedio del largo de las almejas por mes (y = -1.2x + 72.8; R2 = 0.01; p = 0.8). Es decir, tanto en las almejas con 8-9 cm de largo como en las mayores de 11 cm durante todo el periodo de muestreo, los porcentajes de infestación se mantuvieron alrededor de 60% (Fig. 6c).
En El Dátil, durante el último mes de muestreo (octubre 2015), las almejas fueron inusualmente pequeñas (9 cm de largo) y, además, casi 80% de ellas estuvieron infestadas por esponjas. Sin embargo, durante los restantes meses de muestreo la mayoría de las almejas fueron en promedio mayores de 11 cm de largo, e incluso en noviembre y diciembre de 2013 tuvieron alrededor de 13 cm de largo. A pesar de que en este banco, durante los meses de muestreo, predominaron las almejas con mayor longitud, el largo de las almejas no estuvo relacionado con los niveles de infestación (y = 5.9x + 123.4; R2 = 0.02; p = 0.66), ya que los porcentajes de almejas colonizadas por esponjas presentaron una variación muy amplia (Fig. 6d). Las almejas con alrededor de 12 cm de largo registraron 18.8% de infestación durante agosto 2015, pero 76.7% en mayo 2015. Esta amplia variación también se observó en las almejas más largas (13 cm), ya que en diciembre 2013 se presentó un porcentaje de infestación de solo 10.5%, pero en julio 2015 hasta 90.9% de las almejas presentaron esponjas (Fig. 6d).
Discusión
Los epibiontes pueden afectar severamente a las poblaciones de pectínidos, tanto en bancos naturales como cultivados y, si bien, a nivel mundial los estudios sobre epibiontes y los daños provocados en los pectínidos se ha incrementado, en México, este tipo de investigaciones son relativamente escasas (Cáceres-Martínez, 2001). La esponja perforadora Cliona californiana podría tener efectos sobre el crecimiento y desarrollo de la almeja mano de león (Nodipecten subnodosus), en el Pacífico oriental. Sin embargo, estos efectos no han sido estudiados y en este trabajo no se observó una correlación entre la presencia de Cliona californiana y el largo de las almejas estudiadas en la laguna Ojo de Liebre.
A nivel mundial, los procesos de infestación de cliónidos en las conchas de ostiones han sido ampliamente documentados (Alagarswami y Chellam, 1976; Carver et al., 2010; Daume et al., 2010; Thomas, 1979; Warburton, 1958c; Wesche et al., 1997), aunque pocos han analizado su efecto sobre la condición de estos moluscos y su crecimiento (Rosell et al., 1999; Schleyer, 1991). En las regiones templadas de EUA, por ejemplo, Cliona celata ha provocado pérdidas económicas considerables debido a los daños físicos producidos en las conchas de Crassostrea virginica y aunque esta esponja perforadora causa una mayor mortalidad en ostiones grandes y longevos (Rosell et al., 1999; Thomas, 1979; Warburton, 1958b), la mayor parte de las pérdidas económicas son debido a la reducción del valor de mercado por la fragilidad de las conchas (Carver et al., 2010).
Es común encontrar organismos que vivan sobre y dentro de las conchas de moluscos bivalvos, no obstante, no necesariamente se alimentan de ellas o de los tejidos internos del molusco; su presencia puede ocasionar afectaciones que requieran el uso de energía para reparar los daños que los puedan exponer a potenciales depredadores (Cáceres-Martínez, 2001). Warburton (1958b) planteó que la calidad del cuerpo blando de los especímenes de Crassostrea virginica infestados por Cliona celata podría ser inferior a la de organismos libres de esponjas; mientras que, en las costas de Maryland, EUA, Kennedy y Breisch (2001) observaron que la presencia de esta esponja puede inhibir el crecimiento de estos ostiones.
A pesar de que en varias especies de moluscos bivalvos el daño fisiológico provocado por la presencia de cliónidas se considera mínimo (Clavier, 1992), las galerías producidas por las esponjas deforman y debilitan las conchas, haciéndolas frágiles y quebradizas (Pomponi, 1980; Rützler y Rieger, 1973), afectando en forma importante su manejo y comercialización cuando son explotadas por el ser humano (Cáceres-Martínez, 2011). En este sentido, la presencia de esponjas del género Cliona afecta la condición y supervivencia de los moluscos debido a que el hospedero desvía energía hacia la secreción sucesiva de nuevas capas de conquiolina para proteger la cavidad interna de la concha y evitar que las esponjas y otros epibiontes entren en contacto con el cuerpo blando (Hoeksema, 1983; Thomas, 1979). Este proceso afecta la condición fisiológica del molusco debido a la reasignación de energía hacia la formación de la concha y la consiguiente pérdida de volumen interno, alterando sus mecanismos de alimentación (Handley, 1998). Aunque estos efectos aún no han sido estudiados en la almeja mano de león, el proceso de bioerosión sobre la charnela (alterando su capacidad para abrirse o cerrarse) o sobre la inserción del músculo abductor (provocando dificultades para cerrar sus valvas) podría tener efectos importantes en el crecimiento y la condición fisiológica de la almeja.
Se ha observado que la presencia de esponjas perforadoras no tiene efectos tan severos en los bivalvos jóvenes y pequeños, como lo hacen en individuos más grandes (Dunn et al., 2014; Warburton, 1958b). Es posible que los bivalvos más pequeños puedan mantener un cierto equilibrio entre el crecimiento somático y el mantenimiento de la concha, pero a medida que este organismo crece, el gasto energético en la secreción de conquiolina y en la reparación de la concha es mayor, ocasionando una disminución adicional en su crecimiento y condición somática (Palmer, 1992). Sin embargo, cuando la presencia de epibiontes es reducida, el crecimiento y desarrollo del molusco depende, en primera instancia, de otros factores como la disponibilidad de alimento, reproducción, metabolismo, procesos de depredación y condiciones climáticas, usualmente a nivel local (González-Estrada, 2003). En particular, en la laguna Ojo de Liebre, la presencia de esponjas sobre las almejas mano de león parece no ser crítica aún y no tener un efecto notorio sobre el tamaño del molusco, por lo que la mortalidad de las poblaciones de almejas observada previamente en esta laguna probablemente esté relacionada con otros factores de estrés, como las variaciones del ambiente o la presencia de otros invertebrados oportunistas dentro y fuera de la concha.
A pesar de que alrededor de la mitad de las 1,082 almejas recolectadas en la laguna Ojo de Liebre presentaron esponjas (45.7-60.1%), su variabilidad fue muy amplia entre los bancos almejeros. Esta variación, sin embargo, se incrementó a lo largo de los meses de muestreo, ya que se observaron porcentajes desde 0% hasta 100% de almejas infestadas. En principio, el efecto negativo de las esponjas perforadoras sobre su hospedero puede pasar desapercibido, como el de cualquier otro epibionte (poliquetos, algas calcáreas, briozoos), pero la formación de canales en la superficie de la concha pueden hacerla quebradiza, aún sin alcanzar la cara interna y, por tanto, quedar más vulnerable a la acción de los depredadores (Fig. 2e, f; Le Cam y Viard, 2011; Rosell et al., 1999; Wesche et al., 1997). Aunque en la laguna Ojo de Liebre, y en las costas occidentales de la península de Baja California, no hay información previa sobre el porcentaje de almejas mano de león infestadas por esponjas, los valores observados fueron similares a 47% de los caracoles Littorina littorea infestados por Cliona sp. en el Golfo de Maine (Stefaniak et al., 2005), pero claramente menor a 100% de los especímenes de Ostrea edulis infestados por las esponjas Cliona viridis y Cliona celata en el mar Mediterráneo (Rosell et al., 1999).
Varias especies pertenecientes al género Cliona presentan oocitos durante casi todo el año, aunque su maduración está estrechamente vinculada con la temperatura del agua de mar; por ejemplo, se conoce que algunas especies como Cliona celata, C. vermifera y C. viridis inician su actividad reproductiva cuando la temperatura se incrementa, frecuentemente entre mayo y junio (Piscitelli et al., 2011). Es precisamente en este periodo cuando la infestación por esponjas podría incrementarse debido a la pobre condición nutricional de las almejas y al mayor gasto energético dedicado a la reproducción. En la laguna Ojo de Liebre, la almeja mano de león desova entre septiembre y noviembre (Morales-Hernández y Cáceres-Martínez, 1996), pero en el presente estudio, en 3 de los 4 bancos estudiados, las almejas de mayor tamaño presentaron los máximos niveles de infestación durante invierno-primavera. A pesar de ésto, la amplia variabilidad observada en el porcentaje de almejas infestadas, tanto espacial como temporal, sugieren que no hay relación entre la presencia de esponjas y el posible periodo reproductivo de las almejas.
La temperatura del agua es el principal factor que controla la reproducción y el desarrollo de las esponjas y sus larvas y, junto con la profundidad y los márgenes continentales, constituyen las principales barreras para su dispersión (Soest, 1994). En particular, Cliona californiana se distribuye en California, costas occidentales de la península de Baja California, golfo de California, Jalisco, Guerrero y el golfo de Tehuantepec (Carballo et al., 2004). Comparte con los otros miembros de Clionaidae la presencia de células especializadas productoras de anhidrasa carbónica y fosfatasa ácida (Rützler y Rieger, 1973), que facilita su penetración en el periostraco de la concha y en las otras capas de la concha, formando numerosas perforaciones pequeñas que integran una extensa red de canales en toda la concha incluyendo su cara interna (Fig. 2b-d) (Cáceres-Martínez, 2001, 2011). En esta especie, los 3 estados del crecimiento típico de las esponjas se han observado: el estado alfa, que frecuentemente se localiza perforando la concha de bivalvos y en rocas; el estado beta, que crece sobre la superficie del substrato y, al parecer, no presenta fusión papilar y; el estado gama, caracterizado por presentar una superficie con muchas papilas circulares uniformemente distribuidas (Fig. 2a-e) (Carballo et al., 2004).
Las esponjas, sobre todo de la familia Clionaidae, generalmente dominan la comunidad de organismos perforadores (Calcinai et al., 2004), destruyendo y removiendo los substratos de carbonato de calcio y aunque han sido ampliamente registradas en corales, conchas y algas calcáreas (Carballo et al., 2004), afectan preferentemente a los moluscos bivalvos (Evans, 1969), lo que se ve reflejado en los niveles de infestación observados en las almejas mano de león de la laguna Ojo de Liebre. En este sentido, la presencia de estas esponjas perforadoras origina que las conchas de la almeja mano de león sean más porosas y quebradizas (Fig. 2e, f) y por tanto, más vulnerables al ataque de depredadores, bacterias y hongos oportunistas, y los canales formados por las esponjas pueden ser aprovechados por otros organismos como gusanos perforadores (Polydora sp.), deteriorando aún más la concha (Cáceres-Martínez, 2001, 2011). Estas alteraciones producen irregularidades en la concha y, como respuesta, la almeja tiende a secretar una mayor cantidad de conquiolina con el fin de proteger la cavidad del manto (Hoeksema, 1983; Thomas, 1979; Warburton, 1958b). Desde el punto de vista comercial, la presencia de esponjas origina un gasto energético costoso para las almejas, reflejándose en menores tasas de crecimiento y un aumento en la mortalidad, con la consecuente pérdida económica (Carver et al., 2010; Palmer, 1992; Warburton, 1958a; Wesche et al., 1997).
Las esponjas perforadoras del género Cliona representan un serio problema económico para la pesquería de moluscos de importancia comercial. Sin embargo, en la laguna Ojo de Liebre, a pesar de que alrededor de la mitad de las almejas mano de león presentaron esponjas, no hubo relación con el tamaño de las almejas. En los bancos Chocolatero y Zacatoso se recolectaron almejas de 7.8 y 9.4 cm en promedio, pero el porcentaje de almejas infestadas fue muy variable durante el tiempo del muestreo (0-100%), sobre todo cuando las almejas tuvieron solo 7.59 cm de largo (100% infestación). En La Concha y El Dátil, donde se registraron almejas de 10.22 y 11.71 cm de largo en promedio, los porcentajes de infestación se mantuvieron alrededor de 60%, pero tampoco se detectaron relaciones significativas entre los niveles de infestación y el largo de las almejas. Los efectos directos o indirectos de la esponja perforadora sobre el crecimiento y desarrollo de la almeja mano de león, aún no están bien entendidos, por lo que se deben realizar estudios más exhaustivos en los bancos naturales para entender estas relaciones. Además, también se ha observado que el asentamiento de larvas de moluscos podría ser obstaculizado por la presencia de esponjas, incrementando sus tasas de mortalidad y aunque la intensidad de tal impacto aún no es clara, es necesario también explorar el efecto de la presencia de esponjas sobre el asentamiento de las larvas de la almeja mano de león, para estimular y mejorar los mecanismos de reproducción y cultivo tanto en el medio natural como en la acuicultura (Barnes et al., 2010; Dunn et al., 2014).
Por ello, para determinar si la presencia de esponjas afecta el desarrollo adecuado de este pectínido, se recomienda realizar estudios orientados a evaluar la condición fisiológica de los moluscos infestados y ver si el gasto energético dirigido a reparar los daños de la concha afecta directamente el tejido y los órganos internos, como las gónadas, la masa y calidad del cuerpo blando, al igual que la fragilidad de la concha, factores que determinan la calidad del cuerpo blando y su posterior comercialización.
En conclusión, se puede indicar que alrededor de la mitad de las almejas mano de león recolectadas durante el presente estudio (45.7-60.1%) estuvieron colonizadas por esponjas. Los niveles de infestación entre enero 2013 y octubre 2015 fueron muy irregulares entre los bancos almejeros. Las variaciones en el porcentaje de infestación de acuerdo con la longitud de las almejas fueron muy amplias y mostraron comportamientos distintos entre los bancos almejeros; sin embargo, estas diferencias no fueron suficientes para establecer una relación significativa entre el largo de las almejas y los niveles de infestación observados. La presencia de esponjas en las almejas mano de león en la laguna Ojo de Liebre parece no tener un efecto notorio sobre la longitud del molusco, por lo que el decaimiento de las poblaciones de almejas en esta laguna podría estar asociada con otros factores, como las variaciones locales del ambiente o la presencia de otros invertebrados oportunistas dentro y fuera de la concha.











 nueva página del texto (beta)
nueva página del texto (beta)


