Introducción
La fauna anquihalina de la península de Yucatán (PY) se compone hasta ahora por 61 especies: 51 de crustáceos, 6 de esponjas, 2 de peces, 1 de moluscos y 1 de equinodermos (Álvarez e Iliffe, 2008; Álvarez et al., 2019; Gómez y Calderón-Gutiérrez, 2020; Rubio et al., 2016; Solís-Marín y Laguarda-Figueras, 2010). Dentro de los crustáceos, se han registrado 7 especies de isópodos, todas endémicas de la PY: Metacirolana mayana (Bowman, 1987), Cirolana yucatana Botosaneanu y Iliffe, 2000, Cirolana yunca (Botosaneanu y Iliffe, 2000), Creaseriella anops (Creaser, 1936), Haptolana bowmani Botosaneanu y Iliffe, 1997, Yucatalana robutispina Botosaneanu y Iliffe, 1999 y Curassanthura yucatanensisÁlvarez, Benítez, Iliffe y Villalobos, 2019. De éstas, C. anops es la más abundante y la más ampliamente distribuida en la región central y norte de la PY (Álvarez e Iliffe, 2008; Álvarez et al., 2015).
Descrita originalmente como Cirolana anops (Creaser, 1936), este isópodo carece de ojos y pigmento, tiene la capacidad de doblarse formando una pequeña bola, presenta una lámina frontal pentagonal más larga que ancha, endito del maxilípedo con 4-5 ganchos de acoplamiento y pleotelson más ancho que largo. Presenta el margen posterior ampliamente redondeado y crenulado, pleópodo 2 del macho con estilete copulador insertado en la base del endópodo y los pleópodos 3-5 carecen de setas marginales (Kensley y Schotte, 1989). Creaseriella anops se encuentra clasificada como amenazada en la NOM-059-SEMARNAT-2010 (Semarnat, 2010).
Creaseriella anops se distribuye en la capa de agua dulce de las cuevas anquihalinas, aunque ocasionalmente se le encuentra en la haloclina o muy raramente en la capa de agua salada (Benítez et al., 2019); puede ser localmente muy abundante, sobre todo si hay algún animal muerto del que se estén alimentando. Las estructuras sensitivas del cefalón de C. anops fueron descritas por Escobar et al. (2002), quienes sugirieron que estos isópodos pueden detectar una variedad de estímulos en el agua aun viviendo en total oscuridad, por lo que se han distinguido por ser carroñeros muy eficientes. Por otra parte, Ruiz-Cancino et al. (2013) estudiando las poblaciones de C. anops en 3 cenotes del norte de Quintana Roo, encontraron que la composición de tallas es estable a lo largo de un ciclo anual con los juveniles, machos y hembras, siempre mostrando intervalos bien definidos. Es interesante notar que estos son los 2 únicos estudios sobre aspectos biológicos de C. anops, aun cuando se podría catalogar como una especie clave en el ecosistema anquihalino por su papel en el reciclamiento de materia (Durán, 2020).
Considerando la extensión de las cuevas anquihalinas y la variedad de condiciones que en ellas se presentan (e.g., cantidad de materia orgánica, presencia de diferentes masas de agua, grado de conectividad, intervalo de profundidad), aunados a la amplia distribución de C. anops en la porción norte de la PY, es relevante examinar si existen diferencias morfológicas o en la distribución de tallas. En este estudio examinamos la distribución de tallas por sexo y estado de madurez de una muestra amplia de C. anops que abarca toda su área de distribución, se analiza si existe un patrón de distribución dentro de las cuevas inundadas con respecto a la profundidad y si hay alguna variación en las tallas promedio al alejarse de la línea de costa. Finalmente, discutimos si hay alguna característica poblacional o morfológica de C. anops que se pueda relacionar con las 2 grandes áreas de distribución en la PY, una en Yucatán (anillo de cenotes) y otra en Quintana Roo (zona de cuevas del Caribe) y si hay variación de acuerdo a las posibles cuencas existentes en el acuífero de estos estados.
Materiales y métodos
Se realizó una búsqueda de todos los ejemplares de C. anops depositados en la Colección Nacional de Crustáceos (CNCR), del Instituto de Biología de la Universidad Autónoma Nacional de México. Estas muestras se complementaron con ejemplares recolectados de 2014 a 2016, los cuales se obtuvieron manualmente mediante técnicas de espeleobuceo y con el uso de trampas cebadas. Las muestras de los años recientes se obtuvieron en 3 viajes al área de Tulúm, Quintana Roo, en donde se visitaron 4 cenotes y sus cuevas asociadas y 2 viajes al área de Mérida, Yucatán, en donde se muestrearon 2 cenotes (Tabla 1); todos los organismos fueron conservados en EtOH al 70%. Durante los muestreos realizados en años recientes, se caracterizó la columna de agua a través de una sonda multiparámetro (Hydrolab DS5X), registrándose la salinidad, temperatura, concentración de oxígeno disuelto y profundidad, permitiendo conocer las condiciones en que cada organismo fue colectado.
Tabla 1 Coordenadas geográficas de las localidades donde fueron recolectados los ejemplares de Creaseriella anops, número de organismos por localidad y distancia a la costa (km).
| Localidades | Latitud | Longitud | Número de organismos | Distancia a la costa |
|---|---|---|---|---|
| Quintana Roo | ||||
| 1. Cueva Carlos, Xel Ha | 20.3144 | -87.3581 | 11 | 0.36 |
| 2. Cenote Nohoch Nah Chich | 20.2986 | -87.4869 | 119 | 9.98 |
| 3. Cenote Maya Azul | 20.4886 | -87.2515 | 2 | 0.66 |
| 4. Cueva Nah Aktun | 20.3933 | -87.6250 | 1 | 28.34 |
| 5. Cenote Ruinas | 19.6294 | -88.5520 | 48 | 99.45 |
| 6. Cenote Muknal | 20.1886 | -87.4900 | 7 | 4.68 |
| 7. Cenote Odyssey | 20.17388 | -87.4707 | 3 | 2.15 |
| 8. Cenote Bang | 20.2105 | -87.5113 | 5 | 7.73 |
| 9. Poza km 129 | 19.7370 | -88.9217 | 48 | 123.38 |
| 10. Cenote Vaca Ha | 20.2105 | -87.5011 | 329 | 6.67 |
| 11. Cenote Chan Hol | 20.1580 | -87.5691 | 3 | 11.34 |
| Yucatán | ||||
| 12. Cueva San Isidro | 20.9677 | -89.6216 | 11 | 35.87 |
| 13. Cenote Sambulá | 20.6427 | -89.9031 | 6 | 56.49 |
| 14. Cueva Chac Mool | 20.6463 | -88.4175 | 7 | 119.22 |
| 15. Cueva Actun Kaua | 20.6180 | -88.3525 | 15 | 105.54 |
| 16. Cenote Xkeken Dzitnup | 20.6608 | -88.2425 | 1 | 96.28 |
| 17. Cueva Xconsacab | 21.1422 | -88.1508 | 6 | 47.50 |
| 18. Cenote Cervera | 21.3808 | -88.8336 | 5 | 2.79 |
| 19. Cenote del Pochote | 20.5600 | -89.7500 | 138 | 72.90 |
| 20. Cenote Chacsinicché | 20.6400 | -89.4600 | 2 | 89.26 |
| 21. Cenote Chiuo Ho | 20.6350 | -89.6120 | 1 | 85.88 |
| 22. Cenote Chooj Ha | 20.8085 | -87.7221 | 1 | 86.49 |
Los ejemplares de C. anops fueron medidos con un objetivo graduado y sexados con ayuda de un microscopio estereoscópico (Carl Zeiss 6DV4), las medidas tomadas en vista dorsal fueron 2: longitud total (LT), del margen anterior del cefalón hasta el borde posterior del pleotelson y ancho total (AT), tomada al nivel del cuarto pereionito, abarcando la distancia entre el borde lateral de las placas pleurales (Fig. 1A).
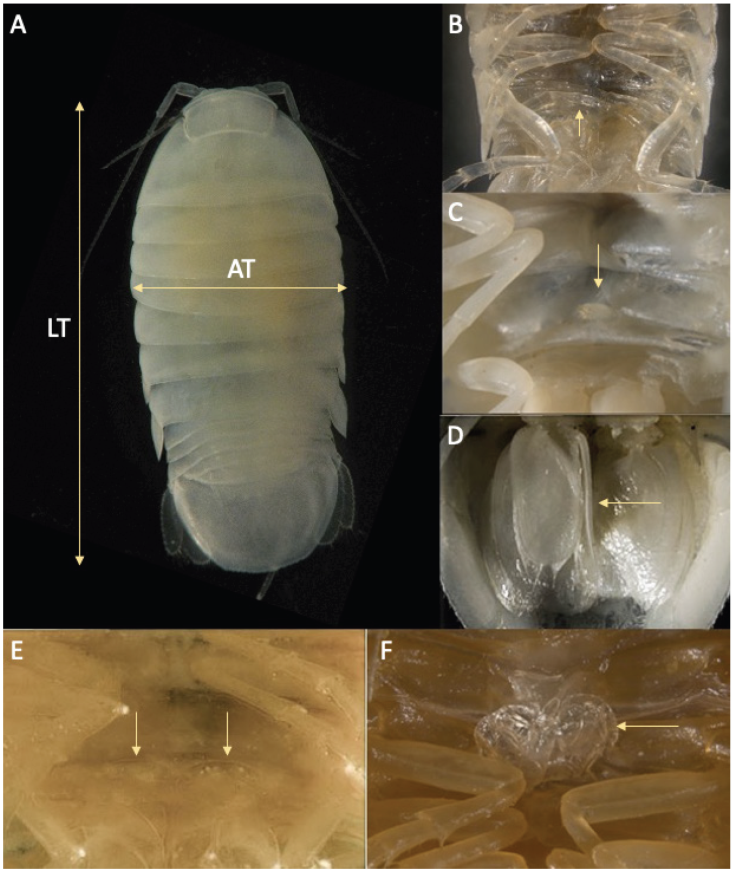
Figura 1 Creaseriella anops: A, vista dorsal con las medidas que se tomaron de AT, ancho total, y LT, longitud total; B, vista ventral de una manca; C, papila genital del macho en la superficie ventral del séptimo pereionito; D, segundo pleópodo del macho con estilete copulador; E, hembra inmadura con una papila genital bilobulada a la altura del séptimo pereionito; F, hembra madura con una osteguitos situados en la superficie ventral.
El sexado y la identificación de la fase de desarrollo en la que se encontraban los ejemplares se realizó con base en la presencia/ausencia de estructuras genitales siguiendo el criterio de Kittlein (1991). Las mancas se identificaron por la presencia del séptimo par de pereiópodos rudimentarios y plegados ventralmente (Fig. 1B) y los organismos juveniles por carecer de cualquier rasgo o diferenciación sexual. En el caso de los machos, éstos se caracterizan por la presencia de una papila genital en la superficie ventral del séptimo pereionito (Fig. 1C), así como un estilete copulador inserto en la base del segundo pleópodo (Fig. 1D). En el caso de las hembras, éstas se separaron en inmaduras y maduras. Para las primeras, únicamente se observó la presencia de una papila genital bilobulada a la altura del séptimo pereionito (Fig. 1E). En el caso de las hembras maduras, éstas presentaron oosteguitos en la superficie ventral, así como una papila genital bilobulada (Fig. 1F).
Los datos de LT y AT se analizaron en el programa estadístico IBM SPSS Statistics 24 (IBM, 2016). Se realizaron regresiones lineales para analizar la relación entre el largo y ancho del cuerpo de la especie en las poblaciones de los estados de Yucatán y Quintana Roo para explorar la existencia de variación geográfica. Las poblaciones de ambos estados se pueden separar tomando como referencia la línea limítrofe entre ellos que corre en una dirección SO-NE, que también se puede asociar a diferentes cuencas subterráneas del acuífero (Bauer-Gottwein et al., 2011). Se realizó un análisis de covarianza (Ancova) para probar si existen diferencias significativas entre las pendientes estimadas para los individuos de todas la localidades. La proporción sexual entre hembras y machos se obtuvo para cada población por estado y en conjunto total, los resultados fueron comparados mediante una prueba de χ².
Los datos de talla contra profundidad se analizaron agrupando las tallas por intervalos de profundidad de 3 m de los 2 hasta los 26 m. Se obtuvieron un total de 65 ejemplares: 18 machos, 17 hembras inmaduras, 16 mancas, 8 juveniles y 6 hembras maduras; los promedios de talla por intervalo se compararon con una Anova de una vía. Las coordenadas geográficas de todas las localidades en donde se registró a C. anops se obtuvieron en campo o por medios cartográficos y con el programa Google Earth. A través de un análisis de regresión, se exploró la relación entre la distancia (km) entre cada una de las localidades a la línea de costa contra la talla promedio de los organismos. Finalmente, se obtuvo un mapa con las cuencas subterráneas que se han propuesto para la PY, en el cual se ubicaron las 22 localidades (Bauer-Gottwein et al., 2011). Posteriormente, se analizó por medio de un análisis de varianza no paramétrico (Kruskal-Wallis) si existen diferencias en las tallas de los organismos dependiendo de la cuenca subterránea a la que pertenecen y al resultar que hay diferencias significativas, se realizó una prueba post hoc de Dunn Bonferroni para determinar cuáles cuencas difieren entre sí.
Resultados
Se revisó un total de 831 organismos de la especie C. anops provenientes de 22 localidades (Fig. 2), 11 en Yucatán con 199 organismos (24%) y 11 en Quintana Roo con 632 (76%). Los machos fueron los más abundantes, seguidos por las hembras inmaduras, los juveniles, mancas y hembras maduras (Fig. 3).
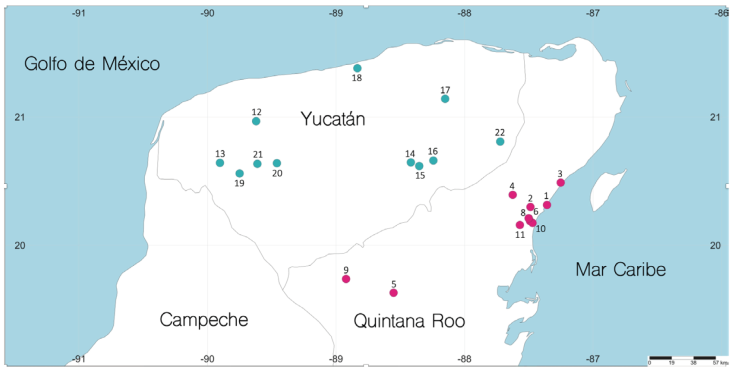
Figura 2 Península de Yucatán, México, con los 22 sitios de colecta de Creaseriella anops. Los nombres y localización de los cenotes aparecen en la Tabla 1.
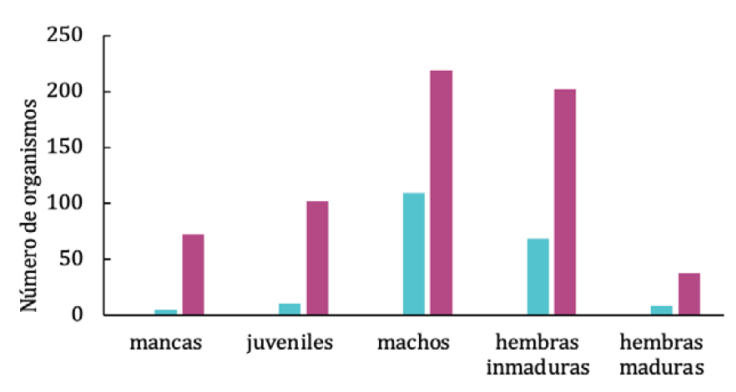
Figura 3 Creaseriella anops: número de organismos por sexo y estado de madurez analizados en este estudio, en los estados de Yucatán y Quintana Roo, México.
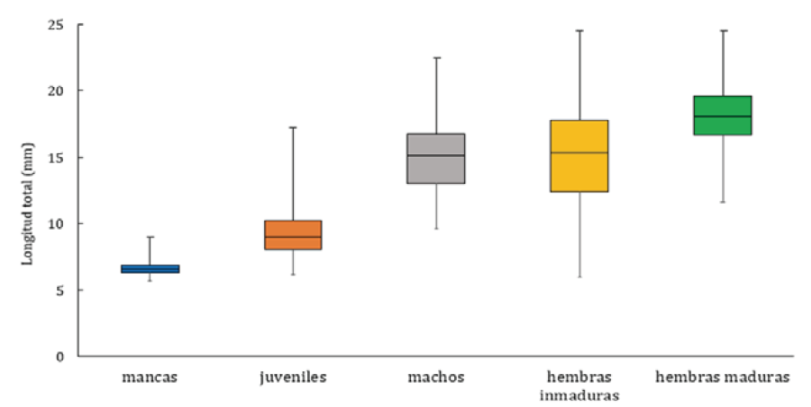
La talla más pequeña se presentó en la categoría de mancas mientras que la categoría de las hembras tanto inmaduras como maduras registraron las tallas más grandes (Fig. 4). La LT máxima correspondió a una hembra del cenote del Pochote de 24.5 mm y la mínima a una manca de 5.7 mm del cenote Vaca Ha (Fig. 5).
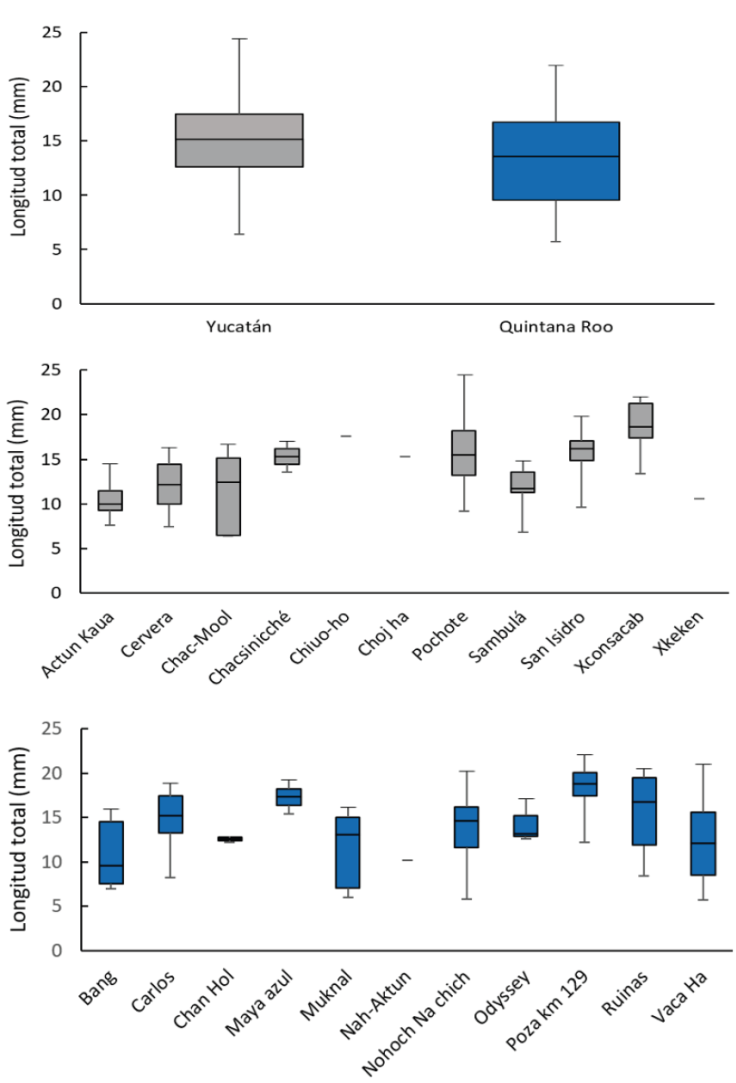
Figura 5 Creaseriella anops: A, mediana e intervalo de talla en Yucatán y Quintana Roo; B, mediana e intervalo de talla por población en Yucatán; C, mediana e intervalo de talla por población en Quintana Roo.
Las 2 regresiones utilizadas para determinar las diferencias entre largo - ancho del cuerpo, en las poblaciones de Yucatán respecto de las de Quintana Roo (Fig. 6), presentaron un valor de pendiente muy similar. Para compararlas, se realizó un análisis de covarianza cuyo resultado fue que la variable de estado sí tiene un efecto significativo sobre la talla (F(1,830) = 4.025; p = 0.045), mientras que la interacción estado-longitud no lo es (F(1,830) = 0.10; p = 0.921). La diferencia entre las 2 zonas geográficas es en realidad muy pequeña (Fig. 6), lo cual se vuelve más evidente al graficar todos los valores clasificándolos solamente por sexo y estado de desarrollo (Fig. 7).
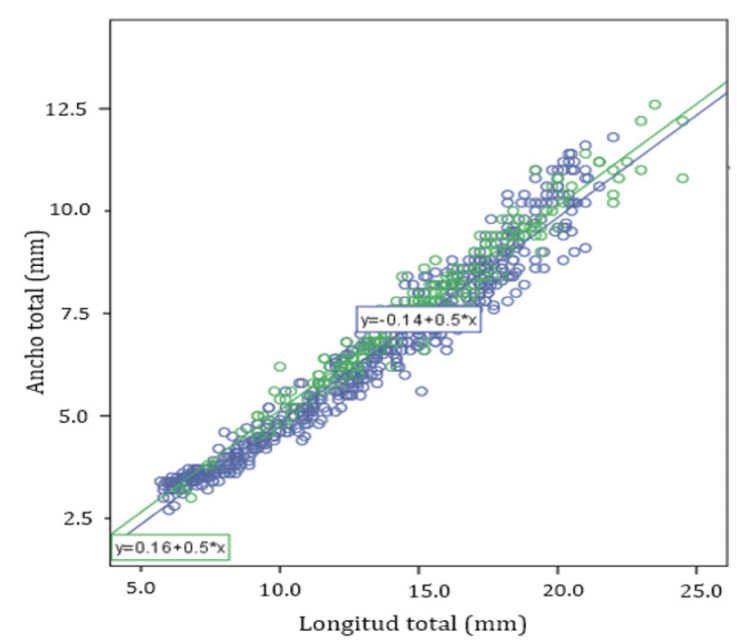
Figura 6 Creaseriella anops: relación ancho total vs. largo total; en verde, población de Yucatán; en azul, población de Quintana Roo.
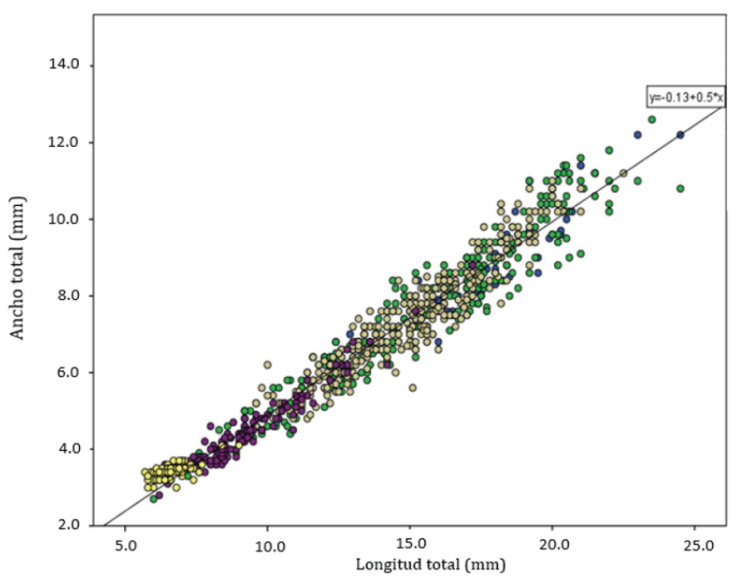
Figura 7 Creaseriella anops: relación ancho total vs. largo total de todos los organismos estudiados por sexo y estado de madurez; círculos amarillos, mancas; círculos morados, juveniles; círculos grises, machos; círculos verdes, hembras; círculos azules, hembras maduras.
La proporción sexual se obtuvo para cada población, por estado y en conjunto total, donde resultó una proporción global de 1M:1H (χ2 = 0.262, p > 0.05) mientras que por separado, en el estado de Yucatán fue de 1.43M:1H (χ2 = 5.88, p < 0.025) y en Quintana Roo de 0.91M:1H (χ2 = 0.8733, p > 0.05).
En cuanto a la distribución de C. anops en la columna de agua de los sitios muestreados, se observó que la abundancia disminuyó conforme aumentó la profundidad (Fig. 8A) y que aun cuando las tallas más grandes están en las zonas someras, la talla promedio no cambia con respecto a la profundidad (Anova, F(5,64) = 0.8204, p > 0.05; Fig. 8B).
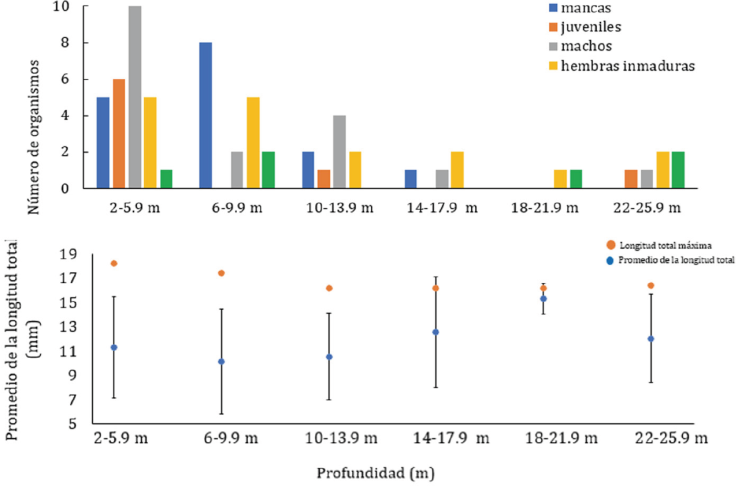
Figura 8 Creaseriella anops: A, distribución batimétrica por sexo y estado de madurez; B, longitud total máxima y promedio con desviación estándar de la longitud total por intervalo de profundidad.
Para Yucatán, la localidad más cercana a la costa es el cenote Cervera (2.79 km) y la más lejana es la cueva Chac-Mool (119.22 km). Para el estado de Quintana Roo, la cueva Carlos es la localidad más cercana a la línea de costa (0.36 km) y la Poza, en el km 129, es la más alejada (123.38 km) (Tabla 1). El análisis de estos datos muestra que no existe un efecto de la lejanía a la costa sobre la talla promedio de los isópodos en las cuevas estudiadas (Fig. 9).
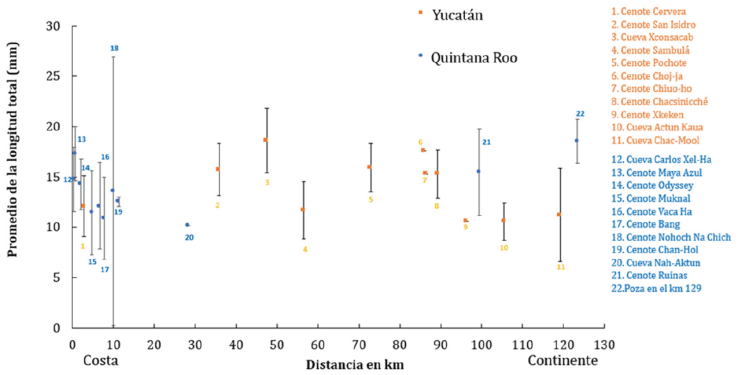
Figura 9 Creaseriella anops: promedio con desviación estándar de la longitud total de cada una de las 22 poblaciones consideradas con relación de la distancia a la costa.
Buscando observar si las distintas cuencas subterráneas que se han propuesto para la circulación del acuífero de la PY afectan la distribución de tallas de C. anops, se organizaron los datos en 4 grupos: la cuenca noroeste, que corresponde al área del anillo de cenotes (AC); la cuenca noreste, cuyo punto central estaría en el poblado de Tizimín, Yucatán (NE); la cuenca de la Riviera Maya, entre Cancún y Tulúm, Quintana Roo (RM), y la cuenca del centro de la península de Yucatán, en la región centro-occidental de Quintana Roo (CP) (Fig. 10). Todos los cenotes estudiados se ubicaron en alguna de las 4 cuencas y los promedios de talla se compararon, encontrándose que existen diferencias significativas entre las cuencas (Kruskal-Wallis, H = 132.69, p < 0.001). La prueba post-hoc de Dunn Bonferroni mostró que las cuencas NE y RM no presentan diferencias significativas entre ellas (p > 0.05), mientras que todos los demás posibles arreglos entre parejas presentaron diferencias significativas (NE-AC, p = 0.001; NE-CP, p < 0.001; RM-AC, p < 0.001; RM-CP, p < 0.001; AC-CP, p = 0.016).
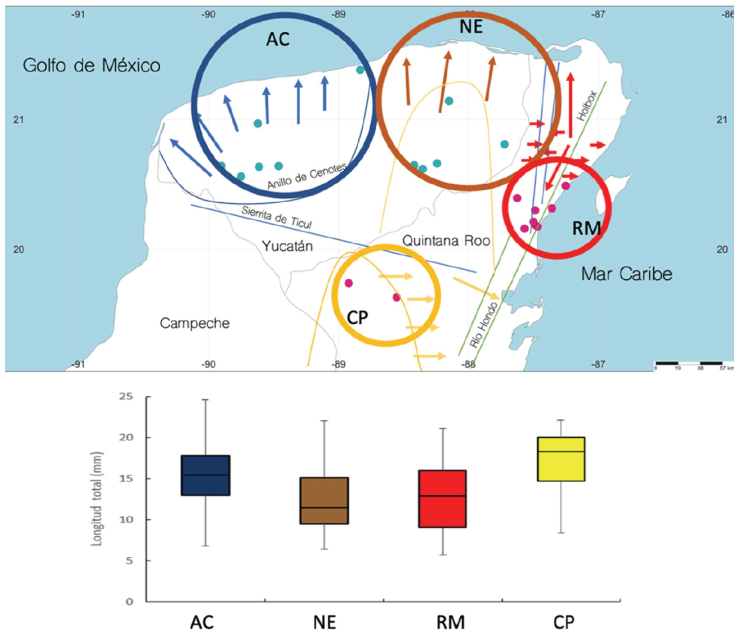
Figura 10 A, Mapa de la península de Yucatán mostrando los principales flujos de agua subterráneos, los círculos denotan 4 cuencas diferentes: azul marino, anillo de cenotes (AC); café, cuenca noreste, cuyo punto central estaría en el poblado de Tizimín, Yucatán (NE); rojo, cuenca de la Riviera Maya, entre Cancún y Tulúm, Quintana Roo (RM); amarillo, cuenca del centro de la PY, en la región centro-occidental de Quintana Roo (CP). B, Mediana e intervalo de talla por cuenca.
Discusión
Las cuevas anquihalinas de la PY, incluyendo en esta denominación a la isla de Cozumel, son sin duda las de mayor extensión en el mundo y en ellas se ha desarrollado una fauna casi totalmente endémica y dominada por especies de crustáceos (Iliffe y Álvarez, 2018). De las 61 especies que se han descrito hasta ahora, C. anops es una de las más abundantes y con más amplia distribución en la PY (Álvarez e Iliffe, 2008; Álvarez et al., 2015). Su papel como carroñero lo hace un organismo de gran importancia en las tramas tróficas y en el reciclamiento de nutrientes dentro de las cuevas anquihalinas (Durán, 2020).
Con solamente 2 estudios previos sobre diferentes aspectos de la biología de C. anops (Escobar et al., 2002; Ruiz-Cancino et al., 2013), en este estudio se analizó si hay diferencias en la talla a través de su intervalo de distribución en la PY, considerando que podría haber procesos de diferenciación que se reflejaran en la talla, debido a lo heterogéneo del hábitat anquihalino. Aun cuando hay diferencias hidrológicas importantes entre las cuevas anquihalinas del anillo de cenotes -no presentan haloclina o que se tiene muy profunda (> 60-80 m), no tienen corrientes, no tienen mucho desarrollo horizontal y se presentan aisladas unas de otras- en comparación con las de la Riviera Maya, entre Puerto Morelos y Tulum -que tienen haloclina a partir de los 18 m, corrientes considerables, un gran desarrollo horizontal, y por lo tanto, un alto grado de conectividad-, las poblaciones de C. anops conservan la misma relación largo-ancho y, en general, las mismas tallas promedio. También es interesante ver que a través de su intervalo de distribución, las tallas y la proporción de mancas, juveniles, machos, hembras inmaduras y maduras, se mantienen dentro de límites bien definidos. El único efecto detectado fue en las cuencas subterráneas NE y RM, donde las tallas mayores podrían sugerir una mayor cantidad de alimento disponible derivado del transporte de materia orgánica hacia el interior de las cuevas o de una creciente contaminación orgánica antropogénica.
Botello y Álvarez (2010) analizaron la variación genética en los genes mitocondriales 16S y COI del camarón Creaseria morleyi (Creaser, 1936), que tiene casi por completo la misma distribución de C. anops, encontrando en ambos casos un haplotipo ampliamente distribuido y otros con distribuciones muy restringidas. Este patrón es congruente con la presencia periódica de cuellos de botella poblacionales, ocasionados por los cambios en el nivel del mar. Es decir, que durante el último millón de años, el abatimiento periódico del nivel del mar hasta -120 m (Carnero-Bravo et al., 2016) produjo que las cuevas anquihalinas desaparecieran, en lo que ahora es la parte emergente de la PY. Los ambientes anquihalinos posiblemente se redujeron a algunas zonas profundas dentro de la plataforma calcárea o se movieron hacia la plataforma continental al oeste y al norte de la PY (Botello y Álvarez, 2010). Considerando esta hipótesis, al recobrarse el nivel mar, las poblaciones se redistribuyeron a partir de unas cuantas, generando una composición homogénea en el nuevo intervalo de distribución. Aunque todavía es especulativo, C. anops podría haber pasado por cambios similares lo que tendría un efecto homogeneizador de las tallas y proporciones corporales como ahora se observa. En contraste, es interesante notar que el bagre Rhamdia guatemalensis (Günther, 1864), ampliamente distribuido en las zonas abiertas de los cenotes de la PY, muestra cierto grado de estructura genética dentro de las 2 grandes áreas de cenotes, anillo de cenotes y Riviera Maya, y también variantes morfológicas, pero sin ningún patrón espacial (Arroyave et al., 2020).
Tomando en cuenta que la cantidad de nutrientes en las cuevas anquihalinas aumentaría hacia las porciones cercanas a la costa, ya fuese por efecto del arrastre y entrada de agua meteórica al acuífero o por las mareas que impulsan agua marina tierra adentro (Sánchez et al., 2002; McNeill-Jewer et al., 2019), se esperaba que la talla promedio de C. anops disminuyera conforme la distancia a la costa aumentara. Sin embargo, las tallas promedio no fueron significativamente diferentes desde las cuevas más próximas al mar hasta cuevas 129 km tierra adentro.
Al ser considerada una especie principalmente carroñera, C. anops quizá no depende de manera directa de la disponibilidad de nutrientes o de microalgas, por lo que su talla tampoco se ve afectada por la distancia a la costa. Utilizando los valores isotópicos de δ15N y δ13C en el sistema Vaca-Ha en el estado de Quintana Roo, se identificó a C. anops como parte de la posición trófica número 3 junto con otras especies de consumidores secundarios como el anfípodo Tuluweckelia cernua Holsinger, 1990 (Durán, 2020). Esto corresponde con los hábitos alimenticios de la especie, ya que si bien no es considerada como un depredador activo, sí aprovecha los restos de otras especies para alimentarse, como del camarón mysido Antromysis cenotensis Creaser, 1936 y del camarón carideo Typhlatya mitchelli Hobbs y Hobbs, 1976 (Durán, 2020).
La distribución batimétrica de C. anops dentro de las cuevas no mostró un patrón definido, esto es, no hay una segregación por talla de acuerdo con la profundidad. Benítez et al. (2019) encontraron en el sistema Ox Bel Ha, un transecto de 10.2 km en el que no había ninguna estratificación horizontal y en el que C. anops se encontró entre los 8 y 18 m de profundidad. Su hábito carroñero, seguramente, produce que los organismos se muevan constantemente dentro de las cuevas en busca de alimento sin un patrón definido, produciendo también una mezcla de tallas.
Al no haber otros estudios sobre aspectos básicos de la ecología de isópodos de cuevas anquihalinas, no se pueden derivar comparaciones que muestren el grado de adaptación a cada sistema anquihalino en particular. La rareza de la mayoría de estas especies de isópodos previene que se puedan llevar a cabo estudios sistemáticos. Siendo así, C. anops es una especie única, que por su abundancia y amplia distribución puede ser el modelo para entender mejor la estructura de la comunidad de especies anquihalinas de la PY.











 nueva página del texto (beta)
nueva página del texto (beta)