Introducción
Uno de los grupos animales más afectados por el calentamiento global es el de los anfibios, debido a que son ectotermos y altamente dependientes de la humedad (Carey y Alexander, 2003; Duarte et al., 2012; Navas, 1997; Navas et al., 2013). Los anfibios deben enfrentarse a una pérdida de agua constante, la cual varía según el hábitat y la resiliencia de su piel a la desecación (Buttemer y Thomas, 2003; Navas, 1999; Seebacher y Alford, 2002; Shoemaker y Nagy, 1977; Tracy et al., 2007). Esta pérdida de agua por evaporación cutánea es afectada principalmente por la humedad, la temperatura y la velocidad del viento; factores que condicionan la selección de hábitat, las horas de actividad y la permanencia de las especies (Schmid, 1965; Withers, 1995; Yorio y Bentley, 1977; Young, 2006), que a su vez influyen en la tolerancia de las especies a las condiciones diferenciales del hábitat.
La tolerancia a la deshidratación en anfibios varía según la especie y el tipo de ambiente (Liu y Ping-Chun, 2012; Titon et al., 2010). Para reducir la desecación utilizan cambios conductuales y secreciones cutáneas (Blaylock et al., 1976; Romero, 2013; Vitt y Caldwell, 2014). La pérdida de agua entre 3-10% de su masa corporal no es letal en periodos cortos, pero cercana a 30% casi siempre ocasiona la muerte (Daneri, 2010; Pough et al., 1983).
La evaluación de la pérdida de agua en anfibios puede utilizar técnicas no invasivas como las réplicas de agar de los organismos, las cuales aunque no reflejan el movimiento del individuo o circulación de la sangre, han mostrado ser adecuadas (Köhler et al., 2011; Liu y Ping-Chun, 2012; Navas y Araujo, 2000; Young et al., 2006). Las réplicas de agar pueden considerarse modelos nulos que emulan a los individuos de las especies en estudio (expuestos a permeabilidad máxima, sin mediar efectos conductuales), y de esta manera proveen mediciones de pérdida de agua (Navas y Araujo, 2000). Algunos estudios sobre la pérdida de agua por evaporación cutánea de anfibios se han realizado en bosques tropicales, pero ninguno en ambientes secos interandinos (Beuchat et al., 1984; Prates y Navas, 2009; Seebacher y Alford, 2002; Young et al., 2006). Estos últimos podrían ser más afectados por los cambios climáticos, incluyendo un incremento en el déficit hídrico, lo cual sería riesgoso para su supervivencia (Anderson et al., 2011). Es posible postular como hipótesis general que el cambio climático afecta las poblaciones de anfibios diferencialmente entre especies, dependiendo de los microambientes que ocupen, sus horarios de actividad, sus características morfológicas y fisiológicas. El objetivo central de este estudio fue evaluar la pérdida de agua por evaporación cutánea en anuros, para avanzar en la comprensión del grado de vulnerabilidad en que se encuentran, particularmente en un ambiente seco andino, ya que los anfibios altoandinos tienen que sobrellevar condiciones extremas como fuertes vientos, elevada amplitud térmica diaria y alta radiación UV, lo que puede representar una amenaza para su permanencia en estas regiones (Navas, 2003). Este estudio se enfocó en 2 especies simpátridas del Valle de La Paz, Bolivia: Gastrotheca marsupiata y Pleurodema cinereum (Aparicio et al., 2015). Ambas especies parecen responder de forma diferente a las presiones ambientales, ya que de acuerdo con nuestras observaciones no cuantificadas, las poblaciones de G. marsupiata parecen ser menos abundantes que hace 25 años, a diferencia de las poblaciones de P. cinereum que parecen ser igual de abundantes actualmente (Aparicio et al., 2015).
Este estudio incluyó una fase de laboratorio, para comparar la pérdida de agua en un ambiente controlado y una fase de campo, donde se comparó la pérdida de agua para G. marsupiata y P cinereum en distintos microhábitats, considerando la influencia de las horas de actividad de ambas especies. Dado que la permeabilidad de la piel es un factor que influye en la pérdida de agua, se trabajó bajo el supuesto que habría una diferencia en la pérdida de agua corporal entre ambas especies.
Materiales y métodos
Gastrotheca marsupiata (Hemiphractidae) es un anuro relativamente pequeño -los adultos miden 28-38 mm de longitud total = LT -, que habita la región altoandina de Perú y Bolivia, incluyendo bosques nublados, cejas de montaña y valles interandinos, entre 1,500 y 4,230 m snm (Aparicio et al., 2015). Las hembras tienen una bolsa cutánea análoga a un marsupio en la región dorsal, donde alojan los huevos fecundados y posteriormente sueltan los renacuajos en un estado avanzado de desarrollo en algún cuerpo de agua para que finalicen la metamorfosis. Los adultos se resguardan bajo piedras, en hoyos y pequeñas cuevas (Aparicio et al., 2015).
Pleurodema cinereum (Leptodactylidae) tiene tamaño mediano (35 a 41 mm LT) y se distribuye desde el sur del Perú, en los valles interandinos de Bolivia y llega al noreste de Argentina entre 2,260 y 4,500 m snm (Aparicio et al., 2015). Es una rana muy común en el Valle de La Paz; se la puede encontrar entre la vegetación emergente, sobre el suelo o debajo las piedras y además en cuerpos de agua. Los huevos son depositados en un nido de espuma en los cuerpos de agua. Tanto G. marsupiata como P. cinereum son de hábitos preferentemente nocturnos y tienen una dieta generalista que incluye coleópteros, himenópteros y dípteros, entre otros insectos (Aparicio et al., 2015).
La fase de campo del estudio se realizó en la comunidad campesina de Taucachi, Municipio de Achocalla, La Paz (16°42’52.8” S, 68°05’26.2” O), donde habitan ambas especies. Taucachi está en una zona de transición entre puna húmeda y valle seco interandino. La vegetación predominante incluye Bacharis tola, Bacharis sp., Stipa sp., Tetraglochin cristatum, Senna aymara, Scenecio clivicolus, Carceolaria sp., Heterosperma sp. y algunas especies de Umbelliferae (Beck et al., 2015). El muestreo se realizó en 2 lagunas, separadas entre sí por 300 m y situadas a 3,986 y 4,033 m snm.
Para la preparación de los modelos de agar, se midieron todos los individuos de ambas especies procedentes del Valle de La Paz, depositados en la Colección Boliviana de Fauna, para obtener promedios de longitud hocico cloaca: 3.60 cm, DS = 0.30, n = 34 para P. cinereum; y 3.05 cm, DS = 0.23, n = 8 para G. marsupiata. Se seleccionó al individuo preservado con el tamaño más cercano al promedio, para preparar moldes hechos de alginato odontológico para cada especie, con los mismos se sacaron modelos de yeso Francia, y finalmente, se elaboraron moldes de cera (modificado de Navas y Araujo, 2000). Utilizamos estos moldes para sacar los modelos de las especies de anfibios con 3% de agar y 97% de agua en repetidas ocasiones. Para tener una mejor simulación de los anfibios reales se agregó colorante vegetal en polvo de un color similar a las especies (verde para G. marsupiata y pardo oscuro para P. cinereum); cabe resaltar que este colorante vegetal no afecta la efectividad de los modelos de agar.
Para estimar la pérdida de agua en ambiente controlado se utilizaron individuos vivos, 10 G. marsupiata y 36 P. cinereum. Los individuos de G. marsupiata fueron capturados en Taucachi, estos se mantuvieron en un terrario a temperatura ambiente durante 48 h después de su captura, para ambientarlos antes de realizar las mediciones de laboratorio (realizadas en un ambiente algo distante de Taucachi, pero en el mismo Valle de la Paz). Para P. cinereum no fue necesario realizar una ambientación, ya que los individuos fueron capturados en el mismo predio donde se realizaron las mediciones de laboratorio.
Se midió la masa corporal inicial de los individuos utilizando una balanza KERN pcb (precisión de 0.001 g) y se colocaron dentro de un recipiente plástico (de masa conocida), exponiéndolos a 37 °C. Se usó esta temperatura para evitar sesgos relacionados con procesos compensatorios del organismo evitar pérdida de agua (Tejedo et al., 2012). Los individuos se pesaron cada 15 min hasta que perdieran 10% de su masa inicial (Navas y Araujo, 2000). Dado que algunos individuos perdían > 10% de su masa inicial antes de los 60 min, se paró el experimento a los 45 min de exposición para preservar su integridad física. Posteriormente, los individuos se colocaron en un ambiente con agua para su recuperación y se retornaron al lugar de captura al tercer día.
Para poner a prueba el supuesto de que los modelos de agar emulan adecuadamente un anfibio vivo en cuanto a la pérdida de agua se refiere, se siguió el protocolo de calibración de Navas y Araujo (2000). Se usaron regresiones lineales de la pérdida de agua en función del tiempo, una para el anfibio real y otra para los modelos de agar, por separado para cada especie (Zar, 1999). Para comparar la pérdida de agua entre los modelos y las especies, se realizó una Andeva de medidas repetidas (en el tiempo) y una prueba post hoc de Tukey (Zar, 1999).
Para evaluar la evaporación de los modelos de agar en campo, se prepararon 80 modelos de agar por especie, se registró su masa inicial (precisión = 0.01 g) y se guardaron en bolsas de plástico para evitar deshidratación al trasladarlos al campo en un conservador térmico. Se realizaron 6 visitas a Taucachi entre diciembre de 2014 y marzo de 2015 (época de lluvias). Se colocaron los modelos en 4 tipos de microhábitats ubicados en y alrededor de las lagunas descritas. Se usaron 2 modelos de cada especie por microhábitat y por laguna. Cada modelo llevaba un registrador automático (HOBO TidBit-v2) programado para medir temperatura cada 10 minutos. En cada punto escogido se pusieron 2 modelos bajo sol y 2 bajo sombra en los siguientes microhábitats: a) campo abierto, con los modelos totalmente expuestos al ambiente, sin protección física ni sombra; b) cerca cuerpo de agua, similar al anterior pero a la orilla de las lagunas, sin tocar el agua; c) bajo piedras, se apilaron piedras (entre 5 y 15 cm de diámetro máximo) dejando un espacio central y otras encima hasta formar un montículo (> 10 piedras) que cubría los modelos; d) bajo vegetación, los modelos se colocaron en la base de los arbustos de mayor tamaño alrededor de las lagunas.
Los microhábitats fueron seleccionados aleatoriamente y quedaron fijos durante todo el muestreo. Los modelos estuvieron expuestos durante 4 horas, para luego ser retirados y colocados nuevamente en bolsas Ziploc (previamente rotuladas) y ser reemplazados con otro modelo. Cada modelo retirado fue pesado in situ (precisión 0.01g). Se obtuvieron datos durante 5 periodos del día: 8:00-12:00 h; 12:00-16:00; 16:00-20:00; 20:00-00:00 y 00:00-8:00.
El porcentaje total de pérdida de agua se calculó respecto al peso inicial del modelo, luego de su exposición correspondiente. Para el análisis, utilizamos un Andeva trifactorial con especie, microhábitat y periodo de tiempo como factores fijos, y una prueba post hoc de Tukey para los análisis a posteriori (Zar, 1999).
Para evaluar la pérdida de agua en relación con las horas de actividad de las especies, separamos los datos de campo en 2 periodos: el primero sin actividad, entre las 8:00 y 20:00 hrs, cuando es menos probable encontrar ranas activas; el segundo con actividad, entre las 20:00 y 8:00 hrs, pues ambas especies son nocturnas (Aparicio et al., 2015). Se analizaron estos datos separando las horas con actividad de aquellas sin actividad utilizando un Andeva bifactorial, tomando como factores especie y microhábitat. Para evaluar la pérdida de agua por evaporación en horas con actividad, se tomó como referencia una pérdida de 20% de la masa inicial, pues una pérdida mayor puede ser letal para anfibios terrestres (Feder y Londos, 1984).
Se registró la temperatura ambiental y de los microhábitats colocando 3 registradores a 1.8 m sobre el suelo, en condiciones expuestas y programados para tomar temperatura cada 10 min. Para determinar la temperatura en los microhábitats se usaron los datos de los registradores de temperatura colocados junto a los modelos. Se evaluó la relación entre temperatura ambiente y la registrada junto a los modelos en los diferentes microhábitats con una correlación de Pearson. Todos los análisis se hicieron utilizando el programa Statistica 8.0.
Resultados
Los datos se expresaron en porcentaje del peso inicial perdido en cada intervalo de tiempo. Como era esperado, ambas especies y sus modelos perdieron un porcentaje mayor de agua corporal con el tiempo (F2.164 = 530.4; p < 0.001), pero a partir de los 30 minutos G. marsupiata se diferencia claramente de P. cinereum y los 2 modelos (F3.82 = 4.62; p < 0.005), con una interacción también significativa (F6.164 = 2.72; p = 0.015). La prueba post hoc de Tukey ( p < 0.05) indica que G. marsupiata se diferencia tanto de P. cinereum como de los modelos de ambas especies a los 45 min de exposición. También indica que no existen diferencias en la pérdida de agua de modelos de ambas especies y la de P. cinereum (Fig. 1). Adicionalmente, los individuos de G. marsupiata perdieron agua más rápidamente en relación con su masa corporal (Fig. 2a) que los de P. cinereum (Fig. 2b). En esta figura también se aprecia que los individuos más pesados son los más resistentes a la desecación.
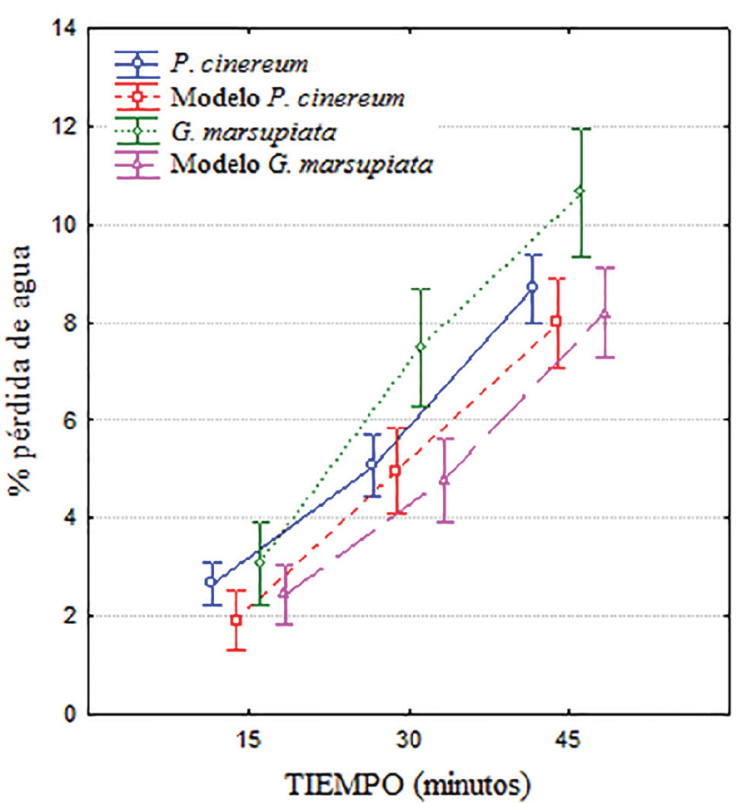
Figura 1 Comparación de los porcentajes de pérdida de agua entre individuos de Gastrotheca marsupiata y Pleurodema cinereum y sus respectivos modelos sometidos a 37 °C en condiciones de laboratorio. Las barras indican el intervalo de 95% de confianza.
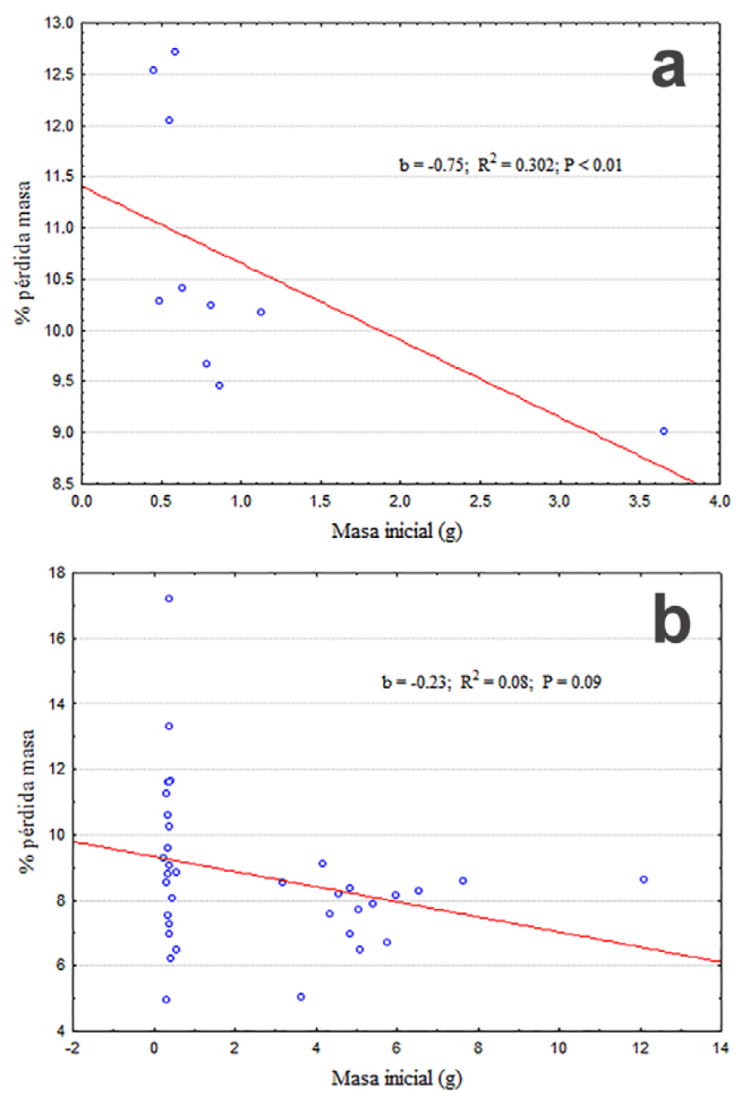
Figura 2 Porcentaje de pérdida de agua en relación con el peso (masa) inicial del individuo, 45 min luego de ser expuestas a 37 °C para Gastrotheca marsupiata (a) y Pleurodema cinereum (b).
Los 3 factores considerados (especie, microhábitat y hora del día) afectaron el porcentaje de pérdida de agua de los modelos. Los modelos de agar de G. marsupiata perdieron significativamente un mayor porcentaje de agua que los modelos de P. cinereum (F1.920 = 82.478; p < 0.001).
En general, la pérdida de agua varía significativamente entre los diferentes microhábitats (F3.920 = 86.289; p < 0.001). Sin embargo, la prueba a posteriori de Tukey mostró que la pérdida de agua es menor y no difiere entre los microhábitats bajo piedras y cerca de cuerpo de agua, pero sí difiere entre éstos y los microhábitats bajo vegetación y campo abierto, en los que la pérdida de agua fue mayor (Fig. 3).
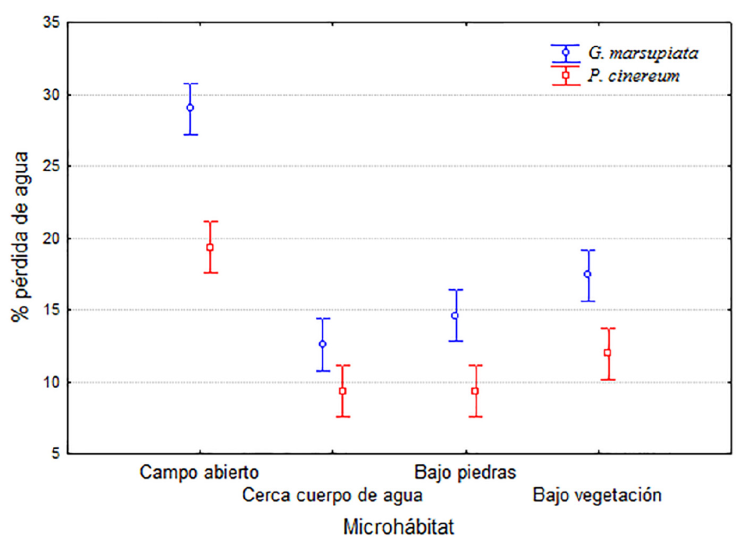
Figura 3 Porcentaje promedio de pérdida de agua para modelos de G. marsupiata y P. cinereum en distintos microhábitats. Las barras indican el intervalo de 95% de confianza.
Finalmente, la pérdida de agua varía significativamente entre las horas de exposición durante el día (F4.920 = 285.904; p < 0.001). Se observaron las menores pérdidas de agua durante los 2 últimos períodos de la jornada (entre las 20:00 y las 8:00 hrs), seguido por el periodo entre las 16:00 y las 20:00 hrs y el periodo de las 8:00 hasta las 12:00 hrs. El periodo en que ocurrió una mayor pérdida de agua se presentó a partir del mediodía hasta las 16:00 hrs (prueba a posteriori de Tukey, α = 0.05; Fig. 4). Además, existen interacciones cuando se analizan los factores en las combinaciones: especie-tratamiento (F4.920 = 4.28, p = 0.005), especie-hora (F4.920 = 8.341; p < 0.001), y tratamiento-hora (F12.920 = 17.84; p < 0.001). Hay que considerar que las interacciones entre tratamiento-hora, y tratamiento-especie pueden deberse a que ambas especies pierden un mínimo de agua en horario nocturno, cuya cantidad es comparable entre ambas (lo cual se discute más adelante), bajando así los promedios de porcentaje de pérdida causando una interacción entre los factores ya mencionados. Sin embargo, no existe una interacción cuando se analizan los 3 factores en conjunto (F12.920 = 0.71; p = 0.73). En síntesis, G. marsupiata presentó una pérdida de agua mayor que P. cinereum (Fig. 4), pero la pérdida de agua por evaporación se ve influenciada tanto por el microhábitat en que se encuentren los individuos como por la hora del día.
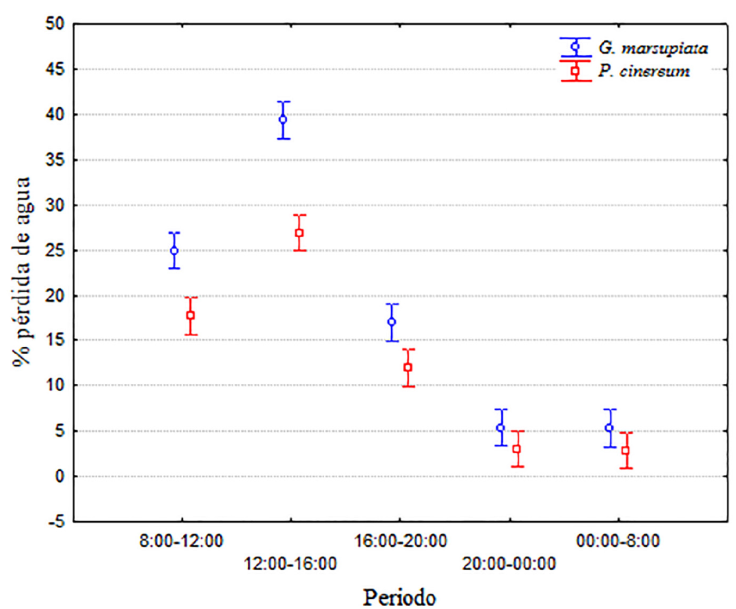
Figura 4 Porcentaje de pérdida de agua para modelos de G. marsupiata y P. cinereum según periodos del día. Las barras indican el intervalo de 95% de confianza.
La pérdida de agua es diferente entre ambas especies durante sus horas de actividad (F1.917 = 40.19; p < 0.001), además estas diferencias dependen del microhábitat (F3.917 = 32.79; p < 0.001) y hay un efecto del periodo (actividad vs no actividad, F1.917 = 514.52; p < 0.001); P. cinereum pierde menos agua que G. marsupiata durante el periodo de no actividad (horas diurnas). Solo se encontraron interacciones significativas entre la especie y el periodo, y entre la especie y el microhábitat. En resumen, G. marsupiata presentó mayor pérdida de agua que P. cinereum en horario diurno o nocturno, aunque es mucho más susceptible durante el día. Por lo tanto, si G. marsupiata quedara expuesta a Campo Abierto durante el día, estaría altamente comprometida su supervivencia (Fig. 5a). El uso de los modelos mostró que la pérdida de agua durante las horas sin actividad sería de alrededor de 45% de la masa corporal para G. marsupiata al encontrarse en campo abierto, y entre 22% y 25% bajo piedras y bajo vegetación, respectivamente; pero por debajo del límite de 20% cuando están cerca cuerpo de agua (Fig. 5a). Los modelos de P. cinereum perdieron entre 3 y 5% por debajo del límite, en 3 de los 4 microhábitats (cerca cuerpo de agua, bajo vegetación y bajo piedras); pero perdieron hasta 30% cuando fueron expuestos a campo abierto durante las horas del día. Es evidente que G. marsupiata pierde más agua que P. cinereum, pero la pérdida en ambos anfibios se encuentra dentro del intervalo que no compromete su sobrevivencia (< 20%) durante los horarios de actividad de ambas (Fig. 5b). Sin embargo, durante las horas del día, ambas especies deben refugiarse bajo piedras o cerca de cuerpos de agua.
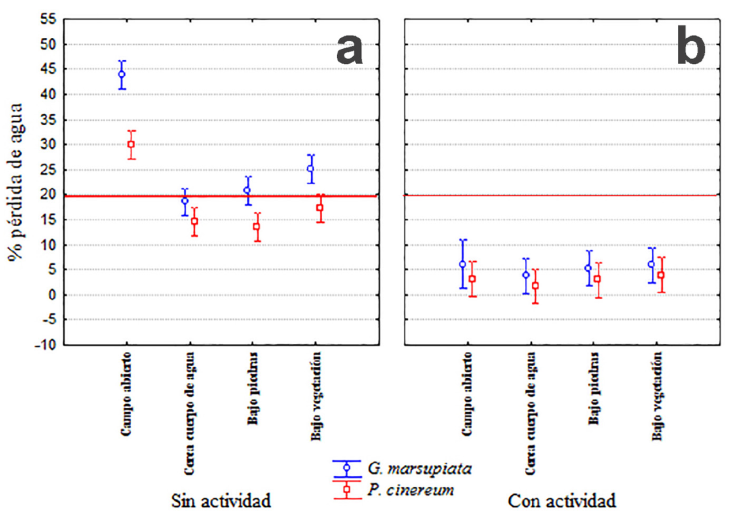
Figura 5 Porcentaje de pérdida de agua para los modelos de G. marsupiata y P. cinereum en horas sin actividad (a) y con actividad (b) en los 4 tipos de microhábitats. La línea roja marca el límite máximo de tolerancia de 20% de pérdida. Las barras indican el intervalo de 95% de confianza.
Las temperaturas más altas se registraron entre las 11:00 y 16:00 hrs. y las más bajas en horas de la noche y cerca del amanecer, pero con una fuerte influencia de los microhábitats en la variación térmica (Fig. 6). Los microhábitats bajo piedras y campo abierto muestran la menor correlación con la temperatura ambiental (r = 0.93 para ambos casos) y las correlaciones con la temperatura de los microhábitats bajo vegetación y cerca cuerpo de agua fue mayor (r > 0.99; p < 0.001 en todos los casos).
Discusión
Se han propuesto varios factores como posibles responsables de la declinación de especies de anfibios a nivel global (Gibbons et al., 2000), por ejemplo la destrucción de hábitat, contaminantes ambientales, las infecciones provocadas por el hongo Batrachochytrium dendrobatidis y el calentamiento del planeta, entre otros (Garner et al., 2006; Zippel y Mendelson, 2008). Nuestros resultados sugieren que G. marsupiata es más vulnerable que P. cinereum al calentamiento global y a la pérdida de cobertura vegetal de los ambientes que ocupan ambas especies, aunque no se descarta que existan otros factores que las estén afectando negativamente; así, la susceptibilidad fisiológica podría ser la causa de que G. marsupiata sea menos abundante actualmente en el Valle de La Paz. Por otra parte, P. cinereum es más resistente a la pérdida de agua y no parece ser tan afectada (Aparicio et al., 2015). Por lo tanto, consideramos que la disminución poblacional de G. marsupiata en el Valle de La Paz es resultado, al menos en parte, de su mayor vulnerabilidad a la desecación, ya que es sintópica con P. cinereum y cualquiera de los efectos mencionados anteriormente mermaría las poblaciones de ambas especies de forma similar.
La mayor vulnerabilidad a la desecación que presenta G. marsupiata en relación con P. cinereum sugiere que la segunda podría ser más resistente en su ambiente natural. Esto puede atribuirse a varios factores como su posición filogenética, robustez y características de la piel. Como estas especies pertenecen a familias distintas, una explicación simple sería que la diferencia en su resistencia a la desecación se deba al grosor de la piel (Liu y Ping-Chun, 2012). Algunos anfibios terrestres poseen una capa dérmica calcificada, conformada principalmente por sales de calcio y, en ocasiones, por sodio y fosfatasa alcalina; esta capa ayuda a los anuros a reducir la deshidratación pero no se encuentra en todas las familias (Toledo y Jared, 1993). Dicha capa dérmica es común en algunas especies de Leptodactylidae, pero no se sabe si está presente en Hemiphractidae; no obstante, cuando la piel dorsal es más granular (como en P. cinereum) forma ranuras finas que ayudan a mantener la piel húmeda (Buttemer, 1990; Vitt y Caldwell, 2014), lo cual no ocurre en G. marsupiata que presenta una piel dorsal más lisa. Esto conduce a la necesidad de realizar estudios histológicos para indagar más sobre el mecanismo que hace más vulnerable a G. marsupiata ante la desecación.
La calibración de los modelos sugiere que la deshidratación simulada para P. cinereum emula a los organismos vivos pero nuestros resultados podrían subestimar la vulnerabilidad de G. marsupiata. El incremento de temperatura y una época de lluvias inestable a nivel local parecen afectar en mayor medida a G. marsupiata (Anderson et al., 2011; Aparicio, 2014; Cayuela et al., 2016). Catenazzi et al. (2014) sugieren que los anfibios de alta montaña están mejor adaptados a las variaciones térmicas pero su conclusión se basa en la ecología térmica de los anfibios y no en la regulación hídrica. Ambas especies estudiadas son mayormente terrestres, por lo que la selección de microhábitats es de suma importancia para evitar la desecación (Schmid, 1965; Schwarzkopf y Alford, 1996), lo cual enfatiza la importancia que podría tener la pérdida de cobertura vegetal nativa para G. marsupiata, ya que la pérdida de agua es menor en el microhábitat bajo vegetación. Nuestros resultados coinciden con los de Seebacher y Alford (2002) para Rhinella marina (Bufonidae), quienes utilizaron lo que denominaron “modelos de sapo” como una alternativa a los modelos de agar, a partir de individuos que sacrificaron para su estudio a los que les inyectaron una solución acuosa al 7% de formalina para evitar la descomposición de los mismos; dichos modelos perdieron más agua cuando fueron expuestos a campo abierto que cuando eran colocados en grietas, huecos bajo árboles, enterrados en hojarasca suelta y entre la vegetación. Ambas especies involucradas en nuestro estudio se hallan con frecuencia bajo la vegetación en su ambiente natural. Hay que recordar que los modelos no simulan la circulación sanguínea, ni la locomoción de los organismos, los cuales pueden trasladarse entre los microhábitats para compensar la deshidratación al exponerse temporalmente a Campo Abierto.
El hecho de que los modelos registraran una menor pérdida de agua en los microhábitats menos expuestos coincide con que los individuos de ambas especies pasan mucho tiempo protegidas del sol (Aparicio et al., 2015). Adicionalmente, el microhábitat cerca cuerpo de agua es el mejor para rehidratarse, ya que los anfibios absorben agua del sustrato a través de la piel del abdomen (Bentley y Yorio, 1976; Parsons y Mobin, 1991). La permeabilidad cutánea depende de la especie y es controlada por una hormona antidiurética conocida como arginina vasotocina (Muzio et al., 2011; Vitt y Caldwell, 2014). Entonces, las diferencias entre G. marsupiata y P. cinereum en su resistencia a la deshidratación pueden explicarse tanto por las características de su piel, como por diferencias hormonales y conductuales. No tenemos información sobre el tema hormonal pero la mayor permeabilidad de la piel dorsal de G. marsupiata es evidente con las pruebas realizadas; P. cinereum, en cambio, tiene la piel más áspera y aparentemente más gruesa, lo que seguramente contribuye a reducir la pérdida de agua.
Además de seleccionar microhábitats, los anfibios limitan temporalmente sus actividades, ya que la radiación solar incrementa la deshidratación (Burggren y Warburton, 2007; Cartledge et al., 2006; Romero, 2013). Nuestros resultados coinciden con esta idea general. Los individuos buscan microhábitats que les permitan evitar las elevadas temperaturas del día, hasta que el ambiente sea óptimo para sus actividades (durante la noche). En este sentido, nuestros resultados sugieren que las especies de anfibios que pierden agua corporal con mayor facilidad serán más susceptibles ante el calentamiento global (Rohr y Madison, 2003).
El límite de deshidratación considerado en este estudio (20% de la masa corporal) es solamente una aproximación al límite letal. Sin embargo, los modelos de P. cinereum expuestos a campo abierto perdieron hasta 30% y los de G. marsupiata hasta 45% de su masa corporal; este nivel de disminución es letal como quedó demostrado para individuos de Eleutherodactylus coqui, que suelen morir con pérdida de agua > 30% (Pough et al., 1983). Está claro también que P. cinereum podría estar activa durante más tiempo que G. marsupiata en ambientes secos, lo cual le confiere una ventaja en el uso de hábitats disponibles y, eventualmente, en la colonización de nuevos ambientes y su permanencia en los mismos.
Algunas especies como P. cinereum, realizan actividades de reproducción durante el día pero esta actividad la realizan sin abandonar los cuerpos de agua y de esta manera se mantienen hidratadas durante sus actividades diurnas (Aparicio et al., 2015). No conocemos los detalles del apareamiento de G. marsupiata, pero se sabe que las hembras resguardan los huevos en su “marsupio” hasta que los renacuajos son depositados en un cuerpo de agua donde culminan su metamorfosis. Esta estrategia reduce su vulnerabilidad hídrica, lo cual podría influir en la supervivencia de las hembras después de un evento reproductivo.
Los resultados obtenidos indican que las fluctuaciones térmicas afectan la deshidratación de ambas especies. Las horas menos favorables (mayor temperatura) se presentaron entre las 10:00 y las 16:00 hrs, mientras que a partir de las 20:00 hrs, todos los microhábitats se encuentran a una temperatura similar, hasta aproximadamente las 8:00 hrs, horario que favorece la actividad de G. marsupiata y P. cinereum, ya que las condiciones ambientales propician una menor pérdida de agua.
La pérdida de agua por evaporación cutánea es mayor para G. marsupiata que para P. cinereum, independientemente de su masa corporal tanto en campo como en laboratorio. Sin embargo, el microhábitat que ofrece peores condiciones para el mantenimiento del agua corporal es el que está expuesto a campo abierto, mientras que los microhábitats bajo piedras y cerca cuerpo de agua ofrecen condiciones similares en cuanto al potencial de deshidratación para ambas especies, lo cual sugiere que la pérdida de cobertura vegetal nativa constituye un factor adicional de riesgo ante escenarios de calentamiento global.











 nueva página del texto (beta)
nueva página del texto (beta)



