Introducción
Guatemala cuenta con gran riqueza de especies de flora y fauna, no obstante, en la actualidad los ecosistemas del país están amenazados por varios impactos ambientales, como la deforestación y la contaminación (Cano, 2006). Ambas amenazas son particularmente importantes en las áreas urbanas, donde hay más actividades humanas y un crecimiento considerable de la población. Para fundamentar las estrategias de conservación de los espacios naturales remanentes, es necesario obtener la información básica de flora y fauna mediante la elaboración de inventarios biológicos y el monitoreo de la biodiversidad (Kremen et al., 1993).
Durante 2006 y 2007 se realizaron estudios de diversidad biológica en el Departamento de Guatemala, en los que se registran diversas especies de plantas y animales (Ixcot et al., 2007). Sin embargo, ante el acelerado deterioro ambiental en la última década, es necesario actualizar la información de la flora y fauna para comprender el estado actual de la biodiversidad del área. Las mariposas diurnas, Lepidoptera, son uno de los grupos taxonómicos importantes para este tipo de investigaciones porque se utilizan como bioindicadores y se investigan en relación a la urbanización o perturbación en varias partes del mundo (Balam-Ballote y León-Cortés, 2010; Bergerot et al., 2010; Brown y Freitas, 2002; Kitahara y Sei, 2001; Kremen, 1992; Ramírez-Restrepo y MacGregor-Fors, 2017; Sánchez-Jasso et al., 2019).
En cuanto a las mariposas diurnas de Guatemala, hasta la fecha se han registrado aproximadamente 400 especies de la familia Hesperiidae (Austin et al., 1998; Barrios et al., 2006) y alrededor de 700 especies de las demás familias de la superfamilia Papilionoidea (Salinas-Gutiérrez, 2013; Salinas-Gutiérrez et al., 2009, 2012). A pesar de lo anterior, aun se conoce poco acerca de la fauna de mariposas del país en comparación con otros países neotropicales. Por ejemplo, en México existen listas exhaustivas de especies a nivel de país y algunos estados (Luis-Martínez et al., 2004, 2011, 2016; Llorente-Bousquets et al., 2014; Maza et al., 1989, 1991); mientras que Guatemala tiene pocos estudios intensivos y listas publicadas de Lepidoptera.
Austin et al. (1996) registraron más de 500 especies de Papilionoidea en una selva lluviosa tropical del norte de Guatemala. Nuestras investigaciones revelan que los bosques estacionalmente secos del país también tienen diversidad alta de mariposas (Yoshimoto et al., 2018, 2019). Por otro lado, es necesario hacer notar que aun existen importantes vacíos de conocimiento sobre los lepidópteros diurnos en otras regiones del país, asociadas a diferentes tipos de vegetación. El presente estudio aporta una lista de especies de Papilionoidea (incluye la familia Hesperiidae; van Nieukerken et al., 2011) con base en muestreos realizados de 2014 a 2019 en un bosque secundario mixto de la Ciudad de Guatemala, que contribuye al inventario de mariposas diurnas de la zona urbana del país. Además, se implementó un monitoreo mensual por 1 año para interpretar patrones fenológicos.
Materiales y métodos
Este estudio se realizó en el Parque Ecológico Deportivo Cayalá (14°37’01” N, 90°29’34” O; 1,450 m snm, ~10 ha), zona 16, Ciudad de Guatemala (fig. 1). En la Ciudad de Guatemala, la estación lluviosa normalmente es de mayo a octubre y la estación seca inicia en noviembre y permanece hasta finales de abril (fig. 2). El parque colinda con una barranca donde se encuentran áreas boscosas; en la actualidad casi todos estos bosques conforman islas por la deforestación y urbanización. La vegetación de la zona donde se ubica el parque corresponde al bosque húmedo subtropical (Cruz, 1982); los árboles dominantes son pinos (Pinus), encinos y robles (Quercus), lo que corresponde al bosque mixto (FAO, 2010). Si bien en el parque hay áreas abiertas y perturbadas, aun se mantiene un bosque secundario mixto con varios árboles latifoliados, pinos, arbustos como el chichicaste (Urera sp.: Urticaceae) y plantas introducidas como Eucalyptus globulus, Liquidambar styraciflua y Magnolia champaca (J. Yoshimoto, observación personal). Cabe mencionar que el parque tiene una riqueza alta de otros grupos taxonómicos; por ejemplo, se registran 117 especies de aves, según la lista elaborada en diciembre de 2019 (FUNDAECO, datos no publicados).
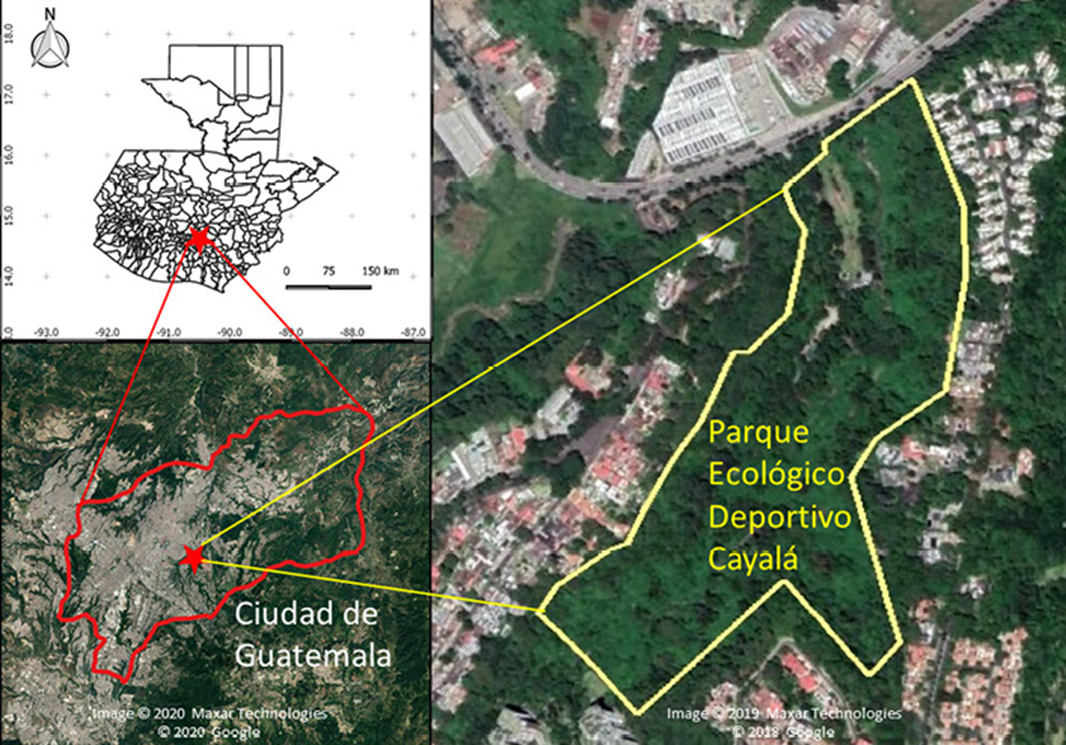
Figura 1 Ubicación del Parque Ecológico Deportivo Cayalá en la Ciudad de Guatemala. Las imágenes satelitales son del Google Earth Pro.
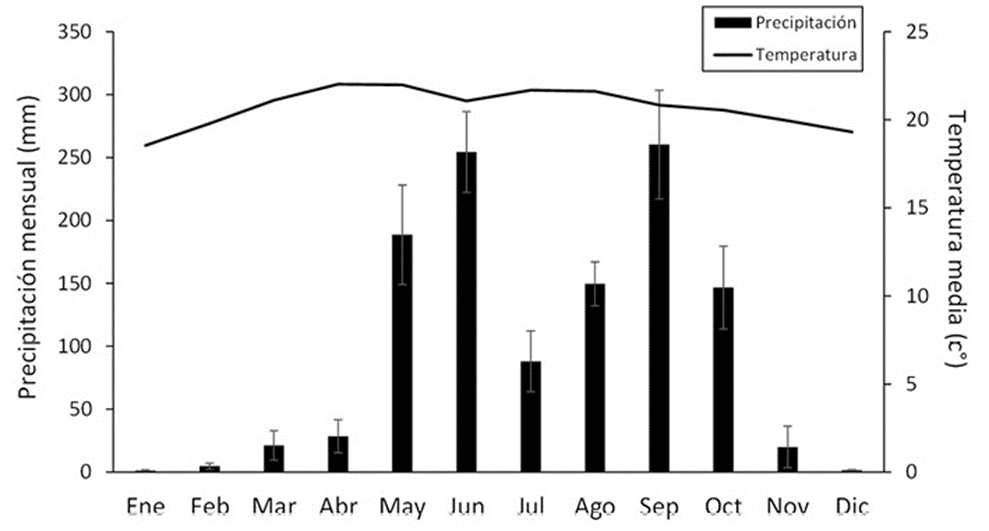
Figura 2 Promedios de temperatura media (línea gruesa) y precipitación (barras gruesas) mensuales (las líneas delgadas de error indican los errores estándares), medidas de 2014 a 2018 en la Estación Climática La Aurora en la Ciudad de Guatemala por el Ministerio de Comunicaciones Infraestructura y Vivienda (INSIVUMEH).
Se realizó un muestreo cualitativo con base en la recolecta de mariposas con red entomológica y registros fotográficos desde noviembre de 2014 hasta octubre de 2019 (34 días en total). Para detectar patrones de fenología, se llevó a cabo un monitoreo semicuantitativo por el mismo observador una vez al mes, de abril de 2016 a marzo de 2017 (12 días en total; 5 de estas fechas coinciden con las fechas en las que se hizo el muestreo cualitativo). Para el monitoreo mensual, se estableció un transecto a lo largo de senderos de 1.4 km y a través de un puente colgante, donde se observaron mariposas diurnas volando o posándose dentro o por la orilla de los senderos de las 09:30 a las 12:30 hrs. A inicios de 2017, el puente y una parte de los senderos se cerraron por la construcción de una residencia, lo que obligó a cambiar parcialmente la ruta del monitoreo durante los 3 meses subsecuentes, de enero a marzo; se desviaron las partes cerradas unos 160 m, pasando por otro sendero y un puente nuevo. La identificación fue visual en el campo, empero, en los casos de determinación difícil a simple vista, los individuos se recolectaron o se fotografiaron para su posterior determinación en el laboratorio. En los casos donde no hay recolecta ni fotografía de los individuos de determinación difícil, se registraron los datos hasta género (apéndice). Con el fin de obtener información de la fenología de abundancia, se realizaron conteos preliminares para las especies y géneros que se pudieron identificar en el campo, con el mismo método y criterio que los del estudio anterior (Yoshimoto et al., 2019); se contabilizaron los individuos para cada especie o género durante cada muestreo, considerando que un taxón es relativamente abundante cuando se registran más de 9 individuos observados, lo que es un criterio arbitrario. Los datos, producto de los muestreos cualitativos y semicuantitativos se utilizaron para crear la lista de especies. Los ejemplares recolectados se montaron como especímenes voucher y se identificaron hasta especie o subespecie, según Warren et al. (2017). Los ejemplares que no se identificaron hasta género no se registraron; solo se incluyen 3 individuos recolectados de Hesperiidae (Hesperiidae sp. 1, Hesperiinae sp. 1 y Hesperiinae sp. 2; apéndice), pues se confirmó que son diferentes especies a las otras determinadas de dicha familia con base en la revisión de los genitales. Todos los especímenes montados se depositaron en la Colección de Artrópodos del Laboratorio de Entomología Sistemática de la Universidad del Valle de Guatemala.
La riqueza de especies fue definida como el número total de especies registradas; además, se estimó con base en el índice de Chao II, que puede ser aplicado a los datos de incidencia con replicación (Chao et al., 2005; Gotelli y Colwell, 2011). Se realizó la misma estimación de riqueza de especies con los datos de la estación seca, 19 días entre noviembre y abril, y de la estación lluviosa, 22 días entre mayo y octubre, para determinar la presencia de algún patrón estacional. A través de los datos del monitoreo mensual semicuantitativo, se utilizaron la riqueza mensual de especies, la riqueza total de especies de la estación seca (abril 2016 y de noviembre 2016 a marzo 2017) y de la estación lluviosa (mayo-octubre 2016) y el promedio de riqueza de especies de cada estación. Se usaron los mismos datos para un análisis multivariado, NMDS (por sus siglas en inglés), para ello se utilizó la matriz de similitud con el índice de Sørensen, con el objeto de interpretar las variaciones en la composición de especies entre los meses. Los taxones no identificados hasta especie fueron incluidos en el género correspondiente (código de paréntesis en el apéndice); solamente los datos de Eurema sp., Urbanus spp. y Bolla sp. se excluyeron de todos los análisis, pues es probable que esos individuos fueran de una de las especies ya determinadas de cada género. Todos estos análisis se realizaron con el programa R 3.5.3, con el paquete Vegan (Oksanen et al., 2019; R Development Core Team, 2019).
Resultados
Durante el periodo de trabajo de campo de 2014 a 2019, se registraron 109 especies (incluyendo 4 taxones no identificados y 56 subespecies) de 77 géneros, 17 subfamilias y 6 familias del orden Lepidoptera (apéndice). La familia que tuvo la mayor riqueza de especies fue Hesperiidae (49 especies), seguida por Nymphalidae, Pieridae, Lycaenidae, Riodinidae y Papilionidae (40, 8, 7, 4 y 1 especies, respectivamente). El número estimado de especies (promedio ± error estándar) con base en el índice de Chao II es 142.93 ± 14.11, el cual indica un muestreo de 76.3% de las especies que habitan en el parque Cayalá. Se registraron 81 especies en la estación seca y 75 especies en la estación lluviosa; la estimación de riqueza de especies no evidenció diferencias significativas entre ambas estaciones, con base a la variación de los valores estimados (fig. 3).
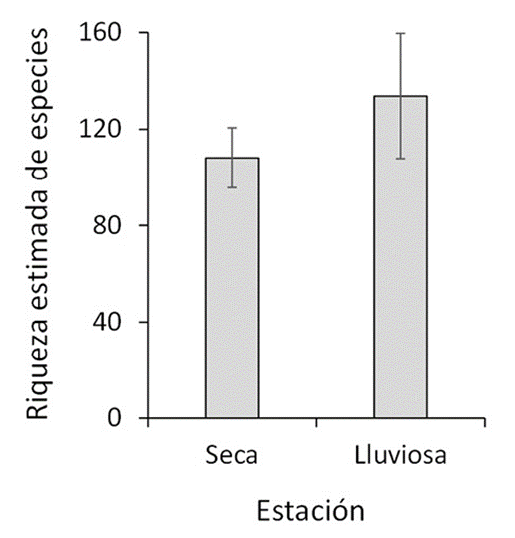
Figura 3 Riqueza estimada de especies (promedio ± error estándar) de mariposas diurnas observadas en la estación seca (noviembre-abril) y en la estación lluviosa (mayo-octubre) de noviembre de 2014 a octubre de 2019 en el Parque Ecológico Deportivo Cayalá, Guatemala. La estimación de riqueza de especies fue realizada con base en el índice de Chao II.
En el monitoreo mensual semicuantitativo, la riqueza de especies suma 68 en la estación seca y 64 en la estación lluviosa; su valor promedio con error estándar de la estación seca es 27.33 ± 2.88 y el de la estación lluviosa es 24.33 ± 2.80. La riqueza de especies fluctuó considerablemente a mediados y a fines de la estación lluviosa (julio-octubre) y al principio de la estación seca (noviembre-enero); incrementó altamente en julio, luego disminuyó al mínimo en septiembre, posteriormente aumentó de nuevo y alcanzó al pico en diciembre (tabla 1). En enero redujo de nuevo y en febrero y marzo fluctuó en menor grado, casi al mismo nivel que entre abril y junio del año anterior.
Tabla 1 Riqueza de especies para 6 familias de mariposas diurnas observadas en el monitoreo mensual realizado de abril de 2016 a marzo de 2017 en el Parque Ecológico Deportivo Cayalá, Guatemala.
| Familia | Abr | May | Jun | Jul | Ago | Sep | Oct | Nov | Dic | Ene | Feb | Mar |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Papilionidae | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Pieridae | 2 | 1 | 2 | 5 | 3 | 1 | 2 | 3 | 4 | 4 | 3 | 2 |
| Lycaenidae | 3 | 0 | 1 | 2 | 1 | 1 | 0 | 0 | 2 | 3 | 4 | 2 |
| Riodinidae | 1 | 1 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| Nymphalidae | 9 | 12 | 8 | 9 | 10 | 8 | 13 | 18 | 20 | 13 | 6 | 10 |
| Hesperiidae | 6 | 10 | 12 | 14 | 5 | 4 | 17 | 12 | 13 | 5 | 9 | 9 |
| Total | 22 | 24 | 24 | 31 | 19 | 15 | 33 | 33 | 39 | 25 | 22 | 23 |
Hay una gran diferencia en los patrones mensuales de riqueza de especies entre las 6 familias (tabla 1). Hesperiidae y Nymphalidae tuvieron la mayor riqueza de especies entre octubre y diciembre, si bien Hesperiidae tuvo riqueza alta también en junio y julio, en cambio, Nymphalidae en mayo y enero. Pieridae fluctuó en mayor grado (1-5 especies) entre abril y septiembre alcanzando el máximo en julio. Lycaenidae tuvo una riqueza más alta en la estación seca (abril, enero y febrero). En cuanto a Papilionidae y Riodinidae, se registró una especie o no se observó ninguna mensualmente.
Se muestra una variación mensual alta e irregular en la composición de especies, según el análisis de NMDS (estrés = 0.179; fig. 4). En el diagrama de ordenación, la composición de especies cambió considerablemente cada mes y no están separados claramente los datos de los meses de la estación seca y de la estación lluviosa.
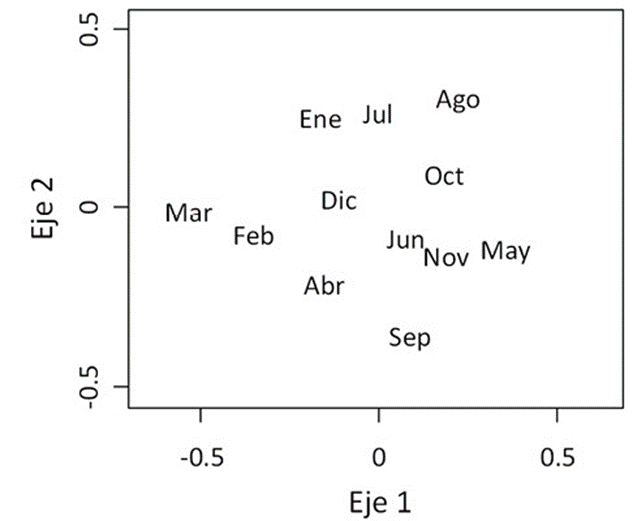
Figura 4 Diagrama de ordenación del análisis multivariado NMDS (por sus siglas en inglés), en el que se presentan las similitudes en la composición de especies de mariposas diurnas observadas en el monitoreo mensual realizado de abril de 2016 a marzo de 2017 en el Parque Ecológico Deportivo Cayalá, Guatemala.
Durante el periodo de los 5 años, se observaron 47 especies en ambas estaciones, 34 especies únicamente en la estación seca y 28 en la estación lluviosa (apéndice). La especie más dominante fue Heliconius charithonia (Nymphalidae), que se observa durante todo el año, con la abundancia más alta (≥ 10 individuos) en 5 meses de la estación seca y en octubre. Las especies que ocupan el segundo lugar en la dominancia (observadas en 11 meses) fueron Greta morgane (Nymphalidae) y Hermeuptychia hermes (el nombre de la especie podría cambiar, porque hermes aplica a las especies de América del Sur, según Cong y Grishin, 2014), seguidas por Eurema salome (Pieridae), Dircenna klugii y Tegosa guatemalena (Nymphalidae), que se observaron en 10 meses. A nivel de género, Heliconius, Anthanassa (Nymphalidae) y Remella (Hesperiidae) fueron los más dominantes registradas durante todo el año, seguidos por Phoebis (Pieridae), Greta y Hermeuptychia que aparecieron durante 11 meses.
Discusión
Se registraron 109 especies de mariposas diurnas en el parque Cayalá en los últimos 5 años y la riqueza de especies estimada con base en el índice de Chao II es 142.93. Estos resultados indican que este bosque, aunque es pequeño y aislado, tiene una riqueza alta de la superfamilia Papilionoidea, lo cual a la vez subraya la importancia de los remanentes de vegetación natural y áreas verdes para mantener la diversidad de insectos en la zona urbana propensa a sufrir de constante deterioro ambiental. Estos datos, en conjunto con la lista de aves (117 especies: FUNDAECO, datos no publicados) mencionada en la sección de sitio de estudio, son evidencias importantes de la riqueza de fauna que aun se observa en el parque Cayalá y sirven de base para el desarrollo y ejecución de planes y estrategias de conservación de la biodiversidad en la zona metropolitana. El presente estudio es el primero que comprende varios años de muestreo de los lepidópteros en la Ciudad de Guatemala.
El parque presenta una diversidad alta de mariposas a pesar de ubicarse en la zona urbana donde el bosque está aislado, mientras que numerosos estudios previos detectaron un impacto negativo de urbanización sobre la diversidad de lepidópteros (Ramírez-Restrepo y MacGregor-Fors, 2017). Se sugiere una posibilidad de que otros remanentes de bosques y áreas verdes tanto como los valles y barrancas alrededor del parque funcionen como un corredor de hábitats (Dennis et al., 2013; Haddad, 1999), con lo cual muchas especies de mariposas observadas en el parque podrían mantener sus poblaciones mediante la dispersión entre hábitats. Otra posibilidad es que estas especies pudieran sostener sus poblaciones dentro del parque sin conexión alta con otros hábitats de los alrededores. Estos resultados subrayan la necesidad e importancia de investigación de diversidad de mariposas del parque en relación con los elementos de paisaje (e.g., conectividad y fragmentación de hábitats) y con los caracteres de historia de vida de las especies (capacidad de vuelo y dispersión, voltinismo, hábito de alimentación).
La riqueza y composición de especies de mariposas cambiaron alta e irregularmente entre los meses y no se detectaron patrones marcados entre la estación seca y lluviosa (tabla 1, figs. 3, 4). Estos resultados contrastan con los de mariposas del bosque seco, donde se observaron muchas más especies en la época lluviosa que en la época seca (Yoshimoto et al., 2019). Aunque es difícil discutir los patrones estacionales irregulares del parque, el aumento de riqueza de especies al principio de la época seca (tabla 1) podría estar relacionado con la fenología de las plantas, porque en esta temporada aparecen flores de varias hierbas y arbustos como los chichicastes (Urera sp.: Urticaceae) y las familias Asteraceae y Acanthaceae (J. Yoshimoto, obs. pers.; M. R. Álvarez, com. pers.). Es por ello que se considera necesario el monitoreo cuantitativo mensual relacionado a factores bióticos y abióticos, especialmente a la fenología florística, para dilucidar la fenología de mariposas del parque Cayalá.
La falta de información de fenología previa a este estudio impide la discusión de las diferencias en la fluctuación entre las familias (tabla 1), pero es muy probable que las 6 especies observadas casi todo el año (Heliconius charithonia, Greta morgane, Hermeuptychia hermes, Dircenna klugii, Tegosa guatemalena y Eurema salome) sean multivoltinas; es decir, que se reproduzcan varias veces al año. También cabe mencionar que algunas de estas especies dominantes aumentaron su abundancia (≥ 10 individuos) en ciertos meses.
Orthos lycortas (Hesperiidae: Hesperiinae) no se reportó con anterioridad para Guatemala; sin embargo, hay un registro fotográfico de esta especie en el suroeste del país, en la Reserva Natural Los Tarrales, a 70 km del parque Cayalá (ver la página web Butterflies of America; Warren et al., 2017); por lo tanto, nuestro dato no es un registro nuevo para el país, pero sí podría corresponder a los primeros especímenes recolectados en el país.
Es importante resaltar el registro de Lasaia sessilis (Riodinidae: Riodininae) en el bosque de pino-encino del parque, porque este género tiende a encontrarse más comúnmente en las tierras bajas y cálidas con otros tipos de vegetación. En México esta especie es más abundante entre 0-1,500 m snm (Arellano-Covarrubias et al., 2019) y se registró principalmente en el bosque tropical subcaducifolio, bosque tropical perennifolio y bosque mesófilo de montaña; un solo ejemplar se recolectó en la vegetación similar al bosque de pino-encino de alrededor de 800 m snm (A. Arellano-Covarrubias, com. pers.). Se subraya que esta especie se recolectó en el parque solamente en el 2019 y que no se había observado en los años anteriores, incluyendo el periodo del monitoreo mensual. Es necesario obtener suficientes datos en varios sitios de Guatemala para determinar si la distribución de L. sessilis está cambiando recientemente o no.











 nueva página del texto (beta)
nueva página del texto (beta)


