Introducción
La declinación de las poblaciones de insectos y otros artrópodos es uno de los problemas más serios a nivel global, y es el resultado de múltiples factores, entre los que destacan la pérdida y degradación del hábitat, la contaminación y el cambio climático (Cardoso et al., 2020; Sánchez-Bayo y Wyckhuys, 2019). En particular, la degradación del hábitat y la contaminación ambiental están claramente asociadas a la cercanía a los asentamientos humanos, por lo que la diversidad de distintos grupos biológicos puede estar impactada por la proximidad a los asentamientos humanos y los disturbios asociados (Lhoest et al., 2020). Los asentamientos humanos tienen efectos negativos en la diversidad de insectos especialistas, lo que causa cambios en la composición de especies que derivan en procesos de homogenización biótica (Knop, 2016). Múltiples factores relacionados con la cercanía a asentamientos humanos, como la contaminación lumínica, causan una disminución en la abundancia y diversidad de las comunidades de artrópodos y modifican sus dinámicas tróficas y sus interacciones con plantas (Merckx y Van Dyck, 2019; Miles et al., 2019; Owens y Lewis, 2018). Por ejemplo, en la zona semiárida de Hidalgo, en el centro de México, la abundancia de abejas visitantes florales de Opuntia heliabravoana (Scheinvar, 1975) disminuye conforme aumenta el porcentaje de superficie impermeable de los asentamientos humanos (Sánchez-Echeverría et al., 2016).
Las zonas áridas y semiáridas abarcan 60% del territorio de México y presentan una gran riqueza de especies vegetales que se desarrollan en condiciones de temperatura alta y humedad limitada debido a la baja precipitación y altas tasas de evaporación (González-Medrano, 2012; Rzedowski, 1978). El valle del Mezquital es una zona árida del centro del país que comprende 33.7% del territorio de Hidalgo y se extiende hacia el norte del Estado de México y el este de Querétaro (Arroyo, 2001). La flora del valle del Mezquital es similar a la del desierto Chihuahuense y entre las plantas vasculares sobresalen, por su riqueza de especies, las familias Asteraceae, Poaceae, Fabaceae y Cactaceae (Rojas et al., 2013; Rzedowski, 1973).
El garambullo Myrtillocactus geometrizans (Mart. ex Pfeiff.) Console, 1897 (Fig. 1) es una cactácea columnar endémica de México (Bravo-Hollis y Sánchez-Mejorada, 1978). Ecológicamente es importante ya que incrementa la cantidad de materia orgánica en los suelos y evita la erosión, captura CO2, promueve la estabilización de suelos inestables y la infiltración de agua pluvial (González-Insuasti y Caballero, 2007; Luna-Morales y Aguirre, 2001). En matorrales abiertos destaca Myrtillocactus geometrizans como elemento arborescente y presenta una alta densidad fuera de las áreas cultivadas (González-Insuasti y Caballero, 2007; Luna-Morales y Aguirre, 2001). Se distribuye principalmente en zonas áridas, en los estados de Hidalgo, Querétaro, Guanajuato, Michoacán, Jalisco, San Luis Potosí, Zacatecas, Tamaulipas, Nuevo León, Estado de México, Puebla, Veracruz, Guerrero y Oaxaca (Guzmán et al., 2003). Las flores son tubulares de color blanco verdoso y producen frutos comestibles del tipo baya, de color azul-rojizo (Arias, 2010). En el valle de Tehuacán, en el centro de México, la temporada de fructificación va de marzo a septiembre y se ha reportado que cada planta adulta produce en promedio 7,650 frutos; sus semillas son dispersadas principalmente por aves y mamíferos (Pérez-Villafaña y Valiente-Banuet, 2009).

Figura 1 Plantas de garambullo (Myrtillocactus geometrizans) en sitios lejos (A, B) y cerca (C, D) de construcciones humanas en el valle del Mezquital, Hidalgo, México.
Aunque se han encontrado compuestos químicos del garambullo que inhiben el crecimiento de algunos insectos, como el lepidóptero Spodoptera frugiperda (J.E. Smith, 1797) y el coleóptero Tenebrio molitor Linnaeus, 1758 (Céspedes et al., 2005), las flores de esta planta son visitadas por himenópteros, dípteros, hemípteros, coleópteros, tisanópteros, arañas y lepidópteros (Maqueda-Díaz y Callejas-Chavero, 2018). Además, se ha reportado un efecto mutualista entre el garambullo y ciertas hormigas, ya que éstas disminuyen la tasa de parasitismo de insectos escama (Hemiptera: Coccidae) (Martínez-Hernández y Callejas-Chavero, 2015; Martínez-Hernández et al., 2015). Sin embargo, no se han descrito los ensambles de artrópodos que podrían hacer uso de los frutos del garambullo como recurso alimenticio, refugio, sitio para captura de presas o de apareamiento. Los ensambles en recursos efímeros como frutos, excremento, hongos o carroña son biológicamente importantes porque la agregación de individuos en estos parches determina la coexistencia local de especies (Atkinson y Shorrocks, 1981; Hartley y Shorrocks, 2002; Ruokolainen y Hanski 2016). Por ello, los ensambles en recursos efímeros constituyen modelos ecológicos donde se pueden investigar los mecanismos que permiten la coexistencia, y por tanto, la diversidad biológica de las comunidades.
El objetivo de este trabajo fue describir la abundancia, riqueza, diversidad y composición de especies de los ensambles de artrópodos asociados a los frutos del garambullo en 2 localidades del valle del Mezquital en México. Además, en un primer intento de evaluar la influencia de la distancia a construcciones humanas en dichos ensambles, se estudiaron garambullos en sitios cerca y lejos de construcciones. Utilizamos el término “ensamble” sensuFauth et al. (1996) para definir el conjunto de especies del mismo grupo taxonómico (Arthropoda) que coexisten en una región (valle del Mezquital) y utilizan un mismo recurso ecológico (frutos del garambullo). Se predijo que los sitios cercanos a construcciones humanas tendrán una menor abundancia, riqueza y diversidad de artrópodos en los frutos que los sitios lejanos. Además, si la distancia espacial entre los sitios y la distancia a asentamientos humanos cambian las condiciones ambientales en que se desarrolla la planta, entonces se esperaba que la composición de especies fuese diferente, tanto entre localidades, como entre sitios ubicados a diferente distancia de las construcciones humanas.
Materiales y métodos
El estudio se llevó a cabo en 2 localidades (Huapilla en el municipio de Alfajayucan: 20º25’23.98” N, 99º22’20.29” O, 1,884 m snm y Dantzibojay en el municipio de Huichapan: 20º26’40.99” N, 99º35’27.14” O, 2,107 m snm), ubicadas a 23 kilómetros de distancia entre sí dentro del valle del Mezquital, Hidalgo, México. Los muestreos de artrópodos se realizaron durante junio y julio de 2018, por ser los meses en los cuales los frutos alcanzan su madurez (Pérez-Villafaña y Valiente-Banuet, 2009). En cada localidad se identificó un sitio cerca y uno lejos de los asentamientos humanos. En ambas localidades la vegetación predominante es matorral xerofilo (Rojas et al., 2013). Se consideró como sitio cercano aquel donde las plantas de garambullo se encontraban en los alrededores de las casas, con una separación máxima de 10 metros de construcciones humanas (Fig. 1). Como sitio lejano, se consideró un área donde las plantas de garambullo se encontraban a más de 20 metros de construcciones humanas, y además, con poco flujo de personas, ya que no son de fácil acceso.
En cada uno de los 4 sitios de estudio (uno cerca y uno lejos de construcciones humanas en cada una de las 2 localidades), se eligieron 15 plantas de M. geometrizans con una separación de al menos 10 m entre plantas (30 plantas por localidad, 60 en total). En cada planta, se realizó una búsqueda directa de artrópodos en los frutos durante 1 hora en la mañana (entre 8:00 y 10:00), 1 hora a medio día (entre 13:00 y 15:00) y 1 hora por la tarde (entre 17:00 y 19:00). Los artrópodos recolectados en las 3 horas se juntaron para obtener en total 60 muestras, 1 por cada planta. Los artrópodos se recolectaron de forma manual con la ayuda de pinzas entomológicas y se guardaron en frascos con alcohol al 70%. Se hizo una estimación visual del número de frutos maduros, registrándose en promedio 348.97 frutos por planta (mínimo: 60, máximo: 1,000). Sin embargo, no fue posible realizar un conteo exacto en todas las plantas estudiadas.
Para la identificación, se utilizaron claves taxonómicas (Aldama y Medrano, 2006; Ayala-Barajas y Meléndez-Ramírez, 2017; Borror y White, 1970; Delgado et al., 2000; Goula y Mata, 2015; Grismado et al., 2014; McGavin, 2000; Medina y Lopera-Toro, 2000; Michener, 2007; Rengifo-Correa y González, 2011) y se compararon algunos ejemplares con colecciones entomológicas del Centro de Investigaciones Biológicas de la Universidad Autónoma del Estado de Hidalgo (CIB-UAEH). Los individuos se identificaron a nivel de familia y morfoespecie. Finalmente, se realizó el montaje únicamente de escarabajos para dejarlos como referencia en el Laboratorio de Ecología de Comunidades del CIB-UAEH, mientras que los ejemplares de otros ordenes se conservaron en alcohol al 70%.
Todos los análisis de datos se realizaron con el programa R (R Core Team, 2018) con los paquetes que se citan para cada caso. El logaritmo de la abundancia por muestra entre los 4 ensambles se comparó mediante un Anova y pruebas pos-hoc de Tukey. Para evaluar la eficiencia de los inventarios, se calculó la cobertura de muestreo, que es el porcentaje de la comunidad que ha sido detectado durante el muestreo, con base en la proporción de los individuos que pertenecen a las especies ya registradas en las muestras (Chao y Jost, 2012). La cobertura de muestreo se obtuvo con el paquete iNEXT (Hsieh et al., 2018).
Se compararon la riqueza y diversidad de artrópodos entre los 4 sitios de muestreo mediante los números de Hill (q D sensuJost, 2006), con 3 órdenes de diversidad q = 0, 1 y 2. La diversidad de orden 0 (0 D) es el número de especies observado, la diversidad de orden 1 (1 D) se basa en la riqueza y equidad de todas las especies observadas y equivale al exponencial del índice de entropía de Shannon-Wiener; mientras que la diversidad de orden 2 (2 D), es la diversidad de las especies más abundantes y equivale al inverso del índice de dominancia de Simpson (Jost, 2006). Estas medidas, que se expresan en unidades de número efectivo de especies (Jost, 2006), se calcularon utilizando el paquete iNEXT (Hsieh et al., 2018). La diversidad de los 4 ensambles se comparó combinando los procesos de interpolación (rarefacción) y extrapolación descritos por Chao et al. (2014), para estandarizar a un tamaño de muestra común. Para comparar estadísticamente la diversidad entre ensambles, se calcularon intervalos de confianza al 95% y se observó el traslape de sus valores a un mismo número de individuos (interpolando las muestras grandes y extrapolando las muestras con menor número de ejemplares recolectados).
Para comparar la composición de morfoespecies de artrópodos entre sitios, se realizó un análisis de agrupamiento con el método UPGMA, con base en el índice de similitud de Bray-Curtis. Además, se realizó un análisis multivariado permutacional de varianza (Permanova), que permite probar la respuesta simultánea de múltiples variables (especies) en uno o más factores en un diseño experimental de análisis de varianza, sobre la base de cualquier medida de similitud, utilizando métodos de permutación (Anderson y Walsh, 2013). En este caso, con las 60 muestras recolectadas, se realizó un Permanova de 2 factores, para evaluar la disimilitud en la composición de morfoespecies entre localidades (Alfajayucan y Huichapan) y entre distancias a construcciones humanas (sitios cerca y lejos). El Permanova se realizó con el paquete vegan (Oksanen et al., 2018).
Resultados
Se recolectaron 560 individuos adultos, más 13 ninfas que no fueron consideradas en este trabajo. Los ejemplares pertenecen a 93 morfoespecies, agrupadas en 48 familias de 8 órdenes de artrópodos (Tabla 1). El orden con más morfoespecies fue Hymenoptera (38), seguido de Coleoptera (15), Diptera (14), Aracnida (14), Hemiptera (7), Lepidoptera (2), Orthoptera (2) y Odonata con una especie: Rhionaeschna psilus (Calvert, 1947). La mayor abundancia fue del orden Hymenoptera (400 individuos), seguido de Diptera (64) y Coleoptera (57), mientras que el menos abundante fue Odonata con 1 solo individuo (Fig. 2). En Alfajayucan se registró mayor abundancia en el sitio lejos de construcciones humanas (201 individuos, cobertura de muestreo 90.59%) que el sitio cercano a construcciones (107 individuos, cobertura de muestreo 82.31%). En Huichapan ocurrió lo contrario, pues se registró una mayor abundancia en el sitio cercano (185 individuos, cobertura de muestreo 90.31%) que en el sitio lejos de construcciones (67 individuos, cobertura de muestreo 80.82%) (Fig. 2). La abundancia promedio por planta fue estadísticamente distinta entre los 4 ensambles (F3,56 = 7.26, p < 0.001), siendo solamente el sitio de Huichapan lejos el que resultó con menor abundancia que los otros 3 sitios (p < 0.05).
Tabla 1 Número total de morfoespecies y número de individuos de artrópodos recolectados en frutos de garambullo (Myrtillocactus geometrizans) en sitios cerca y lejos de asentamientos humanos, en Alfajayucan y Huichapan, Hidalgo, México.
| Orden | Familia | Morfoespecies | Alfajayucan cerca |
Alfajayucan lejos |
Huichapan cerca |
Huichapan lejos |
Total |
| Aracnida | Araneidae | 5 | 4 | 1 | 5 | ||
| Oxyopidae | 1 | 1 | 1 | ||||
| Salticidae | 5 | 4 | 1 | 5 | |||
| Theridiidae | 1 | 1 | 1 | ||||
| Thomisidae | 2 | 1 | 1 | 2 | |||
| Coleoptera | Cerambycidae | 2 | 5 | 2 | 3 | 10 | |
| Cetoniidae | 3 | 1 | 7 | 7 | 7 | 22 | |
| Cleridae | 1 | 1 | 1 | ||||
| Crysomelidae | 2 | 3 | 1 | 4 | |||
| Curculionidae | 1 | 10 | 10 | ||||
| Lycidae | 1 | 1 | 1 | 2 | |||
| Lyctidae | 1 | 1 | 1 | ||||
| Melolonthidae | 1 | 2 | 1 | 3 | |||
| Phalacridae | 1 | 2 | 2 | ||||
| Staphylinidae | 1 | 1 | 1 | ||||
| Tenebrionidae | 1 | 1 | 1 | ||||
| Diptera | Calliphoridae | 2 | 1 | 1 | 1 | 3 | |
| Chloropide | 1 | 2 | 2 | ||||
| Culicidae | 1 | 1 | 1 | 2 | |||
| Drosophilidae | 1 | 1 | 1 | 2 | |||
| Muscidae | 2 | 14 | 2 | 16 | |||
| Nematocera (suborden) | 2 | 8 | 8 | ||||
| Stratiomyidae | 1 | 8 | 3 | 4 | 3 | 18 | |
| Tephritidae | 1 | 2 | 1 | 3 | |||
| Tipulidae | 1 | 1 | 1 | ||||
| Ulidiidae | 2 | 4 | 2 | 3 | 9 | ||
| Hemiptera | Anthocoridae | 1 | 1 | 1 | |||
| Coreidae | 3 | 1 | 10 | 3 | 14 | ||
| Largidae | 1 | 1 | 1 | ||||
| Reduviidae | 1 | 1 | 1 | 2 | |||
| Scutelleridae | 1 | 2 | 2 | ||||
| Hymenoptera | Apidae | 6 | 7 | 7 | 7 | 11 | 32 |
| Braconidae | 1 | 2 | 2 | ||||
| Chalcididae | 1 | 1 | 1 | ||||
| Colletidae | 1 | 1 | 1 | ||||
| Formicidae | 7 | 11 | 19 | 30 | 14 | 74 | |
| Halictidae | 5 | 1 | 8 | 4 | 1 | 14 | |
| Heloridae | 1 | 2 | 2 | ||||
| Ichneumonidae | 1 | 1 | 1 | ||||
| Pompilidae | 1 | 1 | 1 | ||||
| Sphecidae | 1 | 3 | 1 | 4 | |||
| Torymidae | 1 | 1 | 1 | ||||
| Vespidae | 12 | 54 | 103 | 94 | 16 | 267 | |
| Lepidoptera | Lepidoptera (orden) | 2 | 2 | 2 | |||
| Odonata | Aeshnidae | 1 | 1 | 1 | |||
| Orthoptera | Acrididae | 2 | 1 | 1 | 2 | ||
| Total | 93 | 107 | 201 | 185 | 67 | 560 |
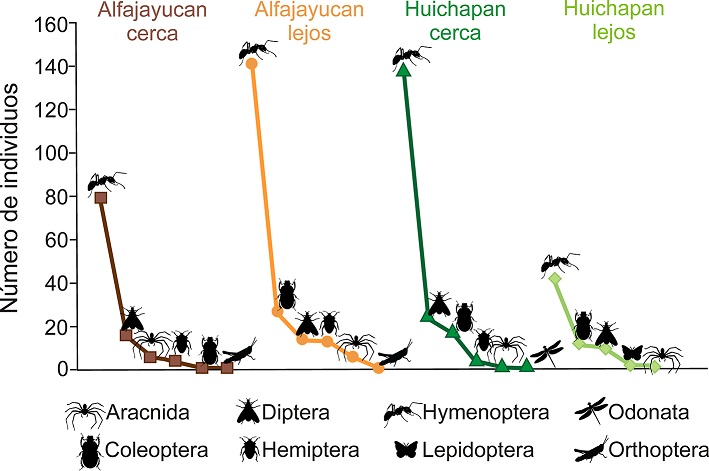
Figura 2 Abundancia de los distintos órdenes de artrópodos registrados en frutos de garambullo (Myrtillocactus geometrizans) en sitios cerca y lejos de construcciones humanas en 2 localidades (Alfajayucan y Huichapan) del valle del Mezquital, Hidalgo, México.
El sitio con mayor riqueza de morfoespecies fue el de Alfajayucan lejos con 42 morfoespecies, seguido del de Huichapan cerca (36), Alfajayucan cerca (33) y Huichapan lejos (27). Sin embargo, al comparar la riqueza de morfoespecies (0 D, diversidad de orden q = 0) entre los 4 sitios extrapolando los valores de los sitios con menor abundancia para estandarizar a un mismo número de individuos (202), se observó que no existen diferencias significativas (Fig. 3).
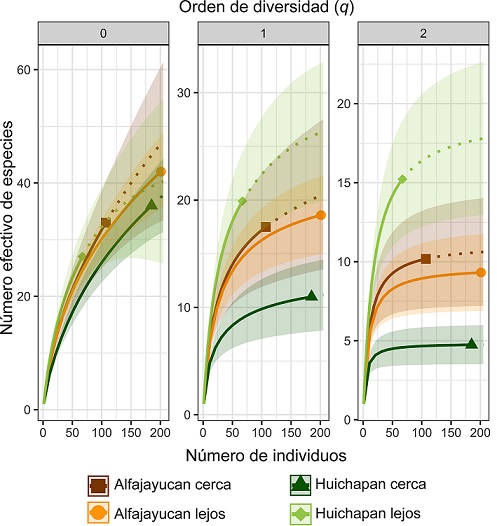
Figura 3 Curvas de interpolación y extrapolación de la riqueza y diversidad de artrópodos en frutos de garambullo en 4 sitios (cerca y lejos de construcciones humanas en 2 localidades) del valle del Mezquital. La línea continua de cada curva es la porción interpolada, el símbolo marca la diversidad observada y la línea punteada es la porción extrapolada. Las bandas sombreadas son los intervalos de confianza al 95%. De izquierda a derecha se muestra el orden q de la diversidad, expresada como número efectivo de especies: 0D: riqueza de morfoespecies, 1D: diversidad de todas las morfoespecies y 2D: diversidad de especies abundantes. Las curvas fueron extrapoladas hasta 202 individuos, que corresponde a la mayor abundancia registrada.
En los sitios cerca y lejos de construcciones humanas de la localidad de Alfajayucan no se detectaron diferencias en la diversidad de todas las morfoespecies ( 1 D) ni en la diversidad de especies más abundantes ( 2 D) (Fig. 3). Sin embargo, en la localidad de Huichapan el sitio lejano tuvo una diversidad de artrópodos ( 1 D y 2 D) significativamente mayor que el sitio cercano a construcciones humanas (Fig. 3). Aún sin extrapolar el número de individuos, y a pesar de tener la menor abundancia y menor número de especies, el sitio lejano en Huichapan tuvo una diversidad de orden 1 ( 1 D = 19.89 especies efectivas) que es casi el doble que la diversidad del sitio cercano a construcciones humanas ( 1 D = 10.98). Esta diferencia es aún mayor cuando se compara la diversidad de orden 2, pues el sitio lejano tiene 3.21 veces mayor diversidad que el sitio cercano a construcciones humanas (sitio lejos 2 D = 15.22, sitio cerca 2 D = 4.74).
La similitud en la presencia y abundancia de morfoespecies entre los 4 sitios fue muy baja (Fig. 4). La mayor similitud se encontró entre los 2 sitios de Alfajayucan (Bray-Curtis: 0.4090), seguida por la similitud entre los 2 sitios de Huichapan (0.3413). Esta alta disimilitud en la composición de los ensambles de artrópodos se corroboró con el Permanova (Tabla 2), que mostró diferencias estadísticamente significativas en la composición de morfoespecies entre localidades (Alfajayucan y Huichapan) y entre distancia de los sitios (cerca y lejos de construcciones humanas).
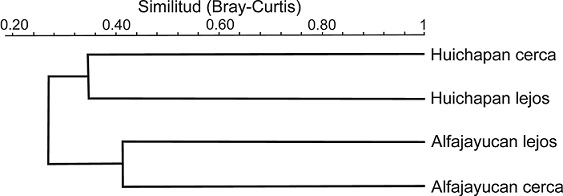
Figura 4 Análisis de agrupamiento (método UPGMA) basado en el índice de similitud de Bray-Curtis de la composición de morfoespecies de artrópodos encontrados en frutos de garambullo en 4 sitios (cerca y lejos de construcciones humanas en 2 localidades del valle del Mezquital).
Tabla 2 Resultados del Permanova usando el índice de similitud de Bray-Curtis en la composición de morfoespecies de artrópodos en 2 localidades (Alfajayucan y Huichapan, Hidalgo) y 2 distancias a asentamientos humanos (cerca y lejos). Número de permutaciones: 999.
| Grados de libertad |
Suma de cuadrados |
Cuadrados medios |
Pseudo-F | p | |
| Localidad | 1 | 2.6091 | 2.6091 | 8.0163 | < 0.001 |
| Distancia | 1 | 1.3420 | 1.3420 | 4.1232 | < 0.001 |
| Residuales | 57 | 18.5521 | 0.3255 | ||
| Total | 59 | 22.5031 | 1 |
Discusión
Este es el primer estudio que describe la diversidad de los ensambles de artrópodos que hacen uso de los frutos del garambullo, ya sea directamente como recurso alimenticio, o bien como sitio de refugio, de apareamiento o de captura de presas. Las elevados valores de la abundancia y de la diversidad de artrópodos registrados indican que los frutos del garambullo resultan altamente atractivos para la fauna de artrópodos de esta zona árida del centro de México, aun cuando son un recurso efímero. La distribución de morfoespecies registradas en los distintos órdenes de artrópodos coincide con lo reportado por Maqueda-Díaz y Callejas-Chavero (2018), quienes señalan que dentro de los visitantes florales de Myrtillocactus geometrizans, el grupo predominante son los himenópteros, pero también están presentes los dípteros, hemípteros, coleópteros y lepidópteros. De acuerdo con nuestros resultados, estos grupos de artrópodos también tienen una relación con la planta durante la época de fructificación, ya que en general, las cactáceas ofrecen recursos y un microhábitat favorable para las comunidades de artrópodos (Martínez-Peralta y Mandujano, 2011; Orendain-Méndez et al., 2016). En particular, la predominancia de los himenópteros puede deberse tanto a su comportamiento social, que hace que se encuentren varios individuos de la misma especie juntos, como a sus relaciones estrechas con las plantas, como se describe en los siguientes párrafos.
La familia Formicidae fue abundante en los 4 sitios, lo cual es contrario a la idea de que las comunidades de hormigas son poco abundantes en matorrales y pastizales áridos (Flores-Maldonado et al., 1999; Rojas y Fragoso, 2000). En nuestro estudio, durante los muestreos realizados se observó que las hormigas consumían los frutos de garambullo y en algunos casos se observó que las colonias estaban en la misma planta, por lo que las hormigas de esta zona árida podrían ser buenas indicadoras ecológicas para monitorear, por ejemplo, la recuperación de áreas degradadas o el grado de antropización ambiental, como lo proponen Arcila y Lozano-Zambrano (2003). En matorrales xerófilos de Hidalgo también se ha registrado una alta diversidad de hormigas asociadas a cactáceas como Opuntia sp. (Gómez-Otamendi et al., 2018). En particular, las hormigas recolectadas se encontraban alimentándose de los frutos del garambullo, pero posiblemente tienen otras interacciones más complejas. Por ejemplo, el garambullo tiene nectarios extraflorales que pueden atraer a las hormigas como fuente de alimento, mientras que las hormigas en el garambullo protegen a otros insectos al reducir sus parasitoides y protegen a la misma planta contra fitófagos (Martínez-Hernández y Callejas-Chavero, 2015; Mauseth et al., 2016). Esto nos hace pensar que las interacciones ecológicas son determinantes de la alta diversidad de especies de hormigas en esta zona árida.
Además de las hormigas, dentro de los himenópteros, las avispas y abejas (Vespidae, Apidae, Halictidae) también se registraron con alta abundancia y riqueza. En matorrales xerófilos de Hidalgo cercanos al valle del Mezquital se han reportado hasta 55 especies de abejas nativas asociadas a flores de Opuntia spp. (Ávila-Gómez et al., 2019). En este trabajo, no resulta sorprendente la abundancia de estos grupos, ya que tanto los abejorros como las avispas consumen frutos de cactáceas (Kevan et al. 2005; Santos et al., 2007). Muy probablemente este consumo sea parte de una dieta generalista dependiente de la disponibilidad efímera de estos recursos. Además, como insectos depredadores, es posible que las avispas también aprovechen los frutos como parches donde se concentran otros artrópodos que podrían ser sus presas.
La predicción planteada en este trabajo ocurrió solamente de forma parcial en la localidad de Huichapan, donde los frutos de garambullo del sitio cercano a construcciones humanas tuvieron una menor diversidad (1 D y 2 D) de artrópodos, a pesar de tener más individuos y especies que el sitio lejano. Esto indica que en el sitio cercano a construcciones hay una baja equidad en la distribución de las abundancias entre morfoespecies de artrópodos. La razón de esta baja equidad es que 2 morfoespecies suman 54.78% de la abundancia en este sitio -una morfoespecie de Vespidae con 79 individuos (42.02%) y una morfoespecie de Formicidae con 24 individuos (12.76%)- mientras que 20 morfoespecies se registraron con un solo individuo.
De acuerdo con lo esperado, se registraron diferencias en la composición de especies, tanto entre localidades como entre sitios ubicados a diferente distancia a construcciones humanas, ya que los artrópodos son capaces de responder a cambios del ambiente dependiendo de sus requerimientos ecológicos (Cardoso, 2020; Samways, 1994). Los cambios en la composición de especies obedecen a múltiples factores, tales como la distancia espacial entre sitios de muestreo, los cambios en las condiciones ambientales, la capacidad de dispersión de las especies, entre otros (Soininen et al., 2018). Estos factores, y otros asociados a las actividades humanas, podrían estudiarse a diferentes escalas (local, de paisaje y regional) considerando los ensambles de artrópodos en frutos del garambullo. También será necesario diseñar estudios que permitan evaluar de forma directa la distancia a asentamientos humanos en gradientes más extensos. Sin embargo, en este estudio la alta disimilitud también podría deberse a que los muestreos fueron insuficientes, y probablemente, con un mayor esfuerzo de muestreo se registraría un porcentaje distinto de especies compartidas entre los distintos sitios, aumentando o disminuyendo de esta manera la similitud en la composición de los ensambles de artrópodos. Alternativamente, al continuar el trabajo taxonómico para identificar todos los ejemplares a nivel de especie, posiblemente disminuya también la disimilitud ya que algunos ejemplares podrían haber sido considerados como distintas morfoespecies cuando posiblemente pertenecen a la misma especie. Finalmente, cabe mencionar que en este trabajo los muestreos se realizaron únicamente durante el día y es posible que haya artrópodos que estén activos únicamente durante la noche, por lo que podría haber una segregación temporal en el uso de los frutos del garambullo.
En general, los resultados de este trabajo revelan a los ensambles de artrópodos en frutos del garambullo como modelos de estudio de fácil acceso para investigar distintos aspectos de ecología de comunidades en recursos efímeros de zonas áridas, tales como la estructura de las redes tróficas, las interacciones intra e interespecíficas, la repartición de nicho y la dinámica de metacomunidades. Además, su importancia ecológica es evidente, ya que los artrópodos realizan funciones importantes en los procesos ecosistémicos, como la descomposición, la polinización, la depredación y el parasitismo (Cardoso, 2020; Sánchez-Bayo y Wyckhuys, 2019). A su vez, al igual que otras cactáceas, Myrtillocactus geometrizans puede considerarse como una especie sombrilla que brinda múltiples recursos a distintos grupos biológicos en las zonas áridas de la región.











 nova página do texto(beta)
nova página do texto(beta)


