Introducción
La pérdida de ambientes naturales es una de las mayores amenazas para la biodiversidad a escala global con una disminución aproximada de 5 millones de hectáreas de bosque por año desde 2015 a la actualidad, debido al incremento e intensificación de actividades humanas como la agricultura, ganadería, tala selectiva y turismo, entre otras (FAO, 2020). Entre las principales consecuencias de estas prácticas se destacan la simplificación y fragmentación del paisaje, incluyendo el incremento de la densidad de parches o fragmentos de bosque, como su grado de aislamiento (Fahrig et al., 2011; Haddad et al., 2015). Dicho escenario genera una notable alteración de la estructura del paisaje, particularmente en cuanto a su composición y configuración espacial (Arroyo-Rodríguez et al., 2017; Galán-Acedo et al., 2019). Existen evidencias de la forma en que se ve afectada la calidad del hábitat por la pérdida gradual de la diversidad vegetal, reducción del tamaño de los fragmentos y aumento del efecto borde. Sumado a ello, es notable el efecto de la introducción de especies exóticas y un marcado aumento de la cercanía entre asentamientos humanos y fauna silvestre (Arroyo-Rodríguez et al., 2017; Bajaru et al., 2019; Fahrig et al., 2011; Gökyer, 2013; Haddad et al., 2015; Ibáñez et al., 2014).
Estudios a escala global y regional sugieren que la simplificación del paisaje afecta negativamente parámetros poblacionales, comportamentales y del estado sanitario de los primates (Chaves y Bicca-Marques, 2017; Estrada et al., 2017; Galán-Acedo et al., 2019; Goffard et al., 2008; Grande et al., 2020; Martínez-Mota et al., 2018; Mbora y McPeek, 2009; Mekonnen et al., 2017; Oklander et al., 2010; Zunino et al., 2007). Por ejemplo, en Etiopía se encontró que grupos de Chlorocebus djamdjamensis (cercopiteco de las montañas de Bale) que habitan paisajes fragmentados presentan cambios en los mecanismos de asignación de energía a diferentes actividades (mayor tiempo de descanso y menor tiempo para alimentación y movimiento) en relación a grupos que habitan ambientes continuos (Mekonnen et al., 2017). En ambientes fragmentados de México, grupos de Ateles geoffroyi (mono araña) mostraron una relación positiva entre la proporción de inmaduro: hembra adulta (relación que se utiliza para evaluar el éxito reproductivo de las hembras y el estado y tendencia poblacional) y el porcentaje de cobertura de bosques (Galán-Acedo et al., 2019).
En el Neotrópico, se evaluaron los efectos del cambio del paisaje en diversas características poblacionales y uso de hábitat de primates silvestres. Para los monos aulladores (Alouatta), se encontró que pueden habitar ambientes con distintos niveles de alteración, como bosques con tala moderada o selectiva y en áreas agrícolas o sitios cercanos a asentamientos humanos (Chaves y Bicca-Marques, 2017; Goffard et al., 2008; Grande et al., 2020; Martínez-Mota et al., 2018; Zunino et al., 2007). Más allá de estos antecedentes, los estudios a escala del paisaje utilizando geotecnologías en los ambientes habitados por primates se enfocan principalmente en ciertas especies (A. caraya:Grande et al., 2020; A. guariba clamitans: Almeida y Silva et al., 2017; A. palliata: Anzures-Dadda y Manson, 2007; Puig-Lagunes et al., 2016; A. pigra: Martínez-Mota et al., 2018; Pozo-Montuy et al., 2013). Para A. palliata en la región de Los Tuxtlas, Veracruz, México se encontró que en un ambiente altamente fragmentado, los grupos de aulladores prefirieron fragmentos de forma regular, mayores a 32 ha y en cercanía a otros fragmentos (distantes a menos de 200 m) (Arroyo-Rodríguez et al., 2008). Por otra parte, para A. guariba clamitans en Taubaté, San Pablo, Brasil, se encontró que ocuparon parches de bosque mayores a 7 ha, aunque no se encontró relación entre la ocupación y la conectividad y forma de los parches (Almeida y Silva et al., 2017). Para A. caraya, un estudio reciente llevado a cabo en la región de El Cerrado, Goias, Brasil concluyó que la ocupación de los fragmentos de bosque por parte de los primates se relaciona positivamente con el número de parches disponibles en el área y a la forma de estos, utilizando parches irregulares (Grande et al., 2020).
La especie de estudio, el mono aullador negro y dorado (Alouatta caraya), presenta la distribución más austral entre los monos platirrinos. Habita bosques fragmentados y en galería en zonas de tierra firme, así como bosques continuos en islas del noreste de Argentina (Oklander et al., 2019), por otra parte, también es reportado en el bosque Atlántico del sur de Brasil, el noreste de Bolivia y Paraguay (Cortés-Ortiz et al., 2015). Forma grupos de tamaño variable, pero en general su composición y tamaño depende de la estructura de los bosques que habita (Oklander et al., 2019). A lo largo de su distribución en Argentina, gran parte de las poblaciones de A. caraya se encuentran fuera de las áreas naturales protegidas. A nivel internacional (IUCN RedList), la especie se encuentra categorizada como preocupación menor (Fernández-Duque et al., 2008), mientras que en Argentina, recientemente se la categorizó como vulnerable ya que sus hábitats han sido alterados como consecuencia de la deforestación para incrementar el uso de tierras para actividades humanas (Oklander et al., 2019). Su principal hábitat, el noreste del Parque Chaqueño argentino, presenta la mayor tasa de deforestación del país con 7% de pérdida anual entre 2007 y 2018, lo que corresponde a aproximadamente 2,600,000 ha de tierras forestales de la mencionada región (UMSEF, 2019). Sin embargo, hasta el momento no existen estudios en Argentina donde se haya evaluado cómo afectan los atributos espaciales del paisaje en los patrones de ocupación y características demográficas de la especie. Con base a lo anterior, nuestro objetivo fue determinar qué atributos del paisaje influyen en el uso de los fragmentos de bosque y en las características demográficas del mono aullador negro y dorado (A. caraya) en un ambiente fragmentado del noreste argentino. Nuestras hipótesis de trabajo fueron, en primer lugar, que los atributos del paisaje (área de parches, índice de forma de parches, abundancia de parches vecinos, aislamiento entre parches y abundancia de corredores) se correlacionan positivamente con la ocupación de parches de bosques por parte de los grupos de Alouatta caraya. La segunda hipótesis de trabajo fue que el tamaño medio de los grupos y la relación inmaduro: hembra es mayor en los parches de mayor superficie.
Materiales y métodos
El estudio se llevó a cabo entre junio de 2017 y noviembre de 2018 en la Estancia Ana María (27°24’36” S, 59°06’48” O), Departamento Libertad, Provincia de Chaco, Argentina. La estancia es una propiedad privada rural de 900 ha, ubicada a 2.5 km de la localidad de Puerto Tirol y a 8 km de Resistencia, la ciudad capital de la mencionada provincia (Fig. 1). Desde el punto de vista biogeográfico, el área pertenece al Distrito Chaqueño Oriental de la Provincia Chaqueña y se caracteriza por presentar clima húmedo con amplias variaciones térmicas entre invierno y verano, con temperatura promedio de 22 ºC y precipitaciones que varían entre 500 y 1,200 mm anuales (Bianchi y Cravero, 2010; Cabrera, 1994). La vegetación se caracteriza por la presencia de bosques fragmentados naturalmente, donde los fragmentos de bosque se encuentran inmersos en una matriz de pastizales naturales (Cabrera, 1994). En las últimas décadas, la región, y específicamente el área de estudio, fueron explotadas intensamente, principalmente para la extracción de ejemplares de quebracho colorado (Schinopsis balansae Engl.) de los cuales se obtiene tanino, recurso con múltiples usos (Cuadra, 2011). Desde 2011, la estancia se encuentra sin explotación maderera, pero, por el contrario, se ha incrementado la actividad ganadera.
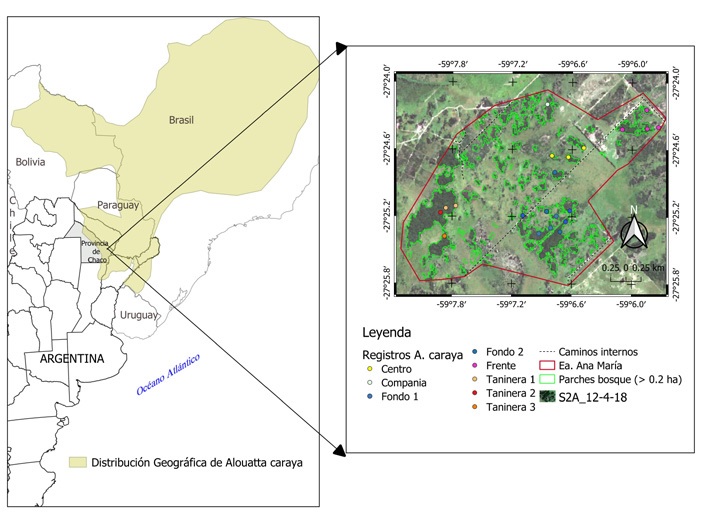
Figura 1 Distribución geográfica de Alouatta caraya (modificado a partir de Oklander et al., 2019) a la izquierda, y a la derecha, ubicación del sitio de estudio con detalle de los parches de bosques (> 0.2 ha) obtenidos de la clasificación de una imagen Sentinel 2; además, se muestran los caminos internos, los límites de la Estancia Ana María y los registros de grupos de A. caraya.
El área de estudio está compuesta por una matriz de pastizales con gramíneas diferenciadas en 2 estratos: de bajo (principalmente pasturas) y alto porte (pajonales). La matriz se encuentra ocupada por fragmentos de bosque pluriespecíficos altos, cerrados, con alta cobertura y un estrato arbustivo escaso, representando el paisaje típico de la región (Cabrera, 1994). Tomando esto en consideración, se definió como parche o fragmento a un remanente discreto de bosque con un área ≥ 0.2 ha (Fig. 2A) y separado de otros parches por otras coberturas de suelo (suelo de baja cobertura, pastizales, arbustales, cuerpos de agua, infraestructura, etc.) y excluyendo corredores menores a 20 m (Fig. 2D) debido a que estos permiten el paso de los monos por la copa de los árboles (Anzures-Dadda y Manson, 2007; Zunino et al., 2007). Para describir la configuración espacial de los parches de bosque dentro del área, se utilizaron herramientas de geomática y datos derivados de sensores remotos y de terreno. En primer lugar, se descargaron, pre-procesaron y procesaron imágenes satelitales del área de estudio provistas gratuitamente por el sensor Sentinel 2 del 12 de abril de 2018 (ESA, 2015), que brinda información de mediana resolución espacial (10, 20 y 60 m, respectivamente, en las diferentes bandas del sensor), espectral (13 bandas) y temporal (aproximadamente 5 días). Utilizando el software libre SNAP (ESA), se importaron, visualizaron, re-muestrearon (20 m), recortaron, y se construyeron compuestos multibandas a los cuales se les realizó una clasificación no supervisada (Kmeans) utilizando el clasificador de máxima verosimilitud (Aceñolaza et al., 2014). Siguiendo a Congalton y Green (2019), se validó la clasificación mediante una matriz de confusión utilizando 36 puntos de control obtenidos en terreno con GPS, representando las diferentes coberturas de suelo como clases temáticas (Fig. 2A).
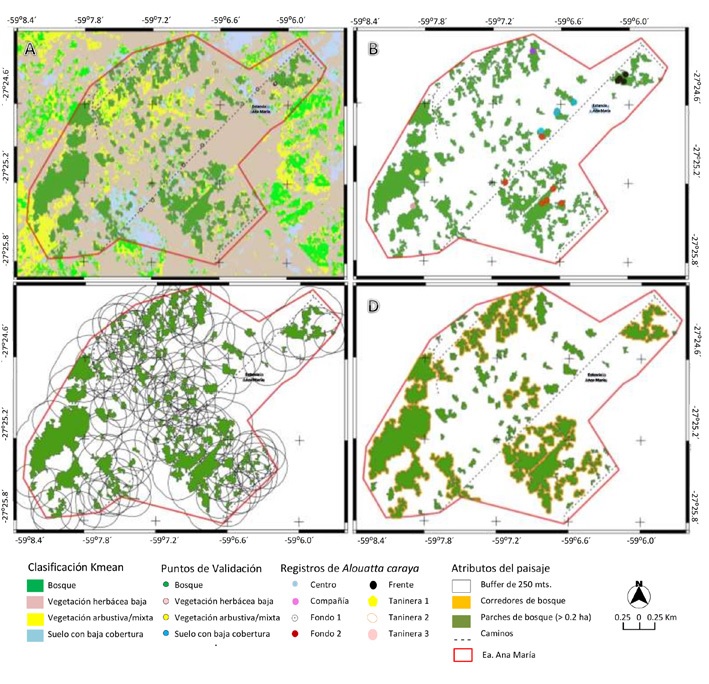
Figura 2 Mapas de atributos del paisaje. A: Clases de cobertura del suelo, puntos de validación y caminos internos; B: parches de bosque y registro de grupos de Alouatta caraya; C: áreas buffer (250 m) a los parches de bosque; D: corredores delimitados a partir de parches de bosques del área de estudio.
Con la integración de la información resultante de la clasificación y de datos obtenidos en campo y otros digitalizados (caminos, infraestructura, límites) en el software QGis 3.2.1 (QGIS), se realizaron análisis espaciales de los datos y se mapearon los atributos del paisaje (Fig. 2). Los análisis de vecindad se realizaron para un área buffer de 250 m alrededor de cada parche (Fig. 2C). Se describieron atributos indicadores de la conectividad del paisaje siguiendo la metodología empleada en trabajos previos (Anzures-Dadda y Manson, 2007; Arroyo-Rodríguez et al., 2008; Martínez-Mota et al., 2018). Se establecieron criterios y describieron atributos para la configuración y la composición del paisaje (Tabla 1).
Tabla 1 Métricas del paisaje, su descripción y clasificación.
| Nombre | Descripción | Tipo de métrica |
| Número de parches (NP) | Cantidad total de parches en el paisaje | Configuración |
| Área de parches (AP) | Superficie de cada parche de bosque, en hectáreas | Composición |
| Índice de forma (IFP) | Perímetro/2√área x π (Forman y Gordon, 1986), que varía entre 1 (forma circular) y 5 (forma altamente irregular) | Composición |
| Abundancia de parches vecinos (ABPv) | Número de parches vecinos contabilizados dentro de un buffer de 250 m alrededor de cada parche | Configuración |
| Aislamiento entre parches (AIP) | Distancia linear entre parches más cercanos, en metros | Configuración |
| Área de parches vecinos (APV) | Superficie total de parches vecinos contabilizados dentro de un buffer de 250 m alrededor de cada parche | Composición |
| Abundancia de corredores (AC) | Número de hileras de árboles/arbustos compartidos con otros parches | Configuración |
| Abundancia de caminos (ACa) | Longitud (en metros) de rutas/caminos internos medidos dentro de un buffer de 250 m alrededor de cada parche | Configuración |
Los censos se realizaron entre junio de 2017 y noviembre de 2018 (N= 14 muestreos) durante 2-4 días consecutivos por mes o de manera bimensual. Cada censo comenzó a las 7:00-8:00 a.m. y finalizó a las 6:00-7:00 p.m.; los 112 parches de bosque del área de estudio se recorrieron caminando a paso lento por dentro y por fuera con el fin de localizar individuos solitarios o grupos de primates mediante señales auditivas y/o visuales; los parches de mayor tamaño (> 5 ha) tuvieron un recorrido aproximado de 2 a 5 hs (Rumiz, 1990; Zunino et al., 2007). Cada vez que un grupo o individuo solitario fue detectado, se registró, con ayuda de binoculares y GPS: día, hora, ubicación geográfica, número de individuos, clasificación sexo-edad aproximada de todos los individuos, nacimientos, muertes o desapariciones, organización social de los grupos (unimacho, es decir con 1 macho adulto, o multimachos, con al menos 2 machos adultos) (Fig. 2B). Para la clasificación sexo-edad de los individuos adultos e inmaduros (subadultos, juveniles e infantes) se siguió el criterio de Rumiz (1990), para el cual se tomaron parámetros como la coloración del pelaje, tamaño corporal y el desarrollo genital. Se definió a los infantes como aquellos individuos ≤ 1 año desde su nacimiento, juveniles > 1 año y < a 3.5 años, machos subadultos de 3.5-5 años, hembras subadultas de 3.5-4.5 años, machos adultos > 5 años y hembras adultas > 4.5 años. Los grupos se reconocieron por su ubicación, composición y por la presencia de marcas naturales en ciertos individuos (cortes en orejas, cicatrices en la cara, ausencia de falanges y heridas). Para estimar la densidad poblacional en el área de estudio, se calcularon: densidad bruta (Nº de individuos/ área total de bosque acumulada) y densidad ecológica (Nº de individuos/área de parches de bosque) propuestas por Eisenberg (1979).
Se utilizó estadística descriptiva (mediana, rango) para datos no normales para caracterizar los parches y las poblaciones de monos aulladores siguiendo a Zar (1999). Se utilizaron modelos lineales generalizados (MLG) para evaluar el efecto de los atributos del paisaje (variables predictoras) en el uso de los parches de bosque (variables respuesta) siguiendo estudios previos (Anzures-Dadda y Manson, 2007; Arroyo-Rodríguez et al., 2008; Puig-Lagunes et al., 2016). Como primer paso, se realizó una correlación de Spearman para evaluar la existencia de asociaciones entre las variables predictoras; la misma determinó multicolinealidad entre las mismas. Por un lado, se encontró correlación positiva entre área de parches (AP) e índice de forma de parches (IFP) (p < 0.001) y por el otro, se encontraron correlaciones entre abundancia de parches vecinos (ABPv), aislamiento entre parches (AIP) y abundancia de corredores (AC) (p < 0.05). Para eliminar la multicolinealidad entre las variables se realizó, por un lado, una regresión residual entre AP e IFP. De esta manera se obtuvo un nuevo IFP que representa la proporción de la variación de esta variable que no está explicada por la variable AP, es decir, un nuevo índice independiente del área. Por otro lado, se realizó un análisis de componentes principales (ACP) entre ABPv, AIP y AC, el cual determinó una fuerte relación entre las 3 variables en el componente 1 con 70% de variación explicada, y de este modo, se obtuvo una nueva variable predictora que agrupa a estas 3, denominada variable de contexto. Estas nuevas variables obtenidas a partir de la regresión residual y ACP se utilizaron para modelar el uso de los parches por parte de los grupos de aulladores. Debido a que el uso de parches tiene respuesta binaria (presencia/ ausencia) se utilizó un modelo de regresión logística. Las variables predictoras fueron estandarizadas y al modelo se le agregó una estructura de autocorrelación de residuos debido a que los parches de bosque se encontraban en cercanía. Por último, se aplicó la prueba U de Mann-Whitney para comparar el tamaño de grupo de aulladores y la RIH (relación inmaduro: hembra adulta) entre parches de bosque grandes (mayores a 4 ha) y pequeños (menores a 4 ha) siguiendo a Zunino et al. (2007). Para todos los análisis, el nivel de significancia considerado fue α = 0.05 (Zar, 1999). Los análisis se realizaron con el software Infostat (licencia CeReGeo-FCyT-UADER) (Di Rienzo et al., 2013) y R versión 3.0.3 (R Development Core Team, 2013).
Resultados
Como resultado de la clasificación de la imagen del sensor Sentinel 2 (ESA, 2015), se obtuvo un mapa con 4 clases de cobertura: bosque, vegetación herbácea baja, vegetación arbustiva/mixta y suelo con baja cobertura (Fig. 2A). La confianza global de la clasificación fue de 80%, mientras que para la clase bosque fue de 100%, la de vegetación herbácea baja o reconocida en el campo como pastizal fue de 89%, y las demás clases no presentaron una buena precisión (menores a 60%).
La Estancia Ana María presentó un total de 112 parches de bosque, que ocuparon una superficie de 194 ha, esto corresponde a 22% del área de estudio (900 ha). Los grupos de aulladores utilizaron 10 de los 112 parches de bosques con 99 ha en total, es decir, ocuparon 11% del área de estudio y 51% del bosque disponible. En general, los parches de bosque habitados por los grupos de aulladores tendieron a ser de mayor tamaño (mayor área), más irregulares, menos aislados, con una mayor disponibilidad de parches vecinos, con menor número de corredores y mayor longitud de caminos rurales con relación a los parches de bosque no habitados (Tabla 2). Sin embargo, de todos los atributos considerados, el área de los parches de bosque fue el único atributo que se relacionó positivamente con la ocupación por parte de los grupos de A. caraya (Tabla 3).
Tabla 2 Descripción de los atributos del paisaje y de la conectividad de los parches de bosque. Se consideraron únicamente aquellos parches de bosque mayores a 0.2 ha.
| Variable | Parches de bosque | |||||
| Total (112) | Ocupados (10) | No ocupados (102) | ||||
| Mediana | Rango | Mediana | Rango | Mediana | Rango | |
| Área | 0.5 | 0.2-45.8 | 3.7 | 1.3-45.8 | 0.4 | 0.2-7.8 |
| IFP | 1.8 | 1.2-4.8 | 2.8 | 1.6-4.8 | 1.8 | 1.2-3.9 |
| ABPv* | 7 | 0-13 | 8 | 1-12 | 7 | 0-13 |
| APV | 9.1 | 0-57.2 | 10.8 | 2.8-38.3 | 9.1 | 0-57.2 |
| AIP * | 32 | 8-278 | 20 | 8-164 | 33.5 | 8-278 |
| AC * | 2 | 0-5 | 1.5 | 0-4 | 2 | 0-5 |
| ACa | 323.4 | 0-1518 | 568.2 | 0-1518 | 313.5 | 0-1272 |
*Variables de context
Tabla 3 Resultados del MLG que muestra los atributos del paisaje considerados para influir en la ocupación de los parches de bosque por parte de los grupos de A. caraya. Contexto= incluye de manera conjunta las variables abundancia de parches vecinos, aislamiento de parches y número de corredores.
| Variables | Value | Std.Error | DF | t-value | p-value |
| Intercept | -2.611 | 0.510 | 106.000 | -5.117 | 0.000 |
| Área | 2.620 | 0.952 | 106.000 | 2.751 | 0.007* |
| Indicé de forma | 0.057 | 0.284 | 106.000 | 0.200 | 0.842 |
| Contexto | -0.420 | 0.397 | 106.000 | -1.058 | 0.292 |
| Área de parches vecinos | -0.272 | 0.461 | 106.000 | -0.590 | 0.557 |
*Valor significativo
Un total de 8 grupos y 45 individuos de monos aulladores fueron censados en la estancia. También se registraron 2 machos adultos solitarios, pero estos individuos no fueron incluidos en los análisis debido a que uno se encontró muerto recientemente y el otro no fue censado nuevamente. La densidad bruta fue de 0.05 ind/ha (5 ind/km2) y la densidad ecológica fue de 0.23 ind/ha (23 ind/km2). Los adultos representaron 53.3% (N = 24) y los inmaduros 46.7% (N = 21) de la población. La organización social de los grupos fue principalmente unimacho (62.5% de los grupos, con un macho adulto y 1-2 hembras adultas vs. 37.5% de grupos multimachos, con 2 machos adultos y 2-3 hembra adultas) y el tamaño medio de los grupos fue de 5.6 individuos (rango = 3-9 individuos) (Tabla 4). En promedio, los grupos de aulladores presentaron 5.6 ± 2.13 individuos. Cada grupo tuvo 3 ± 0.63 individuos adultos (1.37 ± 0.51 machos adultos, rango = 1-2 y 1.62 ± 0.74 hembras adultas, rango = 1-3) y 2.61 ± 0.38 inmaduros (0.62 ± 0.5 machos subadultos, 0.37 hembras subadultas, 1 ± 0.5 juvenil y 0.62 infantes) (Tabla 4). El tamaño de los grupos de aulladores no varió significativamente entre parches de bosque grandes (mayores a 4 ha) y pequeños (menores a 4 ha) (prueba U de Mann-Whitney = 32; n1,2 = 5, 5; p = 0.42).
Tabla 4 Área de parches, organización social, composición de grupos de A. caraya (Número de adultos e inmaduros por grupos) y relación inmaduro: hembra adulta (RIH). Um = Unimacho, Uh = unihembra, Mm = multimacho, Mh = multihembra.
| Grupos | Organización social |
Número de parches utilizados |
Área de parches (Ha) |
Tamaño de grupos |
Número de adultos |
Número de inmaduros |
RIH |
| Frente | Um-Uh | 1 | 7.53 | 4 | 2 | 2 | 2 |
| Compañía | Mm-Mh | 1 | 4.61 | 8 | 4 | 4 | 2 |
| Centro* | Um-Mh | 3 | 2.06 (1.70-2.53) | 5 | 3 | 2 | 1 |
| Fondo 1 | Um-Uh | 1 | 11.44 | 4 | 2 | 2 | 2 |
| Fondo 2* | Mm-Mh | 3 | 10.67 (1.2-20.14) | 9 | 5 | 4 | 1.33 |
| Taninera 1 | Um-Uh | 1 | 46 | 5 | 2 | 3 | 3 |
| Taninera 2 | Um-Uh | 1 | 46 | 3 | 2 | 1 | 1 |
| Taninera 3 | Mm-Mh | 1 | 46 | 7 | 4 | 3 | 1.5 |
| Total | 45 | 24 | 21 | 1.6 |
* Incluye valor promedio y rango para el caso de los grupos que utilizaron 3 parches de bosque
Para la población de estudio, la relación inmaduro: hembra adulta (RIH) fue de 1.61 (rango = 1-3), es decir aproximadamente 2 inmaduros por hembra adulta (Tabla 4). La relación infante: hembra adulta (RInH) fue de 0.38 (rango = 0-1). Los valores más bajos de RIH se encontraron en los grupos Centro y Taninera 2 (Tabla 4), ambos unimacho, con 5 y 3 individuos respectivamente, los cuales ocuparon parches de bosque de muy distinto tamaño (Centro = 2 ha y Taninera 2 = 46 ha). El mayor valor hallado de RIH fue para el grupo Taninera 1 (Tabla 4), que fue unimacho, compuesto por 5 individuos y ocupó, junto a Taninera 2 y Taninera 3, el parche de bosque más grande del sitio de estudio (46 ha). Estos resultados revelaron diferencias significativas en la RIH entre parches mayores a 4 ha y menores a 4 ha (prueba U de Mann-Whitney = 16; n1,2 = 5, 5; p = 0.024).
Discusión
De todos los atributos evaluados en el presente estudio, el área de los parches de bosque fue el único atributo que afectó la ocupación de estos por parte de los grupos de aulladores, por lo tanto comprobamos parcialmente la primera hipótesis. Estos resultados coinciden con estudios previos en A. guariba en el bosque Atlántico de San Pablo, Brasil (Almeida y Silva et al., 2017) y con A. palliata en distintos sitios del sudeste de México (Anzures-Dadda y Manson, 2007; Arroyo-Rodríguez et al., 2008; Puig-Lagunes et al., 2016) donde los grupos de aulladores, en general, ocupan los parches más grandes del sitio de estudio. En nuestro estudio en particular, el grupo más numeroso compuesto por 9 individuos (Fondo 2) utilizó un parche grande (20 ha), pero también el mismo grupo ocupó parches pequeños (1.2 ha y 1.8 ha), los cuales podrían haberse utilizado de manera transitoria o para la búsqueda de recursos alimenticios. Dentro de un paisaje fragmentado, los parches de pequeño tamaño son sumamente importantes para poder conservar la diversidad de recursos alimenticios y hábitats para los animales (Lindenmayer, 2019). Del mismo modo, el parche más grande del sitio de estudio denominado Taninera (46 ha), fue el que más grupos de aulladores contuvo (Taninera 1, Taninera 2 y Taninera 3). Posiblemente, los parches de mayor tamaño poseen mayor disponibilidad de distintos ítems alimenticios, refugio y protección contra depredadores que permiten sostener grupos más grandes de primates en comparación a los parches más pequeños (Almeida y Silva et al., 2017; Anzures-Dadda y Manson, 2007; Arroyo-Rodríguez y Mandujano, 2006; Arroyo-Rodríguez et al., 2008).
Por otro lado, los demás atributos del paisaje evaluados (forma de parche, aislamiento, abundancia de parches vecinos, caminos y corredores y área de parches vecinos), presentaron tendencia a influir en la ocupación de los aulladores, pero estas relaciones no fueron estadísticamente significativas. Sí se han encontrado efecto de algunos de ellos en la ocupación para grupos de A. caraya en Brasil (número y forma de parches: Grande et al., 2020) y A. palliata mexicana (número de corredores: Anzures-Dadda et al., 2007, forma: Arroyo-Rodríguez et al., 2008 y aislación: Puig-Lagunes et al., 2016). Cabe preguntarse entonces acerca de la importancia que tienen los atributos del paisaje que no se reflejaron en la ocupación de los parches de bosque por los grupos de A. caraya en el área estudiada. Particularmente, lo que encontramos fue que los aulladores ocuparon parches generalmente irregulares que además fueron los más grandes del sitio de estudio.
La densidad bruta obtenida (45 ind/900 ha, es decir 0.05 ind/ha) es similar a la encontrada para la población de A. caraya que habita bosques en galería y fragmentados juntos al río Riachuelo en Corrientes, Argentina (0.04 ind/ha: Rumiz, 1990; 0.06 ind/ha: Zunino et al., 2007), y es menor a aquellas encontradas para las poblaciones que habitan los bosques ribereños junto al riacho Pilagá (Estancia Guaycolec) en Formosa, Argentina (0.090.18 ind/ha: Arditi y Placci, 1990; Dvoskin et al., 2004; Juárez et al., 2005). Por otro lado, la densidad ecológica hallada en nuestro estudio (0.23 ind/ha) es la más baja con relación a estudios previos (0.97 ind/ha en bosques en galería de Corrientes a 3.25 ind/ha en islas del río Paraná; Kowalewski y Zunino, 2004; Rumiz, 1990). Estas diferencias pueden deberse a diversos motivos, por un lado, al uso de herramientas de geomática y la escala de trabajo con los datos derivados de sensores remotos utilizados en el presente estudio que posibilitaron un análisis a mayor detalle del cálculo del área de los parches de bosque. Además, en la Estancia Ana María hubo una transformación importante del paisaje debido principalmente a la tala selectiva de quebracho para la extracción de tanino y de otras especies arbóreas lo que generó una importante modificación de la estructura vegetal. Sumado a lo anterior, la estancia se sitúa en un área rural y es frecuentada por cazadores furtivos. En este sentido, un estudio con A. palliata en Costa Rica encontró que la antigüedad de los fragmentos habitados por los monos se relaciona positivamente con su densidad; es decir, los parches con mayor densidad son aquellos que tienen más antigüedad sin ser alterados por actividades antrópicas (DeGama-Blanchet y Fedigan, 2006). De todos modos, el tamaño de los grupos de aulladores de la estancia (5.6 individuos) que no difirió, como propusimos en nuestra segunda hipótesis, entre parches de bosque grandes y pequeños, se encuentra dentro del rango hallado en otras poblaciones estudiadas en ambientes similares de Corrientes y Formosa en Argentina (3.9-8.5 ind.: Arditi y Placci, 1990; Dvoskin et al., 2004; Juárez et al., 2005; Rumiz, 1990; Zunino et al., 2007). Si bien desconocemos si los grupos estudiados disminuyeron en tamaño o se mantuvieron estables a lo largo de los años, se ha propuesto que la transformación antrópica de los ambientes naturales, particularmente el aumento de la fragmentación del paisaje, puede afectar negativamente la densidad, el tamaño y la composición de los grupos de distintas especies de aulladores (Chapman y Balcomb, 1998; Clarke et al., 2002; DeGama-Blanchet y Fedigan, 2006; Estrada et al., 2017; Oklander et al., 2010).
La organización social de los grupos de aulladores de la estancia fue predominantemente unimacho, lo cual sigue el patrón hallado en otros ambientes fragmentados del noreste argentino (Rumiz, 1990; Zunino et al., 2007). También encontramos que los parches de bosque más grandes fueron ocupados por varios grupos de aulladores (Goffard et al., 2008; Rumiz, 1990; Zunino et al., 2007). La RIH para la población de la estancia difirió entre parches grandes y pequeños, e incrementa en parches de mayor tamaño, lo que comprueba nuestra segunda hipótesis. Además, la RIH hallada (1.61) es mayor a las registradas en otras poblaciones. Por ejemplo, para la población de A. caraya que habita el área del río Riachuelo en Corrientes, Argentina, la RIH promedio fue de 1.19 (rango = 0.82-1.45) y la de RInH de 0.28 (Zunino et al., 2007). Para otras poblaciones de monos aulladores existen algunos estudios al respecto: para A. palliata de Hacienda La Pacífica, Costa Rica la RIH poblacional fue de 0.62 (rango = 0.46-0.80) y para un grupo que fue estudiado durante 18 años la RIH fue de 0.78 (rango = 0.22-1.33) (Zucker y Clarke, 2003). Para 4 poblaciones de A. sara en Bolivia, la RIH fue de 1.32 (rango = 0-3) siendo mayor en ambientes mejor conservados en comparación a ambientes con disturbio antrópico (1.7 vs. 1.1) (Goffard et al., 2008). Considerando que la población del área del río Riachuelo se mantuvo estable durante el estudio (1982-2003; Zunino et al., 2007), con los valores de RIH y RInH hallados para la estancia, se puede sugerir que la población de estudio se encuentra estable y podría aún estar en crecimiento.
En conclusión, de los atributos del paisaje analizados en el presente trabajo, solo el área de los parches afectó significativamente el uso de éstos por parte de los aulladores como también la RHI de la población de estudio, aunque no afectó el tamaño de los grupos. Los grupos de A. caraya ocuparon los parches más irregulares del sitio de estudio que a su vez fueron los más grandes, aunque la forma de los parches no afectó su ocupación. Además, el uso de geotecnologías aplicadas en el presente trabajo constituye los primeros antecedentes en Argentina para evaluar la influencia de los atributos del paisaje en el uso del espacio y en las características demográficas de primates. Estudios de este tipo son necesarios para poder identificar y establecer áreas prioritarias para la conservación de los primates e inclusive considerar la posibilidad de trabajo a largo plazo en poblaciones que habitan en áreas privadas. Además, el uso de estas herramientas y escalas de trabajo demostraron la importancia de sumar estudios similares con especies emparentadas que se encuentran en peligro de extinción.











 nueva página del texto (beta)
nueva página del texto (beta)


