Introducción
Un problema de contaminación ambiental resulta del uso descontrolado de pesticidas químicos; éste tiene su origen desde que dichos productos comenzaron a producirse a mediados de los años treinta, provocando con ello diferentes efectos perjudiciales no sólo en el suelo, aire, agua, y la salud humana, sino también sobre el producto sobre el cual se aplican. Al respecto, los entomopatógenos tienen potencialidad para reemplazar, o al menos complementar los tratamientos con insecticidas químicos y pueden utilizarse tal como se encuentran en la naturaleza (Glare, 2004; Miranda-Hernández et al., 2017). Los hongos entomopatógenos tienen potencial como agentes controladores de insectos considerados como plaga en el sector agrícola; entre los géneros más importantes están Metarhizium, Beauveria, Isaria (Paecilomyces) y Lecanicillium (Verticillium), microorganismos que producen unidades infectivas denominadas conidios. La literatura especializada ha reportado procedimientos de cultivo en estado sólido que conllevan la mejoría en el rendimiento y esporulación de hongos entomopatógenos (Jackson et al., 2010; Seiber et al., 2014).
La búsqueda y evaluación de aislamientos nativos de hongos entomopatógenos adaptados a las condiciones locales es una de las actividades a considerar dentro del desarrollo de un micoinsecticida (Ruiz Sánchez et al., 2013). Los aislados fúngicos obtenidos en campo a partir de insectos micosados posiblemente presentan un sin número de genotipos, los cuales pueden variar en virulencia, esta versatilidad puede ser regulada a través de la obtención de cultivos monocolonia formados por una espora, lo cual disminuye la variabilidad genotípica y mantiene las características requeridas para la selección y/o mejoramiento de los hongos (Ayala-Zermeño et al., 2005; Toriello et al., 2008). Lo anterior implica obtener aislamientos nativos que permiten por su adaptación a las condiciones de la región, mayores potencialidades de uso por sus características de tolerancia o resistencia a los ambientes asociados a la región en donde fueron aisladas (Toriello et al., 2008).
Actualmente, es necesario elaborar alternativas para el control biológico de plagas agrícolas, en particular en aquellas que presentan un impacto nulo en el medio ambiente, de ahí que los hongos entomopatógenos ofrezcan una gran eficacia como agentes de control de diferentes plagas ya que actúan por contacto. Existen investigaciones relacionadas con el aislamiento de hongos entomopatógenos en zonas agrícolas de México, como por ejemplo, se ha analizado la virulencia de cepas de Isaria fumosorosea aisladas en zonas citrícolas de Nuevo León (Gandarilla-Pacheco et al., 2018). Por otro lado, se ha estudiado el aislamiento de Metarhizium anisopliae, Beauveria bassiana y Paecilomyces sp. en cultivos de maíz en Morelos (Hernández-Velázquez et al., 2011). De manera análoga, los hongos predominantes encontrados en suelos agrícolas de otros estados como Michoacán, Colima, Nayarit, Veracruz, Jalisco y Sinaloa, han sido Metarhizium anisopliae y Beauveria bassiana (Molina-Ochoa et al., 2003). En cuanto a los suelos agrícolas de la región del oriente del estado de México, no se han llevado a cabo investigaciones con relación al aislamiento de hongos entomopatógenos. El objetivo de esta investigación fue aislar hongos nativos de Metarhizium en suelo agrícola del oriente del estado de México, así como evaluar la producción y calidad de los conidios obtenidos.
Cabe señalar que la calidad de un agente de control biológico se define como un conjunto de propiedades inherentes de la cepa asociadas a la capacidad para funcionar después de su liberación en campo (Castillo-Minjarez et al., 2019; Loera-Corral et al., 2016). Cada lote debe estar sujeto a las pruebas de control de calidad. Los parámetros esenciales que deben verificarse son la viabilidad, germinación e infectividad, entre otros (García-Ortiz et al., 2015; Miranda-Hernández et al., 2014; Tlecuitl-Beristain et al., 2010). La mala calidad conduce a una eficacia inadecuada, esto es desfavorable para el productor y los usuarios; el control del producto solo debería ser necesario para confirmar que el este sea de calidad alta y consistente (Ravensberg, 2011). La hipótesis que se planteó fue que los hongos del género Metarhizium aislados de suelo agrícola del Estado de México tienen una producción de conidios con calidad similar a los obtenidos por una cepa comercial, debido a que los micoinsecticidas tienen un efecto positivo al reducir poblaciones de insectos considerados plaga sin deteriorar el medio ambiente y la salud humana.
Materiales y métodos
Las muestras se recolectaron de parcelas de cultivo en 5 municipios diferentes del Estado de México, los productos que se cultivan y su ubicación se presentan en la tabla 1. Para el muestreo se seleccionaron 5 puntos al azar de cada una de las zonas agrícolas evaluadas (Zimmermann, 1986). Las muestras de suelo se almacenaron en bolsas negras de polietileno para evitar la exposición directa a la luz; se recolectó aproximadamente 0.5 kg de suelo de 0 a 20 cm de profundidad, para lo cual se rodeó el área agrícola y se ubicó la misma a través de GPS; todas las muestras se conservaron en refrigeración a 4 °C hasta su procesamiento (Zimmermann, 1986).
El aislamiento de los hongos entomopatógenos se realizó mediante la técnica de trampeo, la cual consistió en recolectas de suelo que se tamizaron a partir de la propuesta de Zimmermann (1986), para lo cual se tomaron submuestras de 60 g que se colocaron en vasos de plástico con una capacidad de 250 ml; en cada vaso se realizaron 15 perforaciones para favorecer la aireación; además el suelo se humedeció con 7 ml de agua destilada y se colocaron 10 larvas de Tenebrio molitor (Coleoptera: Tenebrionidae) adquiridos de la empresa Petmmal S.A. de C.V; finalmente, se incubaron a 28 °C durante 7 días. Cada 24 h los vasos se giraron 180 ° para que las larvas estuviesen en mayor interacción con la muestra de suelo; en el séptimo día de incubación, las larvas muertas se colocaron en cámaras húmedas (cajas Petri con papel filtro estéril húmedo) e incubados a 28 °C por 7 días, con la finalidad de promover el crecimiento del hongo. Los hongos se desarrollaron sobre la superficie de las larvas, cada uno se aisló y propagó por estría en cajas Petri con medio ADS (agar dextrosa Sabouraud) (BPBioxon ® Becton Dicknson de México S.A. de C.V. Cuautitlán Izcalli), previamente esterilizado en autoclave a 120 °C, 15 psi durante 15 min. (Carrillo-Benítez et al, 2013; Zimmermann, 1986), el medio de cultivo fue preparado de acuerdo con las especificaciones del fabricante (65 g L-1).
Se obtuvieron cultivos monocolonia a partir de una espora, realizado de la siguiente manera: del insecto micosado se tomó una asada de conidios y se sembró en cajas Petri de 90 × 15 mm con medio ADS , y se adicionó desoxicolato de sodio al 0.05% (Sigma-Aldrich, Auckalnd, New Zealand) que es un inhibidor de crecimiento que facilitó la obtención de colonias aisladas; se monitoreo el cultivo a partir de las 12 h de incubación, con un objetivo 40× se localizó un conidio germinado que fue cortado en un cuadro de agar en un área de 2 mm2 aproximadamente, el fragmento cortado fue colocado en medio ADS e incubado durante 10 d a 28 ºC (Montesinos-Matías et al., 2011). De este cultivo, colonias independientes se propagaron por estría en cajas Petri y matraces Erlenmeyer con 20 ml y 50 ml de medio ADS, respectivamente, que se utilizaron para su conservación y estudios posteriores.
Las claves asignadas a los aislados se determinaron con las 3 primeras letras del municipio seguida de un número en forma ascendente después de la clave y separados (clave y número) por un guion; el número indica la cantidad de aislados obtenidos por cada municipio (Estefes-Chávez, 2015). La descripción corresponde a cultivos plurispóricos que se obtuvieron a partir de suelo e insectos. Finalmente, para los cultivos monospóricos se obtuvieron a partir de los cultivos plurispóricos, se designó la nomenclatura ya establecida, con la salvedad de adicionar después del dígito, un punto y un decimal, que hacen referencia al número de cultivos monospóricos obtenidos de cada cultivo plurispórico.
Los hongos aislados se conservaron con el método de agua desionizada estéril (López-Lastra et al., 2002). Para cada aislado se utilizaron cultivos esporulados en cajas Petri; además, en condiciones asépticas se cortaron pequeños bloques de aproximadamente 5 mm2 y se colocaron dentro de viales de vidrio de 15 × 1.5 cm con tapa de rosca, que contenían 4 ml de agua desionizada estéril y los viales se conservaron a 4 °C. Los experimentos posteriores de producción de conidios se iniciaron tomando un vial de conservación; y se transfirieron asépticamente los bloques de inóculo en cajas Petri con medio ADS. Se realizó la propagación en matraces Erlenmeyer de 250 ml con 50 ml de medio ADS, previamente esterilizado en autoclave a 120 °C, 15 psi durante 15 min. Las cajas y los matraces se incubaron a 28 °C durante 10 días. Posteriormente se llevaron a cabo los experimentos.
La identificación morfológica se realizó a partir de observaciones con un microscopio estereoscópico (Velab VE-S1) y un microscopio óptico (OLYMPUS B X 50). Asimismo, se capturaron imágenes y medidas de los conidios utilizando el programa Image-Pro plus 6.3; se obtuvieron al menos 30 mediciones de los conidios para cada aislado. Por otro lado, se realizó un análisis de aspectos morfológicos a nivel microscópico, es decir, formas, colores y dimensiones de los conidios. A nivel macroscópico, se analizaron caracteres como la forma y coloración (Humber, 2012); en esta misma línea, se realizaron observaciones a un producto comercial compuesto de conidios de Metarhizium anisopliae (META-SIN, Agrobionsa, México).
Para la producción de conidios en cultivo sólido, se pesaron 50 g de arroz precocido de la marca (Verde Valle®); la materia sólida fue colocada en bolsas de polipapel de 18 × 25 cm con capacidad para 0.5 kg. Posteriormente, se esterilizó a 121 °C, 15 psi durante 15 min. En condiciones asépticas el medio sólido se inoculó con 5 ml de una suspensión de conidios con una concentración de 5 × 107 conidios ml-1, considerando un inóculo inicial de 1 × 106 conidios por gramo de arroz seco inicial (conidios gasi-1), se ajustó la humedad inicial al 40% de humedad inicial, se mezcló manualmente cada bolsa y se incubó a 28 °C durante ١٥ días (Angel-Cuapio et al., 2015; Méndez-González et al., 2018). Cada 2 días se realizó un mezclado para lograr un crecimiento uniforme de los hongos; para los 6 aislados estudiados se recurrió a la misma metodología.
Para estimar la producción de conidios se utilizaron 3 bolsas para cada hongo, de cada bolsa, 50 gasi se transfirieron a un vaso de precipitado de 500 ml en el cual se adicionaron 150 ml de Tween 80 al 0.05% para realizar la extracción de conidios en una parrilla de agitación durante 10 min. Los extractos se filtraron a través de una gasa estéril de 10 × 10 cm para eliminar los sólidos y obtener las suspensiones de conidios. Los conidios se contaron en cámara de Neubauer (Marienfield, Lauda-Königshofen, Alemania), con un microscopio de luz (BOECO) utilizando un lente objetivo de 40× (Angel-Cuapio et al., 2015). Lo valores de producción se reportan como conidios por gramo de arroz seco inicial (C, conidios gasi-1).
Para determinar el porcentaje de germinación,se prepararon cajas Petri con medio ADS, posteriormente se estandarizaron suspensiones de conidios a una concentración final de 1 × 106 conidios ml-1 de donde se tomaron 50 µL y se adicionaron sobre la superficie del medio ADS; con una varilla de vidrio se distribuyó el inóculo y las cajas se incubaron a 28 °C durante 12 h. S e realizó el conteo de 200 conidios registrando los conidios germinados y los no germinados, utilizando un microscopio (BOECO) con objetivo 40×. Se consideró un conidio germinado aquel que presentó la longitud del tubo germinativo de 2 veces el diámetro del conidio (Ibrahim et al., 2002; Samuels et al., 1989). Para cada aislado se realizó la prueba por triplicado.
Para determinar la viabilidad se utilizaron conidios cosechados a 15 días de cultivo, se estandarizaron suspensiones de conidios de cada aislado a una concentración de 1 × 104 conidios ml-1 y se adicionaron 30 µL (300 conidios) de cada suspensión a una caja Petri con medio ADS. Las cajas se incubaron a 28 ºC y se realizó el conteo de unidades formadoras de colonias (UFC) a las 48 h de cultivo utilizando un microscopio (BOECO) con objetivo 40× (Miranda-Hernández et al., 2014). Para cada aislado se realizó la prueba por triplicado.
Para las pruebas de infectividad (bioensayos) se utilizaron larvas de Tenebrio molitor (Coleoptera: Tenebrionidae), el cultivo fue obtenido de la empresa PETMMAL. Cada aislado se evaluó de forma independiente a través del siguiente procedimiento: en 7 cajas Petri (5 para larvas infectadas y 2 como testigos negativos) se colocaron 10 larvas por caja, el proceso de infección se realizó por inmersión durante 10 segundos en suspensiones estandarizadas a una concentración de 1 × conidios ml-1 en un volumen total de 30 ml. Para los controles negativos, las larvas se sumergieron durante 10 segundos en una solución de Tween 80, al 0.05% estéril. A todas las unidades experimentales se les agregó alimento a base de salvado de trigo y avena (relación 1:1) para evitar la muerte de las larvas por inanición. Posteriormente, se incubó a 28 °C con fotoperiodo 12:12 h luz-oscuridad y cada 24 h las larvas muertas se colocaron en una cámara húmeda (cajas Petri con papel filtro estéril húmedo) y se incubaron a 28 °C, con la finalidad de promover el crecimiento del hongo y confirmar la muerte de las larvas por micosis; el monitoreo se hizo durante 15 días.
Para estimar el tiempo en que apareció la primera larva muerta (to), el tiempo letal 50, que es el tiempo en que se alcanza 50% de mortalidad (TL50) y el porcentaje de sobrevivencia (Sf), se utilizó el modelo de decaimiento descrito por Rodríguez-Gómez et al. (2009); que desarrolla la solución de una ecuación diferencial de primer orden con el tiempo de retardo indicado:
Y = (100-S) *e-k(t-t0) + S, para t > t0
donde Y es el porcentaje de sobrevivencia (%) al tiempo t, k es la tasa específica de muerte (d-1), to es el tiempo para el primer muerto (d) y S es la sobrevivencia estimada asintótica (%).
En el estudio de hongos entomopatógenos es común evaluar su efectividad biológica, la cual es el resultado que se obtiene al aplicar un insumo en el control o erradicación de una plaga que afecta a los cultivos, lo anterior considerando que el insumo es una sustancia destinada para prevenir, matar o controlar una plaga del campo, en la producción, almacenamiento, transporte o comercialización de productos agrícolas. La fórmula que se utiliza para determinar dicha efectividad es la de Abbott (1925):
% EB = ((Tt-Ti) / Tt)*100
Donde % EB es la efectividad biológica de un micoinsecticida expresada en porcentaje (%), Tt es el número de individuos en el tratamiento testigo y Ti es el número de individuos en el tratamiento i.
Para los hongos entomopatógenos estudiados, se realizó un diseño experimental completamente al azar con 3 repeticiones por muestra, a los que se les midió la producción de conidios, la viabilidad y la germinación e infectividad; los resultados obtenidos se analizaron mediante el método Andeva de una vía con la prueba de Tukey para la comparación de medias (p < 0.05). Los análisis se realizaron con el software SPSS (SPSS, Chicago, IL).
Resultados
De cada muestra de suelo agrícola se seleccionó y aisló solamente un hongo, por lo que se obtuvieron 5 hongos entomopatógenos en total, cuyas claves de cada aislado y localización geográfica de las zonas agrícolas muestreadas se presentan en la tabla 1. La identificación morfológica de los aislados se realizó considerando las estructuras de los conidios (fig. 1). Los aislamientos encontrados presentaron colonias verdes con aspecto polvoroso, micelio septado con conidióforos, de los que salían cadenas de conidios, cilíndricos, con sombra de color verde, con un tamaño menor a 9 μm (tabla 2), tales características han sido asociadas al hongo entomopatógeno Metarhizium anisopliae (Metschnikoff) Sorokin (Humber, 2012).
Tabla 1 Claves para cada aislado y localización geográfica de los municipios muestreados.
| Municipio | Localidad | Coordenadas geográficas | Cultivo | Clave |
| Amecameca | Amecameca de Juárez | 19°07’17.24” N, 98°46’36.94” O | Ebo | Ame-2.1 |
| Texcoco | San Bernardino | 19°28’34.23” N, 98°53’19.40” O | Avena | Tex-3.1 |
| Tenango | San Mateo Tepopula | 19°09’33.61” N, 98°51’53.07” O | Trigo | Ten-2.1 |
| Chiconcuac | Barrio San Pedro | 19°32’49.26” N, 98°53’49.92” O | Maíz | Chi-3.1 |
| Chalco | San Gregorio Cuautzingo | 19°15’57” N, 98°51’28.37” O | Maíz | Cha-3.1 |

Figura 1 Microfotografías de conidios de aislados de Metarhizium anisopliae. A) Tex-3.1, B) Chi-3.1, C) Ten-2.1, D) Ame-2.1, E) Cha-3.1 y F) META-SIN. Microfotografías obtenidas con un microscopio OLYMPUS B X 50 y el software Image-Pro plus 6.3.
Tabla 2 Tamaño de los conidios de hongos entomopatógenos aislados en zonas agrícolas del Estado de México.
| Aislado | Diámetro (µm) | Longitud (µm) | ||||
| Tex-3.1 | 2.33 | ± | 0.09 | 5.23 | ± | 0.21 |
| Chi-3.1 | 2.17 | ± | 0.04 | 5.59 | ± | 0.08 |
| Ten-2.1 | 2.27 | ± | 0.13 | 5.31 | ± | 0.13 |
| Ame-2.1 | 2.38 | ± | 0.20 | 5.66 | ± | 0.30 |
| Cha-3.1 | 3.41 | ± | 0.12 | 6.97 | ± | 0.49 |
| META-SIN † | 2.35 | ± | 0.09 | 5.59 | ± | 0.22 |
† Producto comercial a base de conidios de Metarhizium anisopliae.
La producción mayor de conidios fue con el aislado Chi-3.1, con producción promedio de C ≈ 9 × 108 conidios gasi-1 (fig. 2) y no se encontró diferencia significativa (p > 0.05) con los aislados Tex-3.1, Ten-2.1 y Cha-3.1. El incremento en la producción representó 29% respecto a la obtenida por un producto comercial META-SIN (6.4 × 108 conidios gasi-1), asimismo, los aislados Ame-2.1, Tex-3.1, Ten-2.1 y Cha-3.1 alcanzaron una producción promedio de C ≈ 6.9 × 108 conidios gasi-1 y no se encontró diferencia significativa (p > 0.05) entre los aislados y la producción obtenida por el producto comercial.

Figura 2 Producción de conidios de hongos entomopatógenos aislados en zonas agrícolas del Estado de México. META-SIN: producto comercial a base de conidios de Metarhizium anisopliae.
El valor más alto de germinación (G) que se alcanzó con el producto comercial META-SIN fue ≈ 99% (fig. 3), que fue estadísticamente diferente (p < 0.05) a los aislados Ame-2.1, Tex-3.1, Ten-2.1, Chi-3.1 y Cha-3.1. Los aislados Tex-3.1, Ten-2.1, Chi-3.1 y Cha-3.1 no presentaron diferencia significativa (p > 0.05), con una disminución en la germinación de 13% respecto al obtenido por un producto comercial (G ≈ 99%). De manera análoga, para los aislados Ame-2.1, Ten-2.1 y Cha-3.1 1 no se encontró diferencia significativa (p > 0.05), con una disminución de 18%.

Figura 3 Porcentaje de germinación de conidios de hongos entomopatógenos aislados en zonas agrícolas del Estado de México. META-SIN: producto comercial a base de conidios de Metarhizium anisopliae.
Sobre la viabilidad, se encontró un valor aproximado del V ≈ 64% para el producto comercial META-SIN, estadísticamente diferente (p < 0.05) a los aislados Ame-2.1, Tex-3.1, Ten-2.1, Chi-3.1 y Cha-3.1. Los aislados Tex-3.1, Ten-2.1, Chi-3.1 y Cha-3.1, no presentaron diferencia significativa (p > 0.05), con una disminución de 18% respecto al obtenido por un producto comercial (V ≈ 64%) (fig. 4). Así mismo, el aislado Ame-2.1 alcanzó una viabilidad de V ≈ 33.46%, siendo estadísticamente diferente (p < 0.05) a los otros hongos, con una disminución de 48%.

Figura 4 Porcentaje de viabilidad de conidios de hongos entomopatógenos aislados en zonas agrícolas del Estado de México. META-SIN: producto comercial a base de conidios de Metarhizium anisopliae.
Sobre la infectividad (bioensayo), se encontró que el aislado Chi-3.1 presentó un tiempo de t0 ≈ 2.58 días, que es el valor más bajo estadísticamente diferente (p < 0.05) en comparación con el producto comercial. Sin embargo, para los aislados Ame-2.1, Tex-3.1 y Cha-3.1, no se encontró diferencia estadísticamente significativa (p > 0.05) respecto con el t0 obtenido para META-SIN (fig. 5). Por otro lado, para los 5 aislados no se encontró diferencia estadística significativa (p > 0.05) en los parámetros, k y Sf en comparación con META-SIN. En ese sentido, no se pudo estimar el TL50 (tiempo letal 50, tiempo en que tarda para matar 50% de la población), debido a que no murió más de 50% de las larvas infectadas a la concentración de conidios estudiada, por lo que se recomienda evaluar otras concentraciones y estimar la concentración letal 50 (CL50).

Figura 5 Perfiles de infectividad de cepas de Metarhizium anisopliae sobre larvas de Tenebrio molitor.
Discusión
La identificación morfológica de los aislados fue desarrollada con base en las claves descritas por Humber (2012). En este sentido, las características morfológicas para el género Metarhizium son: conidióforos densamente entrelazados, conidios ovoides de color verde, formados en cadenas paralelas largas o cortas, los conidióforos son ramificados, con forma de candelabro y entrelazados. El tamaño de los conidios depende del tipo de especie, es decir, para M. anisopliae los conidios suelen medir menos 9 μm; para M. majus los conidios tienen una longitud mayor a 11 μm y para M. acridum entre 7 y 11 μm. De ahí que, en esta investigación se encontró que los conidios obtenidos de cada aislado están relacionados con el hongo entomopatógeno M. anisopliae, lo que coincide con las características similares presentes en el producto comercial META-SIN, que es elaborado a partir de conidios de M. anisopliae. Como parte complementaria y poniéndolo en perspectiva, se recomienda hacer la identificación molecular de los aislados mediante el análisis de las secuencias de la región ITS del ADNr (Tlecuitl-Beristain et al., 2010), así como realizar un análisis “in silico” utilizando la base de datos del NCBI, Genbank de las secuencias nucleotídicas que codifican para el factor de elongación 5´1α y para β-tubulina, las cuales serán utilizadas como iniciadores para la identificación.
La finalidad de obtener nuevos aislados permite conocer al hongo Metarhizium anisopliae en algunas zonas del Estado de México, en donde se desempeña como regulador de poblaciones de insectos; cabe señalar que este hongo entomopatógeno se produce mediante técnicas de cultivo en soporte sólido (Lizardi-Jiménez y Hernández-Martínez, 2017), además es uno de los más utilizados a nivel industrial y aplicado como agente de control biológico en todo el mundo, de ahí la importancia de producir sus conidios en grandes cantidades. Recientemente Angel-Cuapio (2015), reportó una producción de conidios de 2.7 × 108 conidios gasi-1, en cultivos sobre arroz realizados en frascos de vidrio para M. anisopliae. Por su parte, Van Breukelen et al. (2011), documentaron una producción de conidios de M. anisopliae de 3.4 × 109 conidios g arroz-1 en cultivo sólido utilizando columnas de vidrio y arroz como sustrato. De forma análoga, Dorta et al. (1996) informaron sobre una producción de conidios de 2.3 × 1010 conidios g arroz-1 en cultivos de M. anisopliae, utilizando botellas de vidrio como unidad experimental y salvado de arroz como sustrato. También, Arzumanov et al. (2005) dieron a conocer resultados similares en cultivo sobre soporte sólido usando arroz como sustrato en reactores de columna, se encontró que Metarhizium anisopliae creció exclusivamente sobre los granos de arroz con una producción de 3.5 × 109 conidios por gramo de materia seca. Recientemente, Méndez-González et al. (2018) reportaron la producción de conidios de Metarhizium anisopliae sobre arroz utilizando biorreactores de columna empacada y bolsas de plástico, a 9 días de cultivo se alcanzó una producción de 6.8 × 108 conidios por gramo de materia seca y 5.6 × 108 conidios por gramo de materia seca, respectivamente. La técnica propuesta para la producción de conidios en esta investigación resulta interesante, debido a que el rendimiento alcanzado se ubica en el promedio de los valores reportados por los autores antes mencionados, más aún se alcanzó una producción de 9 × 108 conidios g arroz-1 con el aislado Chi-3.1, que representó un incremento del rendimiento de 1.4 veces en comparación con el producto comercial (6.4 × 108 conidios g arroz-1).
Otro punto por analizar es la calidad de los conidios obtenidos, para determinar la viabilidad, germinación e infectividad que permiten predecir la eficiencia de las células infectivas. La germinación es la formación del tubo germinativo a partir de un conidio, se realiza como un indicador de la capacidad y velocidad de los conidios para emitir un tubo germinativo in vivo y poder penetrar potencialmente la cutícula del insecto objetivo. Se considera un conidio germinado, cuando el tamaño del tubo germinativo es mayor al ancho del conidio (Ibrahim et al., 2002). Dicho lo anterior, se encontraron valores superiores a 80% de germinación en los conidios producidos para los 5 aislados de Metarhizium anisopliae, que fueron 1.11 veces menores al obtenido con el producto comercial META-SIN®. Con respecto a la viabilidad, la medida de la cantidad de conidios que tienen la capacidad de desarrollar unidades formadoras de colonias (UFC), expresada en porcentaje (Angel-Cuapio, 2015); se encontraron valores de viabilidad similares (V ≈ 50%) que fueron 1.28 veces menores al obtenido por el producto comercial (V ≈ 64%), concordando con los valores reportados por Méndez-González et al. (2018). No obstante los valores de germinación y viabilidad obtenidos en las cepas aisladas, éstos se consideran adecuados para la elaboración de bioplaguicidas basados en hongos entomopatógenos, de acuerdo con los estándares internacionales (Jenkins y Grzywacs, 2000; Jenkins et al., 1998), hay que mencionar, además que la germinación es un factor determinante de la virulencia que puede ser afectado por las condiciones nutricionales (Fragues et al., 2001).
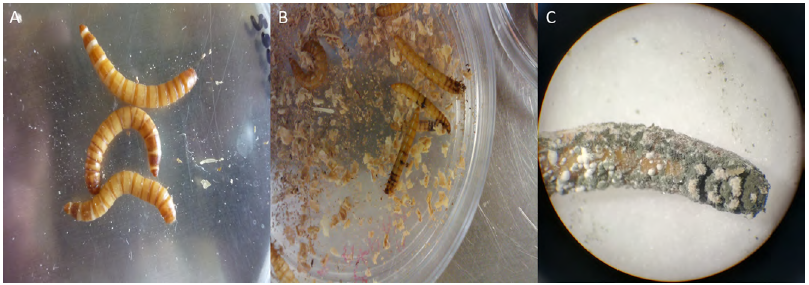
La infectividad de los conidios producidos fue analizada mediante técnicas de bioensayo utilizando larvas de Tenebrio molitor, insecto considerado plaga en granos almacenados, y también utilizado comúnmente como insecto huésped, modelo para estudios con hongos patógenos de insectos (Damborsky et al., 1999). Los aislados nativos de Metarhizium anisopliae resultaron ser más infectivos que la cepa comercial estudiada, el aislado Ame-2.1 alcanzó la mortalidad más alta correspondiente a 43% con una eficiencia biológica de 60% en comparación con el producto comercial con una mortalidad de 34% y una eficiencia biológica de 60%. En la figura 6 se muestran las etapas típicas de infección de M. anisopliae sobre larvas de T. molitor. En conclusión, los aislados de M. anisopliae, por ser cepas nativas adaptadas a las condiciones ambientales de la región, son potencialmente los candidatos idóneos para el desarrollo de bioplaguicidas a base de hongos entomopatógenos para el control biológico de plagas agrícolas en los municipios estudiados del Estado de México.











 text new page (beta)
text new page (beta)