Introducción
La mayor parte de las algas marinas bentónicas son Rhodophyta y existen alrededor de 7,300 especies, lo que constituye la diversidad más alta de todos los grandes grupos de macroalgas, aunque este tipo de algas se desarrolla en todas las latitudes, se encuentran en mayor cantidad en regiones templadas y tropicales superando por mucho a los grupos de macroalgas restantes (Guiry y Guiry, 2020). Además de su riqueza específica, las Rhodophyta se encargan de la producción primaria y también participan en procesos ecológicos como nichos de reclutamiento, reproducción y crianza de distintas especies de peces e invertebrados y otros herbívoros, consolidan y fijan el sustrato por medio de sus rizoides disminuyendo la erosión (Sentíes y Dreckmann, 2011).
Los primeros registros de algas rojas de la costa de Michoacán corresponden con 35 taxones de la familia Rhodomelaceae registrados para la porción norte del litoral de Michoacán, en el estudio de Sentíes et al. (1990). Dreckmann et al. (1990) citan 36 especies de Rhodophyta para San Telmo, ubicado en la costa norte de Michoacán. Posteriormente, Stout y Dreckmann (1993) identificaron 68 especies de macroalgas en el faro de Bucerías: 41 de las cuales eran Rhodophyta. Subsiguientemente, León-Tejera et al. (1993) ubicaron 34 Rhodophyta, 9 de ellas fueron registros para Caleta de Campos. León-Álvarez y González-González (1993) citaron a Cruoriella mexicana (E. Y. Dawson) Denizot y Peyssonnelia mexicana E. Y. Dawson; mientras que Sentíes (1995) registra a Polysiphonia sertularioides (Grateloup) J. Agardh, P. subtilissima Montagne y Tayloriella dictyurus (J. Agardh) Kylin, en San Telmo.
Otras investigaciones han agregado nuevas especies de Rhodophyta para Michoacán, como es el caso de Ochtodes searlesii Mendoza-González, Mateo-Cid y Sentíes (Mendoza-González, Sentíes et al., 2011), Pyropia raulaguilarii Mateo-Cid, Mendoza-González y Sentíes (Mateo-Cid et al., 2012) y Osmundea purepecha Sentíes, Mendoza-González y Mateo-Cid (Sentíes et al., 2014). Recientemente, Ceballos-Corona et al. (2019) en una revisión de las macroalgas marinas de Michoacán enlistaron 90 especies de Rhodophyta.
En los trabajos señalados anteriormente se encuentran citados 112 taxones de Rhodophyta para la costa de Michoacán (Ceballos-Corona et al., 2019; Dreckmann et al., 1990), por lo que el objetivo de este trabajo fue actualizar el conocimiento de las Rhodophyta que habitan el litoral de este mismo estado. El presente estudio incorpora una lista florística de 7 localidades poco estudiadas de esta región, además de Las Peñas, La Saladita, Caleta de Campos, Maruata y San Telmo, aportando nuevos registros de Rhodophyta para la zona de estudio, así como datos acerca de su distribución, variación estacional, hábitat y reproducción durante las estaciones climáticas de lluvias y secas. Además, se realizó un análisis de afinidad ficoflorística de las Rhodophyta de Michoacán con otras regiones del Pacífico tropical de México.
Materiales y métodos
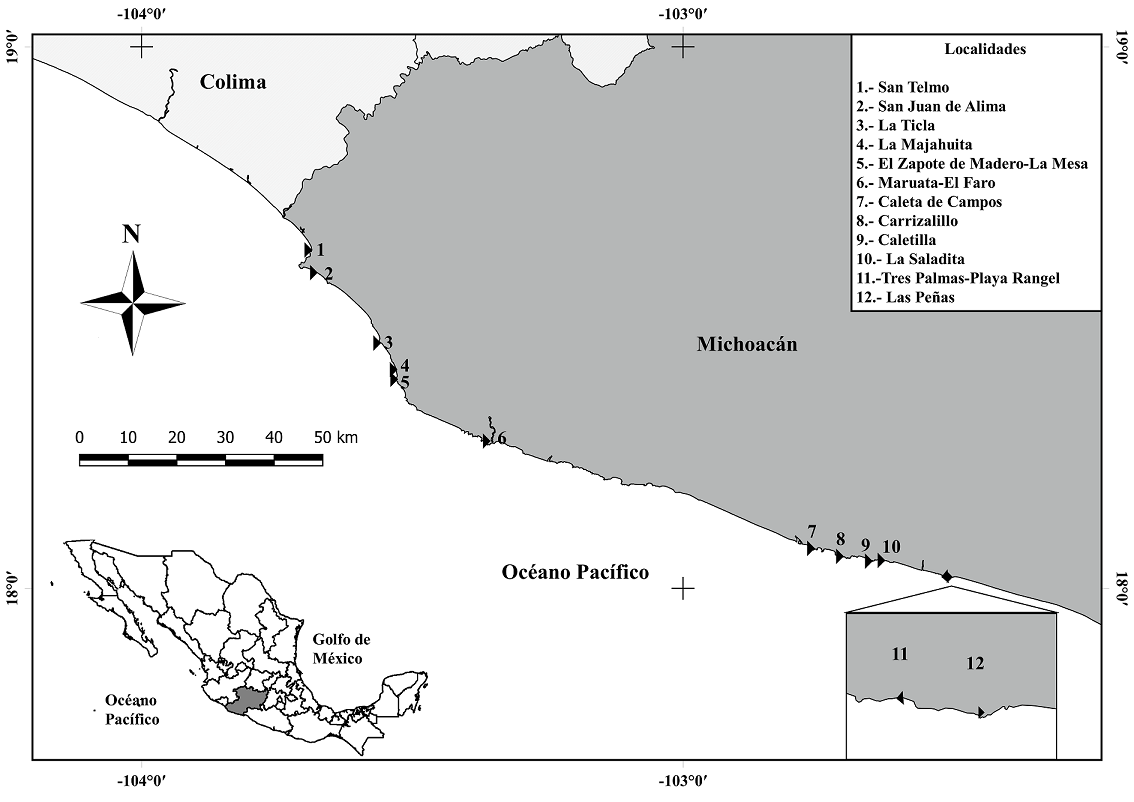
El material ficológico se obtuvo de 15 muestreos, 4 en la temporada de lluvias y 11 en la de secas en 12 localidades del litoral de Michoacán: San Telmo, San Juan de Alima, La Ticla, La Majahuita, El Zapote de Madero-La Mesa, Maruata-El Faro, Caleta de Campos, Carrizalillo, Caletilla, La Saladita, Tres Palmas-Playa Rangel y Las Peñas; que incluyeron desde marzo de 2006 hasta mayo de 2014. En la tabla 1 se muestran las localidades de muestreo con coordenadas geográficas (GPS), fisiografía, exposición al oleaje, sustrato, profundidad y fecha de recolecta. En la figura 1 se muestra la distribución de las localidades en el área de estudio. Las Rhodophyta se recolectaron manualmente en el nivel intermareal y en el submareal hasta 2 m de profundidad con espátulas, y se fijaron en formaldehido a 5% en agua de mar. Las recolectas se hicieron en segmentos de playa de 500-1,500 m de extensión.
Tabla 1 Localidades de muestreo, ubicación, fisiografía, exposición al oleaje, sustrato, profundidad, fechas de recolección.
| Localidades | Coordenadas GPS |
Fisiografía | Exposición al oleaje |
Sustrato | Profundidad | Fecha de recolecta |
|---|---|---|---|---|---|---|
| 1. San Telmo | 18°37129” N, 103°41’06” O |
Arenosa con acantilados, agregados rocosos |
Expuesto | Rocoso | 0-1 m | 12/2009 |
| 2. San Juan de Alima | 18°34’59” N, 103°40’28”O |
Arenosa con agregados rocosos |
Expuesto | Rocoso | 0-1 m | 12/ 2012; 08/ 2013 |
| 3. La Ticla |
18°27’16” N, 103°33’19” O |
Arenosa con cantos rodados |
Expuesto |
Cantos rodados |
0-2 |
12/2012; 08/2013 |
| 4. La Majahuita | 18°24’13”N, 103°31’39” O |
Rocosa con plataforma de marea |
Expuesto y protegido |
Rocoso con pozas intermareales con canales de corriente |
0-2 m | 01, 03, 09/2008; 04/2009; 03/2010; 12/2012 |
| 5. El Zapote de Madero-La Mesa |
18°23’10” N, 103°31’35” O |
Arenosa con plataformas rocosas y agregados de rocas |
Expuesto y protegido |
Rocoso con pozas intermareales |
0-2 m | 03, 05/2006; 03, 06/ 2007; 09, 12/ 2008; 12/ 2009; 03/2010; 08, 12/ 2012; 08/2013 |
| 6. Maruata-El Faro | 18°16’18” N, 103°21’20” O |
Arenosa con acantilados, agregados rocosos |
Expuesto | Rocoso | 0-3 m | 08/2013; 12/2012 |
| 7. Caleta de Campos | 18°04’26” N, 102°45’23” O |
Arenosa con acantilados, agregados rocosos |
Expuesto | Rocoso, acantilados |
0-1 m | 04/2009; 12/2012 |
| 8. Carrizalillo | 18°03’33” N, 102.42’11” O |
Arenosa con agregados rocosos |
Expuesto | Rocoso con pozas | 0-1 m | 01, 04/2009; 03/2010 |
| 9. Caletilla | 18°03’01” N, 102°38’58” O |
Arenosa con plataformas rocosas y agregados de rocas |
Expuesto y protegido |
Rocoso con pozas intermareales |
0-2 m | 12/2006; 03/2007; 03/2008; 04/2009; 03/2010, |
| 10. La Saladita | 18°03’06” N, 102°37’35” O |
Arenosa con agregados rocosos |
Expuesto | Rocoso con pozas intermareales |
0-1 m | 03/2007; 12/2008; 04/2009 |
| 11. Tres Palmas-Playa Rangel |
18°01’14” N, 102°30’06” O |
Arenosa con agregados rocosos |
Expuesto | Rocoso con pozas intermareales |
0-1 m | 05/2008; 08/2013; 05/2014 |
| 12. Las Peñas | 18°01’14” N, 102°30’6” O |
Arenosa con acantilados, agregados rocosos |
Expuesto | Rocoso con pozas intermareales |
0-1 m | 12/2008; 04, 12/2009; 03/2010 |
El material fue determinado, herborizado y depositado en el herbario ENCB (Thiers, 2017). Para la observación de las Rhodophyta se utilizó un microscopio binocular Olympus CX31RBSF (Manila, Filipinas), se hicieron cortes de los talos con navajas de doble filo para diferenciar estructuras reproductivas y vegetativas. Para la descalcificación de los representantes de las familias Corallinaceae, Liagoraceae y Peyssonneliaceae se utilizó HNO3 al 0.6 M. La determinación de las Rhodophyta se hizo usando los trabajos de Abbott y Hollenberg (1976), Cho et al. (2008), Dawson (1944, 1953, 1954, 1959, 1960a, b, 1961, 1962, 1963a, b, 1966), Hollenberg (1961), Norris (2014), Setchell y Gardner (1924), Taylor (1945) y Won et al. (2009). La secuencia de la lista florística sigue el orden propuesto por Wynne (2017). La actualización nomenclatural se basó en los trabajos de Guiry y Guiry (2020) y Wynne (2017). Las imágenes y fotomicrografías de las muestras se tomaron con una cámara Canon D30 (Tokio, Japón) acoplada a un microscopio Olympus CX31 (Manila, Filipinas). Las imágenes digitales fueron editadas y organizadas en láminas con Adobe Photoshop 7.0 (San José, CA, EUA).
El estado de Michoacán pertenece al litoral de la República Mexicana ubicado en el Pacífico transicional mexicano también conocido como Pacífico tropical mexicano (PTM), el límite más septentrional de la región coincide con el sitio donde la corriente de California vira hacia el oeste en verano, dejando a la región bajo la influencia de la cálida corriente costera de Costa Rica (Wilkinson et al., 2009). La costa de Michoacán se sitúa desde la boca de Apiza del río Coahuayana hasta la boca de San Francisco al este del delta del río Balsas, abarcando 264 km de litoral (Correa, 1974), entre los 20°23’27” - 17°53’57” N, 100°03’32” - 103°44’49” O (fig. 1), limita al noroeste con el municipio de Tecomán de Colima y al suroeste con el municipio de La Unión (región costa Grande) del estado de Guerrero (Juárez-Gutiérrez et al., 2006). Son costas tectónicas de colisión de rocas sedimentarias que forman gran cantidad de cantiles, puntas rocosas y pequeñas bahías. Hay algunos ríos que llegan a la costa y casi una total ausencia de cuerpos de agua costeros (Ortiz-Pérez y De la Lanza-Espino, 2006). El clima del área es del subtipo Aw 1 (W), cálido subhúmedo con 2 periodos de lluvia separados por sequías intraestivales; las lluvias de verano son abundantes, las invernales escasas (menos del 5% del total anual) (García, 1983). La temperatura ambiental alcanza los 33 °C y la mínima invernal de 18 °C, la precipitación pluvial anual es de 600 a 800 mm, siendo la precipitación máxima en la zona sur del estado de 1,000 a 1,200 mm (García, 1983; INEGI 1989). La estación de lluvias se presenta de mayo a octubre y la de secas de noviembre a abril. El régimen de mareas es micromareal mixto, ocurriendo generalmente 2 pleamares y 2 bajamares cada día de marea, con una amplitud de alrededor de 0.27 metros (Grivel, 1983).
Resultados
En el presente estudio fueron determinadas un total de 124 especies de algas rojas. Estas especies estuvieron distribuidas en 4 clases, 17 órdenes, 34 familias, 67 géneros, 121 especies, 2 variedades y 1 forma (tabla 2). Los géneros con mayor riqueza específica fueron Grateloupia C. Agardh (7), Ceramium Roth (6), Jania J. V. Lamouroux, Acrochaetium Nägeli, Laurencia J. V. Lamouroux y Gracilaria Greville con 5 cada uno, entre los géneros monoespecificos se encontraron: Bangia Lyngbye, Pyropia J. Agardh, Dermonema Harvey ex Heydrich, Izziella Doty, Antithamnionella Lyle, Anotrichium Nägeli, Osmundea Stackhouse, Tayloriella Kylin, Ochtodes J. Agardh y Sahlingia Kornmann, entre otros (tabla 2).
Tabla 2 Algas rojas (Rhodophyta) del litoral de Michoacán. La explicación de los símbolos al final de la tabla.
| Especies | Localidades | Est. | Fenología | Hábitat | Obs. | Referencias | Número Herbario ENCB |
|---|---|---|---|---|---|---|---|
| Bangyophyceae | |||||||
| Bangiales | |||||||
| Bangiaceae | |||||||
| 1. Bangia fuscopurpurea (Dillwyn) Lyngbye |
2, 4, 9, 10 | Ll S | Ci, ♂, ♀ | R, Epi | A, I | 24058 25154 | |
| 2. Pyropia raulaguilarii Mateo-Cid, Mendoza-González et Sentíes |
8, 9 | S | Ci, ♂, ♀ | R | A, I | 19523 19524 | |
| Florideophyceae | |||||||
| Corallinales | |||||||
| Corallinaceae | |||||||
| 3. Chamberlainium decipiens (Foslie) Caragnano, Foetisch, Maneveldt et Payri |
9 | S | Te | R | A, I | 20221 | |
| 4. C. tumidum (Foslie) Caragnano, Foetisch, Maneveldt et Payri |
12 | S | ♀ | R | NRM | A | 24987 |
| 5. Crusticorallina muricata (Foslie) P.W. Gabrielson, Martone, K.R. Hind et C.P. Jensen |
E | ||||||
| 6. Jania capillacea Harvey | E, I | ||||||
| 7. J. longiarthra E.Y. Dawson | 5, 6, 9 | S | Te | R | NRM | A | 12074 25118 |
| 8. J. pacifica Areschoug | 2, 5, 6, 9, 12 |
Ll S | Te | R | A, E, I | 24699 25119 25120 |
|
| 9. J. tenella (Kützing) Grunow | 4, 5, 7 | S | Te | R | A, B, D, E, I | 24700 25121 25368 |
|
| 10. J. tenella var. zacae E.Y. Dawson | 4, 5, 10 | Ll S | Te | R Epi | NRM | A | 24701 24702 24703 |
| 11. J. ungulata f. brevior (Yendo) Yendo Hydrolithaceae |
5, 9, 10 | S | Te ♂ | R | NRM | A | 25122 25372 |
| Hydrolithaceae | |||||||
| 12. Fosliella paschalis (Me. Lemoine) Setchell et N.L. Gardner |
E, I | ||||||
| 13. Hydrolithon farinosum (J. V. Lamouroux) D. Penrose et Y. M. Chamberlain |
2, 4, 6 | Ll S | Te | Epi | NRM | A | 23848 23861 23869 |
| 14. Pneophyllum confervicola (Kützing) Y.M. Chamberlain |
E, I | ||||||
| 15. P. fragile Kützing | 5 | S | ♂ | Epi | NRM | A | 19093 |
| 16. P. nicholsii (Setchell et L.R. Mason) P.C. Silva et P.W. Gabrielson |
B, E, F, H, I | ||||||
| Lithophyllaceae | 24693 24694 | ||||||
| 17. Amphiroa beauvoisii J.V. Lamouroux | 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 |
Ll S | Te | R Epi | A, B, D, E, I | 24695 25105 25108 25109 25111 25351 25352 25353 |
|
| 18. A. dimorpha Me. Lemoine | RD | B, D | |||||
| 19. A. franciscana W.R. Taylor | RD | B | |||||
| 20. A. misakiensis Yendo | 3, 5, 8, 9 | Ll S | Te | R | A, E, I | 18636 25113 25114 25360 |
|
| 21. A. rigida J.V. Lamouroux | RD | D, E, H, I | |||||
| 22. A. valonioides Yendo | 2 | Ll | Te | R | A, E, I | 25115 | |
| 23. Lithophyllum corallinae (P. Crouan et H. Crouan) Heydrich |
9 | S | Te | R | NRM | A | 24993 |
| 24. L. imitans Foslie | E, I | ||||||
| 25. L. prototypum (Foslie) Foslie | 5 | Ll | ♀ | R | NRM | A | 20208 |
| 26. L. stictaeforme (Areschoug) Hauck | 4, 9, 10, 12 | S | Te ♀ ♂ | R Pm | A, I | 24995 24996 24997 25000 |
|
| 27. Titanoderma pustulatum (J.V. Lamouroux) Nägeli |
4, 5, 6, 9 | Ll S | Te ♂ | Epi | A, E, H, I | 18796 24097 24720 25131 25132 |
|
| Porolithaceae | |||||||
| 28. Dawsoniolithon conicum (E.Y. Dawson) Caragnano, Foetisch, Maneveldt et Payri |
5 | S | Te | Epi | NRM | A | 24988 |
| 29. Harveylithon rupestre (Foslie) A. Rösler, Perfectti, V. Peña et J.C. Braga |
9 | Ll S | Te | R | A, I | 24989 24990 | |
| 30. H. samoënse (Foslie) A. Rösler, Perfectti, V. Peña et J.C. Braga |
8 | S | Te | R | NRM | A | 24991 |
| 31. Porolithon onkodes (Heydrich) Foslie | 5 | S | Te | R | NRM | A | 25003 |
| Spongitaceae | |||||||
| 32. Neogoniolithon megalocystum (Foslie) Setchell et L. R. Mason |
9 | S | ♂ | R | NRP | A | 25005 |
| 33. N. trichotomum (Heydrich) Setchell et L. R. Mason |
1, 4, 5 | Ll S | Te | Pm | A, I | 22170 24706 25124 25125 25376 |
|
| 34. Spongites yendoi (Foslie) Y.M. Chamberlain Hapalidiales Hapalidiaceae |
12 | S | Te ♀ | R | NRM | A | 25004 |
| Hapalidiales | |||||||
| Hapalidiaceae | |||||||
| 35.Melobesia accola (Foslie) Me. Lemoine |
F | ||||||
| 36. M. membranacea (Esper) J.V. Lamouroux |
5, 6, 9 | Ll S | Te ♀ ♂ | Epi | NRM | A | 24704 24705 25203 |
| Hildenbrandiales | |||||||
| Hildenbrandiaceae | |||||||
| 37. Hildenbrandia rubra (Sommerfelt) Meneghini |
D, H | ||||||
| Acrochaetiales | |||||||
| Acrochaetiaceae | |||||||
| 38. Acrochaetium arcuatum (K. M. Drew) C. K. Tseng |
4 | S | Mn | Epi | A, H | 25381 | |
| 39. A. crassipes (Børgesen) Børgesen | 2, 9 | S | Mn | Epi | NRM | A | 25333 |
| 40. A. microscopicum (Nägeli ex Kützing) Nägeli |
2, 7, 9, 12 | S | Mn | Epi | NRM | A | 23953 24034 24036 24062 |
| 41. A. pacificum Kylin | 5 | Ll | Mn | Epi | NRM | A | 19624 |
| 42. A. plumosum (K. M. Drew) G. M. Smith |
5 | Ll | Mn | Epi | NRM | A | 19624 |
| Colaconematales | 19624 | ||||||
| Colaconemataceae | 24004 | ||||||
| 43. Colaconema daviesii (Dillwyn) Stegenga |
4, 5, 6, 9 | Ll S | Mn | Epi | NRM | A | 24031 24130 24131 |
| 44. C. punctatum (E.Y. Dawson) J.N. Norris |
E, H, I | ||||||
| 45. C. savianum (Meneghini) R. Nielsen | 5, 6 | Ll | Mn | Epi | A, I | 24130 24131 | |
| 46. C. scinaiae (E.Y. Dawson) J.N. Norris | E, H | ||||||
| 47. C. sinicola (E.Y. Dawson) J.N. Norris | B, H | ||||||
| Nemaliales | 25129 25130 | ||||||
| Galaxauraceae | 25379 | ||||||
| 48. Tricleocarpa fastigiata (Decaisne) Huisman, G.H. Boo et S.M. Boo |
3, 4, 5 | S | ♂ | R | NRM | A | |
| Liagoraceae | 24634 24635 | ||||||
| 49. Dermonema virens (J. Agardh) Pedroche et Ávila-Ortiz. |
1, 5, 6, 8. 9, 12 |
Ll S | ♂ ♀ Ci | R | A, B, E, I | 25044 25205 25320 25413 |
|
| 50. Izziella orientalis (J. Agardh) Huisman et Schils |
3, 5, 10 | S | ♀ ♂ Ci | R | A, H, I | 24109 24636 25045 25206 |
|
| Bonnemaisoniales | |||||||
| Bonnemaisoniaceae | |||||||
| 51. Asparagopsis taxiformis (Delile) Trevisan |
9 | S | Te | R Epi | A, D, I | MICH-06-55/02 | |
| Ceramiales | |||||||
| Callithamniaceae | |||||||
| 52. Crouania attenuata (C. Agardh) J. Agardh |
I | ||||||
| Ceramiaceae | |||||||
| 53. Antithamnionella breviramosa (E.Y. Dawson) Wollaston |
4, 5, 10, 12 | S | Te Ci | Epi | NRM | A | 23948 24112 25141 |
| 54. Centroceras clavulatum (C. Agardh) Montagne |
RD | B, D, E, I | |||||
| 55. C. gasparrinii (Meneghini) Kützing | 2, 4, 5, 6, 7, 9, 10, 11 |
Ll S | Te Ci ♂ | R Epi | A, I | 24434 25142 25143 25144 25145 25149 25150 |
|
| 56. Ceramium caudatum Setchell et N.L. Gardner |
5, 8, 9, 12 | Ll S | Te Ci ♂ | Epi | A, I | 19103 21098 25148 25141 25159 25413 |
|
| 57. C. clarionense Setchell et N. L. Gardner |
5, 9 | S | Te Ci | Epi | A, I | 25139 | |
| 58. C. corniculatum Montagne | RD | B | |||||
| 59. C. hamatispinum E. Y. Dawson | 4, 5, 9 | S | Te Ci | R Epi | A, I | 10870 21098 | |
| 60. C. leutzelburgii O. C. Schmidt | RD | B | |||||
| 61. C. procumbens Setchell et N. L. Gardner |
9 | S | Te | Epi | A, I | MICH-09-A/01 | |
| 62. C. sinicola Setchell et N. L. Gardner | 7, 12 | S | Te | Epi | NRM | A | 21539 |
| 63. C. zacae Setchell et N. L. Gardner | 5, 10 | Ll S | Te Ci | Epi | A, I | 18796 | |
| 64. Gayliella flaccida (Harvey ex Kützing) T. O. Cho et L. J. McIvor |
5, 6 | Ll S | Te ♀ ♂ | Epi | A, B, E, I | 15468 15469 15556 |
|
| 65. G. fimbriata (Setchell et N. L. Gardner) T. O. Cho et S. M. Boo |
2, 5, 6, 9, 10 |
Ll S | Te ♀ ♂ | Epi | NRM | A | 24115 25150 25151 25391 |
| 66. G. taylorii (E. Y. Dawson) T. O. Cho et S. M. Boo |
2, 4, 5, 6, 7, 9, 10, 12 |
Ll S | Te Ci ♂ | Epi | A, I | 22618 22631 22740 23851 24062 25131 25153 |
|
| Wrangeliaceae | |||||||
| 67. Pleonosporium mexicanum E.Y. Dawson |
5, 9, 10 | Ll S | Po Ci ♂ | R | A, B, I | 25261 | |
| 68. P. rhizoideum E. Y. Dawson | 6, 7, 10 | Ll S | Po | R | A, I | 2588 15555 24033 |
|
| 69. Anotrichium tenue (C. Agardh) Nägeli | 19622 22627 | ||||||
| 2, 5, 9, 10 | Ll S | Te Ci ♂ | R Epi | NRM | A | 23907 24180 25344 |
|
| 70. Bornetia binderiana (Sonder) Zanardini |
10, 12 | S | Te | R Epi | NRM | A | 23934 23935 24182 |
| 71. Griffithsia pacifica Kylin | 2, 4, 10, 12 | S | Te Ci ♂ | R Pm Epi |
A, E, H, I | 24181 24183 24184 24185 24443 |
|
| Delesseriaceae | |||||||
| 72. Cryptopleura crispa Kylin | 9 | S | Te | Epi | NRM | A | 19584 |
| 73. C. peltata (Montagne) M.J. Wynne | I | ||||||
| 74. C. ramosa (Hudson) L. Newton | I | ||||||
| 75. Myriogramme caespitosa E.Y. Dawson | 5, 9, 10 | Ll S | Te Ci ♂ | R Epi | A, I | 25168 25169 25170 25171 |
|
| 76. Taenioma perpusillum (J. Agardh) J. Agardh |
4, 5 | S | Te | R | NRM | A | 24071 24144 |
| Dasyaceae | |||||||
| 77. Dasya sinicola var. abyssicola (E.Y. Dawson) E.Y. Dawson |
2, 10 | S | Te | R | A, I | 25279 | |
| Rhodomelaceae | |||||||
| 78. Bryothamnion pacificum W.R. Taylor | 6 | Ll | Ve | R | NRM | A | 15529 |
| 79. Chondria arcuata Hollenberg | 2 | S | Te | R | A, B | 25225 | |
| 80. C. dasyphylla (Woodward) C. Agardh | C, E, I | ||||||
| 81. C. decipiens Kylin | C | ||||||
| 82. C. repens Børgesen | 2, 6 | S | Te | Epi | NRM | A | 10970 25226 |
| 83. Eutrichosiphonia confusa (Hollenberg) A.M. Savoie et G.W. Saunders |
3, 6, 9 | S | Te Ci | R Epi | A, B, C, E, G, H |
24119 | |
| 84. Herposiphonia littoralis Hollenberg | B, C, E, I | ||||||
| 85. H. plumula (J. Agardh) Falkenberg | C | ||||||
| 86. H. subdisticha Okamura | 2, 5, 9 | S | Te Ci | Epi | A, I | 24077 25329 25407 |
|
| 87. H. secunda (C. Agardh) Ambronn | E, I | ||||||
| 88. H. secunda f. tenella (C. Agardh) M.J. Wynne | 4, 6 | S | Te | Epi | A, E | 15604 25117 | |
| 89. H. tenella (C. Agardh) Ambronn | 12 | S | Te | Epi | A, B, C | ||
| 90. H. verticillata (Harvey) Kylin | B, E, I | ||||||
| 91. Laurencia clarionensis Setchell et N.L. Gardner |
C, I | ||||||
| 92. L. hancockii E.Y. Dawson | 2, 4, 5, 9, 10 | Ll S | Te | R | A, B, C, E | 24115 25383 | |
| 93. L. heteroclada Harvey | 9 | S | Te | Epi | A, I | 19514 | |
| 94. L. lajolla E.Y. Dawson | 4, 5, 8, 10 | Ll S | Te | R Epi | NRM | A | 25330 25331 25332 |
| 95. L. mutueae Sentíes, Cassano et Dreckmann |
5, 9 | Ll S | Te | Pm | NRM | A | 25422 25423 25424 |
| 96. L. pacifica Kylin | E | ||||||
| 97. L. voragina W.R. Taylor | 6, 8 | S | Te | R | A, B, C, E | 10957 24117 | |
| 98. Melanothamnus concinnus (Hollenberg) Díaz-Tapia et Maggs |
8 | S | Ci | Epi | A, B, C | 24118 | |
| 99. M. sphaerocarpus (Børgesen) Díaz- Tapia et Maggs |
RD | B, C, G, I | |||||
| 100. Ophidocladus simpliciusculus (P. Crouan et H. Crouan) Falkenberg |
9 | S | Te | R | NRP | A | 25333 |
| 101. Osmundea purepecha Sentíes, Mendoza-González et Mateo-Cid |
5 | S | ♂ | R | A, I | 19200 25425 | |
| 102. Polysiphonia decussata Hollenberg | E, I | ||||||
| 103. P. mollis J.D. Hooker et Harvey | G | ||||||
| 104. P. nathanielii Hollenberg | G | ||||||
| 105. P. scopulorum Harvey | B | ||||||
| 106. P. sertularioides (Grateloup) J. Agardh |
2, 8, 9, 10 | Ll S | Te Ci | R Epi | A, G, I | 19620 24120 24121 |
|
| 107. P. subtilissima Montagne | G | ||||||
| 108. P. villum J. Agardh | 9 | S | Te | Epi | NRM | A | 24063 |
| 109. Tayloriella dictyurus (J. Agardh) Kylin |
2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 |
Ll S | Te ♂ | R Epi | A, B, C, E, G, H, I |
24122 24123 24124 24125 24278 24638 24639 25047 25338 25337 25340 25427 |
|
| Gelidiales | |||||||
| Gelidiaceae | 24431 | ||||||
| 110. Gelidium galapagense W.R. Taylor | 7, 9 | S | Te Ci | R | A, I | 25355 | |
| 111. G. pusillum (Stackhouse) Le Jolis | 2, 6, 9, 10 | S | Te | R | A, B | 25041 25174 25175 25281 25282 |
|
| 112. G. pusillum var. pacificum W.R. Taylor | 2, 5, 10 | S | Te | R | NRM | A | 25285 |
| 113. G. sclerophyllum W.R. Taylor |
2, 8, 10 | S | Te | R | A, B, E, I | 15522 24092 25173 |
|
| Gelidiellaceae | 24091 25040 | ||||||
| 114. Gelidiella mexicana E.Y. Dawson | 2, 5 | S | Te | R | NRM | A | 25172 |
| Pterocladiaceae | |||||||
| 115. Pterocladiella caloglossoides (M. Howe) Santelices |
2, 9 | S | Te | R Pm | A, I | 25222 25223 | |
| Gigartinales | 22134 25156 | ||||||
| Cystocloniaceae | 25157 25158 | ||||||
| 116. Hypnea johnstonii Setchell et N.L. Gardner |
2, 3, 4, 5, 6, 7, 8, 9, 10, 12 |
Ll S | Te Ci | R | A, I | 25159 25391 25392 25393 25394 |
|
| 117. H. pannosa J. Agardh | 3, 4, 5, 6, 7, 8, 9, 10, 12 |
Ll S | Te | R Pm | A, D, I | 19089 24623 24624 25160 25162 25163 25164 25398 25399 |
|
| 118. H. spinella (C. Agardh) Kützing. | 2, 3, 4, 5 | Ll S | Te | R | A, B, D, E; I | 19092 19619 25165 |
|
| 119. H. valentiae (Turner) Montagne | 5, 6 | Ll S | Te | R | A, E, I | 25166 25276 | |
| Kallymeniaceae | |||||||
| 120. Callophyllis violacea J. Agardh | B | ||||||
| Phyllophoraceae | |||||||
| 121. Ahnfeltiopsis gigartinoides (J. Agardh) P.C. Silva et DeCew |
4, 5, 6 | Ll S | Ve | R | NRM | A | 19067 24101 24440 25046 |
| 122. A. hancockii (E.Y. Dawson) J.N. Norris et Fredericq |
2. 3 | S | Ci | R | NRM | A | 25209 25210 |
| 123. A. smithii (W.R. Taylor) K.M. Dreckmann et I. Stout |
B, E, I | ||||||
| 124. Besa leptophylla (J. Agardh) M.S. Calderon et K.A. Miller |
2 | S | Ci | R | A, E, H, I | 25211 | |
| 125. Gymnogongrus crustiformis E.Y. Dawson |
8, 9 | S | Ci | R | NRM | A | 25212 |
| 126. G. durvillei (Bory) M.S. Calderon et S.M. Boo |
5 | Ll | Ve | R | NRM | A | 25418 |
| 127. G. johnstonii (Setchell et N.L. Gardner) E.Y. Dawson |
2, 3, 4, 5, 6, 7, 10, 11, 12 |
Ll S | Ci | R | A, I | 24102 24103 24104 24441 24641 25213 25214 25215 25216 25322 25324 25325 25420 25421 |
|
| Rhizophyllidaceae | 19105 19116 | ||||||
| Rhizophyllidaceae 128. Ochtodes searlesii Mendoza- González, Mateo-Cid et Sentíes |
4, 5, 9 | Ll S | Te Ci ♂ | R | A, I | 24113 24303 | |
| Ahnfeltiales | |||||||
| Ahnfeltiaceae | 19105 | ||||||
| 129. Ahnfeltia plicata (Hudson) Fries | 2, 4, 5 | Ll S | Ci | R | A, I | 25133 25386 | |
| 130. A. svensonii W.R. Taylor | 3, 5, 6, 12 | Ll S | Ve | R | NRM | A | 15582 25249 25388 25389 |
| Gracilariales | |||||||
| Gracilariaceae | 19621 | ||||||
| 131. Gracilaria crispata Setchell et N.L. Gardner |
4, 5 | Ll S | Te Ci | R | A, I | 24095 25042 25177 25290 |
|
| 132. G. pachydermatica Setchell et N.L. Gardner |
2, 5, 8 | Ll S | Te Ci | R | A, I | 25180 25181 25292 |
|
| 133. G. ramisecunda E.Y. Dawson | 4, 5 | S | Ci | R Pm | NRM | A | 19096 24094 25293 |
| 134. G. subsecundata Setchell et N.L. Gardner |
2, 3, 4 | S | Te | R | NRM | A | 25182 25294 25403 |
| 135. G. veleroae E.Y. Dawson | 2, 3, 5, 8, 9, 12 |
S | Te | R | NRM | A | 25043 25183 25184 25185 25186 25295 |
| Halymeniales | 24627 25188 | ||||||
| Halymeniaceae | 25189 25190 | ||||||
| 136. Grateloupia catenata Yendo | 2, 3, 4, 5, 6, 7 | Ll S | Ci | R Pm | NRM | A | 25296 |
| 137. G. clarionensis (Setchell et N.L. Gardner) S. Kawaguchi et H.W. Wang |
6, 9 | Ll S | Ci | R Pm | A, I | 24628 24629 | |
| 138. G. dactylifera E.Y. Dawson | 5 | S | Ci | R | NRM | A | 25406 |
| 139. G. doryphora (Montagne) M. Howe | 4, 5, 7, 9, 11, 12 |
Ll S | Te Ci | R | A, B, E, I | 19103 24096 24630 25407 |
|
| 140. G. filicina (J.V. Lamouroux) C. Agardh |
RD | E, I | |||||
| 141. G. hancockii E.Y. Dawson | B, H | ||||||
| 142. G. huertana Mateo-Cid, Mendoza- González et Gavio |
4, 5, 8, 9 | Ll S | Te Ci | R | A, I | 24097 25191 25297 25298 25408 |
|
| 143. G. prolongata J. Agardh | 3, 5, 7 | S | Te | R | NRM | A | 25192 25193 25300 |
| 144. G. versicolor (J. Agardh) J. Agardh | 2, 4, 5, 6, 7, 8, 9, 10 |
Ll S | Te Ci | R | A, E, I | 24098 24099 24632 25194 25195 25196 25198 25199 25309 25310 25411 |
|
| 145. Halymenia elongata C. Agardh | 5, 7 | S | Te Ci | R | NRM | A | 24100 24623 |
| 146. Prionitis abbreviata Setchell et N.L. Gardner |
10 | S | Ci | R | A, B, H | 25200 | |
| 147. P. filiformis Kylin | B | ||||||
| Peyssonneliales | 19257 20221 | ||||||
| Peyssonneliaceae | 20811 | ||||||
| 148. Cruoriella fissurata E.Y. Dawson | 5, 9 | Ll S | Te | R | NRM | A | |
| 149. C. mexicana (E.Y. Dawson) Denizot | F | ||||||
| 150. Metapeyssonnelia mexicana (E.Y. Dawson) D.L. Ballantine et H. Ruiz |
5, 9 | S | Te | R | A, I | 19125 21448 | |
| 151. Peyssonnelia mexicana E.Y. Dawson | 4, 5, 8, 9 | Ll S | Te | R | A, B, F | 24708 25126 25127 25128 25397 |
|
| 152. P. orientalis (Weber Bosse) Cormaci et G. Furnari |
9, 10 | Ll S | Te | R | A, I | 19136 22828 24998 |
|
| Rhodymeniales | |||||||
| Champiaceae | |||||||
| 153. Champia caespitosa E.Y. Dawson | 5, 9 | Ll S | Ci | Epi | NRM | A | 25139 |
| 154. C. parvula (C. Agardh) Harvey | 5, 6, 9 | S | Te | Epi | A, B, E, I | 11085 23852 | |
| Lomentariaceae | |||||||
| 155. Ceratodictyon tenue (Setchell et N.L. Gardner) J.N. Norris |
3, 4, 5, 7, 10 |
S | Te | R | NRM | A | 24110 24111 24637 25054 25207 25312 |
| 156. C. variabile (J. Agardh) R.E. Norris | 2, 3, 4, 5, 8, 9, 12 |
Ll S | Te | R | A, I | 24112 25203 25208 25313 25314 25316 25317 25319 |
|
| Rhodymeniaceae | |||||||
| 157. Drouetia coalescens (Farlow) G. De Toni |
8, 9 | S | Te | R | NRM | A | 25432 |
| 158. Halichrysis irregularis (Kützing) A.J.K. Millar |
5, 8, 9 | Ll S | Te | R Pm | A, I | 23890 24114 | |
| 159. Rhodymenia californica Kylin | B | ||||||
| 160. R. pacifica Kylin | B | ||||||
| Compsopogonophyceae | |||||||
| Erythropeltidales | |||||||
| Erythrotrichiaceae | |||||||
| 161. Erythrotrichia biseriata Tanaka | 2 | S | Ve | Epi | NRM | A | 25280 |
| 162. E. carnea (Dillwyn) J. Agardh | 2, 4, 5, 6, 9, 10 |
Ll S | Ve | Epi | A, B, I | 19358 23844 23938 23984 25154 25293 |
|
| 163. Sahlingia subintegra (Rosenvinge) P. Kornmann |
2, 4, 5, 9, 10 |
Ll S | Ve | Epi | A, B, I | 19358 23856 25280 25428 |
|
| Stylonematophyceae | |||||||
| Stylonematales | |||||||
| Stylonemataceae | |||||||
| 164. Chroodactylon ornatum (C. Agardh) Basson |
4 | S | Ve | Epi | NRM | A | 23869 |
| 165. Stylonema alsidii (Zanardini) K.M. Drew |
4, 9 | S | Ve | Epi | A, B, E, I | 24079 25269 | |
| 166. S. cornu-cervi Reinsch | 8 | Ll | Ve | Epi | NRM | A | 23858 |
Localidades: 1. San Telmo, 2. San Juan de Alima, 3. La Ticla, 4. La Majahuita, 5. La Mesa-El Zapote de Madero, 6. Maruata, 7. Caleta de Campos, 8. Carrizalillo, 9. Caletilla, 10. La Saladita, 11. Tres Palmas-Playa Rangel, 12. Las Peñas. Est. (estacionalidad): Ll = lluvias (mayo de 2006, 2008, 2014; agosto 2013; septiembre 2009), S = secas (marzo de 2007, 2008, 2010; abril 2009; noviembre 2010; diciembre de 2006, 2008, 2009, 2012). Fenología: ♀ = carpogonios; ♂ = espermacios; Ci = carpoesporofitos; Te = tetrasporangios; Mn = monosporas; Po = poliesporangios; Ve = vegetativo. Hábitat: R = rocoso; Pm = pozas intermareales; Epi = epífito. Obs. (observaciones): NRM = nuevo registro para Michoacán; NRP = nuevo registro para la costa del Pacífico de México; RD = registro dudoso. Referencias: A) este estudio, B) Dreckmann et al. (1990), C) Sentíes et al. (1990), D) León Tejera et al. (1993), E) Stout y Dreckmann (1993), F) León-Álvarez y González-González (1993), G) Sentíes (1995), H) Norris (2014), I) Ceballos-Corona et al. (2019).
Las familias mejor representadas de acuerdo con el número de taxones fueron Rhodomelaceae (18) y Ceramiaceae (13). Seguidas en importancia por Halymeniaceae (9), Corallinaceae, Lithophyllaceae y Porolithaceae con 7 cada una. También se ubicaron especies de Bangiaceae, Liagoraceae, Galaxauraceae, Delesseriaceae, Gelidiaceae, Cystocloniaceae, Peyssonneliaceae y Gracilariaceae representadas por 1 o 5 especies (tabla 2).
La integración del listado florístico permitió reconocer 54 nuevos registros infragenéricos para el litoral de Michoacán, Neogoniolithon megalocystum (Foslie) Setchell et L.R. Mason y Ophidocladus simpliciusculus (P. Crouan et H. Crouan) Falkenberg, fueron nuevos registros para el litoral del Pacífico de México. De los 112 registros infragenéricos previos, 72 taxones fueron encontrados en este estudio y 42 no se ubicaron en las muestras recolectadas, cabe aclarar que algunos de estos registros se consideran dudosos y se encuentran señalados en la tabla 2. En virtud de lo anterior, el número de especies registradas para la costa de Michoacán se amplió a 166 taxones infragenéricos de algas rojas marinas bentónicas, lo que representa un incremento de 47.2% del total de las Rhodophyta del área de estudio. La mayoría de los registros nuevos para Michoacán pertenece a géneros de algas coralinas como Chamberlainium Caragnano, Foetisch, Maneveld et Payri, Hydrolithon (Foslie) Foslie, Amphiroa J. V. Lamouroux, Lithophyllum Philippi, Dawsoniolithon Caragnano, Foetisch, Maneveld et Payri, Harveylithon Rösler, Perfectti, Peña et Braga y Porolithon Foslie, así como Acrochaetium, Taenioma J. Agardh, Laurencia, Ahnfeltiopsis P.C. Silva y DeCew, Gracilaria, Grateloupia y Stylonema Reinsch.
A continuación, se hace una descripción de los 2 nuevos registros de Rhodophyta para el litoral del Pacífico de México, con comentarios y distribución de las especies.
Neogoniolithon megalocystum (Foslie) Setchell et L.R. Mason
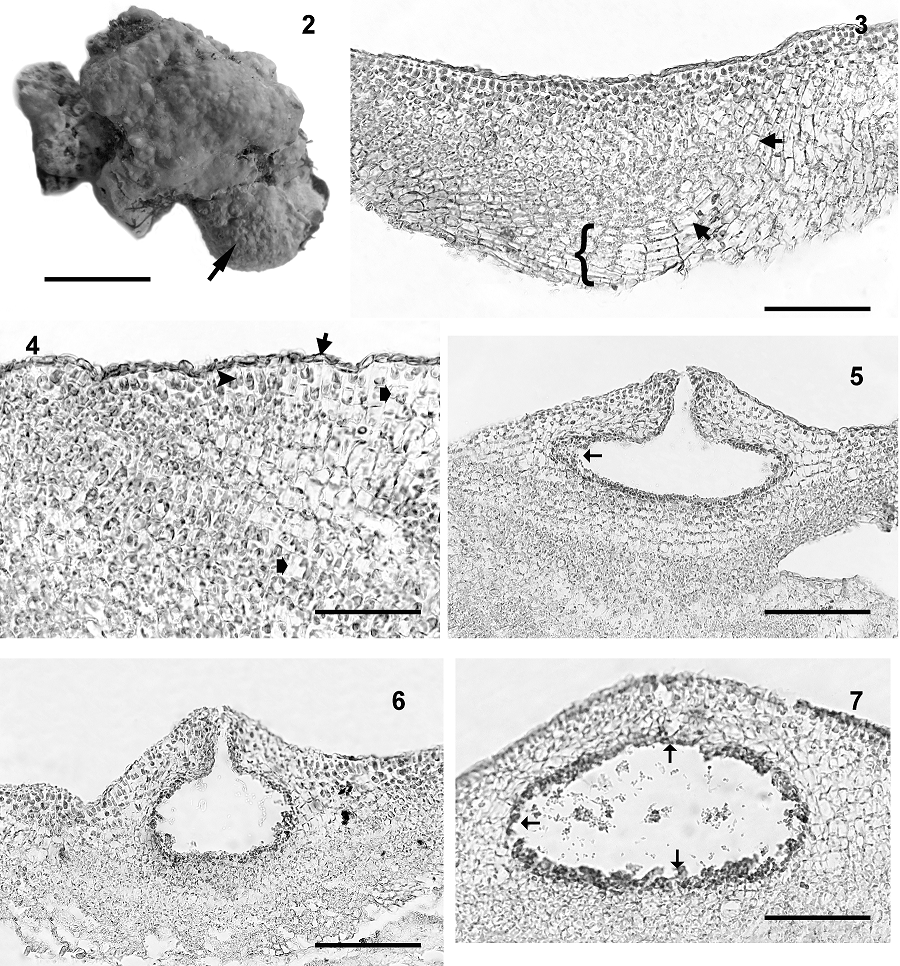
Figuras 2-7 Neogoniolithon megalocystum. 2) Aspecto general del talo creciendo en esqueletos de coral, superficie lisa con conceptáculos (flecha); escala 1.6 cm. 3) Sección del talo mostrando la construcción monómera, se observa la médula (llave) y 2 fusiones celulares (flechas); escala 90 μm. 4) Sección de la región dorsal mostrando un epitalo uniestratoso de células aplanadas (flecha), un tricocito solitario (cabeza de flecha) y fusiones celulares (flechas anchas) en la corteza; escala 55 μm. 5) Sección del talo mostrando la cámara espermatangial elipsoidal y espermacios (flecha) en la pared de la cámara; escala 125 μm. 6) Sección del talo mostrando una cámara espermatangial madura; escala 105 μm. 7) Detalle de la cámara espermatangial con espermacios (flechas) desarrollados en el piso, paredes y techo; escala 90 μm.
Talo incrustante liso, siguiendo el contorno del sustrato, sin protuberancias (fig. 2), unido al sustrato ventralmente por adhesión celular, 230 hasta 300 μm de espesor. La construcción del talo monómera (Fig. 3), que consiste en un sistema multiaxial de filamentos ramificados que contribuyen colectivamente de 30 a 40% del espesor total del talo, una región periférica donde porciones de filamentos centrales o sus derivados se curvan hacia afuera hacia la superficie del talo; las células ventrales son oblongas o rectangulares de 8-10 μm de ancho y 30-40 μm de largo; las células corticales son cuadradas (6-8 μm en diámetro), con numerosas fusiones celulares entre ellas (fig. 4); epitalo uniestratoso con células aplanadas de 9-10 μm de ancho y 2.5-3.0 μm de alto. Los tricocitos se presentan solitarios y dispersos en la región dorsal, de 10 a 12 μm de ancho y de 12 a 14 μm de largo (fig. 4).
Reproducción. Plantas gametangiales dioicas; conceptáculos espermatangiales uniporados y dispersos sobre el talo, protuberantes y apiculados, cámaras oblongas a elipsoidales de 160-230 μm de diámetro y 80-100 μm de altura. Espermatangios simples, los espermacios se desarrollan en el piso, paredes y techo de las cámaras masculinas (figs. 5-7). Talos femeninos y espóricos no observados.
Comentarios taxonómicos
Las características del ejemplar revisado difieren de la descripción original de Foslie (en Weber-van Bosse y Foslie, 1904) en el grosor del talo y la proporción de la medula, que Foslie indica que ocupa más de 80% del talo, los tricocitos son escasos y se menciona la presencia de conceptáculos esporangiales los que son apiculados y sobresalientes en el talo. Mateo-Cid et al. (2014) mencionan que en el género Neogoniolithon, las características morfoanatómicas como la construcción del talo y los tricocitos son útiles para delimitar a las especies. En este caso se asigna el nombre de N. megalocystum con base en su morfo anatomía y la presencia de conceptáculos espermatangiales característicos de este género. Es evidente que son requeridos estudios moleculares para dar certeza en la determinación de las especies.
Distribución: océano Índico, Mayotte y Comoras, Indonesia, Filipinas, China, Japón, Micronesia, Guam, Isla Marianas, Polinesia Francesa, Australia (Guiry y Guiry, 2020). México: Caletilla, Michoacán.
Ophidocladus simpliciusculus (P. Crouan et H. Crouan) Falkenberg

Figuras 8-11 Ophidocladus simpliciusculus. 8) Aspecto general del talo; escala 2 mm. 9) Detalle de la porción postrada del talo, con rizoides (flecha) y ramillas jóvenes fuertemente curveadas (cabeza de flecha); escala 50 μm. 10) Detalle de los rizoides unicelulares (cabeza de flecha), y conexión intercelular de los rizoides con las pericentrales (flecha); escala 50 μm. 11) Corte transversal de la porción basal del talo mostrando 19 células pericentrales (flechas); escala 45 μm.
Talo filamentoso, de organización dorsiventral, con una porción basal postrada (figs. 8, 9), fija al sustrato por rizoides unicelulares de (fig. 10) 25 a 28 μm que nacen en conexión intercelular de las pericentrales (fig. 11), de color verde-rojizo y de 5-7 mm de longitud. Porción basal de 130-140 μm diámetro, con 17 a 19 células pericentrales, ramificación endógena, las ramas erguidas simples, de color verde-rojizo. Los ápices curveados sin tricoblastos. Talo fértil no observado.
Comentarios taxonómicos
Las características de nuestros ejemplares concuerdan en general con la descripción de Saenger (1971) para especímenes de Sudáfrica, este autor indica que las bases postradas presentan 15 a 25 células pericentrales y que los ápices presentan tricoblastos, los cuales no se encontraron en los especímenes revisados. Ophidocladus simpliciusculus fue ubicado en el mes de marzo, su presencia en el área de estudio puede deberse a que el litoral de Michoacán pertenece al Pacífico transicional mexicano que es un mar tropical afectado estacionalmente (en el invierno) por la influencia del extremo sur de la corriente de California de aguas frías y cuya manifestación se presenta hacia el invierno y principios de primavera (Wilkinson et al., 2009).
Distribución: Pacífico de América: EUA, California (Abbott y Hollenberg, 1976). Brasil (Díaz-Tapia et al., 2018). Azores, Islas Canarias, Mauritania, Marruecos, Mozambique, Namibia, Sudafrica, Australia y Nueva Zelanda (Guiry y Guiry, 2020). México: Caletilla, Michoacán.
Generalidades del resto de las especies
Estacionalidad. La mayor riqueza específica se presentó en secas con 117, en contraste, el menor número de especies se ubicó en lluvias (60). El número de especies por localidad también presentó diferencias entre temporadas climáticas (tabla 2).
Fenología reproductiva. Del total de taxones determinados en este estudio se encontró a 115 en reproducción (92.74%), siendo la fase tetraspórica la que se encontró con mayor frecuencia en Rhodophyta ubicada en 82 taxones lo que representa 66.13%, y superó tanto a las algas encontradas con fase gamética masculina (23) como femenina (10). La fase carpoesporofítica se encontró en 34 especies, mientras que monosporas y polisporangios se hallaron en 9 especies. Finalmente, solo 9 especies se hallaron en fase vegetativa (7.25%). La mayoría de los representantes de las familias Ceramiaceae y Rhodomelaceae presentaron tetrasporangios, como: Ceramium procumbens Setchell et N.L. Gardner, C. sinicola Setchell et N.L. Gardner, Chondria arcuata Hollenberg y C. repens Børgesen, entre otros (tabla 2). Bangia fuscopurpurea (Dillwyn) Lyngbye, Pyropia, raulaguilarii, Dermonema virens (J. Agardh) Pedroche et Ávila-Ortiz e Izziella orientalis (J. Agardh) Huisman et Schils, se encontraron en estado reproductivo sexual (tabla 2).
Hábitat. Las especies determinadas en este estudio se localizaron en zonas rocosas expuestas, hábitat frecuente en la zona de estudio y representado por plataformas rocosas, pozas de marea, canales de corriente, guijarros, cantos rodados y zonas de acantilados. En este sustrato se ubicaron 89 especies, por lo que respecta a las epífitas estas fueron 49, 35 de ellas son estrictamente epífitas y 14 facultativas, es decir, también crecían en hábitats rocosos (tabla 2).
Distribución e índices. Las localidades en donde se ubicó el mayor número de taxones fueron: La Mesa-El Zapote de Madero, Caletilla y la Majahuita con 73, 63 y 42 taxones, respectivamente; mientras que en San Telmo y Tres Palmas-Playa Rangel solo se ubicaron 3 y 6 especies, en el resto de las localidades el número de taxones hallados osciló entre 18 y 34. Los resultados del presente estudio fueron analizados con los índices de Feldmann y Cheney y se compararon con lo encontrado por Mateo-Cid y Mendoza-González (1991, 2002, 2012) para Colima, Oaxaca y el litoral noroccidental de Guerrero, respectivamente; el de Dreckmann et al. (2006) para Chiapas, con el de Mendoza-González, Mateo-Cid et al. (2011) para la costa sur de Jalisco, Mendoza-González et al. (2018) de Chlorophyta de Michoacán y el de Mendoza-González et al. (en prensa) de algas pardas del litoral de Michoacán (tabla 3). Los resultados de los índices de Feldmann y de Cheney indican que la ficoflora de la zona de estudio (3.16, 4.39) es similar a la del litoral del estado de Oaxaca (3.7, 5) y con un valor cercano al obtenido para Colima (3.34, 4.52), es interesante resaltar que los índices obtenidos para el área de estudio son los más bajos del Pacífico tropical de México.
Tabla 3 Índices de Feldmann y Cheney para algunos ambientes marinos del litoral del Pacífico Tropical de México.
| Localidad/estado | Índice de Feldmann (R/P) |
Afinidad fitogeográfica |
Índice de Cheney (R+C)/P |
Afinidad fitogeográfica |
|---|---|---|---|---|
| Chiapas | 3.62 | Mixta | 5.62 | Mixta |
| Oaxaca | 3.70 | Mixta | 5.00 | Mixta |
| Costa noroccidental de Guerrero | 3.72 | Mixta | 4.84 | Mixta |
| Litoral sur de Jalisco | 3.59 | Mixta | 4.62 | Mixta |
| Colima | 3.34 | Mixta | 4.52 | Mixta |
| Costa sur de Nayarit | 4.31 | Tropical | 6.12 | Tropical |
| Litoral de Michoacán (este estudio) | 3.16 | Mixta | 4.39 | Mixta |
Discusión
El número total de taxones encontrados en este estudio es mayor que lo registrado en la costa sur de Nayarit donde Mateo-Cid y Mendoza-González (1992) citaron 69 taxones de Rhodophyta; Mateo-Cid y Mendoza-González (1991) registraron 77 algas rojas en el litoral de Colima; Mendoza-González y Mateo-Cid (1996) y Dreckmann et al. (2006) registraron 29 especies de Rhodophyta en Chiapas. Por otro lado, Mendoza-González, Mateo-Cid et al. (2011) documentaron 97 taxones de Rhodophyta para el litoral sur de Jalisco, mientras que 93 taxones se registraron por Mateo-Cid y Mendoza-González (2012) para la costa noroccidental de Guerrero. En el caso del litoral de Oaxaca, Bastida-Zavala et al. (2013) registraron 149 especies de algas rojas para esa región. Lo anterior evidencia que el litoral de Michoacán posee una gran riqueza específica de algas rojas del litoral del Pacífico tropical mexicano, con numerosos taxones característicos de la región.
Además, los resultados obtenidos sugieren que el litoral de Michoacán es un área con alta diversidad florística, si se tiene en cuenta que en su línea costa se puede encontrar 63.6% de las Rhodophyta conocidas para la costa del Pacífico tropical de México que es de 264 (Mendoza-González, Mateo-Cid et al., 2011; Pedroche y Sentíes, 2003).
De los 112 taxones citados previamente para el litoral de Michoacán, no se ubicaron a 42 de ellos (Ceballos-Corona et al., 2019; Dreckmann et al., 1990; Sentíes et al., 1990; Stout y Dreckmann, 1993). Lo anterior puede obedecer a diferentes razones entre ellas el cambio en los hábitats donde actualmente existe una mayor influencia humana que ha transformado la arquitectura del paisaje y la contaminación domestica e industrial de esa región (Wilkinson et al., 2009).
Por otro lado, también existen registros dudosos de algunas especies, por citar algunos, Won et al. (2009) en su trabajo de caracterización morfológica y molecular del género Centroceras, encontraron que muestras identificadas bajo el concepto de “Centroceras clavulatum” representaban 9 grupos morfológicos que correspondían a clados diferentes en sus análisis filogenéticos y determinaron que la distribución de C. clavulatum está restringida al norte de Chile, Perú, sur de California, sur de Australia y Nueva Zelanda, lo que hace poco probable su presencia en la zona tropical del Pacífico de México. En el caso de Ceramium leuetzelburgii (localidad tipo: Cabo Blanco, Brasil) y C. corniculatum (localidad tipo: Guadeloupe, Antillas Menores) ambas son especies típicamente Caribeñas (Guiry y Guiry, 2020). Díaz-Tapia et al. (2017) buscaron aclarar las relaciones en el complejo Neosiphonia/Polysiphonia utilizando una combinación de análisis moleculares y morfológicos, basándose en sus resultados transfirieron 46 especies de Neosiphonia a Melanothamnus, entre ellos Melanothamnus sphaerocarpus (localidad tipo: Islas Vírgenes) indicando, además, que la distribución del género Melanothamnus es predominantemente en el Indo-Pacífico.
Por lo que respecta al género Amphiroa, Norris y Johansen (1981) describieron a A. beauvoisii como una especie altamente variable en su morfología, mientras que Riosmena-Rodríguez y Siqueiros-Beltrones (1996) concluyeron que los caracteres externos e internos tienen una variación muy estrecha entre ellos y que la morfología externa no varía entre especímenes como en otros taxones. Harvey et al. (2009) determinaron que la variabilidad morfológica y anatómica general de A. beauvoisii no se pueden determinar por completo hasta que las identificaciones anteriores de los especímenes descritos en Australia sean reevaluados, asimismo mencionan que las descripciones previamente publicadas de Australia y de otras partes del mundo requieren una reevaluación para garantizar que las muestras en las que se basan las descripciones se han determinado correctamente. Claramente existe la necesidad de realizar estudios moleculares de este género y se ha demostrado que una combinación de identificación morfológica y código de barras COI es una herramienta útil en la delineación de especies de Amphiroa (Kogame et al., 2017). Es evidente que las especies de Amphiroa citadas en el litoral del Pacífico de Mexico como: A. beauvoisii, A. dimorpha, A. drouetii, A. franciscana, A. misakiensis y A. rigida requieren estudios morfológicos y moleculares para encontrar las verdaderas afinidades taxonómicas y filogenéticas de estas especies así como delimitar su distribución.
Particularmente, para el género Grateloupia, se tiene un amplio conocimiento acerca de su complicado escenario para establecer límites entre especies debido a la sustancial variación morfológica que exhibe (De Clerck et al., 2005). Si bien históricamente se consideraba a G. filicina como una especie de distribución cosmopolita, en los últimos años se han registrado molecularmente ejemplares de un amplio intervalo de distribución y a partir de ello se demostró que la “verdadera Grateloupia filicina” solo está presente en el mar Mediterráneo (De Clerck et al., 2005). Debido a lo incierto de los registros y la distribución de las especies mencionadas, es necesario realizar estudios moleculares especialmente en Colaconema, Laurencia y Polysiphonia, entre otros, con el fin de delimitar su estatus taxonómico.
Se ubicaron 54 nuevos registros para el área de estudio, este resultado puede deberse a: 1) las localidades de muestreo que no habían sido previamente estudiadas, 2) la revisión de especies epífitas y 3) el número de recolectas llevadas a cabo. Entre los nuevos registros tenemos Acrochaetium crassipes (Børgesen) Børgesen, A. microscopicum (Nägeli ex Kützing) Nägeli, A. plumosum (K. M. Drew) G. M. Smith, Antithamnionella breviramosa (E. Y. Dawson) Wollaston, Ceramium sinicola Setchell et N. L. Gardner y Gayliella fimbriata (Setchell et N. L. Gardner) T. O. Cho et S. M. Boo, todas de hábitos epífitos. En general, es reducido el número de especies y estudios florísticos en que se cita a los representantes de la familia Acrochaetiaceae (Woelkerling, 1971) y Coleconemataceae, debido quizás a su hábito de vida epífito. En el orden Corallinales se ubicaron un número alto de registros (14), es sabido que para los géneros y especies de este orden en el Pacífico tropical de México, enfrentamos los mismos problemas que Fragoso-Tejas y Rodríguez (2002), Kato et al. (2013) en las Islas Ryukyu, Japón y Mateo-Cid et al. (2014), entre otros: 1) la diversidad de especies es mayor de lo que se piensa con la presencia de varias especies crípticas, 2) numerosos caracteres de tipo diagnóstico a nivel principalmente específico se traslapan, haciendo difícil la delimitación de las especies, tal es el caso de Lithophyllum Philipi, Porolithon Foslie, Spongites Kützing y Neogoniolithon Setchell et L.R. Mason, entre otros y 3) el uso de caracteres morfoanatómicos para vincular especímenes recolectados en el campo y validarlos con nombres de especies ya publicadas en general ha resultado problemático. Es importante señalar que la mayoría de los especímenes de Corallinales ubicadas se encontraban en reproducción, lo que facilitó su determinación. A pesar de la dificultad de aplicar nombres, se encontró un conjunto de caracteres morfoanatómicos y reproductivos que son útiles para segregar a las especies de Corallinales registradas en el litoral de Michoacán.
Finalmente, los nuevos registros para el Pacífico de México: Neogoniolithon megalocystum y Ophidocladus simpliciusculus, pueden atribuirse a que la localidad en que fueron ubicados ha sido poco estudiada, en el caso de Neogoniolithon, éste se encontró en reproducción sexual, los conceptáculos espermatangiales permitieron reconocer el género, ya que una característica distintiva es el desarrollo de espermacios en el piso, paredes y techo de las cámaras (Mateo-Cid et al., 2014). En el caso de Ophidocladus, éste puede pasar desapercibido por su talla pequeña y por su periodo de vida, ya que al parecer es anual y solo se ubicó en una ocasión en la zona de muestreo.
Se observaron fluctuaciones temporales de la riqueza específica a lo largo del periodo de estudio, las cuales se encuentran relacionadas con las variaciones climáticas, condiciones oceanográficas y estacionalidad de las especies, sean anuales o perennes. La mayor riqueza se presentó en secas (117), que corresponde a noviembre, diciembre, marzo y abril. Lalli y Parson (1997) indican que la transparencia y la intensidad lumínica además de influir directamente sobre la productividad primaria, actúan principalmente en el fotoperiodo de las algas y no solo la cantidad, también la calidad es importante, lo que incide directamente en la abundancia y la diversidad de especies. El menor número de especies se ubicó en la temporada de lluvias (60) y a pesar de que el litoral de Michoacán se encuentra en latitudes tropicales, donde la superficie del agua de mar recibe más energía del sol durante verano y los días son 4 o 5 horas más largos, en comparación con el invierno, en este periodo las lluvias arrastran terrígenos al mar disminuyendo de este modo la energía proveniente del sol. Este patrón ha sido registrado en estudios realizados en otros estados del Pacífico tropical de México, por ejemplo, Mateo-Cid y Mendoza-González (2002) ubicaron un mayor número de especies de Rhodophyta en la costa de Oaxaca en la época de secas. En 2012, las mismas autoras en su trabajo de algas marinas bentónicas de la costa noroccidental de Guerrero, también encontraron un mayor número de especies en la temporada de secas y en ambos casos propusieron que sus resultados se encontraban relacionados con la presencia de las especies anuales, las que dominan en época de secas y disminuyen en la época de lluvias. En contraparte, Saad-Navarro y Riosmena-Rodríguez (2005), en un trabajo realizado en Baja California Sur, concluyen que las temporadas climáticas no determinan la variación temporal de la abundancia y composición, pero las condiciones y características especiales de cada sitio si influyen en la composición y abundancia de las macroalgas y esto debido principalmente al tipo de sustrato. Otros factores como nutrientes, evaporación, salinidad y cambios en la dinámica del agua producto de los huracanes y tormentas, también inciden en el desarrollo de la flora marina (Santelices, 1977).
De los 124 taxones ubicados en este estudio, 92% presentaron estructuras reproductoras, la etapa reproductiva mejor representada dentro de este trabajo fue la espórica lo cual coincide con los resultados obtenidos por Magalhaes-Lucio y Castro-Nunes (2002), Mateo-Cid y Mendoza-González (1991, 2012) y Mendoza-González et al. (2011b), estos últimos mencionan que la dominancia de una fase reproductiva puede estar influida por los cambios temporales de factores ambientales locales. De acuerdo con Santelices (1977), la reproducción asexual tiene la ventaja de requerir un menor gasto de energía para la formación de las esporas y su diseminación en forma rápida. Estos datos permiten considerar que la generación esporofítica tiene una duración más larga con respecto a la gametofítica, y a otros mecanismos de reproducción como la propagación vegetativa o la apomeiosis (Ardito y Gómez, 2005).
Es importante resaltar que un alto porcentaje de las especies de Rhodophyta del Pacífico tropical de México han sido recolectadas en sustrato rocoso. Mateo-Cid y Mendoza-González (1991, 2002, 2012), Mendoza-González et al. (2011b) y Norris (2014) indican que este sustrato expuesto al oleaje es el lugar donde se localiza una gran diversidad de algas marinas. La textura, el grado de dureza y el color de las rocas influyen sobre las comunidades algales. Por ejemplo, Amphiroa beauvoisii J.V. Lamouroux, Jania pacifica Areschoug, Neogoniolithon trichotomum (Foslie) Setchell et Mason y Peyssonnelia orientalis (Weber-van Bosse) Cormaci et Furnari, crecen en las pozas intermareales de las plataformas rocosas; en el caso de Dermonema virens, Izziella orientalis, Ahnfeltiopsis gigartinoides y Ahnfeltia plicata, habitan en sustrato rocoso liso y muy expuesto al oleaje. La presencia de acantilados, plataformas rocosas, pozas intermareales, canales de corriente y agregados rocosos, combinado con características oceanográficas particulares, actúan en conjunto en el área de estudio y proveen las condiciones para el desarrollo de un elevado número de algas rojas (Mateo-Cid y Mendoza-González, 1992, 2012; Mendoza-González et al., 2011b, Sentíes et al., 1990).
Las localidades con mayor riqueza específica corresponden a La Mesa-El Zapote de Madero y Caletilla, en donde se ubicaron 73 y 63 taxones, respectivamente, esta riqueza puede ser explicada por el sustrato rocoso expuesto, plataformas rocosas con pozas intermareales y canales de corriente, este sustrato duro y estable permite la fijación y desarrollo de un mayor número de algas marinas bentónicas (Santelices, 1977). En este estudio, la mayoría de las especies de las familias Corallinaceae, Gracilariaceae, Halymeniaceae y Phyllophoraceae, se localizaron en zonas rocosas expuestas. Lo anterior ha sido documentado por Mateo-Cid y Mendoza-González (1992, 2002, 2012), Mendoza-González et al. (2011b), Sentíes y Dreckmann (2014) y Stout y Dreckmann (1993), quienes hallaron que las algas rojas que habitan en las costas mexicanas del Pacífico tropical de México se desarrollan principalmente sobre sustratos duros.
En el caso de San Telmo, La Ticla y Tres Palmas-Playa Rangel, se encontró una riqueza específica baja (3, 18 y 6 taxones, respectivamente), comparada con los otros sitios de muestreo, tal situación se atribuye a que estas 3 playas son principalmente arenosas y con formaciones rocosas expuestas a intenso oleaje. En Maruata, Carrizalillo y Las Peñas se ubicaron 32, 24 y 22 taxones, respectivamente, a pesar de que en las 3 localidades se encuentran formaciones rocosas, éstas se encuentran en mar abierto fuertemente expuestas al oleaje.
Las familias más diversas fueron: Rhodomelaceae con 18, Ceramiaceae con 13 y Halymeniaceae con 9. Sentíes et al. (1990) indican que la familia Rhodomelaceae (orden Ceramiales) es la más numerosa no solo dentro del orden, sino también de la división Rhodophyta, estos autores en 2014 registraron 16 especies de Rhodomelaceae para el litoral de Michoacán, mencionando que las especies de esta familia presentan una mayor afinidad por zonas tropicales, subtropicales y templadas, ocupando en su mayoría sustratos rocosos y algunas epífitas en ambientes intermareales y submareales.
El mayor número de epífitas se obtuvo en secas con 44, observándose la mayor cantidad de especies de las familias Rhodomelaceae y Ceramiaceae con 11 cada una, seguida de Acrochaetiaceae con 5, la mayoría de estas especies son filamentosas, de tallas pequeñas y anuales. La mayoría de las epífitas se encontraron creciendo frecuentemente sobre al gas como Gracilaria Greville, Laurencia J.V. Lamouroux, Palisada K. W. Nam, Padina Adanson y Sargassum C. Agardh. Se ha sugerido que la longevidad del hospedero debe ser lo suficientemente larga para permitir a estos organismos completar su ciclo vital y que ésta podría ser una razón de la ausencia de epífitas en las algas de periodos de vida cortos y efímeros (Santeli ces, 1977). Por lo que concierne a la época de lluvias, se ubicaron 22 especies, lo que puede atribuirse a que las poblaciones de algas marinas bentónicas se hallan en crecimiento y produciendo sustancias bioactivas, por lo que ofrecen menos superficie susceptible de ser colonizada (Mateo-Cid y Mendoza-González, 1991; Ortuño-Aguirre y Riosmena-Rodríguez, 2007).
Las Rhodophyta determinadas en este trabajo, han sido registradas en las zonas tropicales y templadas rocosas del mundo, incluidas la costa del Pacífico de América, el océano Índico, o bien en el Atlántico tropical de América (Norris, 2014, Wynne, 2017). Para describir la distribución geográfica de las algas marinas, Feldmann (1937) propuso el índice R/P (número de especies de Rhodophyta entre número de especies de Phaeophyceae), útil para conocer las áreas geográficas donde se distribuyen las algas y así clasificar la flora de una región determinada en función del gradiente latitudinal. De este modo, un valor de la relación R/P > 4 se encuentra en regiones tropicales, mientras que R/P < 2 corresponde con la ficoflora de regiones templado-frías. Cheney (1977) incluyó a las Chlorophyta (C) en un índice análogo al expuesto anteriormente (R+C)/P y evidenció que valores de la relación (R+C)/P ≥ 6 se obtienen en floras tropicales, en tanto que las de mares templados-fríos tienen índices < 3, valores intermedios sugieren una flora mixta.
Las Rhodophyta ubicadas en el área de estudio representan una flora mixta en la cual conviven elementos que tienen una predominante distribución tropical como: Hypnea pannosa J. Agardh, Grateloupia huertana Mateo-Cid, Mendoza-González et Gavio, Halymenia elongata C. Agardh, Jania capillacea Harvey, Lithophyllum stictaeforme (Areschoug) Hauck, Izziella orientalis (J. Agardh) Huisman et Schils, Gayliella fimbriata (E.Y. Dawson) T.O. Cho et S.M. Boo, Taenioma perpusillum (J. Agardh) J. Agardh y Chondria dasyphylla (Woodward) C. Agardh, entre otros (Mateo-Cid y Mendoza González, 2012, Mendoza-González, Mateo-Cid et al., 2011). Mientras que Ahnfeltiopsis gigartinoides (J. Agardh) P.C. Silva et DeCew, Besa leptophylla (J. Agardh) M.S. Calderón et A.K. Miller, Ahnfeltia plicata (Hudson) Fries, Halichrysis irregularis (Kützing) A.J.K. Millar y Cryptopleura crispa Kylin, entre otros, tienen distribución en mares templados (Abbott y Hollenberg, 1976; Norris, 2014). Esta situación ya había sido sugerida por Dreckmann et al. (1990) y Stout y Dreckmann (1993) en el sentido de que el litoral norte de Michoacán representa una zona de transición fitogeográfica en el gradiente ficoflorístico latitudinal entre las regiones tropical y templada del Pacífico; además de que existe una mayor similitud florística de las Rhodophyta de Michoacán con localidades de Oaxaca que con regiones cercanas como el litoral de Guerrero. Los resultados obtenidos en el presente estudio sustentan la hipótesis de Stout y Dreckmann (1993), en relación con que las algas bentónicas que habitan en el Pacífico tropical mexicano deben ser consideradas como un conjunto ficoflorístico en el que se sobreponen taxones tropicales y templados.
Los estudios previos en la costa de Michoacán y los resultados obtenidos en el presente trabajo indican la importancia de realizar actualizaciones de los listados ficoflorísticos con frecuencia en regiones del litoral mexicano poco estudiadas. Además, estos resultados son la base para futuros estudios ecológicos y de conservación, por lo que se recomienda continuar con los muestreos en las localidades visitadas para observar los cambios espaciales y temporales de la flora que permitan identificar posibles alteraciones en las condiciones ambientales del litoral michoacano como contaminación de ríos, lagunas y la eutrofización de las aguas marinas costeras.











 text new page (beta)
text new page (beta)