Introducción
El género Lasiurus Gray, 1831 agrupa a murciélagos insectívoros aéreos, fácilmente reconocidos por presentar gran cantidad de pelos largos sobre la superficie dorsal del uropatagio (Díaz et al., 2016). El género se distribuye principalmente en Norte y Sur América, ocupando una gran variedad de hábitats desde el nivel del mar hasta los 3,300 m de elevación (Graham, 1983). Actualmente, Lasiurus incluye al menos 19 especies, 8 de las cuales se distribuyen en Sudamérica (Baird et al., 2015, 2017; Gardner y Handley, 2008): L. atratusHandley, 1996, L. blossevillii (Lesson, 1826), L. castaneusHandley, 1960, L. villosissimus (Geoffroy St.-Hilaire, 1806), L. ebenusFazzolari-Correa, 1994, L. ega (Gervais, 1856), L. egregius (Peters, 1870) y L. variusPoeppig, 1835.
Tres especies del género Lasiurus habitan en Perú: L. blossevillii, murciélago rojizo, habitando en el bosque pluvial del Pacífico, bosque seco ecuatorial, desierto costero, Yungas y selva baja; L. villosissimus, murciélago escarchado, habitando la Puna, Yungas, selva baja y sabana de palmeras; L. ega, murciélago amarillento, habitando en el bosque pluvial del Pacífico y selva baja (Pacheco et al., 2009).
Si bien Lasiurus blossevillii es la única especie que habita en el desierto costero del Perú, recientes trabajos de campo realizados en la vertiente occidental del sur del país revelaron la presencia de una población de Lasiurus, cuyo único set de caracteres la reconocen como una especie nueva para la ciencia. Aquí describimos dicha nueva especie en base a evidencia molecular y morfológica, enfocado en aclarar sus relaciones con otras especies del género.
Materiales y métodos
Se examinaron especímenes depositados en las siguientes instituciones: Colección Científica del Museo de Historia Natural de la Universidad Nacional de San Agustín, Arequipa, Perú (MUSA); Colección de Mamíferos de la Universidad de Costa Rica, San José, Costa Rica (UCR); Royal Ontario Museum, Toronto, Canadá (ROM).
Se realizó la extracción de ADN a partir de tejido proveniente de hígado preservado en alcohol al 90%. La extracción y purificación de las muestras se realizó siguiendo las instrucciones del kit de extracción de ADN de tejido IBI Scientific (cat# IB47281). Se amplificó el gen Citocromo B por reacción en cadena de la polimerasa (PCR) (Saiki et al., 1988), la cual fue llevada a cabo en reacciones de 25 µL que contenían de 40 - 60 ng de ADN, Buffer 5X, dNTPs, MgCl2, Taq DNA polimerasa. Los cebadores usados para la amplificación fueron LGL 765 (5'-GAAAAACCAYCGTTGTWATTCAACT- 3') (Bickham et al., 1995) y LGL 766 (5'-GTTTAATTAGAATYTYAGCTTTGGG- 3') (Bickham et al., 2004). La reacción comenzó con desnaturalización a 94 °C por 2 minutos, seguido de 35 ciclos de desnaturalización a 94 °C por 45 segundos, alineamiento a 49 °C por 1 minuto y extensión a 72 °C por 1 minuto 15 segundos, además de una extensión final a 72 °C por 10 minutos (Larsen et al., 2007). Los productos finales de PCR fueron verificados en un gel de agarosa al 1% y posteriormente secuenciados en un analizador automático de ADN ABI 3730x1 (Macrogen, USA Inc.) utilizando los cebadores antes mencionados. La secuencia producida en este estudio fue depositada en Genbank con el número de Acceso MN523651.
Se reunieron 32 secuencias pertenecientes a 16 especies del género Lasiurus y 2 secuencias como grupo externo (Tadarida brasiliensis y Myotis velifer) (tabla 1). Las secuencias fueron alineadas usando el algoritmo Muscle (Edgar, 2004), implementado en Mesquite 3.2 (Maddison, 2017). La búsqueda y selección del mejor modelo de sustitución nucleotídica se basó en el Criterio de Información de Akaike (AIC), implementado en JModel Test 2.1.4 (Akaike, 1974; Posada y Crandall, 1998).
Tabla 1 Listado de muestras utilizadas para reconstrucciones filogenéticas.
| Taxón | Tejido voucher | Localidad | Número Genbank |
| Tadarida brasiliensis | UF31730 | Bahamas | MF135779 |
| Myotis velifer | MF21044 | EUA | EU680209 |
| Lasiurus atratus | F54400 | Guyana | KP341704 |
| Lasiurus blossevillii | AK13464 | Argentina | KP341705 |
| Lasiurus blossevillii | F44348 | Brasil | KP341706 |
| Lasiurus blossevillii | F44354 | Brasil | KP341707 |
| Lasiurus blossevillii | NK21290 | Bolivia | KC747683 |
| Lasiurus borealis | AK21072 | Kansas | KP341709 |
| Lasiurus borealis | AK21073 | Kansas | KP341710 |
| Lasiurus cinereus | AK11006 | Querétaro | KP341711 |
| Lasiurus cinereus | AK11013 | Querétaro | KP341712 |
| Lasiurus cinereus | AK11014 | Querétaro | KP341713 |
| Lasiurus cinereus | ASK 1079 | Texas | KP341717 |
| Lasiurus cinereus | ASK 3520 | Texas | KP341718 |
| Lasiurus cinereus | NK 3627 | Nvo. México | KP341733 |
| Lasiurus frantzi | AK11179 | Tamaulipas | KP341754 |
| Lasiurus frantzi | F34142 | Guatemala | KP341755 |
| Lasiurus ega | AK7693 | Belice | KP341741 |
| Lasiurus ega | NK12302 | Bolivia | KP341742 |
| Lasiurus ega | NK15304 | Bolivia | KP341743 |
| Lasiurus ega | SP12622 | Guatemala | KP341744 |
| Lasiurus egregius | F54554 | Guyana | KP341745 |
| Lasiurus egregius | F54845 | Surinam | KP341746 |
| Lasiurus insularis | TK32049 | Cuba | KP341747 |
| Lasiurus intermedius | ASK422 | Guatemala | KP341748 |
| Lasiurus pfeifferi | TK32016 | Cuba | KP341749 |
| Lasiurus pfeifferi | TK32029 | Cuba | KP341750 |
| Lasiurus seminolus | AK1565 | Texas | KP341751 |
| Lasiurus seminolus | AK21348 | Texas | KP341752 |
| Lasiurus semotus | BPBM185245 | Hawaii | KP341722 |
| Lasiurus varius | AK16070 | Argentina | KP341756 |
| Lasiurus vellosissimus | NK11502 | Bolivia | KP341727 |
| Lasiurus xanthinus | NK11103 | Nvo. México | KP341757 |
| Lasiurus sp. nov. | MUSA21058 | Perú | MN523651 |
Análisis de distancia genética como divergencia nucleotídica intra e inter-especifica fue estimada con el software Mega 6.06 (Tamura et al., 2013) a través del modelo Kimura 2 - parámetros (Kimura, 1980). La búsqueda de Máxima Verosimilitud (ML) fue llevada a cabo en RAxML (Stamatakis, 2006, 2014) a través del portal CIPRES (Miller et al., 2010), implementado usando el modelo general de tiempo reversible con variaciones en las tasas gammas y sitios invariantes (GTR+G+I). Los valores de soporte para los nodos del árbol fueron evaluados con 1,000 réplicas de “bootstrap”.
Análisis de inferencia bayesiana (IB) se realizaron en Mr. Bayes 3.2.6 (Ronquist y Huelsenbeck, 2003) mediante el portal CIPRES (Miller et al., 2010). El análisis fue implementado usando el modelo General de Tiempo Reversible incorporando distribución gamma y sitios invariantes (GTR+G+I). Cuatro cadenas fueron corridas simultáneamente, 10 millones de generaciones fueron corridas a partir de un árbol al azar, además los árboles y parámetros fueron muestreados cada 1,000 generaciones. El 10% de las generaciones iniciales fueron descartadas como parte del “burn-in” y las generaciones restantes fueron utilizadas para estimar las probabilidades a posteriori de cada nodo. La convergencia de este análisis fue evaluada en Tracer 1.6.0 (Rambaut y Drummond, 2013), considerando un tamaño de muestra efectivo (ESS) superior a 500 para todos los parámetros. Los árboles resultantes de los análisis de IB se compilaron en un árbol consenso por mayoría, los cuales fueron visualizados mediante el programa Figtree 1.4.3 (Rambaut et al., 2016).
Las medidas externas fueron recopiladas de las etiquetas de campo (tabla 3), mientras que las medidas craneales fueron tomadas con un calibrador de 0.1 mm de precisión, siguiendo a las definiciones de Barquez et al. (1999).
Los análisis de componentes principales (ACP) fueron llevados a cabo usando una matriz de varianza-covarianza en base a medidas externas y craneales de la nueva especie y especies emparentadas filogenéticamente, las cuales fueron obtenidas de los especímenes examinados y de la literatura (Barquez et al., 1999; Fazzorali-Correa, 1994; Handley, 1960, 1996). Todas las medidas fueron normalizadas usando la transformación logarítmica. Los primeros 3 componentes fueron obtenidos y los pesos de todas las variables fueron evaluados como una medida de importancia en esta separación preliminar. Las diferencias estadísticas entre grupos fueron evaluadas usando análisis de función discriminante (AFD) (Brown y Wicker, 2000) y validación cruzada fue evaluada usando la opción “leave out” en el programa PAST. Los análisis fueron llevado a cabo el software PAST 3.0 para Windows (Hammer, 2013).
Se realizó la comparación de caracteres morfológicos externos y craneales, con apoyo de especímenes depositados en el MUSA, UCR y ROM; descripciones originales de especies del género Lasiurus (Fazzorali-Correa, 1994; Handley, 1960, 1996; Lesson, 1826; Poeppig, 1835) y registros actuales (Villalobos-Chaves y Dick, 2014). La nomenclatura a la morfología craneal sigue a Giannini et al. (2006) y Giannini y Simmons (2007).
Descripción
Orden Chiroptera Blumenbach, 1779
Familia Vespertilionidae Gray, 1821 Género Lasiurus Gray, 1831
Lasiurus arequipae sp. nov. Málaga, Díaz, Arias y Medina Murciélago acanelado de Arequipa http://zoobank.org/urn:lsid:zoobank.org:act:802A8349-47BB-495C-9140-95F1D50584F2
Diagnosis. Lasiurus arequipae sp. nov. se distingue de las otras especies del género Lasiurus por la siguiente combinación de caracteres: antebrazo de tamaño intermedio (46.4-47.6 mm); pelaje denso de coloración dorsal canela o anaranjado, mezclado con marrón oscuro (jaspeado) (fig. 1); membrana alar negruzca, moteada de rojo a ambos lados de los antebrazos y metacarpos (fig. 2); borde anterior de los huesos nasales en forma de “V”; órbitas oculares de forma ovalada en vista dorsal; proceso medial del paladar poco desarrollado; fosa mesopterigoidea en forma de “V”; anillo timpánico de forma circular.

Figura 1 Individuo de Lasiurus arequipae sp. nov. (MUSA 21891) colectado en Huatiapa, Castilla, Arequipa.

Figura 2 Izquierda: vista dorsal del cuerpo y membrana alar de Lasiurus arequipae sp. nov. (MUSA 21891) mostrando patrones de coloración. Derecha: vista dorsal, ventral y lateral del cráneo y vista lateral de la mandíbula del holotipo (MUSA 21058). Barra de escala = 5 mm).
Descripción. Lasiurus arequipae sp. nov. presenta un pelaje denso, cuya coloración dorsal es canela o anaranjado, con pelos tricoloreados (banda basal negra, banda media amarillenta, y banda terminal, canela o marrón oscuro); mientras que la coloración ventral es amarillenta, con pelos bicoloreados (base negra y puntas amarillentas). Hocico romo, rostro de color moreno, fosas nasales bien separadas, sin hoja nasal. Orejas gruesas, cortas y anchas, redondeadas, sobresalen a penas de la coronilla. Hombros con parche de pelos blanquecinos o cremosos amarillentos. Membrana alar negruzca, moteada de naranja pálido a ambos lados de los antebrazos y metacarpos. Cola larga incluida dentro del uropatagio, el cual está cubierto dorsalmente de pelos en su totalidad sin sobrepasar su borde. Cráneo con perfil del rostro recto; interparietal ligeramente proyectado posteriormente, con una terminación globular; borde anterior de los huesos nasales en forma de “V”; cresta lacrimal bien desarrollada; órbitas oculares ovaladas en vista dorsal; crestas supraorbitales fusionadas al nivel de la constricción postorbital; ancho del paladar (M-M) intermedio (6.5-6.8 mm); borde posterior lateral del paladar sin muesca; proceso medial del paladar poco desarrollado; fosa mesopterigoidea en forma de “V”; fisura esfenorbital bien desarrollada; anillo timpánico de forma circular; procesos mastoideos rectos; procesos paraoccipitales poco desarrollados.
Resumen taxonómico
Holotipo: macho adulto, preservado en líquido con cráneo removido y tejido preservado en alcohol etílico 96°, depositado en la Colección Científica del Museo de Historia Natural de la Universidad Nacional de San Agustín (Número de catálogo: MUSA 21058), colectado el 20 agosto 2017 por Brian A. Málaga con el número de recolecta original BMT-027.
Localidad tipo: Huatiapa; 11.5 km al norte de Aplao, provincia de Castilla, departamento de Arequipa, Perú (15°58’39.6” S, 72°27’52.9” O), altitud 726 m.
Paratipos: 2 especímenes, 1 macho adulto (MUSA 21853), preservado en líquido con cráneo removido y tejido preservado en alcohol etílico 96°, colectado el 7 noviembre 2018 (BMT-70) en la localidad de Chaucalla, distrito de Ocoña, provincia de la Unión, departamento de Arequipa, Perú (15°36’11.99” S, 73°4’58.62” O), altitud 860 m; 1 hembra adulta (MUSA 21891), preservada en líquido con cráneo removido y tejido preservado en alcohol etílico 96°, colectada el 10 de enero 2019 por Darwin R. Díaz (DDV-2600) en la localidad tipo.
Distribución: Lasiurus arequipae sp. nov. es conocido de 2 localidades ubicadas al suroeste del Perú, vertiente occidental de los Andes (fig. 3). Adicionalmente, se sospecha de una tercera localidad, basada en fotografías de un ejemplar de Lasiurus capturado y liberado en las cataratas de Sogay, distrito de Yarabamba, departamento de Arequipa (16°34’14.65” S, 71°24’45.66” O), altitud 2,760 m. Dicho individuo presentó caracteres morfológicos y medidas externas similares a las del holotipo (coloración anaranjada y AB ≈ 48 mm).
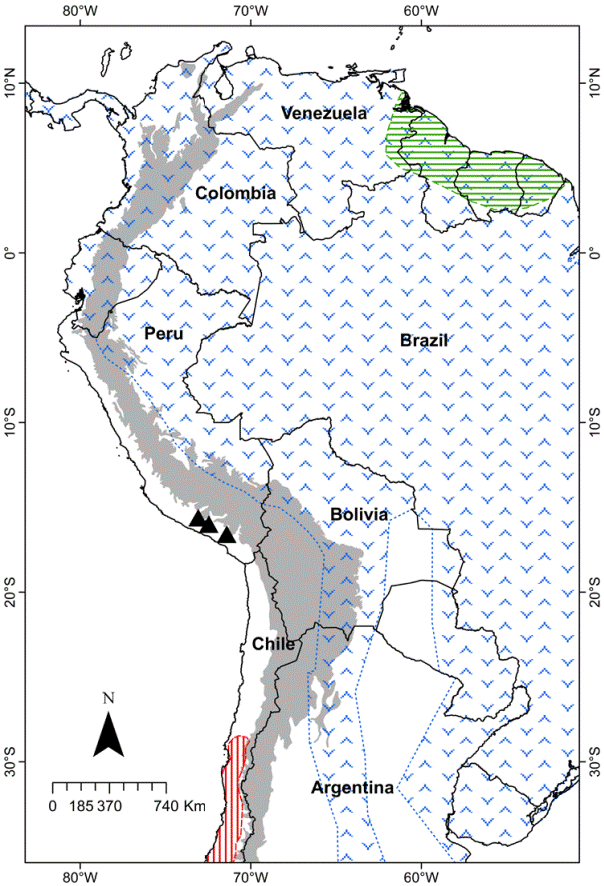
Figura 3 Mapa de Sudamérica mostrando la distribución de formas rojizas del género Lasiurus: L. arequipae sp. nov. (triángulos negros), L. atratus (líneas verdes), L. blossevillii (símbolos azules) y L. varius (líneas rojas). Área en gris corresponde a elevaciones por encima de los 2,000 m.
Historia natural: Lasiurus arequipae sp. nov. habita en valles costeros encañonados, con pendientes > 60°, del sur de Perú (fig. 4), los cuales se caracterizan por tener un clima caluroso, cuyas temperaturas medias anuales oscilan entre 15 y 24 °C, con precipitaciones escasas e irregulares (Kosaka et al., 2001). La principal actividad económica es la agricultura, con predominio de monocultivos de arroz, maíz, papa, alfalfa, entre otros. La vegetación nativa está restringida al borde de los ríos, donde es posible encontrar algunos ejemplares de Prosopis pallida Kunth, y un predominio de especies arbustivas como Tessaria integrifolia Ruíz et Pav., Salix humboldtiana Willd., Baccharis salicifolia (Ruíz et Pav.) Pers. La vegetación acuática está dominada por Nasturtium aquaticum Wahlenb. y Veronica anagallis-aquatica Linneo.

Figura 4 Hábitat que ocupa Lasiurus arequipae sp. nov. (MUSA 21058 y MUSA 21891). Nótese los cuerpos de agua lenta que discurren al costado del cauce principal del río.
Etimología: el epíteto específico “arequipae” es dado en honor a la Ciudad Blanca de Arequipa, ubicada en el suroeste del Perú, cuyo centro histórico fuese reconocido como Patrimonio Cultural de la Humanidad por la Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura (UNESCO) en noviembre de 2000. Cabe resaltar que en el departamento de Arequipa se encuentran los cañones más profundos del mundo, cañones de Cotahuasi y del Colca, los cuales delimitan los rangos de distribución de varias especies de flora y fauna en la vertiente occidental de los Andes (Pearson, 1982).
Comentarios taxonómicos
Los análisis de máxima verosilimitud y bayesiano recuperaron topologías similares con elevados valores de soporte en sus nodos (fig. 5), ubicando a Lasiurus arequipae sp. nov. dentro de las especies rojizas del género Lasiurus (Baird et al., 2015, 2017). La nueva especie se ubica como grupo hermano de L. atratus, con valores de soporte elevados (boostrap = 80 y probabilidad a posteriori = 1.00), los cuales, a su vez, forman un grupo hermano con el resto de especies rojizas del género Lasiurus. Curiosamente, L. atratus habita en los bosques lluviosos de tierras bajas del norte de Sudamérica (Gardner y Handley, 2008), a una distancia de 2,700 km al noreste de la localidad tipo de L. arequipae.

Figura 5 Relaciones filogenéticas del género Lasiurus basado en secuencias de citocromo b. Los números indican los valores de soporte de bootstrap (arriba) y probabilidad a posteriori (abajo).
La distancia promedio de pares de bases del Citocromo b entre las especies de Lasiurus incluidas en el presente estudio tuvo un rango de 1.2% (L. seminolus - L. pfeifferi) a 30.2% ( L. frantzii - L. egregius) (tabla 2); mientras que la distancia promedio entre L. arequipae y otras especies de Lasiurus fue de 9.4%, con L. frantzii, hasta 25.6% con L. egregius, valores muy por encima de aquellos típicamente utilizados para separar otras especies de mamíferos (Medina et al., 2014; Zeballos et al., 2018).
Tabla 2 Distancias promedio del parámetro Kimura 2 (en porcentajes) entre especies de Lasiurus, basado en 1,140 pares de bases del citocromo b. La divergencia intraespecífica está denotada en la diagonal. Los taxones del grupo externo no fueron incluidos.
| Especies | n | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | |
| 1 | Lasiurus atratus | 1 | - | |||||||||||||||
| 2 | L. blossevillii | 4 | 14.3 | - | ||||||||||||||
| 3 | L. borealis | 2 | 8.3 | 18.0 | - | |||||||||||||
| 4 | L. cinereus | 8 | 12.3 | 22.3 | 19.8 | - | ||||||||||||
| 5 | L. semotus | 1 | 10.7 | 21.6 | 18.2 | 1.4 | - | |||||||||||
| 6 | L. villosissimus | 1 | 11.9 | 22.6 | 18.4 | 12.2 | 10.6 | - | ||||||||||
| 7 | L. ega | 4 | 19.2 | 22.6 | 15.0 | 18.0 | 17.5 | 23.3 | - | |||||||||
| 8 | L. egregius | 2 | 17.7 | 27.9 | 21.0 | 14.6 | 16.6 | 18.8 | 19.9 | - | ||||||||
| 9 | L. insularis | 1 | 18.0 | 17.5 | 16.1 | 19.1 | 17.4 | 19.8 | 11.5 | 23.5 | - | |||||||
| 10 | L. intermedius | 1 | 24.3 | 21.7 | 20.3 | 23.6 | 21.8 | 26.0 | 10.1 | 22.4 | 8.9 | - | ||||||
| 11 | L. pfeifferi | 2 | 9.9 | 11.0 | 7.1 | 21.7 | 20.2 | 24.6 | 16.2 | 23.7 | 16.2 | 18.5 | - | |||||
| 12 | L. seminolus | 2 | 11.3 | 12.4 | 8.5 | 23.3 | 21.8 | 26.1 | 17.8 | 25.2 | 17.7 | 20.1 | 1.2 | - | ||||
| 13 | L. frantzii | 2 | 10.6 | 11.3 | 9.9 | 26.2 | 24.6 | 20.6 | 19.0 | 30.2 | 14.9 | 21.7 | 9.0 | 10.4 | - | |||
| 14 | L. varius | 1 | 11.5 | 11.7 | 15.1 | 15.8 | 14.1 | 12.0 | 26.1 | 26.9 | 18.7 | 24.9 | 13.5 | 11.8 | 11.1 | - | ||
| 15 | L. xanthinus | 1 | 15.7 | 21.4 | 12.6 | 18.5 | 16.8 | 25.5 | 10.9 | 23.8 | 16.6 | 13.3 | 14.5 | 12.6 | 18.9 | 16.4 | - | |
| 16 | L. sp. nov. | 1 | 13.6 | 16.5 | 14.0 | 22.5 | 20.8 | 21.8 | 13.4 | 25.6 | 10.9 | 13.0 | 11.8 | 13.3 | 9.4 | 14.1 | 16.2 | - |
Lasiurus arequipae sp. nov. es un miembro de tamaño intermedio del género Lasiurus, siendo de tamaño similar a L. castaneus y L. atratus, pero notoriamente más grande que L. blosevillii y L. varius (tabla 3).
Tabla 3 Comparación de medidas (mm) del holotipo de Lasiurus arequipae sp. nov. y otras especies del género Lasiurus del neotrópico. Los números incluyen la media ± SD, rangos en paréntesis y tamaño de la muestra.
| Medidas | Lasiurus arequipae | L. atratus 1 | L. castaneus 2 | L. varius 3 | L. blossevillii 3,4 | ||
| Holotipo(MUSA 21058) ♂ | Paratipo (MUSA 21853) ♂ | Paratipo (MUSA 21891) ♀ | |||||
| Longitud total | 120 | 106 | 123 | 114 ± 2.83 | 104.94 ± 4.71 | 108.6 ± 4.87 | 100.6 ± 5.65 |
| (112-116) 2 | (102.5-112) 4 | (105.0-118.0) 7 | (92.0-112.0) 10 | ||||
| Longitud de la cola | 60 | 56 | 64 | 55 ± 2.83 | 48.38 ± 1.25 | 52.1 ± 4.67 | 47.9 ± 2.77 |
| (53-57) 2 | (47-50) 4 | (44.0-58.0) 7 | (44.5-52.0) 10 | ||||
| Longitud de pata posterior | 10.3 | 8.6 | 11 | 10.57 ± 0.53 | 8.62 ± 1.79 | 7.3 ± 1.44 | 8.0 ± 0.75 |
| (10-11) 7 | (7-11) 4 | (6.0-10.0) 7 | (7.0-9.0) 8 | ||||
| Longitud de la oreja | 12.9 | 11 | 13 | 13 ± 0.0 | 11.98 ± 1.36 | 11.8 ± 1.84 | 10.3 ± 1.16 |
| (13-13) 2 | (11-14) 4 | (9.0-13.9) 7 | (8.0-11.6) 10 | ||||
| Longitud del antebrazo | 46.4 | 46.7 | 47.6 | 46.34 ± 0.82 | 44.95 ± 0.82 | 40.6 ± 0.88 | 39.3 ± 1.22 |
| (45.1-47.6) 7 | (44-46) 4 | (39.9-42.1) 7 | (37.7-41.3) 12 | ||||
| Peso (gr) | 13 | 12 | 12 | - | 11.52 ± 0.47 | 10.2 ± 1.06 | 8.2 ± 1.36 |
| (11.06-12) 3 | (9.5-11.0) 2 | (6.0-10.0) 6 | |||||
| Máxima longitud del | 14.2 | 13.7 | 14.3 | 12.84 ± 0.25 | 13.05 ± 0.24 | 13.0 ± 0.21 | 11.8 ± 0.38 |
| cráneo | (12.5-13.2) 7 | (12.9-13.4) 4 | (12.8-13.4) 7 | (11.3-12.5) 10 | |||
| Longitud condilobasal | 14.1 | 14.0 | 14.5 | - | 13.08 ± 0.31 | 12.6 ± 0.24 | 11.1 ± 0.47 |
| (12.87-13.44) 3 | (12.2-12.9) 7 | (10.3-11.8) 10 | |||||
| Ancho cigomatico | 10.8 | 10.2 | 10.8 | 9.76 ± 0.33 | 10 ± 0.35 | 9.7 ± 0.10 | 8.7 ± 0.38 |
| (9.3-10.2) 7 | (9.7-10.5) 4 | (9.6-9.8) 7 | (8.3-9.4) 7 | ||||
| Ancho interorbital | 6.4 | 6.1 | 6.4 | - | 6.14 ± 0.05 | 6.0 ± 0.08 | 5.3 ± 0.18 |
| (6.09-6.19) 3 | (5.9-6.1) 7 | (4.9-5.5) 11 | |||||
| Constricción postorbital | 5.0 | 4.9 | 4.9 | 4.28 ± 0.25 | 4.42 ± 0.17 | 4.5 ± 0.13 | 4.2 ± 0.14 |
| (4.1-4.8) 7 | (4.2-4.6) 4 | (4.3-4.7) 7 | (4.1-4.5) 11 | ||||
| Ancho mastoideo | 8.9 | 8.6 | 8.9 | - | 8.46 ± 0.21 | 7.8 ± 0.39 | 7.4 ± 0.22 |
| (8.24-8.66) 3 | (7.0-8.2) 7 | (7.1-7.9) 10 | |||||
| Ancho de caja cranial | 8.1 | 7.9 | 8.0 | 7.76 ± 0.11 | 7.83 ± 0.15 | 7.7 ± 0.19 | 7.3 ± 0.38 |
| (7.6-7.9) 7 | (7.6-7.9) 4 | (7.5-8.0) 7 | (6.6-7.8) 11 | ||||
| Longitud de hilera maxilar | 5.0 | 4.9 | 5.2 | 5.4 ± 0.22 | 4.7 ± 0.08 | 4.6 ± 0.07 | 3.9 ± 0.14 |
| de dientes | (5.0-5.7) 7 | (4.6-4.8) 4 | (4.5-4.7) 7 | (3.6-4.1) 11 | |||
| Longitud palatal | 5.2 | 4.7 | 5.3 | - | 4.82 ± 0.09 | 5.5 ± 0.20 | 4.8 ± 0.26 |
| (4.71-4.89) 3 | (5.3-5.9) 6 | (4.4-5.0) 7 | |||||
| Longitud de hilera | 5.8 | 5.8 | 6.1 | - | 5.48 ± 0.05 | 5.3 ± 0.05 | 4.6 ± 0.10 |
| mandibular de dientes | (5.44-5.54) 3 | (5.3-5.4) 7 | (4.5-4.8) 10 | ||||
| Longitud de la mandíbula | 10.8 | 10.4 | 11.1 | - | 10.29 ± 0.19 | 9.8 ± 0.09 | 8.7 ± 0.29 |
| (10.16-10.52) 3 | (9.7-10.0) 7 | (8.4-9.4) 9 | |||||
| C-C (ancho entre caninos) | 5.4 | 5.4 | 5.8 | 5.4 ± 0.22 | 5.66 ± 0.04 | 5.2 ± 0.16 | 4.4 ± 0.18 |
| (5.0-5.7) 7 | (5.62-5.7) 4 | (5.0-5.4) 7 | (4.1-4.7) 10 | ||||
| M-M (ancho entre molares) | 6.5 | 6.6 | 6.8 | 6.56 ± 0.26 | 6.73 ± 0.05 | 6.3 ± 0.13 | 5.3 ± 0.28 |
| (6.1-6.8) 7 | (6.7-6.8) 4 | (6.1-6.5) 7 | (4.9-5.7) 11 | ||||
1. Handley (1996), ROM; 2. Handley (1960), UCR; 3. Barquez et al. (1999); 4. Fazzorali-Correa (1994).
Los 3 primeros componentes del ACP recuperaron el 94.23% de la variación total, observándose una separación espacial de L. arequipae del resto de especies rojizas analizadas (fig. 6). El componente principal 1 (CP1) recuperó el mayor porcentaje de variación (81.61%) y sus vectores mostraron valores positivos, siendo la longitud hilera maxilar de dientes, el ancho entre molares (M-M) y la longitud del antebrazo los caracteres que presentaron los mayores valores (tabla 4). El AFD mostró que 76.20% y 17.62% de la variación es explicado por el primer y segundo eje canónico (tabla 4). La matriz de factores discriminantes indica que la longitud de la hilera maxilar de dientes, la longitud del antebrazo y el ancho entre molares (M-M), tienen una alta correlación positiva con el axis de la primera función discriminante; mientras que la longitud del antebrazo y la constricción postorbital tienen una alta correlación positiva con el axis de la segunda función discriminante. El AFD muestra una correcta asignación de los individuos a los grupos previamente definidos, sin embargo, utilizando la prueba de jackknifed solo 85.37% de los casos estarían correctamente asignados.

Figura 6 Gráficos resultado del ACP (izquierda) y AFD (derecha) de Lasiurus (n = 43) extraído desde 7 medidas. Lasiurus arequipae sp. nov. (estrellas), L. atratus (cuadrados), L. castaneus (círculos), L. varius (triángulos) y L. blossevillii (rombos).
Tabla 4 Factores extraídos del ACP y AFD de 5 especies de Lasiurus (Lasiurus arequipae sp. nov., L. atratus, L. castaneus, L. varius y L. blossevillii), con base en una matriz de varianza-covarianza.
| Componentes principales | Función discriminante | |||||
| Caracteres | PC1 | PC2 | PC3 | Axis 1 | Axis 2 | Axis 3 |
| Longitud del antebrazo | 0.4161 | -0.2615 | -0.6054 | 0.0096 | 0.0039 | 0.0038 |
| Ancho cigomático | 0.3754 | 0.0572 | 0.1057 | 0.0076 | -0.0052 | 0.0009 |
| Máxima longitud del cráneo | 0.3749 | 0.4896 | -0.3016 | 0.0078 | -0.0051 | -0.0014 |
| Constricción postorbital | 0.1188 | 0.6790 | 0.3549 | 0.0018 | -0.0066 | 0.0075 |
| Ancho de caja cranial | 0.2174 | 0.2165 | 0.0354 | 0.0043 | -0.0021 | -0.0017 |
| Longitud hilera maxilar de dientes | 0.5343 | -0.0697 | -0.0145 | 0.0111 | -0.0042 | -0.0036 |
| M-M (ancho entre molares) | 0.4455 | -0.4192 | 0.6355 | 0.0089 | -0.0024 | -0.0047 |
| Eigenvalue | 0.0067 | 0.0006 | 0.0005 | 15.216 | 3.518 | 1.067 |
| Varianza explicada (%) | 81.61 | 6.77 | 5.85 | 76.20 | 17.62 | 5.34 |
Lasiurus arequipae sp. nov. se distingue fácilmente de L atratus, L. castaneus y L. blossevillii por su colocación canela a anaranjado, versus color rojizo a marrón oscuro; borde anterior de los huesos nasales en forma de “V”, versus forma de U y anillo timpánico circular, versus anillo ovalado (fig. 7). Así mismo, L. arequipae presenta una coloración dorsal similar a L. varius (canela o anaranjado), pero fácilmente diferenciable por su membrana alar negruzca, moteada de naranja pálido a ambos lados de los antebrazos y metacarpos, versus membrana alar completamente negruzca (tabla 5).
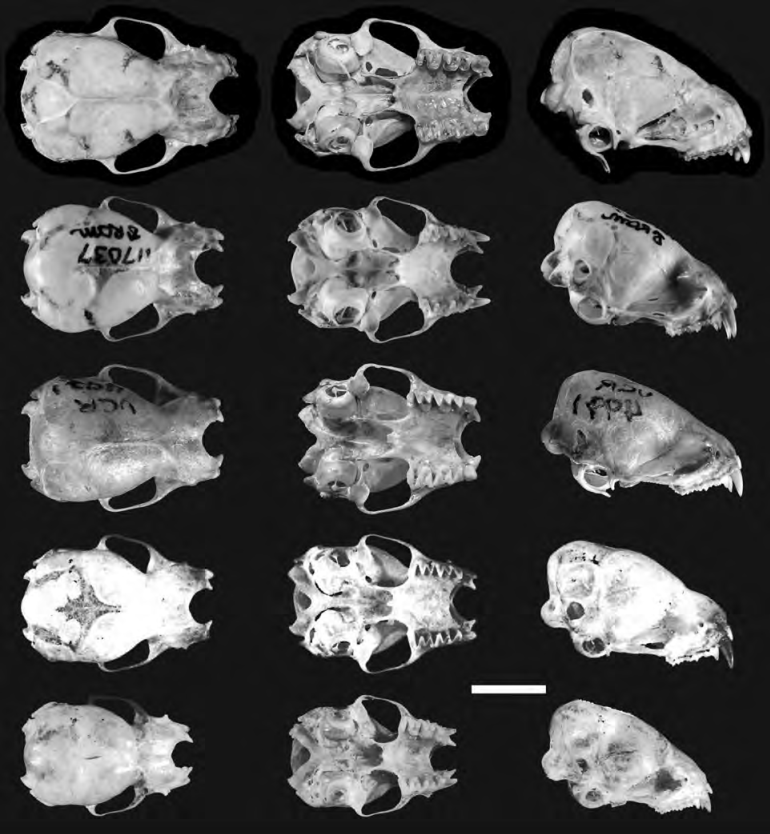
Figura 7 De arriba hacia abajo: vistas dorsal, ventral y lateral del cráneo de Lasiurus arequipae sp. nov. (MUSA 21058), L. atratus (ROM 117037), L. castaneus (UCR 4971), L. varius (CML 2005) y L. blossevillii (OMNH 18668). Barra de escala = 5 mm.
Tabla 5 Comparación de la morfología de Lasiurus arequipae sp. nov. con otras especies rojizas del género Lasiurus presentes en el neotrópico.
| Caracteres | Lasiurus arequipae | L. atratus | L. castaneus | L. varius | L. blossevillii |
| Coloración dorsal general | Canela, mezclado con marrón oscuro (jaspeado) | Rojizo | Marrón oscuro (castaño) | Canela | Rojizo, mezclado con pelos de punta blanca o gris (escarchado) |
| Bandas de color en pelos dorsales (desde la base hacia la punta) | Tres bandas: negro, amarillento, canela o marrón oscuro | Tres bandas: negro, amarillento, rojizo | Una banda: marrón oscuro | Tres bandas: negro, amarillento, rojizo | Tres bandas: negro, amarillento, blanco o gris |
| Bandas de color en pelos ventrales (desde la base hacia la punta) | Dos bandas: marrón oscuro, amarillento | Dos bandas: negro, blanco | Una banda: marrón oscuro, con amarillo cremoso | Dos bandas: negro, rojizo | - |
| Coloración del rostro | Moreno | Moreno | Negruzco | Negruzco | Moreno |
| Membrana alar | Negruzca, moteada de naranja pálido a ambos lados de los antebrazos y metacarpos | Negruzca en su totalidad | Negruzca en su totalidad | Negruzca en su totalidad | Negruzca, moteada de naranja pálido a ambos lados de los antebrazos y metacarpos |
| Parche de pelos sobre los hombros | Presente (color amarillento o blanco) | Presente (color blanco) | Presente (color amarillento o blanco) | Presente (color amarillento) | Ausente |
| Pelos sobre el uropatagio | Cubren la totalidad del uropatagio, sin sobrepasar su borde | Cubren la totalidad del uropatagio, sin sobrepasar su borde | Cubren los 2/3 proximales | Cubren la totalidad del uropatagio, sobrepasando su borde | Cubren los 2/3 proximales |
| Tamaño del Antebrazo | Intermedio (46.4-47.6 mm) | Intermedio (45.1-47.6 mm) | Intermedio (44-45 mm) | Pequeño (39.9-42.1 mm) | Pequeño (37.7-41.3 mm) |
| Perfil de rostro | Recto | Recto | Recto | Ligeramente cóncavo | Recto |
| Interparietal | Ligeramente proyectado posteriormente, con una terminación globular | Ligeramente proyectado posteriormente, con una terminación globular | No proyectado posteriormente | Notoriamente proyectado posteriormente, con una terminación globular | Ligeramente proyectado posteriormente, con una terminación globular |
| Borde anterior de los huesos nasales | Forma de “V” | Forma de “U” | Forma de “U” | Forma de “U” | Forma de “U” |
| Cresta lacrimal | Bien desarrollada | Bien desarrollada | Poco desarrollada | Poco desarrollada | Bien desarrollado |
| Forma de las órbitas oculares en vista dorsal | Ovaladas | Rectangulares | Rectangulares | Rectangulares | Rectangulares |
| Crestas supra-orbitales | Fusionadas al nivel de la constricción postorbital | Fusionadas por detrás de la constricción postorbital | Fusionadas al nivel de la constricción postorbital | Fusionadas por detrás de la constricción postorbital | Fusionadas por detrás de la constricción postorbital |
| Ancho del paladar (M-M) | Intermedio (6.5-6.8 mm) | Intermedio (6.1-6.8 mm) | Intermedio (6.7-6.8 mm) | Intermedio (6.1-6.5 mm) | Pequeño (4.9-5.7 mm) |
| Borde posterior lateral del paladar | Sin muesca | Sin muesca | Con muesca | Con muesca | Con muesca |
| Proceso medial del paladar | Poco desarrollado | Bien desarrollado | Bien desarrollado | Bien desarrollado | Poco desarrollado |
| Fosa mesopterigoidea | Forma de “V” | Forma de “V” | Forma de “U” | Forma de “U” | Forma de “U” |
| Fisura esfenorbital | Bien desarrollada | Poco desarrollada | Bien desarrollada | Bien desarrollada | Poco desarrollada |
| Anillo timpánico | Circular | Ovalado | Ovalado | Ovalado | Ovalado |
| Procesos mastoideos | Rectos | Rectos | Curvados hacia adelante | Rectos | Rectos |
| Procesos paraoccipitales | Poco desarrollados | Poco desarrollados | Bien desarrollados | Poco desarrollados | Poco desarrollados |
Por consiguiente, la combinación de datos moleculares, morfométricos y morfológicos respaldan el reconocimiento de Lasiurus arequipae sp. nov. como una especie nueva para la ciencia.
Lasiurus arequipae sp. nov. puede ser fácilmente diferenciable de otras especies del género Lasiurus de Sudamérica, utilizando la siguiente clave dicotómica (modificada de Díaz et al., 2016):
1 Coloración uniforme, amarillenta o rojiza; generalmente un premolar superior en cada lado . . . . . . . . . 2
1 Coloración mezclada con pelos negros o grises, rojizos y amarillentos o marrones; al menos, 2 premolares superiores en un lado, el anterior muy pequeño y con desplazamiento medial . . . . . . . . . . . . . . . . . . . . . 3
La coloración dorsal y ventral es olivácea amarillenta; uropatagio cubierto con pelos hasta la mitad en la parte dorsal…………………………………………………………….. Lasiurus ega
2´ La coloración dorsal y ventral es rojiza; uropatagio cubierto con pelos en la parte dorsal sólo hasta el primer tercio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lasiurus egregius
Coloración negra, puntas del pelaje dorsal y ventral negras; sólo presente en Brasil . . . . . . . . . . . . . . . Lasiurus ebenus
3´ Coloración diferente, puntas del pelaje dorsal y ventral no son negras . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
Antebrazo mayor a 50 mm; coloración escarchada con predominio de pelos grises y amarillos . . . . . Lasiurus cinereus
4´ Antebrazo menor a 48 mm; coloración marrón oscura o rojiza. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5
Coloración marrón oscuro, solo presente en Brasil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Lasiurus castaneus
5´ Coloración rojiza o acanelada . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6
Antebrazo mayor a 45 mm . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7
6´ Antebrazo menor a 44 mm . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8
Membrana alar negra . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lasiurus atratus
7´ Membrana alar negruzca pero moteada, coloración naranja opaco a lo largo de antebrazo y metacarpos . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lasiurus arequipae sp. nov.
Coloración fuertemente rojiza pero no escarchada, uropatagio cubierto por pelos que se extienden más allá del borde . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lasiurus varius
8´ Coloración rojiza brillante mezclada con gris, de apariencia escarchada; uropatagio totalmente cubierto por pelos, sin extenderse más allá del borde . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lasiurus blossevillii
Especímenes examinados: a continuación, los ejemplares utilizados para análisis moleculares, morfométricos y morfológicos se denotan con los símbolos alfa, beta y delta, respectivamente:
Lasiurus arequipae sp. nov. (n = 3). Perú: Arequipa, Huatiapa (MUSA 21058α,β,Δ, MUSA 21891β,Δ), Chaucalla (MUSA 21853β,Δ). Lasiurus atratus (n = 10) Guyana: Reserva Iwokrama, Potaro-Siparuni (ROM 109207β,Δ). Guyana Francesa: Saul, Clear Waters (984Tβ). Surinam: Kaiserberg (FMNH 93235β, Holotipo); Bakhuis, Sipaliwini (ROM 117037β,Δ). Venezuela: El Dorado (UCV 5409β, UCV 5410β); Imataca (Ochoa 506β, Ochoa 2587β, Ochoa 2588β, Ochoa 3183β). Lasiurus castaneus (n = 4). Costa Rica: Puntarenas, Estación de Campo San Gerardo (UCR 2538β,Δ, UCR 2539β,Δ, UCR 4971β,Δ). Panamá: Darién, Río Pucro, Villa Tacarcuna (USNM 310263 β,Δ). Lasiurus blossebillii (n = 16). Argentina: Jujuy, Yuto (CML 483β); Catamarca, Río Potrero (IML 2070β); Tucuman, Ciudad (IML 400β); Corrientes, Laguna Paiva (Julio Rafael Contreras 991β); Salta, El Arrazayal (RMB 1000β); La Pampa, General Pico (MACN 15570β). Brasil: Ceará: Crato, Floresta Nacional do Araripe (MZUSP 18722β-18725β); São Paulo: São Paulo (MZUSP 2448β). Uruguay: Montevideo (FMNH 42420β), Salto (FMNH 63811β-63814β). Lasiurus varius (n = 7). Argentina: Neuquén, Las Coloradas (MACN 13617β, MACN 13621β, MACN 13626β), Isla Victoria (CML 2005β); Río Negro, Bariloche (MVZ 158311β), Beatriz (BMNH 9.1.1.1β, BMNH 9.1.1.2β).











 nueva página del texto (beta)
nueva página del texto (beta)


