Introducción
La erradicación de grandes depredadores y el cambio en el uso del suelo durante los últimos 100 años han generado una expansión en la distribución histórica y un aumento en la densidad del coyote (Canis latrans) en el norte y centro de América (Berger y Gese, 2007; Gompper, 2002; Hidalgo-Mihart et al., 2004; Hody y Kays, 2018; Newsome et al., 2017; Newsome y Ripple, 2015), lo anterior lo ha llevado a ser el depredador dominante de muchas comunidades en las que habita, consumiendo y compitiendo con otros carnívoros, tanto domésticos (e.g., gatos y perros) como silvestres (Fleming et al., 2017; Gompper et al., 2016; Kamler et al., 2003; Lesmeister et al., 2015 ).
En el caso de las interacciones de C. latrans con otras especies de cánidos, además de competir por las presas, el coyote puede llegar a ser una de las principales causas de mortalidad en especies del género Vulpes, particularmente de la zorra del desierto (Vulpes macrotis, cuyo peso va de 2 a 3 kg en comparación con los 8 a 10 kg del coyote) sobre la que puede llegar a generar más de 70% de mortalidad, según estudios realizados con telemetría (Cypher y Spencer, 1998; Cypher et al., 2000; White et al., 1995; White y Garrott., 1997). La fuerte competencia de estas especies y la reducción histórica de las densidades de V. macrotis (Moehrenschlager et al., 2004; Arjo et al., 2007; Lonsinger et al., 2018) han resultado en la publicación de diversos estudios sobre los factores que determinan su interacción y dinámica poblacional (Arjo et al., 2007; Cypher y Scrivner, 1992; Cypher y Spencer, 1998; Cypher et al., 2000; Lonsinger et al., 2018; Ralls y White, 1995). La mayoría de estos trabajos se han realizado en las zonas áridas de EUA y reportan que pese a la presión negativa del coyote sobre la zorra del desierto, ambos cánidos logran coexistir (Moehrenschlager et al., 2004; Lonsinger et al., 2018).
Algunos de los mecanismos propuestos por los cuales ambos cánidos pueden coexistir regionalmente son: la variación en la dieta, que disminuye la competencia por explotación y la segregación espacial para disminuir la competencia por interferencia. En el caso de la dieta, aunque existe una superposición de presas consumidas por las 2 especies, la preferencia y variación temporal de sus componentes pueden cambiar (Byerly et al., 2017; Cypher et al., 2000; List et al., 2003); por un lado, V. macrotis puede consumir pequeños roedores, insectos, aves, pequeños vertebrados y lepóridos, no obstante, los roedores del género Dipodomys generalmente son el componente principal de su dieta a lo largo de su distribución (Byerly et al., 2017; Kozlowski et al., 2008, Moehrenschlager et al., 2004; White et al., 1995). Por otro lado, C. latrans posee un amplio espectro alimenticio y puede consumir pequeños vertebrados, insectos, roedores, tortugas y liebres, las cuales parecen ser uno de los principales componentes de su dieta en zonas áridas (Grajales-Tam y González-Romero, 2014; Hernández y Delibes, 1994). Además, cuando sus presas escasean, puede llegar a consumir frutos (de nopales Opuntia spp. y mezquite Prosopis glandulosa) o carroña (Byerly et al., 2017; Cypher et al., 2018; Kozlowski et al., 2008; List et al., 2003; Nelson et al., 2007).
En cuanto a la segregación espacial, el uso del espacio se da en función de la disponibilidad del recurso alimenticio y evasión del riesgo de depredación (Kozlowski et al., 2012). Aunque los ámbitos hogareños de ambas especies se puedan superponer, cada una usa el hábitat diferencialmente (Lonsinger et al., 2017; Nelson et al., 2007; Robinson et al., 2014). De esta manera, los coyotes prefieren hábitats de matorrales que les proporcionan mayor acceso a las presas, además de la cobertura frente a la radiación solar (Kozlowski et al., 2012; Nelson et al., 2007), mientras que V. macrotis, hace uso principalmente de zonas abiertas y pastizales, los cuales, aunque presenten menor abundancia de recursos, minimizan la probabilidad de encuentro con coyotes (Kozlowski et al., 2012; List y Macdonald, 2003; Lonsinger et al., 2017; Nelson et al., 2007; Robinson et al., 2014; White et al., 1995). Esta segregación de hábitat se debe a que V. macrotis está mejor adaptada a zonas desérticas, ya que consume menor cantidad de presas para adquirir sus requerimientos de agua, en comparación con C. latrans (Golightly y Ohmart 1983, 1984).
Estas características hacen que la interacción se constituya como un sistema de depredación intragremios (IGP, por sus siglas en inglés) (Holt y Polis, 1997; Polis et al., 1989), la cual se da cuando 2 especies compiten por un mismo recurso, pero además hay una especie dominante (IGPD) que puede matar y consumir a la subordinada (IGPS), en este caso, el coyote y la zorra del desierto, respectivamente. Para el modelo básico de IGP existen 3 posibles estados de equilibrio: la exclusión del depredador dominante (IGPD), la coexistencia estable entre las 2 especies y la exclusión del depredador subordinado (IGPS) (Holt y Polis, 1997). Dichos estados están mediados por la regla de R* que se refiere al nivel de equilibrio del enriquecimiento del recurso, así por ejemplo, en el caso de la escasez (R* N ) el competidor que mejor explote los recursos dominará, el cual generalmente es IGPS, causando la exclusión de IGPD; por otro lado, cuando existan niveles de recursos intermedios (R* NP ) ambas especies pueden coexistir, pese a la mortalidad que induce IGPD sobre IGPS. Y finalmente, cuando los recursos son abundantes (R* P ) se espera que exista dominancia de IGPD y exclusión de IGPS (Holt y Polis, 1997).
Pese al conocimiento que se ha generado sobre la interacción de ambos cánidos, el efecto de la presión del coyote sobre las poblaciones de V. macrotis no es del todo clara, ya que puede llegar a influir seriamente sumándose al efecto negativo de otras presiones (p. ej., fluctuación en la disponibilidad de presas) a largo plazo (Moehrenschlager et al., 2004) o en algunos casos, se cree que llega a ejercer un efecto positivo que ayuda a regular las densidades de V. macrotis (White y Garrott, 1997, 1999). Particularmente en la zona sur de la distribución de V. macrotis (desiertos sonorense y chihuahense), el conocimiento sobre la interacción de ambos cánidos es escaso. Los únicos estudios publicados para México provienen de una localidad en el desierto chihuahuense (Janos, en Chihuahua, al noroeste de México), donde ambos cánidos parecen seguir los patrones de uso de hábitat encontrados en estudios realizados en EUA (List y Macdonald, 2003); sin embargo, no se ha registrado ningún evento de depredación del coyote sobre zorras (Moehrenschlager et al., 2007), esto se atribuye a la abundancia de perritos de las praderas (Cynomys ludovicianus) en la zona de estudio, los cuales ofrecen escape inmediato a V. macrotis frente a la depredación de C. latrans. Por lo anterior, es posible que la importancia e influencia de los mecanismos de coexistencia de ambas especies puedan variar dependiendo de las poblaciones analizadas y su contexto biológico (Moehrenschlager et al., 2007).
Dado el desconocimiento de los patrones y mecanismos de coexistencia de V. macrotis y C. latrans en el desierto chihuahuense, y la posible heterogeneidad de dicha interacción a lo largo de la distribución de ambos cánidos (Moehrenschlager et al., 2004, 2007), el objetivo del presente estudio fue comprender qué factores influyen en dicha interacción en la Reserva de la Biósfera de Mapimí (RBM) por medio de modelos de ocupación para 2 especies, con el fin de analizar la coexistencia en el marco de un sistema de IGP. Por lo ya reportado en estudios anteriores, esperamos que el sistema se comporte de manera similar a lo encontrado en zonas áridas, donde V. macrotis es segregada a zonas abiertas y pastizales por la presencia de coyotes en zonas de matorral (List y Macdonald, 2003; Nelson et al., 2007; Robinson et al., 2014). En ese sentido, se espera que la probabilidad de detección y ocupación de la zorra sean menores en lugares donde la ocupación del coyote sea mayor y que esta relación esté dada por variables del hábitat.
Materiales y métodos
La Reserva de la Biosfera de Mapimí (RBM) se encuentra ubicada en el Bolsón de Mapimí al norte-centro de México, en el suroeste del estado de Chihuahua, este de Coahuila y noreste de Durango, y cuenta con una extensión de 342,388 ha (Conanp, 2006). Se caracteriza por un clima cálido y semiárido. Su temperatura promedio es de 11 °C en invierno y 28 °C en verano. Su promedio de precipitación anual es de 264 mm, con temporadas de lluvia de julio a septiembre, en donde 71% de las lluvias suceden (Cornet, 1988). En general, presenta una topografía plana con elevaciones que van desde 1,200 a 1,650 m snm.
La RBM forma parte de la región xerofítica de la provincia biótica de la Altiplanicie Mexicana (Rzedowski, 2006) y su vegetación está constituida por matorrales xerófilos, donde se reconocen las siguientes unidades de vegetación principales: el matorral desértico rosetófilo, vegetación halófita, vegetación de desiertos arenosos, pastizal natural, matorral desértico micrófilo, matorral subinerme y matorral espinoso (Conanp, 2006). Adicionalmente, existe una presión de pastoreo en la RBM, ya que la principal actividad de la población humana que habita en el área es la ganadería extensiva de bovinos (Conanp, 2006).
Durante el trabajo de campo se realizó un muestreo de septiembre a diciembre de 2018 con 30 cámaras trampa (Cuddeback’s Black Flash®, Model 1231). Se tuvieron en cuenta 2 criterios para la ubicación de las cámaras trampa: los tipos de cobertura vegetal y la cercanía a caminos, lo anterior con base en la limitación logística de tiempo que no permitía llegar a algunas zonas muy alejadas, y a que los propietarios de los predios de la RBM solo permiten el uso de caminos previamente existentes. Las estaciones fueron ubicadas en transectos perpendiculares al camino con 5 cámaras trampa cada uno y separadas, mínimo, por 1 km de distancia. Para maximizar el número de sitios, se ubicaron 6 transectos del 7 de septiembre al 14 de octubre de 2018 y posteriormente se trasladaron a otras ubicaciones del 16 de octubre al 2 de diciembre de 2018, para un total de 60 sitios de muestreo (Fig. 1). En cada sitio las cámaras trampa se ubicaron a 40 cm del suelo sobre 3 varillas de acero, adicionalmente se cebaron con latas de sardinas perforadas clavadas al suelo para impedir su remoción, lo anterior con el fin de aumentar la detectabilidad de las especies sin afectar sus patrones de actividad ni abundancia (Gerber et al., 2012; Stewart et al., 2019; Zapata-Ríos y Branch, 2018). Las cámaras trampa estuvieron activas durante las 24 h del día durante el periodo de muestreo, sin embargo, algunas cámaras fueron removidas por el ganado, lo cual causó mal funcionamiento parcial o total durante el muestreo. En total, se consideraron 54 estaciones de muestreo con un promedio de funcionamiento de 29.3 días continuos (26 a 45 días) y un esfuerzo de muestreo total de 1,762 días-cámara-trampa.

Figura 1 Ubicación de la Reserva de la Biosfera de Mapimí (RBM) y principales tipos de coberturas vegetales. Ubicación de las cámaras trampa y periodos de muestreo, (1) muestreo de septiembre a octubre del 2018, (2) periodo de octubre a diciembre del 2018.
Para analizar el uso de hábitat y la coexistencia de las especies de cánidos se emplearon modelos de ocupación de una y 2 especies en una temporada. Los modelos de ocupación utilizan matrices de presencia y ausencia para estimar la probabilidad de que la especie objetivo ocupe un sitio determinado (Ψ) teniendo en cuenta la probabilidad de detectarla (p) (MacKenzie et al., 2002). Este tipo de datos sigue una distribución Bernoulli (éxito-no éxito en una tirada), por lo cual la ocupación presenta la siguiente función descriptora:
donde Ζ es el valor de ocupación real en cada sitio i con una probabilidad de presencia de ψ. Este componente del modelo es llamado el componente ecológico, que puede estar influenciado por las características del hábitat y ecología de las especies de interés, pero también por la facilidad de detección, de esta manera el proceso ecológico se corrige mediante el proceso observacional o logístico, que sigue una función de probabilidad así:
donde pij es la observación en cada sitio i, cada visita j, dado que el sitio i esté ocupado y a su vez, es un proceso que está influenciado por variables relacionadas con la capacidad de detectar a las especies (MacKenzie et al., 2018).
Para los modelos de ocupación, un sitio se definió como cada estación de cámara-trampa, sin embargo, dado que el campo de muestreo en la cámara solo representa un punto en el espacio geográfico del sitio, más no un área, la ocupación (Ψ) se interpretó como la probabilidad de uso del sitio (Cruz et al., 2018; Farris et al., 2016; MacKenzie et al., 2018). Así mismo, las historias de captura se analizaron agrupadas en 3 días seguidos de fototrampeo.
Los modelos de ocupación de una especie se ajustaron mediante el paquete “Unmarked” (Fiske et al., 2017) para el lenguaje estadístico R (R Core Team, 2017) y se evaluaron mediante el criterio de información de Akaike corregido para muestras pequeñas (AICc), en donde el mejor modelo presentó el valor más bajo de AICc. Para escoger los mejores modelos, se siguió una aproximación de 2 etapas, en primer lugar se evaluaron los modelos del componente detección de las especies, una vez encontrado el mejor modelo para la detección, se procede a fijarlo y a evaluar los modelos con variables que afectan la ocupación. Para analizar la sobre dispersión de los modelos se utilizó la prueba de bondad de ajuste MacKenzie-Bayle en el modelo más parsimonioso, con un bootstrap de 1,000 repeticiones (MacKenzie y Bailey, 2004). Las variables de los mejores modelos (ΔAICc < 2) se interpretaron como las más influyentes sobre los parámetros de ocupación y detección de las especies y su importancia se evaluó por medio de intervalos de confianza de 95% (IC) de cada variable en los mejores modelos (Anderson, 2008).
Para evaluar la coexistencia (presencia simultánea en el sitio y en ocasión de muestreo) de las especies de cánidos, se utilizó un modelo de ocupación de 2 especies (MacKenzie et al., 2004, 2006) con la reparametrización condicionada propuesta por Richmond et al. (2010). Dicho modelo supone una especie dominante, en este caso C. latrans, y una especie subordinada que es V. macrotis, y calcula la ocupación y la detección de la especie subordinada, condicional a la presencia o ausencia de la dominante, de esta manera se obtienen los parámetros listados en la Tabla 1. En este caso, ΨC significa la probabilidad de ocupación de C. latrans, mientras que ΨVC es la probabilidad de ocupación de V. macrotis en presencia de coyote y ΨVc es la probabilidad de ocupación de V. macrotis en su ausencia. De la misma forma se evalúan los parámetros de detección de cada especie (p), así como la detección condicionada a la presencia o ausencia de la otra especie (r) (Tabla 1).
Tabla 1 Descripción de los parámetros para el modelo de coexistencia de coyote (Canis latrans) y zorra del desierto (Vulpes macrotis). Modificado de Richmond et al. (2010).
| Parámetro | Descripción |
|---|---|
| ΨC | Probabilidad de ocupación de C. latrans |
| ΨVC | Probabilidad de ocupación de V. macrotis, dada la presencia de C. latrans |
| ΨVc | Probabilidad de ocupación de V. macrotis, dado que C. latrans esté ausente |
| pV | Probabilidad de detección de V. macrotis, dado que C. latrans esté ausente |
| pC | Probabilidad de detección de C. latrans, dado que V. macrotis esté ausente |
| rC | Probabilidad de detección de C. latrans, dado que ambas especies estén presentes |
| rVC | Probabilidad de detección de V. macrotis, dado que ambas especies estén presentes y el C. latrans sea detectado |
| rVc | Probabilidad de detección de V. macrotis, dado que ambas especies estén presentes y C. latrans no sea detectado |
Las covariables de los mejores modelos de ocupación de cada especie se utilizaron para construir los modelos de coexistencia mediante el programa PRESENCE (Hines, 2012) con la opción de reparametrización ψBa /rBa para modelos de 2 especies. Con los parámetros estimados se calculó el factor de interacción entre especies (SIF) (MacKenzie et al., 2006), el cual consiste en la relación de la probabilidad de coexistencia de las 2 especies comparado con el valor esperado bajo la hipótesis de independencia (Richmond et al., 2010). El cálculo de SIF se hace de la siguiente manera:
Cuando el valor de φ toma valores > 1, el SIF sugiere que las 2 especies tienden a coexistir más de lo esperado y los valores < 1 sugieren que las especies tienden a evadirse, es decir, que ambas especies tienden a presentarse menos de lo esperado por el azar, mientras que cuando SIF es = 1 indica que las especies existen de manera independiente o no existe un patrón evidente de evasión o agregación (MacKenzie et al., 2004; Richmond et al., 2010).
Adicionalmente, se usaron factores y variables que pudieran influir sobre la ocupación y detección de ambas especies (Tabla 2), todas las covariables provenientes de sistemas de información geográfica fueron analizadas a la misma resolución de píxel de 1 km. Las covariables relacionadas con la ocupación de las especies se categorizaron en 3 grupos: variables relacionadas con el hábitat, topográficas y de interacción con otras especies.
Tabla 2 Lista de covariables y su efecto esperado sobre la ocupación y detección de C. latrans y V. macrotis en la Reserva de la Biosfera de Mapimí. Ψ = Efecto sobre la ocupación; p = efecto sobre la detección; + = efecto positivo; - = efecto negativo; +/- = efecto dependiente del tipo de factor; / = efecto aleatorio
| Variable | Índice | Influencia | Efecto | Fuente | |
|---|---|---|---|---|---|
| V. macrotis | C. latrans | ||||
| Tipo de vegetación | Vegetación del sitio de instalación de la cámara y especies dominantes | Ψ, p | +/- | +/- | Mapa de vegetación e información en campo |
| 500m buffer (% Matorral) | % de vegetación de matorral en un radio de 500 m a partir del punto de ubicación de la cámara | Ψ | - | + | Mapa de vegetación |
| MSAVI2 | Valor de índice de verdor de vegetación para cada punto de muestreo | Ψ, p | + | - | Imagen satelital Sentinel 2 |
| Altura | Valor de altura del sitio de muestreo Ψ (metros sobre el nivel del mar) | Ψ | - | - | Modelo digital de elevación INEGI versión 2003 |
| Liebres | Número de registros de liebres por sitio | Ψ | / | + | Datos de fototrampeo |
| Tipo de suelo | Categoría de tipo de suelo | Ψ | +/- | / | Información en campo |
| Pendiente | Valor de pendiente del sitio de muestreo | Ψ | - | - | Modelo digital de elevación INEGI |
| Ganado Bovino | Número de registros por sitio | Ψ | +,- | - | Datos de fototrampeo |
| Periodo de muestreo | Periodo en el que se capturan los datos; primer periodo = 1 y segundo periodo = 2 | p | / | / | Información en campo |
| Cebo | Número de días del cebo en campo | p | - | - | Diseño de muestreo |
Las variables de hábitat fueron: tipo de vegetación, índice de verdor de la vegetación (MSAVI2, por sus siglas en inglés), tipo de suelo y porcentaje de matorral. El tipo de vegetación es un factor que ha sido reportado como importante en la ocupación (Ψ) de ambas especies, ya que C. latrans ocupa en mayor proporción hábitats de matorrales mientras que V. macrotis utiliza hábitats de pastizales (Kozlowski et al., 2012; Lonsinger et al., 2017; Nelson et al., 2007; Robinson et al., 2014). Para esta variable se utilizó un mapa digitalizado de la vegetación de la RBM a partir de una imagen satelital Sentinel 2 tomada en septiembre de 2018 (Fig. 1). Para construir el mapa se realizó una digitalización supervisada basada en la similitud espectral de los pixeles adyacentes y calibrados posteriormente mediante información de campo (Bock et al., 2005). Para entrenar la digitalización, se usaron datos tomados en campo de los tipos de hábitat en cada sitio de muestreo. Se consideraron 3 tipos de hábitat predominantes: 1) matorrales abiertos (M_A), que se caracterizan por poseer grandes espacios abiertos con especies de matorrales (principalmente Larrea tridentata y Prosopis glandulosa); 2) matorrales (M): son áreas más densas o mogotes que presentaron dominancia de especies como P. glandulosa junto con otras menos comunes (Montaña y Breimer, 1988); 3) pastizales (P_M): se caracterizan por la predominancia de pastizales (Pleuraphis mutica), pero puede contener en menor medida otras especies de matorral.
Así mismo, debido a que la respuesta de las especies sobre el hábitat puede evidenciarse a una mayor escala (Galán-Acedo et al., 2018; Lyra-Jorge et al., 2010; Nagy-Reis et al., 2017), se analizó el porcentaje de matorrales con buffers de 500 metros alrededor de cada sitio de muestreo, lo anterior con el fin de asegurar la independencia de esta variable entre sitios de muestreo. Adicionalmente, se utilizó una modificación del índice de vegetación ajustado (MSAVI2) (Qi et al., 1994) como indicador de la producción vegetal de cada sitio, calculada a partir de la misma imagen satelital Sentinel 2 de la variable de coberturas de vegetación. Debido a su mayor proporción de suelo desnudo, los hábitats menos densos tendrán menor valor de MSAVI2.
La abundancia de presas también es una variable importante en la ocupación y abundancia de carnívoros. Para este caso se espera encontrar más roedores, tanto en cantidad como en biomasa, en las zonas de matorral en comparación con las zonas de pastizales (Owen, 1988; Ernest et al., 2000; Hernández et al., 2005; Hernández, Laundré, González-Romero et al., 2011; Hernández, Laundré, Grajales et al., 2011); por este motivo, se espera que tanto la variable de tipo de vegetación como MSAVI2 se relacionen con la ocupación y detección de ambas especies, ya que influyen sobre sus patrones de forrajeo.
Finalmente, el tipo de suelo influye sobre la ocupación de las especies por 2 razones, en primer lugar, está relacionado con la estructura del hábitat, filtración de agua y escorrentía en zonas áridas (Montaña y Breimer, 1988). En segundo lugar, es una característica determinante para V. macrotis, ya que esta especie prefiere suelos suaves para la construcción de madrigueras (Arjo et al., 2003). Este factor se evaluó mediante observación en campo y se clasificó cada sitio de muestreo en 3 posibles categorías de suelo: arcilloso, pedregoso y arenoso.
Las variables topográficas fueron 2, la altitud y la pendiente. Estas variables determinan la composición de especies en una comunidad, en este caso se ha observado que V. macrotis así como C. latrans, no suelen encontrarse en cerros o zonas altas, prefiriendo zonas planas (Elizalde et al., 2014; List, 1997; McGrew, 1979; Nelson et al., 2007), debido a lo anterior, se espera que influyan sobre la ocupación de ambas especies. Estas variables fueron tomadas a partir del modelo digital de elevación de las cartas geográficas 1:50,000 G13B54, G13B55, G13B64, G13B65, G13B74 y G13B75, provistas por el Instituto Nacional de Estadística, Geografía e Informática (INEGI) y todos los raster (imágenes en pixeles) presentaron una resolución de aproximadamente 1 km2.
Las variables de interacción con otras especies fueron 2, la cantidad de registros de liebre americana de cola negra (Lepus californicus) y la cantidad de registros de ganado bovino por sitio, ambas variables se midieron simplemente como la frecuencia de registros de cada especie en cada sitio de muestreo. En la RBM, L. californicus es la principal presa del coyote (Grajales-Tam y González-Romero, 2014; Hernández, Laundré, Grajales et al., 2011b), por lo cual se espera que exista una relación positiva en la ocupación del coyote con la cantidad de registros de esta especie. En el caso de la zorra del desierto, aunque la liebre puede formar parte de su dieta, la proporción e importancia es baja, ya que consume en mayor medida especies de menor tamaño, especialmente roedores del género Dipodomys y conejos (Sylvilagus audubonii) (Byerly et al., 2017; List et al., 2003; Nelson et al., 2007; Moehrenschlager et al., 2004), por lo cual no se espera que esta variable incida sobre la ocupación de la zorra del desierto. En el caso de la ganadería, el efecto del sobrepastoreo genera espacios abiertos y compactación del suelo, lo que ocasiona cambios en la estructura de vegetación principal del área (Orodho et al., 1990). Este cambio puede afectar el uso del hábitat de ambas especies de cánidos dado que genera espacios abiertos que podrían favorecer a V. macrotis, pero la presencia del ganado como tal, puede influir negativamente sobre ambas especies.
Finalmente, se generaron variables para modelar los posibles efectos del muestreo sobre la probabilidad de detección de las especies (p) como son: los efectos entre periodos de muestreo (Fig. 1), el cual se toma como un factor de 2 niveles: 1 es el primer periodo de muestreo y 2, el segundo periodo. También el efecto del cebo, dado que el atrayente pierde efectividad a medida que pasa el tiempo, se consideró cada 3 días de fototrampeo como un factor de envejecimiento del cebo, es decir que se utilizó como una variable continua que resultó de la suma de los días de muestreo en los cuales el cebo estuvo activo, por ejemplo, si el cebo duró activo durante 4 ocasiones de muestreo, su factor de envejecimiento es de 12 (4 × 3días).
Todas las variables continuas consideradas fueron estandarizadas a media 0 y varianza 1 para facilitar la convergencia de los modelos. Adicionalmente se realizó una prueba de Pearson para identificar alguna correlación entre pares de las variables utilizadas. En caso de existir una correlación, las variables implicadas no se usaron en el mismo modelo.
Resultados
Se obtuvieron un total de 970 registros independientes de 18 especies de mamíferos, de los cuales 473 registros fueron de C. latrans distribuidos en 51 estaciones, siendo la especie con más registros del muestreo; mientras que V. macrotis, presentó 8 registros en 7 de las estaciones de muestreo, siendo la catorceava especie más registrada. La ocupación “naive” que consiste en el cociente del número de sitios donde la especie fue registrada sobre el total de sitios, fue de 0.94 para C. latrans y 0.13 para V. macrotis. Adicionalmente, ninguna de las covariables utilizadas presentó un coeficiente de correlación mayor a 70%, por lo cual todas fueron incluidas en la modelación.
En el caso del coyote, se ajustaron un total de 23 modelos (Apéndice 1A, B), en los cuales las covariables que se relacionaron con la detección del coyote fueron el tipo de vegetación, el periodo de muestreo y el cebo, mientras que las variables relacionadas con la ocupación fueron el índice de verdor de vegetación y el tipo de vegetación (Apéndice 1A, B, C). Estos modelos no presentaron sobredispersión (X2 = 99930.62; p-valor = 0.33; ĉ =1.04).
Según las estimaciones del modelo más parsimonioso, el coyote tuvo una mayor probabilidad de detección en zonas de matorrales abiertos con respecto a matorrales densos y zonas de pastizales (M = 0.54 ± 0.07; M_A = 0.67 ± 0.04; p = 0.62 ± 0.07), no obstante, M_A fue la única categoría importante en este parámetro (IC 95% diferentes de 0) (Apéndice 1C; Fig. 2b). El segundo periodo de muestreo (octubre-diciembre) presentó una menor probabilidad de detección respecto al primer periodo (Fig. 2c), lo que podría atribuirse a características no medidas en los sitios de muestreo de la segunda temporada (lluvias en algunos sitios o sitios fuera de territorios de las especies). Finalmente, la variable del cebo presentó un comportamiento esperado, ya que su relación con la probabilidad de detección fue negativa, es decir que a medida que aumentó el tiempo de envejecimiento del cebo, la detección fue menor (Fig. 2a).
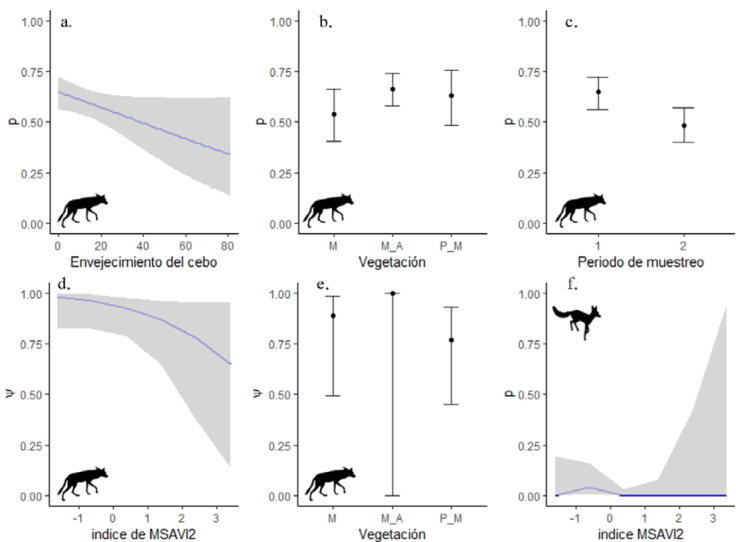
Figura 2 Relación de los parámetros de detección (p) y ocupación (psi) con las variables estandarizadas de los mejores modelos para C. latrans y V. macrotis. M = Matorral; M_A = matorral abierto; P_M = pastizal. Figuras a - e corresponden a parámetros de C. latrans; figura f corresponde a V.macrotis.
En relación con la ocupación del coyote, los mejores modelos mostraron que las covariables de índice de verdor de vegetación y el tipo de vegetación fueron las más influyentes. El coyote presentó una relación negativa con los valores de índice de verdor de vegetación, ocupando en mayor medida zonas de valores bajos (Fig. 2d); de igual forma, los coyotes presentaron mayor ocupación en zonas de matorral, pese a ello, esta última variable presentó baja precisión en la estimación (Fig. 2e; Apéndice 1C). No obstante, el modelo con ocupación constante también es uno de los que mejor ajustaron (Apéndice 1B), indicando la baja importancia de las covariables sobre la ocupación, lo cual se confirmó con los IC de todas las variables de la ocupación que se superpusieron al 0 (Apéndice 1C).
Para V. macrotis fueron evaluados un total de 23 modelos (Apéndice 2A, B), sin embargo, la prueba de bondad de ajuste indicó que existió subdispersión en el mejor modelo (X2 = 575.27; p-valor = 0.31; ĉ = 0.61), lo cual era de esperarse dada la baja cantidad de registros. El mejor modelo indicó que la detección de V. macrotis estuvo relacionada con el índice de verdor de vegetación en su forma cuadrática (Fig. 2f) pues tuvo mayor probabilidad de detección en valores bajos (dados por los sitios donde se registró), sin embargo, debido a la gran cantidad de sitios con ausencias, el modelo perdió precisión en valores altos y bajos del índice de verdor de vegetación; adicionalmente, esta covariable presentó IC que se superpusieron al 0 (MSAVI2 CI 95% = -10.08 a 0.57). Por otro lado, ninguna de las covariables se relacionó con la ocupación de V. macrotis ya que el modelo con ocupación nulo presentó el menor valor de AICc, muy alejado de los otros modelos (Apéndice 2B).
En la construcción del modelo de coexistencia se utilizaron las variables cuyos IC al 95% no superpusieron el 0 en los modelos de una especie, por lo cual solamente se utilizó el tipo de vegetación como covariable que afecte la detectabilidad del coyote. El mejor modelo de coexistencia mostró que la ocupación de V. macrotis es independiente de la ocupación del coyote (ΨVC = ΨVc = 0.47 ± 0.13) (Tabla 3), contrario a lo esperado bajo la hipótesis de segregación espacial, aunque el segundo modelo asume un valor de ocupación diferente, éste falló en calcular a ΨVc (ΨVc = 0) debido a que en todos los sitios donde se registró V. macrotis, también fue registrado C. latrans. Sin embargo, ambos modelos coincidieron en los parámetros de detección. En concordancia con lo anterior, el factor de interacción obtuvo un resultado de 1, es decir que la ocupación de ambas especies es independiente o debida al azar, por lo cual la población V. macrotis y C. latrans registrada en el estudio de la RBM no cumplió la hipótesis de segregación espacial.
Tabla 3 Modelos de ocupación condicional de 2 especies para evaluar los patrones de coexistencia de Vulpes macrotis y Canis latrans en la RBM. AIC = Valor de criterio de información de Akaike; delta AIC = diferencia del AIC de cada modelo con el mejor modelo; peso AIC = valor de soporte relativo de cada modelo y nPars = número de parámetros.
| Modelo | AIC | Delta AIC | Peso AIC | nPars |
|---|---|---|---|---|
| Ψ C,Ψ V,pC,pV,rC | 793.28 | 0 | 0.5512 | 7 |
| Ψ C,Ψ VC,Ψ Vc,pC,pV,rC | 794 | 0.72 | 0.3845 | 8 |
| Ψ C,Ψ V,pC,pV,rC, rVC, rVc | 795.86 | 2.58 | 0.131 | 9 |
| Ψ C,Ψ VC,Ψ Vc,pC,pV,rC,rVC,rVc | 797.86 | 4.58 | 0.0558 | 10 |
| Ψ C,Ψ V,pC,pV | 805.33 | 12.05 | 0.0013 | 6 |
| Ψ C,Ψ VC,Ψ Vc,pC,pV | 805.87 | 12.59 | 0.001 | 7 |
| Ψ C,Ψ V,pC,pV, rV | 807.2 | 13.92 | 0.0005 | 7 |
| Ψ C,Ψ VC,Ψ Vc,pC,pV, rV | 807.34 | 14.06 | 0.0005 | 8 |
| Ψ C,Ψ V,pC,pV,rVC,rVc | 807.37 | 14.09 | 0.0005 | 8 |
| Ψ C,Ψ VC,Ψ Vc,pC,pV,rVC,rVc | 809.34 | 16.06 | 0.0002 | 9 |
| Ψ C,Ψ V,pC,pV,rC,rV | 820.77 | 27.49 | 0 | 8 |
| ΨC,ΨVC,ΨVc,pC,pV,rC,rV | 822.77 | 29.49 | 0 | 9 |
Bajo la hipótesis de segregación espacio-temporal, se espera que la probabilidad de detectar a V. macrotis en la ausencia de C. latrans fuera mayor (pV > rVc > rCV), no obstante, los mejores modelos indican que la probabilidad de detección de V. macrotis es la misma independientemente de la presencia o detección del coyote (pV = rVc = rCV = 0.037 ± 0.062). En el caso de C. latrans, los modelos indicaron que la probabilidad de detección fue mayor en presencia V. macrotis (pC = 0.47 ± 0.61 < rC = 0.73 ± 0.61).
Discusión
Los resultados encontrados en el presente estudio indicaron que para la población muestreada de V. macrotis y C. latrans en la RBM, no existió una segregación espacial, especialmente porque C. latrans fue registrado para la mayoría de los sitios de muestreo, mientras que los registros de la zorra se restringieron solo a 7 estaciones durante los 2 periodos de muestreo. Lo anterior coincidió con lo ya reportado anteriormente para la RBM, donde el coyote es el depredador más común en el área y relega a las zorras como un depredador poco usual (Castelazo, 2014; Elizalde et al., 2014).
La alta movilidad del coyote y su capacidad de hacer uso de diferentes hábitats cuando hay recursos suficientes derivaron en su ubicuidad en la zona de estudio (Hernández et al., 1993; Lonsinger et al., 2017). Lo anterior pudo influir en que ninguna de las covariables utilizadas tuvo un efecto importante sobre su ocupación (modelo nulo en los mejores modelos) (Apéndice1B), lo cual es evidente en la RBM debido a la disponibilidad de presas tanto en pastizales como matorrales (Hernández et al., 2005; Hernández, Laundré, González-Romero et al., 2011; Hernández, Laundré, Grajales et al., 2011). De hecho, la principal presa de los coyotes en la RBM, las liebres, son más abundantes en zonas de pastizal respecto de las zonas de matorrales (Hernández, Laundré, Grajales et al., 2011; Laundré et al., 2009; Marı́n et al., 2003; Portales, 2006). Sin embargo, a pesar de la mayor abundancia de las liebres en los pastizales, los coyotes forrajean en mayor medida en zonas de matorrales debido a que son más eficaces cazando en este tipo de hábitats (Laundré et al., 2009), lo que explica que la única variable importante de detección de esta especie fueron los matorrales abiertos.
Por el contrario, la cantidad de registros de V. macrotis no permitió generar conclusiones biológicas robustas respecto del efecto de las variables sobre su ocupación y aunque mediante el uso de cebo se esperaba maximizar el número de detecciones (en efecto, algunos de los individuos de V. macrotis parecen mostrar interés en él), según los modelos, el cebo solo tuvo efecto evidente sobre los coyotes. Adicionalmente, los registros de zorras fueron menores a otras especies raras como Urocyon cinereoargenteus o incluso especies en las cuales el cebo pudiera causar algún tipo de repulsión como Lepus californicus. Por lo anterior, es posible que la baja cantidad de registros de zorras pueda relacionarse con sus ámbitos hogareños pequeños (Servín-Martínez, 1999) y su baja densidad en el área, lo anterior asumiendo que la baja tasa de detección y ocupación fueran un reflejo de la abundancia (MacKenzie et al., 2006; Rovero y Marshall, 2009).
La proporción de registros de V. macrotis en nuestro estudio es menor en comparación con otros estudios realizados tanto en México como en EUA, los cuales reportan una mayor ocupación o frecuencia de registro de V. macrotis, aun con la presencia del coyote (Lonsinger et al., 2017; Moehrenschlager et al., 2007; Nelson et al., 2007; Rich et al., 2018). No obstante, Rich et al. (2018) reportan valores de ocupación bajos para V. macrotis en la ecorregión del desierto de Great Valley en California, EUA y coincidentemente con este estudio, C. latrans fue el mamífero con mayores valores de ocupación. En contraste, el mismo estudio reportó a V. macrotis como el mamífero con mayor ocupación para la ecorregión del desierto de Mojave también en el estado de California, EUA. Si bien se ha reportado que las zorras bajo ciertas condiciones pueden aprovechar zonas de agricultura periurbanas (Cypher y Frost, 1999), los hábitats altamente transformados por la agricultura en el desierto Great Valley que benefician la proliferación de coyotes y otros mamíferos (Rich et al., 2018), pueden estar afectando la ocupación de las zorras del desierto.
En nuestro caso, pese a que en la RBM no existe una presión generada por la agricultura, la ganadería extensiva ha sido por años la principal actividad humana dentro de la reserva (Conanp, 2006). Aunque los modelos no encontraron ninguna relación de la presencia de la ganadería sobre las especies, los efectos históricos del sobrepastoreo sí ejercen una presión y un cambio en la dinámica de los hábitats de zonas áridas, especialmente sobre las zonas de pastizales (Ceballos et al., 2010). Pese a que el efecto histórico del sobrepastoreo no se evaluó formalmente en los modelos, en la literatura se describen 3 efectos principales sobre los hábitats desérticos: 1) compacta el suelo y reduce la supervivencia de plántulas por el pisoteo; 2) genera una presión negativa a pastizales por el consumo de gramíneas, y 3) promueve la invasión de arbustos en pastizales por la dispersión de semillas por el consumo de las vainas del mezquite Prosopis glandulosa (Ceballos et al., 2005; Peters y Gibbens, 2006). No obstante, en el presente estudio no se evaluó formalmente el efecto histórico del sobrepastoreo sobre el hábitat y sobre las especies estudiadas, en los pastizales de la RBM existe una invasión de las especies vegetales de los matorrales (L. tridentata y P. glandulosa) (Obs. pers).
Este cambio en la estructura de hábitat promueve la colonización de liebres (Lepus californicus) y roedores (ej. Dipodomys spp.) a los hábitats de pastizales (Peters y Gibbens, 2006), lo cual ha sido reportado en la RBM para roedores, con un aumento de especies de matorral en zonas de pastizales (Dipodomys merriami y Neotoma albigula) (Hernández et al., 2005; Hernández, Laundré, González-Romero et al., 2011) y para las liebres, las cuales presentan una mayor abundancia y densidad en las zonas de pastizales respecto de zonas de matorral en la RBM (Hernández, Laundré, Grajales et al., 2011b; Laundré et al., 2009; Marı́n et al., 2003; Portales, 2006). De esta manera, con la disponibilidad de presas para los coyotes, así como la reducción en la extensión de los pastizales en la RBM, no es posible para V. macrotis evitar a los coyotes por medio de la segregación espacial.
Por el contrario, la detección de coyotes fue mayor en presencia de zorras (pC < rC), lo que sugiere que ambas especies forrajean en mayor medida en los mismos sitios. Este patrón de coexistencia también es reportado por otros estudios sobre ocupación de ambas especies, en donde a pesar de que existe partición de hábitat en términos de ocupación, el coyote es detectado con mayor probabilidad en matorrales donde también fueron registradas zorras (Lonsinger et al., 2017; Robinson et al., 2014). Este patrón puede ser explicado por estados alternativos de IGP, los cuales postulan que cuando ambas especies logran coexistir, la estabilización de la interacción puede deberse a la presencia de recursos alternativos y/o a mecanismos conductuales (Amarasekare, 2008; Verdy y Amarasekare, 2010).
En el caso de los recursos alternativos, la competencia por explotación puede mitigarse cuando los depredadores consumen distintas presas (Holt y Huxel, 2007), lo cual en efecto podría darse en la RBM dada la variedad y abundancia de las mismas; por un lado, las especies de roedores importantes en la dieta de V. macrotis como D. merriami (Byerly et al., 2017; Moehrenschlager et al., 2004), son más abundantes en sitios de matorrales, mientras que por otro lado, C. latrans consume preferentemente liebres en la RBM en los mismos sitios (Grajales-Tam y González-Romero, 2014; Laundré et al., 2009). Dado que las presas no son un recurso limitante en el área de estudio, es posible que la competencia intraespecífica sea más fuerte que la competencia interespecífica en el caso de los coyotes, lo cual libera presión por interferencia hacia V. macrotis. Adicionalmente, otro recurso alternativo para el coyote son los bebederos artificiales (Hall et al., 2013; Kluever y Gese, 2016; Lonsinger et al., 2017), ya que es en condiciones de sequías fuertes donde la competencia por interferencia puede ser más intensa (Ralls y White, 1995). En la RBM, si bien existen bebederos artificiales instalados para el ganado (Obs. pers.), no se ha evaluado su efecto sobre la presencia o detección de ambas especies, lo que no descarta que sean utilizados por los coyotes e influyan sobre su interacción con las zorras. De hecho, en la región del Gran Valle, donde se reportan valores similares de ocupación para las especies de estudio, los bebederos artificiales parecen tener una influencia positiva sobre la ocupación de los coyotes (Rich et al., 2019).
Otro de los mecanismos propuestos que puede estabilizar la coexistencia en un sistema IGP es aquel donde el depredador subordinado invierte mayor cantidad de tiempo en vigilancia y evasión del depredador dominante (Amarasekare, 2003; Kimbrell et al., 2007; Lonsinger et al., 2017). En este caso, es posible que V. macrotis al frecuentar zonas de mayor probabilidad de detección de C. latrans, invierta menos tiempo forrajeando, pero mayor tiempo evitando y vigilando ante el riesgo de depredación. Este mecanismo se ha evidenciado en otros carnívoros, los cuales realizan cambios en el uso del espacio a una escala muy fina para evitar encuentros con depredadores dominantes (Lesmeister et al., 2015; Vanak et al., 2013). Incluso, el comportamiento de aumentar el tiempo de vigilancia ha sido registrado para las zorras del desierto cuando utilizan bebederos en zonas de matorrales (Hall et al., 2013). Este tipo de evasión es similar al reportado en Janos, en el estado de Chihuahua, México, ya que las zorras evaden el riesgo de depredación mediante refugios provistos por las madrigueras de perritos de las praderas (Cynomys ludovicianus) (List y Macdonald, 2003; List et al., 2003; Moehrenschlager et al., 2007). Si bien en la RBM actualmente no hay registros de C. ludovicianus, las zorras pueden aprovechar madrigueras de Dipodomys e incluso de individuos juveniles de Gopherus flavomarginatus como posible refugio frente a la depredación. Sin embargo, no hay información previa del uso de madrigueras de otras especies por parte de V. macrotis en el área.
Es posible que tanto la variación y disponibilidad de presas, así como mecanismos antidepredatorios permitan una estabilización de la interacción de ambas especies en la RBM. De hecho, estudios sobre la densidad de ambos cánidos en Utah, EUA, muestran que a pesar de la reducción histórica de V. macrotis y la subsecuente dominancia de C. latrans, ambas especies logran estabilizarse y coexistir en menor densidad (Lonsinger et al., 2018), posiblemente porque la mortalidad de V. macrotis depende de la tasa de encuentro de ambos canidos y porque C. latrans mata principalmente juveniles que se están dispersando más que adultos reproductores (Moehrenschlager et al., 2004, 2007). En la RBM, sin embargo, no existen estudios publicados sobre la densidad histórica de estas especies, no obstante, los datos de detecciones a partir de estaciones olfativas de varios años (1997-2012) no muestran alguna tendencia de disminución de V. macrotis, sino de fluctuación de la detección por efecto de la cantidad de lluvia del año anterior (Castelazo, 2014), lo que podría dar un indicio de la estabilización en ambas poblaciones y por lo tanto de la interacción.
Es preciso mencionar que este estudio solo fue realizado durante la temporada de lluvias, por lo que se desconoce cómo se comporta la interacción durante la temporada seca y a través de los años en la RBM. Esto es particularmente importante debido a que se ha visto que la precipitación del año anterior influye en la tasa de detección de ambas especies (Castelazo, 2014) y que en los sitios donde ambas especies coexisten, se presenta un gran recambio en la tasa de ocupación (presencia o ausencia por periodo de muestreo) de V. macrotis (Lonsinger et al., 2017), lo que hace vulnerable a la población de la especie en la RBM. En ese sentido, es necesario un mayor esfuerzo de muestreo en esta y otras zonas en México para evaluar cómo las variaciones climáticas y estructura del paisaje influyen sobre la interacción de ambos cánidos. Adicionalmente, dado que la extensión de los pastizales en México es mucho menor comparado con las zonas desérticas de EUA, es posible que la partición de hábitat no sea el principal mecanismo de coexistencia de ambos cánidos en el desierto chihuahuense, sino que dependa de otros mecanismos ya mencionados, así como refugios provistos por otras especies (Moehrenschlager et al., 2007) para estabilizar su coexistencia. Sin embargo, se desconoce el estado y ubicación de otras poblaciones de V. macrotis, por lo cual es preciso ubicar y evaluar otras poblaciones a lo largo del territorio mexicano, así como conocer las posibles dinámicas de fuente y sumidero que influyan sobre la dinámica poblacional de la especie en zonas donde coexiste con C. latrans, particularmente porque la subespecie de zorra que habita México (V. macrotis zinseri) es considerada como especie amenazada a escala nacional (Semarnat, 2010).
En conclusión, debido a la disponibilidad de presas en todos los hábitats, agua disponible en bebederos y la pequeña extensión de los pastizales de la RBM, el coyote fue registrado en todos los hábitats y en la mayoría de los sitios de estudio; lo anterior hace que para las zorras no sea posible una partición del hábitat con el fin de mitigar la competencia por interferencia. La abundancia del coyote probablemente mantenga las densidades de zorras bajas en el área de estudio, sin embargo, los coyotes se detectaron más de lo esperado en sitios con presencia de zorras, lo cual también ha sido evidenciado en otras zonas de su distribución. A partir del patrón encontrado, se plantea la hipótesis de que ambas especies pueden coexistir en los mismos hábitats ricos en recursos debido a la diversidad de presas y a mecanismos de evasión a escala más fina de la depredación por el depredador subordinado (Holt y Huxel, 2007; Kimbrell et al., 2007; Lonsinger et al., 2017; Robinson et al., 2014).











 nueva página del texto (beta)
nueva página del texto (beta)


