Introducción
La quema de las áreas dedicadas a la agricultura y ganadería es una práctica comúnmente usada por los campesinos en varios países de América (Arellano y Castillo-Guevara, 2014; Armenteras et al., 2005, 2009). Esta actividad les garantiza a los agricultores y ganaderos una reducción de costos en el desmonte de los terrenos, en la erradicación de malezas y en la preparación de la tierra para la siembra (Armenteras et al., 2005; Hoyos et al., 2017). Sin embargo, en algunos casos estas prácticas se salen de control y se propagan hasta las áreas naturales provocando incendios forestales de grandes proporciones (Nasi et al., 2002; Rivera-Cervantes y García-Reales, 1998).
Los incendios forestales naturales o de origen antrópico son un tipo de disturbio que causa modificaciones en la estructura de la vegetación y en las condiciones ambientales de los ecosistemas. Además, disminuyen la diversidad de especies, contribuyen a la pérdida del banco de semillas y dejan los suelos propensos a la erosión (Collett, 2003; Dale et al., 2001; Farji-Brener et al., 2002). La severidad de estos efectos depende en gran medida de la magnitud del incendio, la duración y frecuencia del mismo, así como de la capacidad del ecosistema para regresar a sus condiciones originales (resiliencia) (Apigian et al., 2006; Collett, 2003). En algunos ecosistemas templados (sabanas, matorrales y bosques), los incendios forestales juegan un papel importante en su dinámica natural contribuyendo a la reducción de la biomasa de plantas, a la regeneración y remplazo de la vegetación y al mantenimiento de la estructura de las comunidades (Blanche et al., 2001; Bond et al., 2005; Farji-Brener et al., 2002; Holliday, 1992). Sin embargo, en ecosistemas como los bosques tropicales, los incendios tienen repercusiones negativas de grandes dimensiones sobre la fauna y flora (Barlow y Peres, 2004, 2006; Cochrane, 2003; Lindenmayer et al., 2009).
En Colombia, la frecuencia de los incendios forestales naturales o antrópicos ha aumentado en las últimas 2 décadas, siendo los Llanos Orientales, el piedemonte andino y del Caquetá y la región Caribe las áreas con mayor presencia de este disturbio (Armenteras et al., 2009; Hoyos et al., 2017). De acuerdo con el Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM), entre 2011 y 2015, el número de hectáreas consumidas por los incendios forestales fue de 330,913, siendo el 2014 cuando se presentó el mayor número de hectáreas quemadas (98,361 ha), lo cual coincidió con presencia del fenómeno de El Niño en el país.
Con el creciente aumento de los incendios forestales en Colombia, también se ha incrementado el volumen de información sobre el tema. Sin embargo, ésta se ha enfocado en identificar las zonas del país donde más se presentan estos eventos, las causas que los provocan (Amaya y Armenteras, 2012; Armenteras et al., 2005, 2009, 2011; Hoyos et al., 2017) y el efecto sobre el cambio en las propiedades del suelo ( Camargo-García et al., 2012). No obstante, aún hay poca información sobre la respuesta de algunas comunidades biológicas a los cambios en los hábitats provocados por los incendios.
Con el fin de aportar información a esta discusión, en el presente trabajo se realizó un análisis sobre el efecto de los incendios forestales sobre las comunidades biológicas, tomando como grupo de estudio los escarabajos coprófagos. El trabajo se realizó en la Reserva Bijibana, ubicada en el departamento del Atlántico-Colombia, la cual sufrió un incendio forestal en el año 2014. La selección de los escarabajos coprófagos (Scarabaeidae: Scarabaeinae) como grupo de estudio obedece a 2 razones: 1) porque son un excelente indicador de la modificación de los hábitats y responden rápidamente con cambios en su composición y estructura cuando factores naturales o antrópicos causan alteraciones de sus hábitats (Favila y Halffter, 1997; Halffter y Favila, 1993; Nichols et al., 2007, 2008; Spector, 2006) y 2) tiene que ver con la información disponible para la reserva antes del incendio, la cual a la fecha solo cuenta con la publicada por Rangel-Acosta y Martínez-Hernández (2017); quienes evaluaron la variación temporal del ensamblaje de escarabajos coprófagos en el fragmento de bosque y los hábitats aledaños de la reserva.
Teniendo en cuenta lo anterior, el objetivo de este trabajo fue evaluar la respuesta de la comunidad de escarabajos coprófagos (Scarabaeidae: Scarabaeinae) a la modificación del hábitat causada por un incendio forestal en la Reserva Bijibana, Atlántico-Colombia. También se pretende contribuir a la construcción de planes de manejo de las áreas afectadas por estos eventos en el país, sobre todo en ecosistemas como el bosque seco tropical donde aún no se cuenta con este tipo de información. Desde la perspectiva esta investigación, se plantea la siguiente hipótesis: las modificaciones sobre la cobertura vegetal del fragmento de bosque y sobre algunas condiciones ambientales causadas por el incendio forestal, provocaron cambios negativos en la riqueza, abundancia, diversidad y biomas de la comunidad de escarabajos coprófagos en la Reserva Bijibana.
Materiales y métodos
El trabajo se realizó en la Reserva Bijibana, la cual se encuentra localizada en el municipio de Repelón a 10º29’17.3” N, 75º11’22.4” O, a una altitud que oscila entre 100 y 226 m (Fig. 1). El área boscosa comprende una extensión de 47 ha de bosque secundario en estados sucesionales mayores a los 16 años. Alrededor de la reserva se encuentran áreas de cultivos y potreros las cuales se delimitan entre sí con el uso de cercas vivas. Según la clasificación de zonas de vida de Holdridge (1987), la zona es parte de una formación higrotropofítica correspondiente a un bosque seco tropical (BST) y de acuerdo con Berdugo-Lattke y Rangel (2012), corresponde a bosques secos dominados por especies vegetales como Hura crepitans L. y Terminalia amazonia L. El bosque presenta un dosel discontinuo con altura de 8-10 m, con algunos árboles emergentes que pueden alcanzar los 14 m. En términos generales, el área presenta un régimen bimodal de lluvias, con un primer periodo comprendido entre mayo y julio y un segundo entre octubre y diciembre. La precipitación anual promedio varía entre 911 y 1,224 mm (Rangel y Carvajal-Cogollo, 2012). Alrededor de la reserva es común encontrar áreas dedicadas a la agricultura y a la ganadería, así como también es frecuente, entre los campesinos, el uso de cercas vivas como método de delimitación de los terrenos (Rangel-Acosta y Martínez-Hernández, 2017).
Para finales de marzo de 2014 durante el periodo seco, en la reserva se presentó un incendio forestal de gran magnitud el cual afectó gran parte del área de la reserva, provocando una reducción de la cobertura vegetal en un 60% y afectando los diferentes estratos de la vegetación desde el suelo hasta el dosel. Este evento fue ocasionado por propagación del fuego desde las áreas aledañas al fragmento, las cuales estaban siendo quemadas con el fin de preparar el suelo para fines agrícolas, sin embargo, no se tomaron las precauciones necesarias y el incendio se expandió hacia el interior de la reserva; debido a la abundancia de material vegetal seco y a las altas temperaturas de la época seca. Aunque el incendio ocasiono afectaciones, ninguna entidad gubernamental realizó estudios sobre los daños causados a nivel de las comunidades biológicas; por lo que este trabajo se convierte en el primero en realizar un análisis de las implicaciones del incendio sobre la diversidad de escarabajos coprófagos.
Para la toma de datos, se tuvieron en cuenta 2 eventos: uno antes y otro después del incendio. Los datos del primer evento fueron recolectados por Rangel-Acosta y Martínez-Hernández (2017) entre mayo de 2013 y marzo de 2014, sin embargo solo se tuvieron en cuenta los datos de los muestreos realizados en mayo y junio de 2013 al inicio de la estación de lluvias. Posterior a la primera toma de datos, ocurrió un incendio forestal a finales de marzo de 2014. Dos años después de este suceso, se registran los datos del segundo evento (postincendio) entre mayo y junio de 2016 durante el inicio de la estación de lluvias. En total, se realizaron 4 muestreos: 2 antes del incendio y 2 postincendio. El inicio de la estación de lluvias fue seleccionado para hacer la comparación antes y después del incendio, ya que durante esta temporada es cuando se captura la mayor diversidad de especies escarabajos coprófagos en la zona según lo descrito por Rangel-Acosta y Martínez-Hernández (2017). Además, de acuerdo con Blanche et al. (2001) y Barreto-de Andrade et al. (2011), durante la época seca la diversidad y abundancia de escarabajos coprófagos en los bosques tropicales disminuye drásticamente, incidiendo en el análisis de los datos, lo que pueden conducir a conclusiones erróneas sobre los efectos de disturbios como el fuego sobre las comunidades de insectos.
El protocolo de muestreo utilizado antes y después del incendio fue el descrito por Rangel-Acosta y Martínez-Hernández (2017), incluyendo los mismos sitios de ubicación de las trampas. En el fragmento de bosque se trazó un transecto lineal de 450 m, donde se ubicaron 10 puntos de muestreo distanciados 50 m uno de otro. En cada punto fue instalada una trampa “pitfall” (trampa de caída) con modificaciones según lo descrito por Martínez et al. (2009). Las trampas fueron cebadas con 30 g de excremento humano y permanecieron en campo durante 24 horas. La distancia entre trampas obedece a lo propuesto por Larsen y Forsyth (2005), quienes puntualizan que esta distancia entre puntos de muestreo garantiza la independencia entre trampas y evita su interacción. Por otra parte, el tiempo de permanencia de la trampa en campo obedece a que varias investigaciones realizadas en fragmentos de BST de esta parte del país han demostrado que este tiempo es suficiente para obtener una buena representación de la riqueza de especies, abundancia y diversidad de escarabajos en los sitios de muestreos (Barraza, 2010; Martínez, Cañas, Rangel, Barraza et al., 2010; Martínez, Cañas, Rangel, Blanco et al., 2010; Rangel-Acosta et al., 2012; Rangel-Acosta, Blanco-Rodríguez et al., 2016; Rangel-Acosta, Hernández et al., 2016).
Además del fragmento de bosque, también se realizaron muestreos en hábitats como potreros y cercas vivas los cuales no fueron afectados por el incendio. También se tuvo en cuenta que el ganado que usa estos potreros no estuviera siendo tratado con ivermectina u otro desparasitante que pueda causar efectos negativos en la comunidad de escarabajos coprófagos. Para el muestreo de estos hábitats, se usó la metodología descrita en el apartado anterior y los sitios de muestreos son los mismos usados por Rangel-Acosta y Martínez-Hernández (2017). El propósito de muestrear el potrero y cerca viva es comparar el estado actual de la comunidad de escarabajos coprófago del fragmento de bosque después del incendio con los hábitats aledaños que son de uso antrópico.
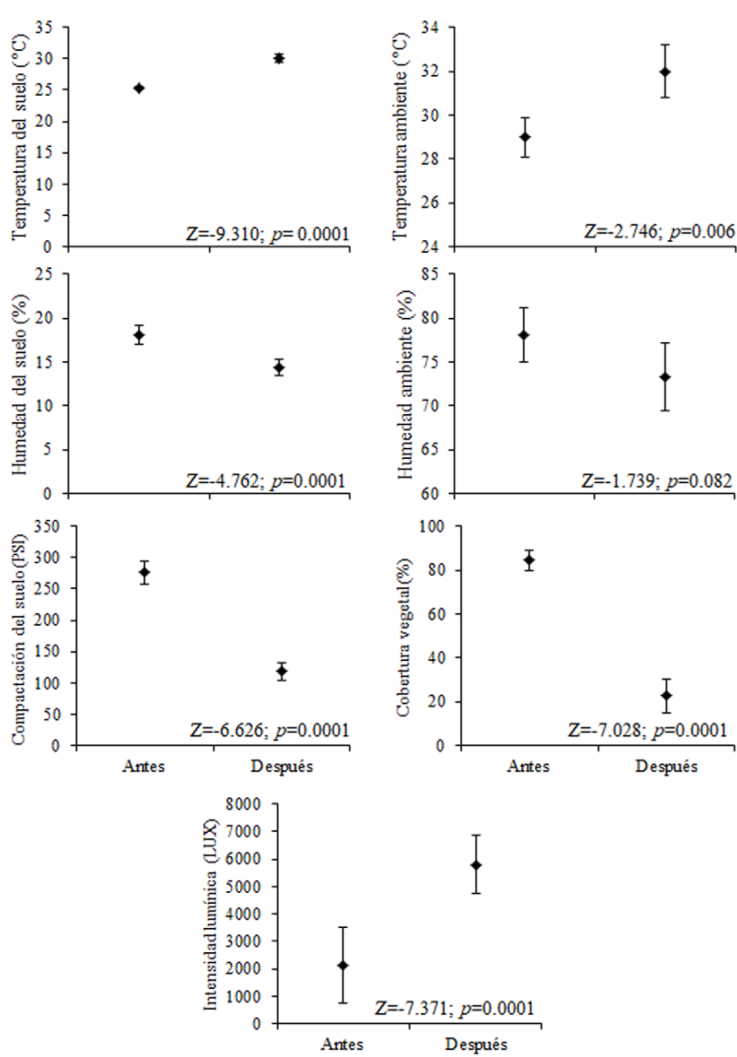
Adicional a la captura de los escarabajos coprófagos en cada punto de muestreo, se realizó la medición de las variables ambientales: temperatura y humedad ambiente (datalogger Extech RHT50), temperatura del suelo (termómetro de suelo Extech 39240), humedad del suelo (higrómetro para suelo Extech MO750), intensidad lumínica (luxómetro Extech LT 300), compactación del suelo (Agratronix 08180) y la cobertura vegetal (densitómetro esférico Forestry-Suppliers). Las mediciones fueron realizadas con una frecuencia de 30 minutos.
El material recolectado fue lavado, preservado en alcohol al 70% y trasladado al laboratorio de Zoología de la Universidad del Atlántico para su identificación y obtener la biomasa. Los escarabajos se identificaron con las claves taxonómicas propuestas por Medina y Lopera (2000) y Vaz-de-Mello et al. (2011) para los géneros y para especies, las propuestas por Delgado y Kohlmann (2007), Edmonds y Zídek (2010), Génier (2009), González-Alvarado y Vaz-de-Mello (2014), Kohlmann y Solís-Blanco (2001), Sarmiento-Garcés y Amat-García (2014), Solís-Blanco y Kohlmann (2002) y Vitólo (2000). Para estimar la biomasa se eligieron entre 10 y 20 individuos de cada especie, dependiendo de la disponibilidad de material. Estos escarabajos fueron secados en una mufla a 120 °C durante 48 horas. Posteriormente fueron pesados con una balanza analítica marca Radwag AS 220 (0.0001 g) y se obtuvo un promedio de la biomasa por cada especie. Los datos de diversidad, riqueza de especies, abundancia y biomasa de los escarabajos, así como las variables ambientales fueron comparados con la información recolectada por Rangel-Acosta y Martínez-Hernández (2017) para observar la respuesta de los escarabajos a la modificación del hábitat causada por el incendio.
Para observar los cambios en la riqueza de especie y diversidad de escarabajos coprófagos en el fragmento de bosque antes y después del incendio se utilizó el análisis de interpolación y extrapolación propuesto por Chao et al. (2014). Para este análisis se utilizaron los números de Hill (Hill, 1973) en unidades del número efectivo de especies (Jost, 2006). Se calcularon los valores de diversidad verdadera: 0 D (riqueza especies), 1 D (el exponencial del índice de Shannon) y 2 D (el inverso del índice de Simpson) (Jost, 2006). La diversidad calculada fue comparada usando los intervalos de confianza de 95% y basados en la superposición de éstos para determinar si existen diferencias (Cumming et al., 2007). Este análisis también fue utilizado para comparar la riqueza y diversidad de especie actual del fragmento de bosque con los hábitats adyacentes (cerca viva y potrero). Este análisis fue realizado con el script iNEXT para R Studio (Chao et al., 2014) y ejecutado en el programa R versión 3.4.1 (R Development Core Team, 2017).
Para comparar la abundancia y biomasa de escarabajos coprófagos antes y después del incendio se utilizó la prueba de Wilcoxon. Mientras que para comparar la abundancia y biomasa del fragmento de bosque después del incendio con las cercas vivas y el potrero se utilizó una prueba de Kruskal-Wallis acompañado de una prueba pareada de U Mann-Whitney. Por otro lado, los cambios causados por el incendio sobre las abundancias de cada una de las especies así como en las variables ambientales (temperatura ambiente, temperatura del suelo, humedad ambiente, humedad del suelo, compactación del suelo e intensidad lumínica) y la cobertura vegetal del fragmento de bosque, fueron analizados con una prueba de Wilcoxon. Este análisis fue realizado con el programa R versión 3.4.1 (R Development Core Team, 2017).
Las modificaciones provocadas por el incendio sobre la estructura de la comunidad y la distribución de las abundancias relativas de cada especie, fueron analizadas a través de la comparación de las curvas de rango abundancia (Magurran, 2004). Con estas curvas se pueden observar las diferencias en las distribuciones de las abundancias entre las especies dominantes, raras y la uniformidad de la comunidad antes y después del incendio.
Con el fin de observar la distribución espacial y la similitud en la composición y estructura de Scarabaeinae antes y después del incendio y entre la composición actual del fragmento con los hábitats cercas vivas y potreros, fue realizado un análisis de escalamiento multidimensional no-métrico (nMDS). Para realizar el nMDS, se utilizó el índice de disimilitud de Bray-Curtis, debido a que sirve para encontrar relaciones de disimilitud entre sitios y distancias ecológicas entre especies (Faith et al., 1987). Este análisis fue realizado con el programa R versión 3.4.1, utilizando los paquetes MASS (Venables y Ripley, 2002) y VEGAN (Oksanen et al., 2007). Con fin de determinar si los agrupamientos observados en el nMDS presentaban diferencias, se utilizó un Anosim de una vía (análisis de similitud). Este análisis se realizó de manera independiente para comparar el fragmento de bosque antes y después del incendio, y para comparar el fragmento de bosque después del incendio con los hábitats cerca vivas y potrero. Este análisis permite detectar diferencias en composición de especies entre grupos y dentro de cada uno. Esta prueba es utilizada porque tiene en cuenta el aporte que cada especie hace a la estructura a través de su abundancia. Para realizar este análisis se utilizó el programa PRIMER versión 6.0 (Clarke y Warwick, 2001).
Resultados
En total fueron recolectados 14,307 individuos agrupados en 22 especies; de los cuales 4,868 individuos y 20 especies fueron capturados en el bosque antes del incendio y 4,082 individuos y 16 especies después de éste. En la cerca viva se capturaron 15 especies y 3,043 individuos y para el potrero 13 especies y 2,314 individuos. Las especies Canthon aff. morsei y Onthophagus lebasi fueron las más abundantes en el fragmento de bosque antes y después del incendio. En la cerca viva y el potrero Canthon lituratus y Onthophagus marginicollis fueron las especies más comunes (Tabla 1). La cobertura del muestreo para el fragmento de bosque fue de 99.9% antes y después del incendio, e igual valor fue observado para la cerca viva y el potrero (Tabla 1).
Tabla 1 Especies de escarabajos de la Reserva Bijibana, Colombia.
| ID | Especies | BAI | BDI | Cerca viva |
Potrero | Prueba Wilcoxon | |
|---|---|---|---|---|---|---|---|
| W | p | ||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Abreviaturas: bosque antes del incendio (BAI), bosque después del incendio (BDI), identificación de las especies en graficas (ID) y especies que experimentaron cambios significativos en su abundancia (*).
En términos generales, el fragmento de bosque antes del incendio presentó mayores valores de riqueza y diversidad de especies que los hábitats bosque después del incendio, cerca viva y potrero (Fig. 2). En cuanto a la riqueza de especie (0 D), el mayor valor fue observado en el bosque antes del incendio (20 especies), el cual supera lo observado para el bosque después del incendio (16 especies) (Fig. 2A). Por otro lado y pese al incendio, la cerca viva (15 especies) y el potrero (13 especies) tuvieron valores menores de riqueza de especies que el fragmento de bosque después del incendio (Fig. 2B).

Figura 2 Análisis de la diversidad 0 D (A y B), 1 D (C y D) y 2 D (E y F) para el fragmento de bosque antes y después del incendio, así como para los hábitats bosque después del incendio cerca viva y potrero. Abreviaturas: bosque antes del incendio (BAI), bosque después del incendio (BDI), cercas vivas (CV) y potrero (Pot).
La diversidad de especies comunes (1 D) fue alta en el fragmento bosque antes del incendio (6.82 especies efectivas) en comparación al fragmento de bosque después del incendio (4.5 especies efectivas) (Fig. 2C). Por su parte, la diversidad observada en la cerca viva (5.7 especies efectivas) y el potrero (5 especies efectivas) fue superior a la observada en el fragmento bosque después del incendio (Fig. 2D). La diversidad de especies muy abundantes (2 D) fue alta en el fragmento de bosque antes del incendio (4.3 especies efectivas), la cual supera al bosque después del incendio (2.8 especies efectivas) (Fig. 2E). Hábitats como cerca viva (4.1 especies efectivas) y potreros (3.8 especies efectivas) mostraron valores de diversidad superiores a los observados al fragmento de bosque después del incendio (Fig. 2F).
En cuanto a la abundancia, la prueba de Wilcoxon no encontró diferencias significativas entre el fragmento de bosque antes (4,868 individuos) y después del incendio (4,082 individuos) (Z = 0.336, p = 0,737). Sin embargo, la prueba de Kruskal-Wallis detectó diferencias significativas entre el fragmento de bosque después del incendio, la cerca viva (3,043 individuos) y el potrero (2,314 individuos) (H = 12,31, p = 0.002). La abundancia en el fragmento de bosque después del incendio fue mayor que la cerca viva (U = 113, p = 0.019) y el potrero (U = 85, p = 0.002). La cerca viva y el potrero no presentaron diferencias en la abundancia (U = 129.5, p = 0.006).
En el caso de la biomasa se observó una reducción significativa en el fragmento de bosque después del incendio (antes = 67.55 g, después = 25.68 g) (Z = 0.3547, p < 0.001). Pese a esto, la biomasa del fragmento de bosque después del incendio fue superior a la de la cerca viva (20.42 g) (U = 122.5, p = 0.03) y el potrero (14.71 g) (U = 84.5, p = 0.001). Cerca viva y potrero no presentaron diferencias en biomasa (U = 133.5, p = 0.07).
La curva de abundancia muestra cambios en la estructura de la comunidad y en el aporte a la abundancia total realizado por las distintas especies después del incendio en el fragmento. Especies como C. aff. morsei y O. lebasi experimentaron una reducción en el número de individuos; sin embargo, esta reducción resultó no ser significativa (p > 0.05) y se mantienen como las especies más abundantes antes y después del incendio (Fig. 3A, Tabla 1). Otras especies como Eurysternus impresicollis, Onthophagus crinitus, Onthophagus landolti, O. marginicollis, Uroxys deavilai y Canthon aequinoctialis tuvieron una reducción significativa de sus abundancias (p < 0.05). C. aequinoctialis registró una disminución de su abundancia en un 96%; mientras que O. crinitus (cuarta especie más abundante en fragmento de bosque antes del incendio) no fue capturada después del incendio (Fig. 3A, Tabla 1). Este mismo patrón se observó para Canthon septemmaculatus, Coprophanaeus gamezi, Eurysternus mexicanus y Eurysternus plebejus, las cuales antes del incendio fueron catalogados como especies poco abundantes y después del incendio no fueron capturadas. Por otro lado, especies como Canthidium sp. 1 y C. lituratus aumentaron significativamente su número de individuos después del incendio (p < 0.05). Canthidium sp. 1 pasó de 13 individuos antes del incendio a 338 y C. lituratus pasó de 31 a 225 (Fig. 3A, Tabla 1).

Figura 3 Curvas de abundancia construidas con datos de abundancia (A y B) y biomasa (C y D) para el fragmento de bosque antes y después del incendio, así como para los hábitats bosque después del incendio, cerca viva y potrero. Las letras en la figura corresponden a la identificación de las especies en el Tabla 1. Abreviaturas: bosque antes del incendio (BAI), bosque después del incendio (BDI), cercas vivas (CV) y potrero (Pot).
Teniendo en cuenta la cerca viva, el potrero y el fragmento de bosque después del incendio, las curvas de rango de abundancia indican que difieren en la estructura y el aporte que realizan las especies a la abundancia (Fig. 3B). En la cerca viva y el potrero las especies que más aportan a la abundancia son C. lituratus, O. marginicollis, Canthidium sp. 1, Canthon mutabilis, Onthophagus landolti, Canthon juvencus, mientras que el bosque después del incendio las especies que más aportan son C. aff. morsei, O. lebasi, Canthidium sp. 1 C. juvencus, C. lituratus (Fig. 3B). Al realizar la curva de rango teniendo en cuenta el aporte a la biomasa que realiza cada especie, encontramos que antes del incendio, C.aff. morsei, C. aequinoctialis, D. guildingii, O. crinitus, C. gamezi fueron las especies que más aportan a la biomasa. Sin embargo, después del incendio, C. morsei fue la única especie que mantuvo su mayor aporte a la biomasa en este hábitat, aunque experimenta una reducción en su aporte de manera no significativa (p > 0.05, Fig. 3B). Por su parte, las otras especies postincendio presentaron una reducción significativa de su aporte a la biomasa y fueron remplazadas por O. lebasi, Canthidium sp. 1 y C. juvencus respectivamente (Fig. 3C, Tabla 2). Teniendo en cuenta la curva de rango construida con los datos de biomasa para la cerca viva, el potrero y el fragmento de bosque después del incendio, se observa que para este último hábitat las especies que realizaban mayor aporte son C.aff. morsei y O. lebasi, mientras que para cerca viva y potrero las que más aportan son C. lituratus y O. marginicollis (Fig. 3D).
Tabla 2 Especies de escarabajos y biomasa de los individuos capturados en el fragmento de bosque de la Reserva Bijibana antes y después del incendio y en los hábitats adyacentes.
| Especies | BAI | BDI | Cerca viva |
Potrero | Prueba Wilcoxon | |
|---|---|---|---|---|---|---|
| Z | p | |||||
|
|
|
|
|
|
|
|
Abreviaturas: bosque antes del incendio (BAI), bosque después del incendio (BDI), identificación de las especies en graficas (ID) y especies que experimentaron cambios significativos en su biomasa (*).
El nMDS mostró que la composición y estructura de especies del fragmento de bosque antes del incendio difiere a la composición después de éste, observándose la formación de 2 grupos separados. La composición y estructura de estos 2 es diferente de la observada para el potrero y la cerca viva, los cuales presentan una composición de especies similar formando un solo grupo (Fig. 4). Los resultados observados con la curva de rango de abundancia y el nMDS concuerdan con lo encontrado con la prueba Anosim, donde se determinó que existen diferencias significativas en la estructura de la comunidad entre el bosque antes y después del incendio (R = 0.437 p = 0.001). Por otra parte el bosque después del incendio, la cerca viva y el potreo presentaron diferencias en la estructura de la comunidad (R = 0.585, p = 0.001).
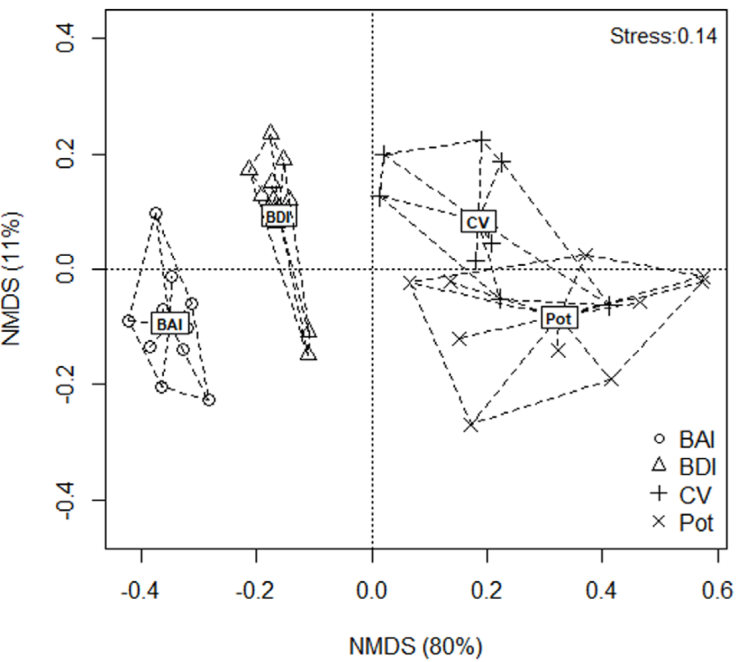
Figura 4 Análisis de escalamiento multidimensional no métrico (nMDS) realizado para el fragmento de bosque seco antes y después del incendio, así como para los hábitats cerca viva y potrero. Abreviaturas: bosque antes del incendio (BAI), bosque después del incendio (BDI), cercas vivas (CV) y potrero (Pot).
Por último, variables ambientales como temperatura ambiente y del suelo e intensidad lumínica postincendio tuvieron un aumento significativo (p < 0.05), mientras que la humedad y compactación del suelo, así como la cobertura vegetal presentaron una disminución en sus valores postincendio (p < 0.05) (Fig. 5).
Discusión
La respuesta de las comunidades de artrópodos a los incendios forestales es diferenciada y depende en gran medida del tipo de ecosistema, la frecuencia y severidad de los incendios, así como de la biología de los organismos (Cochrane, 2003; Lindenmayer et al., 2009). Algunos trabajos han demostrado la respuesta diferencial de algunas familias de escarabajos antes estos eventos, como por ejemplo el realizado por Samu et al. (2010); que registraron aumentos significativos en la abundancia de individuos de la familia Carabidae en áreas quemadas y mayor riqueza de especies en las no quemadas; mientras que Saint-Germain et al. (2005) determinaron el efecto negativo de los incendios en esta familia. Otras familias de escarabajos como Cerambycidae, Curculionidae, Anobiidae, Elateridae, Latridiidae, Phagidae, Nitidulidae, Staphylinidae y Scarabaeidae muestran un incremento significativo en su número de especies e individuos postincendio (Blanche et al., 2001; Muona y Rutanen, 1994).
En el caso del gremio de los escarabajos coprófagos de la subfamilia Scarabaeinae para este estudio presentó una respuesta negativa, con cambios drásticos en la riqueza de especies, biomasa, diversidad, y estructura de la comunidad después del incendio. Los cambios en el fragmento postincendio reflejan valores de diversidad inferiores a los de hábitats dedicados a la agricultura y ganadería, actividades que tienen una incidencia fuerte en la pérdida de la diversidad de este grupo de insectos (Barragán et al., 2011; Escobar, 2004; Gardner et al., 2008; Nichols et al., 2007). Estos cambios es posible que obedezcan a efectos directos o indirectos de los incendios sobre las comunidades biológicas. Los efectos directos causan la muerte de los organismos adultos y larvas durante el incendio, así como la emigración de los organismos a nuevas áreas (Cochrane, 2003; Farji-Brener et al., 2002). Los efectos indirectos tienen que ver con la modificación causada por el incendio sobre la estructura de bosque, produciendo pérdida de la cobertura vegetal, cambios en las condiciones ambientales y disposición de recursos (Barlow y Peres, 2004; Blanche et al., 2001; Moretti et al., 2004). Estos últimos cambios cobran mayor importancia en la recuperación de la comunidad de insectos, ya que de estas condiciones depende la supervivencia de los organismos que no murieron durante el disturbio y el establecimiento de los potenciales organismos de hábitats aledaños que puedan llegar a colonizar (Cochrane, 2003).
Por otro lado, la respuesta de los Scarabaeinae en el bosque después del incendio también puede resultar de una reacción en cadena provocada por efectos directos e indirectos de los incendios sobre las comunidades de plantas y mamíferos. Después de un incendio, las comunidades de platas frutales y no frutales sufren una disminución en riqueza de especies y abundancias; así como la producción de frutos y hojas, causando la disminución de las poblaciones de mamíferos que se alimentan de este recurso (Barlow y Peres, 2006). Así mismo, la ausencia de estos organismos conlleva a una fuerte caída en la cantidad y calidad de recursos (excrementos) disponibles para los escarabajos coprófagos, provocando una disminución en la riqueza y abundancia de especies de estos insectos (Nichols et al., 2009).
Los resultados expuestos en esta investigación difieren a los encontrados por otros autores. Por ejemplo Barreto-de Andrade et al. (2011) reportan un aumento en la riqueza y abundancia de escarabajos coprófagos en fragmentos de bosques después haber sufrido incendios forestales en Brasil; mientras que Arellano y Castillo-Guevara (2014), Louzada et al. (2010) y Rivera-Cervantes y García-Reales (1998) no reportan cambios en la riqueza y abundancia de escarabajos después de un incendio forestal en bosques templados en México y las sabanas en Brasil. Tanto los resultados de esta investigación como los descritos por otros autores demuestran que la respuesta de los escarabajos coprófagos a los incendios forestales es diferenciada y parte de ella depende del tipo de ecosistema. Mientras que en algunos ecosistemas (bosques templados y boreales), el fuego es una perturbación natural y la recuperación es rápida permitiendo el regreso de la fauna en poco tiempo; en otros como los tropicales (bosque húmedos y secos) esta perturbación causa daños que pueden tomar varios años para la recuperación de la flora y fauna (Cochrane, 2003).
En cuanto a la abundancia de las especies de escarabajos encontradas se observaron 3 respuestas diferentes después del incendio. La primera tiene que ver con especies como C. aff. morsei y O. lebasi, las cuales no mostraron diferencias en sus abundancias antes y después del incendio, sin embargo, en sitios como cercas vivas y potreros sus abundancias fueron bajas. Este patrón también fue observado en otras investigaciones para fragmentos de bosque seco del Caribe colombiano (Delgado-Gómez et al., 2012; Rangel-Acosta et al., 2018; Rangel-Acosta, Blanco-Rodríguez et al., 2016; Rangel-Acosta, Hernández et al., 2016); donde se demuestra que estas especies están asociadas a sitios que presentan cierto grado de cobertura vegetal (bosques intervenidos, bordes de bosque y pequeños fragmentos de bosque). Lo anterior sugiere que, aunque son resistentes a los cambios provocados en los fragmentos donde residen, requieren un mínimo de condiciones como cobertura vegetal moderada y temperatura ambiente y del suelo no elevadas (Rangel-Acosta et al., 2018), condiciones que presenta el fragmento de bosque pese al incendio, razón por la cual ambas especies prevalecen en este sitio.
La segunda respuesta observada tiene que ver con la reducción significativa de la abundancia de las especies C. aequinoctialis, E. impresicollis, O. landolti, O. marginicollis y U. deavilai, así como la pérdida local de especies como O. crinitus, C. septemmaculatus, C. gamezi, E. mexicanus y E. plebejus. Lo anterior se puede atribuir a los cambios causados por el incendio en el fragmento de bosque, como la pérdida de un buen porcentaje de la cobertura vegetal, modificación de las variables ambientales y variación en la disposición de recursos. Lo anterior incide directamente sobre los grupos de especies que tienen requerimientos estrictos de hábitats (bosque), ya que no son capaces de tolerar la cantidad de cambios causados por el incendio (Bouget y Duelli, 2004; Cochrane, 2003; Farji-Brener et al., 2002). De acuerdo con Rangel-Acosta y Martínez-Hernández (2017), especies como C. aequinoctialis, E. impresicollis, O. landolti, U. deavilai, O. crinitus, E. mexicanus y E. plebejus muestran una fuerte preferencia hacia hábitats con alta cobertura vegetal y humedad del suelo como el fragmento de bosque. Así mismo, estas especies son intolerantes a lugares con altos valores de intensidad lumínica y temperatura ambiente; condiciones que se presentaron postincendio en el fragmento e inciden en la reducción de la abundancia de las especies mencionadas.
Por otro lado, la reducción de la abundancia o pérdida local de especies de escarabajos después del incendio posiblemente esté sujeta al efecto del incendio forestal sobre la disponibilidad de recursos; ya sea por la muerte o migración de los mamíferos o por los cambios ambientales postincendio que afectan la calidad del recurso. Ambos casos trae consigo la disminución de la diversidad y abundancia de escarabajos, ya que el excremento de mamíferos es la principal fuente de recursos para este grupo de insectos (Nichols et al., 2009). Esta estrecha relación entre mamíferos y escarabajos coprófagos en los bosques secos del Caribe colombiano también ha sido observada por Rangel-Acosta, Martínez-Hernández et al. (2016) en la cuenca del río Cesar, donde los fragmentos con mayor presencia de mamíferos presentaron alta diversidad y abundancia de escarabajos coprófagos.
Por último, la tercera respuesta está relacionada con el incremento de las abundancias de Canthidium sp. 1 y C. lituratus postincendio. Estas especies presentan 2 condiciones importantes en su ciclo de vida: la primera es que son especies que han sido descritas como típicas de áreas abiertas, donde han demostrado tener tolerancias a las elevadas temperaturas ambiente y del suelo e intensidad lumínica (Barraza et al., 2010; Delgado-Gómez et al., 2012; Rangel-Acosta, Blanco-Rodríguez et al., 2016; Rangel-Acosta, Hernández et al., 2016). La segunda es la alta plasticidad trófica, ya que ambas especies han mostrado ser generalistas siendo capturadas en trampas cebadas con excrementos de ganado vacuno, carroña, excremento de mono aullador y humanos; así como también han sido observadas en áreas abiertas manipulando y haciendo uso de estos recursos (Martínez et al., 2012; Rangel-Acosta y Martínez-Hernández, 2017; Rangel-Acosta et al., 2012). Estas 2 condiciones le han permitido a estas especies estar en varios hábitats y colonizar nuevas áreas producto de la desforestación o sucesos naturales o antropogénicos como los incendios forestales.
Este trabajo se convierte en uno de los primeros esfuerzos por comprender el efecto de los incendios forestales sobre las comunidades de escarabajos coprófagos en el Caribe colombiano. Los resultados muestran un efecto negativo sobre la riqueza, abundancia, diversidad y biomasa de escarabajos, así como en la cobertura vegetal del bosque y las variables ambientales. Sin embargo, algunas especies se ven favorecidas, otras por el contrario son afectadas negativamente y otros grupos no experimentan cambios mostrando una respuesta estable a los cambios. La presente información cobra mayor valor en los planes de conservación y restauración del fragmento, ya que muestra una visión sobre cómo la comunidad de escarabajos responde ante perturbaciones como las causadas por un incendio forestal. Esta información será fundamental para evaluar y monitorear la recuperación de la comunidad de Scarabaeinae y el éxito de los planes de restauración aplicados en el área de estudios y otros lugares en las zonas bajas del Caribe colombiano.











 nueva página del texto (beta)
nueva página del texto (beta)