Introducción
Coreidae forma parte del orden Hemiptera, el grupo de insectos hemimetábolos más exitoso con casi 82,000 especies conocidas (Forero, 2008); su riqueza se posiciona solo después de los órdenes de insectos hiperdiversos: Coleoptera, Diptera, Lepidoptera e Hymenoptera (Gastón, 1991). Hemiptera está formado por los subórdenes Heteroptera, Coleorryncha, Auchenorryncha y Stenorryncha, tiene el potencial de ser empleado como indicador ambiental o ecológico (Moir y Brennan, 2007), ya que la mayoría de las especies de las familias que componen el orden son fitófagas, de hábitos oligófagos, por lo que su área de distribución está determinada por las plantas de las cuales se alimentan (Lattin, 1995; Pérez-Contreras, 1999).
Las especies de la familia Coreidae (Hemiptera: Heteroptera), comúnmente llamada insectos patas de hojas, tienen cuerpos pesados y endurecidos, sus especies alcanzan un rango de tamaño entre 6 mm (Vilga sp.) y 40 mm (Thasus sp., Fernández-Marín et al., 2015). Muchas especies tienen los fémures posteriores alargados, con espinas y tubérculos; la tibia posterior curvada con expansiones en forma de hoja además del tercer y cuarto antenómero dilatado (Fernández-Marín et al., 2015; Schuh y Slater, 1995). Esta familia tiene relevancia económica, ya que es considerada plaga de muchos cultivos (calabaza, maíz, coco, pistache, camote, etc.; Fernández-Marín et al., 2015); ha sido empleada como agente de control biológico para especies vegetales introducidas y en algunos lugares se comercializa como alimento (Burrows y Balcuinas, 1998; Ramos et al., 2006; Schuh y Slater, 1995).
La riqueza de la familia es de 2,563 especies descritas en el mundo, aunque la familia está mejor representada en las regiones tropicales (Brailovsky y Pérez-Gelabert, 2019). En México, Coreidae es un grupo taxonómicamente bien conocido (Brailovsky, 2016; Brailovsky y Barrera, 2009; Brailovsky y Mayorga, 1995; Brailovsky et al., 1994, 1995, 1998), pero aspectos como la composición de sus comunidades (diversidad, riqueza, abundancia) y su comportamiento estacional han sido escasamente abordados.
Este trabajo explora la diversidad y la estacionalidad de Coreidae en una localidad de bosque tropical caducifolio (BTC) del sur de Morelos. El BTC mexicano es considerado uno de los ecosistemas forestales más vulnerables por las actividades antropogénicas y el efecto del cambio climático en la región neotropical, el conocimiento detallado de las especies que la habitan y su relación con su estructura y procesos ecológicos permitirán diseñar estrategias para su adecuado manejo además de coadyuvar en su conservación (Banda et al., 2016; Ceballos et al., 2010; Maass et al., 2010; Miles et al., 2006).
Materiales y métodos
El trabajo se desarrolló en el BTC del ejido de Huaxtla, Tlaquiltenango, Morelos, en el centro de México (18°22’ N, 99°02’ O; fig. 1) (Rzedowski, 2006). El área de estudio forma parte de la Reserva de la Biosfera Sierra de Huautla (REBIOSH). Presenta una topografía accidentada con una altitud promedio de 1,000 m snm; el clima es cálido subhúmedo, con una temperatura media anual de 24.6 °C, lluvias en verano (mayo-octubre) y una precipitación media anual de 938.4 mm (INEGI, 2007).
Figura 1 Ubicación geográfica de la localidad de estudio (UTM). A) Reserva de la Biosfera Sierra de Huautla en el estado de Morelos; B) localidad de Huaxtla en la Reserva de la Biosfera Sierra de Huautla.
Las recolectas se desarrollaron cada mes durante 5 días, de enero a diciembre de 2009; durante las mismas, se realizaron recorridos “ad libitum” buscando individuos de forma directa en la vegetación y golpeando ésta con la red entomológica. Asimismo, se tomaron muestras de las plantas en las que se capturaron individuos, las recolectas tuvieron una duración de 5 h (10:00 - 15:00 h) y se realizaron por 5 personas, logrando un esfuerzo de muestreo de 1,500 horas (5 personas × 5 h × 5 días × 12 meses).
El material entomológico recolectado se conservó en seco depositándose en la Colección de Insectos de la Universidad Autónoma del Estado de Morelos (CIUM), resguardada en el Centro de Investigación en Biodiversidad y Conservación (CIβγC - UAEM), y otra parte en la Colección Nacional de Insectos, resguardada en el Instituto de Biología de la Universidad Nacional Autónoma de México; en tanto que el material botánico fue identificado en el Herbario Nacional de México (MEXU) de la Universidad Nacional Autónoma de México y resguardado en el Instituto de Biología (IBUNAM).
Se evaluó la eficiencia del muestreo en el área de estudio para las temporadas húmeda (época de lluvias; mayo, junio, julio, agosto, septiembre y octubre) y seca del año (época de estiaje; enero, febrero, marzo, abril, noviembre y diciembre) por medio de la cobertura de muestreo de los datos (Cˆm). La cobertura de la muestra mide qué tan completo está un inventario en términos de las abundancias observadas y permite extrapolar la riqueza esperada con base en el estimador Chao 1 (Chao y Jost, 2012). También se utilizaron curvas de rango-abundancia que permiten evaluar, de forma visual, la estructura de la comunidad.
Los valores de diversidad para toda el área y para cada estación se calcularon utilizando las medidas de diversidad verdadera (qD), estas medidas integran en una misma serie numérica diferentes niveles de diversidad y permiten una interpretación fácil e intuitiva, ya que se expresan en las mismas unidades (número de especies efectivas, Jost, 2006, 2007). Estas diversidades se calcularon para el nivel alfa y para 3 órdenes de q (0, 1, 2). El orden q indica la sensibilidad de la medida de diversidad a la abundancia de las especies (especies comunes y raras). Cuando q = 0, ignora la abundancia de las especies, 0D = la riqueza de especies. Cuando q = 1, da un peso a las especies proporcional a sus abundancias, 1D = al exponencial del índice de Shannon. Cuando q = 2, favorece a las especies con mayor abundancia, 2D = al inverso del índice de dominancia de Simpson (Jost, 2006). Además, se calculó el factor de uniformidad (evenness factor, EF 0,1), el cual es equivalente al índice de equitatividad de Pielou (Jost, 2010). Las diversidades y la cobertura de muestreo se calcularon utilizando el programa estadístico R (versión 3.3.2) con el paquete Entropart (Marcon y Hérault, 2015).
Para entender si la estacionalidad genera cambios composicionales en la comunidad de coreidos, se realizó un análisis de escalamiento multidimensional (NMDS; Dunn y Everitt, 2004). Para este análisis, se construyó una matriz con los valores pareados de índice de similitud de Jaccard entre meses de muestreo (tabla 1), este índice de similitud está directamente relacionado con los valores de diversidad del orden 0 de q. Este se calculó utilizando la ecuación para la similitud composicional entre comunidades (Jost, 2006, 2007). Para interpretar la ordenación de las unidades de muestreo, se buscaron patrones de agrupamiento y se correlacionaron los valores de las dimensiones con las variables precipitación y temperatura media mensual, obtenidos de la estación climatológica de la Comisión Nacional del Agua, número 17008, ubicada en la localidad de Huautla (Conagua, datos no publicados).
Tabla 1 Matriz de los valores pareados de índice de similitud de Jaccard entre meses de muestreo.
| Enero | Febrero | Marzo | Abril | Mayo | Junio | Julio | Agosto | Septiembre | Octubre | Noviembre | Diciembre | |
| Enero | 1 | 0.111 | 0.333 | 0.375 | 0.176 | 0.154 | 0.1 | 0.188 | 0.143 | 0.167 | 0.167 | 0.111 |
| Febrero | 0.111 | 1 | 0.333 | 0.222 | 0.25 | 0.154 | 0.158 | 0.118 | 0.143 | 0.105 | 0.167 | 0.111 |
| Marzo | 0.333 | 0.333 | 1 | 0.3 | 0.375 | 0.308 | 0.263 | 0.313 | 0.286 | 0.353 | 0.455 | 0.333 |
| Abril | 0.375 | 0.222 | 0.3 | 1 | 0.313 | 0.231 | 0.15 | 0.176 | 0.214 | 0.222 | 0.364 | 0.375 |
| Mayo | 0.176 | 0.25 | 0.375 | 0.313 | 1 | 0.389 | 0.333 | 0.45 | 0.3 | 0.348 | 0.412 | 0.333 |
| Junio | 0.154 | 0.154 | 0.308 | 0.231 | 0.389 | 1 | 0.5 | 0.412 | 0.75 | 0.368 | 0.583 | 0.364 |
| Julio | 0.1 | 0.158 | 0.263 | 0.15 | 0.333 | 0.5 | 1 | 0.55 | 0.556 | 0.435 | 0.368 | 0.222 |
| Agosto | 0.188 | 0.118 | 0.313 | 0.176 | 0.45 | 0.412 | 0.55 | 1 | 0.563 | 0.429 | 0.353 | 0.267 |
| Septiembre | 0.143 | 0.143 | 0.286 | 0.214 | 0.3 | 0.75 | 0.556 | 0.563 | 1 | 0.421 | 0.538 | 0.333 |
| Octubre | 0.167 | 0.105 | 0.353 | 0.222 | 0.348 | 0.368 | 0.435 | 0.429 | 0.421 | 1 | 0.563 | 0.313 |
| Noviembre | 0.167 | 0.167 | 0.455 | 0.364 | 0.412 | 0.583 | 0.368 | 0.353 | 0.538 | 0.563 | 1 | 0.556 |
| Diciembre | 0.111 | 0.111 | 0.333 | 0.375 | 0.333 | 0.364 | 0.222 | 0.267 | 0.333 | 0.313 | 0.556 | 1 |
Resultados
Se recolectaron 846 individuos de Coreidae, pertenecientes a 2 subfamilias, 10 tribus, 18 géneros y 32 especies (tabla 2), 26 de las 32 especies cuentan con información de la planta en la que se localizó, estas especies de plantas corresponden a 18 familias, 22 géneros y 24 especies (tabla 3). De las 32 especies de Coreidae citadas en este trabajo, 2 son registros nuevos para la REBIOSH y 1 para el estado de Morelos.
Tabla 2 Subfamilias, tribus, géneros y especies de la familia Coreidae de Huaxtla, Tlaquiltenango, Morelos.
| Subfamilia | Tribu | Género | Especie |
| Coreinae | Acanthocephalini | Acanthocephala | Acanthocephala alata (Burmeister, 1835) |
| Acanthocephala femorata (Fabricius, 1775) | |||
| Stenoscelidea | Stenoscelidea sp. | ||
| Anisoscelini | Anisoscelis | Anisoscelis (Bitta) affinis Westwood, 1840 | |
| Leptoglossus | Leptoglossus gonagra (Fabricius, 1775) | ||
| Leptoglossus zonatus (Dallas, 1852) | |||
| Narnia | Narnia (Narnia) inornata Distant, 1892 | ||
| Chariesterini | Chariesterus | Chariesterus albiventris Burmeister, 1835 | |
| Chariesterus alternatus Distant, 1881 | |||
| Chelinideini | Chelinidea | Chelinidea tabulata (Burmeister, 1835) | |
| Coreini | Anasa | Anasa andresii (Guérin-Méneville, 1857) | |
| Anasa capaneodes Stål, 1862 | |||
| Catorhintha | Catorhintha divergens Barber, 1926 | ||
| Catorhintha elongatula Brailovsky, 1983 | |||
| Cebriniscella | Cebreniscella antennataBrailovsky, 1995 | ||
| Hypselonotus | Hypselonotus interruptus Hahn, 1833 | ||
| Hypselonotus lineatus Stål, 1862 | |||
| Hypselonotus punctiventris Stål, 1862 | |||
| Zicca | Zicca taeniola (Dallas, 1852) | ||
| Discogastrini | Savius | Savius jurgiosus jurgiosus (Stål, 1862) | |
| Savuis jurgiosus nigroclavatus Brailovsky, 1986 | |||
| Nematopodini | Mozena | Mozena lineolata (Herrich-Schäffer, 1840) | |
| Mozena lunata (Burmeister, 1835) | |||
| Mozena preclara Brailovsky et Barrera, 2001 | |||
| Mozena ventralis (Mayr, 1865) | |||
| Piezogaster | Piezogaster chiriquinus (Distant, 1893) | ||
| Piezogaster spurcus (Stål, 1862) | |||
| Piezogaster tetricus (Stål, 1862) | |||
| Piezogaster vates (Stål, 1862) | |||
| Spartocerini | Sephina | Sephina vinula Stål, 1862 | |
| Meropachydinae | Meropachyini | Salamancaniella | Salamancaniella alternata (Dallas, 1852) |
| Spathophorini | Lycambes | Lycambes varicolor Stål, 1862 |
Tabla 3 Relación entre especies de Coreidae y la especie planta en la que se encontró en Huaxtla, Tlaquiltenango, Morelos.
| Coreido | Planta |
|---|---|
| Acanthocephala alata | Bursera linanoe (La Llave) Rzed., Calderón et Medina |
| Acanthocephala femorata | Bursera copallifera (DC.) Bullock |
| Stenocelidea sp. | Operculina pinnatifida (Kunth) O´Donell |
| Leptoglossus gonagra | Sorghum vulgare Pers. |
| Leptoglossus zonatus |
Spondias mombin L. Euphorbia schlechtendalii Boiss. Galactia viridiflora (Rose) Standl. Sorghum vulgare Pers. Gouania lupuloides (L.) Urb. |
| Narnia (Narnia) inorata | Opuntia sp. |
| Chariesterus albiventris | Euphorbia pulcherrima Willd. ex Klotzsch |
| Chariesterus alternatus | Euphorbia pulcherrima Willd. ex Klotzsch |
| Chelinidea tabulata | Opuntia sp. |
| Anasa andresii | Nissolia fruticosa Jacq. |
| Anasa capaneodes | Eysenhardtia polystachya (Ortega) Sarg. |
| Catorhintha divergens | Clematis dioica L. |
| Catorhintha elongatula |
Parthenium hysterophorus L. Combretum fruticosum (Loefl.) Stuntz |
| Cebreniscella antennata | Perymenium macrocephalum Greenm. |
| Hypselonotus interruptus | Iresine interrupta Benth. |
| Hypselonotus lineatus | Ficus insipida Willd. |
| Hypselonotus punctiventris |
Eysenhardtia polystachya (Ortega) Sarg. Ceiba sp. Ficus insipida Willd. Ziziphus amole (Sessé y Moc.) M.C. Johnst. |
| Zicca taeniola | Thouinidium decandrum (Bonpl.) Radlk. |
| Savuis jurgiosus jurgiosus | Aeschynomene americana L. |
| Savius jurgiosus nigroclavatus | Meliaceae sp. |
| Mozena lunata | Acacia cochliacantha Humb. y Bonpl. ex Willd. |
| Mozena ventralis | Acacia picachensis Brandegee |
| Piezogaster tetricus | Bursera lancifolia (Schltdl.) Engl. |
| Sephina vinula | Curcubitaceae sp. |
| Salamancaniella alternata | Meliaceae sp. |
| Lycambes varicolor | Meliaceae sp. |
De las subfamilias, la más rica y abundante fue Coreinae con 30 especies, 16 géneros, 8 tribus y 844 individuos, mientras que Meropachydinae, únicamente presentó 2 tribus, 2 géneros y 2 especies con 1 individuo cada una.
Las tribus más ricas y abundantes fueron Acanthocephalini con 2 géneros, 3 especies y 91 individuos; Anisoscelini con 3 géneros, 4 especies y 133 individuos; Coreini con 5 géneros, 9 especies y 62 individuos y Nematopodini con 2 géneros, 8 especies y 490 individuos; éstas 4 tribus contienen 91.7% de los individuos, 66.6% de los géneros y 75% de las especies registradas en este trabajo. Los géneros con mayor número de especies e individuos fueron Mozena Amyot y Serville con 4 especies y 475 individuos, Piezogaster Amyot y Serville con 4 especies y 15 individuos e Hypselonotus Hahn con 3 especies y 39 individuos, 9 géneros (50%) presentaron 1 especie.
Cinco especies fueron las más dominantes, concentrando 80% de la abundancia, Mozena lunata Burmeister con 263 individuos, Mozena ventralis Mayr con 205, Leptoglossus zonatus Dallas con 123, Acanthocephala alata Burmeister con 47 y Acanthocephala femorata Fabricius con 43, mientras que 69% de las especies registradas estuvieron representadas por menos de 10 individuos (fig. 2).
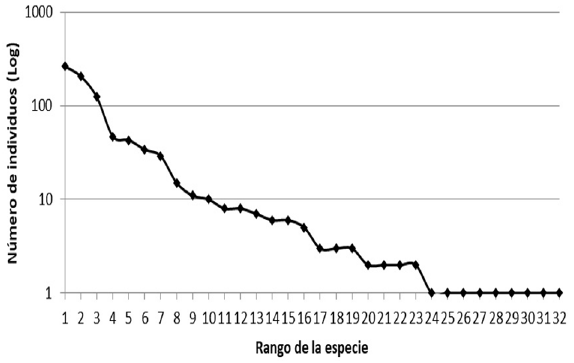
Figura 2 Gráfica de rango - abundancia de las 32 especies de la familia Coreidae de Huaxtla, Tlaquiltenango, Morelos.
El valor de cobertura para todo el muestreo fue de 98%, lo que sugiere que las 9 especies no recolectadas, de acuerdo con el estimador Chao 1, solo representan 2% de los individuos de la comunidad, la cobertura de muestreo por estación fue de 98% para la temporada húmeda y 97% para la seca (tabla 4). El análisis del comportamiento estacional de las especies de Coreidae en el área de estudio muestra una relación positiva con la precipitación, ya que la mayor riqueza y abundancia se obtuvieron en la temporada húmeda del año, registrando en ésta 736 individuos de 30 especies; mientras que en la estación seca se encontraron 110 individuos de 15 especies (fig. 3). Encontramos que 17 especies (53%) solo están presentes en la temporada húmeda, 2 (6%) solo estuvieron presentes durante la temporada seca y 13 (41%) durante las 2 estaciones.
Tabla 4 Valores de diversidad alfa (0Dα, 1Dα y 2Dα), factor de uniformidad (EF0,1) y cobertura de la muestra (Ĉm,%) para Huaxtla y por temporada.
| Húmeda | Seca | Huaxtla | |
| 0Dα | 30 | 15 | 32 |
| 1Dα | 7.6 | 8.7 | 8.5 |
| 2Dα | 4.7 | 5.9 | 5.3 |
| EF0,1 | 0.25 | 0.58 | 0.26 |
| Ĉm | 98 | 97 | 98 |

Figura 3 Comparación de la riqueza (círculos negros) y abundancia (círculos blancos) mensual de la comunidad Coreidae con la precipitación media mensual (barras) de Huaxtla, Tlaquiltenango, Morelos.
Para la localidad, se obtuvieron valores de diversidad de 32 especies efectivas (0Dα), 8.5 especies efectivas con un peso igual a su abundancia (1Dα) y 5.4 especies efectivas dominantes (2Dα). Los mayores valores de diversidad del orden 0Dα por temporada se obtuvieron para la temporada húmeda, mientras que los valores más altos de 1Dα y 2Dα se obtuvieron para la temporada seca. De acuerdo con el factor de uniformidad (EF0,1) es la temporada seca la que presenta la mayor equitatividad (tabla 4).
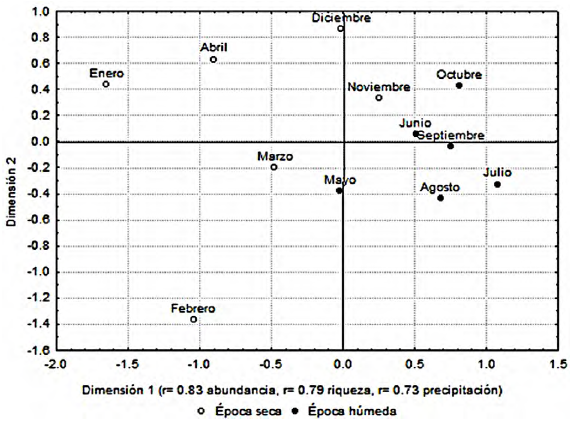
El análisis de escalamiento multidimensional mostró que existe una diferencia en la composición de especies entre las muestras (meses) diferenciando la estación húmeda de la seca (fig. 4). La dimensión 1 estuvo correlacionada con la precipitación (r = 0.73, p = 0.002), la riqueza (r = 0.79, p = 0.003) y la abundancia (r = 0.83, p = 0.001); la dimensión 2 no se correlacionó significativamente con ninguna variable. Al juzgar la gráfica del análisis de escalamiento multidimensional, se observa que junio, julio, agosto, septiembre y octubre (temporada húmeda) se agrupan con noviembre (temporada seca) y que mayo (temporada húmeda) se agrupa con enero, febrero, marzo y abril (temporada seca).
Discusión
El número de especies de Coreidae citado en este trabajo, representa 1.2% de la riqueza mundial de esta familia, lo que resulta importante, tomando en cuenta que la extensión del área de estudio es de 66.32 km2. Al comparar nuestros resultados con los mencionados en trabajos realizados en Centro y Sudamérica, así como la extensión de las áreas de estudio de cada uno (Barcellos et al., 2008; Froeschner, 1981; Maes y Goellner-Scheiding, 1993), podemos hipotetizar que la riqueza de coreidos en el BTC mexicano es equiparable a la existente en ecosistemas considerados más biodiversos como las selvas humedas de Centro y Sudamérica. Los registros nuevos tanto para Morelos como para la REBIOSH, son evidencia de la necesidad de aumentar el conocimiento que se tiene sobre la distribución real de este grupo de Heteroptera.
La comunidad de Coreidae presenta 50% de especies con baja abundancia (1-4 individuos), 31% de especies con abundancia media (5-30 individuos) y 19% de especies muy abundantes (más de 30 individuos). Este patrón se presenta en otros grupos de insectos en la REBIOSH (Toledo-Hernández et al., 2015; Zaragoza-Caballero et al., 2003), además apoya lo propuesto por Lucky et al. (2002), quienes plantean que el porcentaje de especies con una baja abundancia en las comunidades de insectos varía entre 50 y 60% del total de especies. Los coreidos mostraron un marcado comportamiento estacional, presentaron los mayores valores de riqueza, abundancia, diversidad del orden 0Dα en la temporada húmeda y los valores del factor de uniformidad (EF0,1) y diversidad 1Dα y 2Dα durante la temporada seca. Este comportamiento estacional encuentra respaldo en el análisis de escalamiento multidimensional que muestra una clara diferenciación de las especies de coreidos presentes en las muestras de las temporadas húmeda y seca del BTC. La gráfica del NMDS nos sugiere que durante el mes de mayo ocurre la transición de la comunidad de la temporada seca a la temporada húmeda y durante los meses de noviembre y diciembre la transición entre la comunidad de la temporada húmeda a la temporada seca (fig. 4). Sin embargo, los valores de diversidad no muestran diferencias significativas entre las comunidades de las estaciones húmeda y seca más allá del número de especies (0Dα) presentes en cada una (tabla 4).
Los datos de las especies de coreidos con relación a las especies de plantas en las que se encontraron, sugieren que la mayoría de las especies de coreidos son de hábitos monófagos; sin embargo, varios estudios presentan datos adicionales de plantas huésped para varias especies de coreidos citadas en este trabajo (Maes y Goellner-Scheiding, 1993; Tepole, 2011).
Aunque los datos muestran que las especies de la familia Coreidae en el BTC presentan un comportamiento estacional ligado a la precipitación, el alto número de especies que se encuentran presentes en ambas temporadas puede ser evidencia que contradice lo anterior. Esta discrepancia de los resultados puede encontrar explicación en que las especies de esta familia presentes en ambas temporadas tienen más de una generación por año (polivoltinas, Brailovsky et al., 1994, 1995, 1998) y presentan diferentes hábitos de alimentación, encontrando especies polifagas y olifagas. Estas características otorgan a estas especies la capacidad de aprovechar diferentes plantas en diferentes momentos del año, de acuerdo a su disponibilidad (Lattin, 1995; Pérez-Contreras, 1999). Los resultados confirman la relación de la variación climática del BTC con los períodos de actividad de los coreidos, mostrando a la precipitación como el factor con mayor peso en la segregación temporal de las especies de este grupo de hábitos fitófagos. El BTC es un ecosistema de amplia distribución en México y es considerado uno de los ecosistemas más amenazados por las actividades humanas (Kegan, 2014; Miles et al., 2006), así que trabajos como este ayudan a incrementar el conocimiento sobre este complejo ecosistema y así colaborar en su conservación.











 text new page (beta)
text new page (beta)