Introducción
México es un país con una riqueza natural extraordinaria, considerado como uno de los 17 países megadiversos (Llorente-Bousquets y Ocegueda, 2008). Ese reconocimiento tiene su sustento en las 94,412 especies que han sido registradas en el territorio nacional (Martínez-Meyer et al., 2014). De ellas, 1,500 especies corresponden a un grupo de invertebrados: los anélidos poliquetos, gusanos que se distribuyen prácticamente en todos los ecosistemas bénticos marinos, donde a menudo son el componente dominante en términos de número de individuos y especies (Tovar-Hernández et al., 2014a). No obstante, los poliquetos han logrado invadir con éxito el ambiente pelágico, cuerpos de agua dulce e inclusive el medio terrestre: en el plancton 9 familias son consideradas holopláncticas exclusivas de ecosistemas pelágicos de mar abierto (Suárez-Morales et al., 2005a); aproximadamente 168 de las 15,000 especies de poliquetos conocidas en el mundo son dulceacuícolas o semiterrestres y arbóreas, propias de los bosques húmedos tropicales (Glasby y Timm, 2008; Glasby et al., 2009). El éxito del grupo se atribuye a su plan corporal metamérico, el cual es responsable de su gran variabilidad morfológica y alta diversidad funcional.
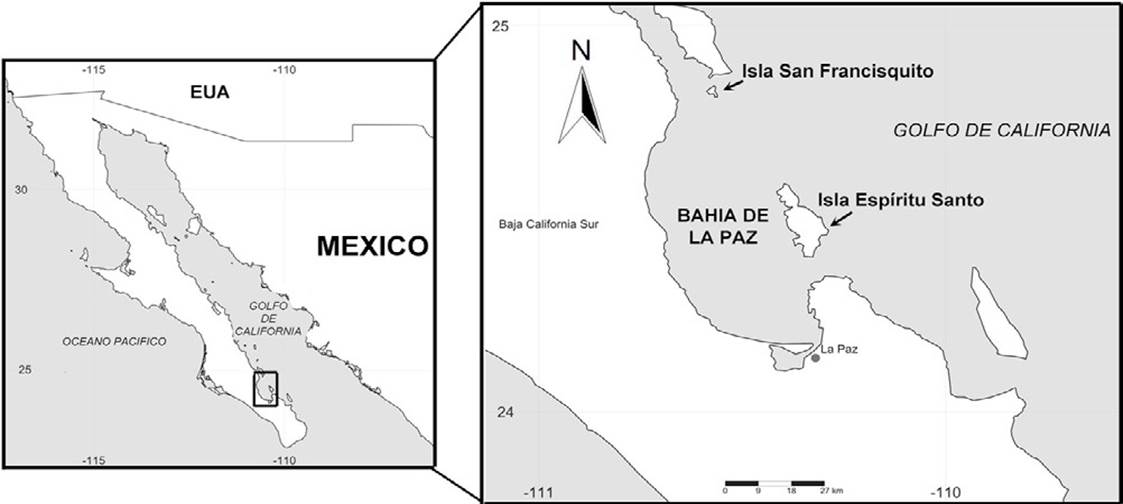
La bahía de La Paz representa el cuerpo de agua más grande dentro de la fisiografía del golfo de California, con alta diversidad de peces, mamíferos y aves marinas e invertebrados, así como gran heterogeneidad de hábitats. De acuerdo con Conabio-Conanp-TNC-Pronatura (2007), la bahía de La Paz está clasificada como un área de extrema importancia entre los 21 sitios prioritarios costeros y de margen continental no cubiertos por ningún área protegida federal, además está dentro de la Región Prioritaria Marina Complejo Insular de Baja California Sur. Contar con inventarios actualizados y validados taxonómica y geográficamente para la bahía de La Paz, contribuye al conocimiento de su biodiversidad y gestión de planes de manejo y programas de desarrollo, y con ello es posible reorientar las políticas de manejo y conservación de la biodiversidad.
El objetivo de esta contribución es conocer los poliquetos en la bahía de La Paz con base en registros históricos y registros nuevos, destacando aquellas especies que han sido descritas para la zona como localidad tipo y las registradas como introducidas.
Materiales y métodos
La bahía de La Paz se encuentra en la parte meridional de la península de Baja California, en el estado de Baja California Sur y su litoral corresponde al margen occidental dentro del golfo de California. La zona costera de la bahía se ubica dentro de las coordenadas 24°23’31.64” N, 110°29’22.3” O (Fig. 1). Su borde litoral se extiende desde Punta Mechudo, al norte, hasta Punta Las Pilitas, en el sureste. Además, está protegida al noreste por las islas Partida y Espíritu Santo, y hacia el norte por la isla San Francisquito. Su profundidad máxima es de 400-450 m (Velasco-García, 2009).
Los nuevos registros de poliquetos aquí presentados, corresponden a gusanos recolectados en el 2011 en muelles, en el casco de una embarcación y en compuertas de una granja camaronícola: Marina La Paz, Club de Yates Palmira, canal de navegación del puerto de La Paz y Granja “Acuacultores de La Paz, S.A. de C.V.” (Tabla 1). La Figuras 2 y 3 contienen fotografías de esos poliquetos en vivo, a excepción de los opérculos de un serpúlido (Fig. 2F, G) y los radiolos de sabélidos (Fig. 3B, C) que se fotografiaron después de la fijación. Para su identificación taxonómica se revisaron las descripciones originales (Hartman, 1944b; Kudenov, 1975; Tovar-Hernández y Dean, 2014) y los trabajos de Kupriyanova (1999), Bastida-Zavala (2008), Tovar-Hernández et al. (2009b), Tovar-Hernández y Carrera-Parra (2011). Las muestras fueron depositadas en la Colección Poliquetológica de la Universidad Autónoma de Nuevo León (NL-INV-0002-05-09).
Tabla 1 Sitios de recolecta recientes en la bahía de La Paz. Abreviaturas: IRS, Irving Ramírez Santana; JMAC, José María Aguilar Camacho; TFVG, Tulio Fabio Villalobos Guerrero.
| Sitio | Localidad | Sustrato | Latitud N | Longitud O | Salinidad | Recolectores | Fecha |
|---|---|---|---|---|---|---|---|
| 1 | API La Paz | Casco de embarcación | 24°16.447’’ | 110°19.852’’ | 32 | IRS, JMAC | 13/VIII/2011 |
| 2 | Marina La Paz | Muelles | 24°09.318’’ | 110°19.630’’ | 35 | IRS, JMAC | 14/VIII/2011 |
| 3 | Club de Yates Palmira La Paz | Muelles | 24°10.992’’ | 110°18.185’’ | 35 | JMAC, TFVG | 15/VIII/2011 |
| 4 | Granja camaronícola Acuacultores de La Paz, S. A. de C. V. | Compuertas | 24°14.519’ | 110°18.321’’ | 35-40 | TFVG | 16/VIII/2011 |
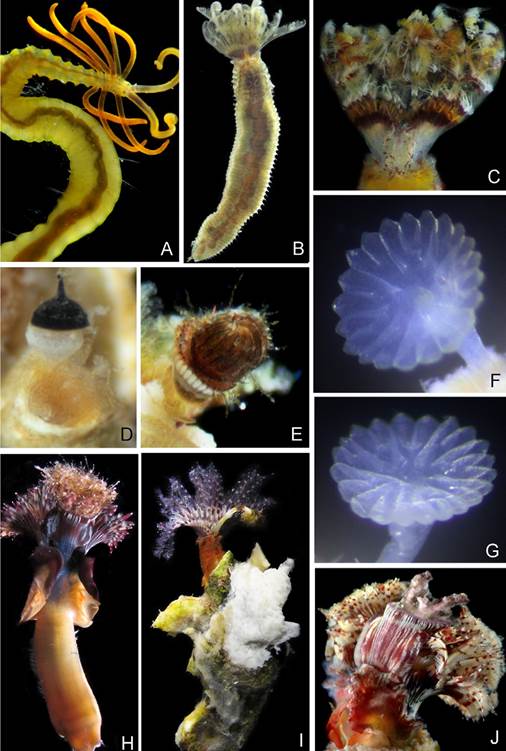
Figura 2 Poliquetos reportados en este estudio para La Paz. A) Acrocirrus incisa, B) Parasabella pallida (sin su tubo), C) Pseudobranchiomma schizogenica (sin su tubo), D) opérculo de Pseudovermilia occidentalis, E) opérculo de Hydroides similis, F, G) opérculos de Serpula sp., H) Spirobranchus incrassatus (sin su tubo), I) H. similis, J) opérculo de S. incrassatus. A-E, H-J) Fotografiados en vivo, F, G) posterior a la fijación.

Figura 3 Algunos sabélidos reportados en este estudio para La Paz. A) Acromegalomma circumspectum, B) ojos radiolares de A. circumspectum, C) Pseudopotamilla socialis.
Para el Pacífico mexicano se cuenta hoy en día con 3 compilaciones relevantes sobre gusanos poliquetos: Salazar Vallejo y Londoño-Mesa (2004), Hernández-Alcántara et al. (2008) y de León-González et al. (2009), así como un catálogo de autoridades taxonómicas de las especies de poliquetos del Pacífico mexicano y otras localidades del Pacífico oriental tropical (Salazar-Silva, 2015). A partir de esos trabajos y de la contribución de Bastida-Zavala (1993), se realizó una búsqueda, recopilación y análisis de la literatura existente hasta el 2019 sobre la poliquetofauna en la bahía de La Paz, excluyendo literatura gris (tesis, informes técnicos). Los nombres de especies válidos hoy en día, las autoridades taxonómicas y fechas, y la localidad tipo de cada especie fueron corroborados por 2 vías: en una primera aproximación usando la plataforma digital WoRMS (2019) y después cotejando las fuentes originales y revisiones taxonómicas. Los registros que cuentan con coordenadas geográficas, éstas se verificaron usando Google Earth Pro 7.3. La Tabla 3 contiene el número de géneros y especies por familia.
En el apéndice 1 se incluyen las especies de poliquetos registradas en la bahía de La Paz, agrupadas en familias y en géneros. El orden no sigue una clasificación en particular, sino que es estrictamente alfabético. Las especies marcadas con un asterisco son aquellas cuya localidad tipo se ubica en la bahía de La Paz; es decir, que fueron originalmente descritas para esa zona. Las especies denotadas con un Q son registros dudosos; las denotadas como NIS indican especies no nativas para el golfo de California. Se indica la localidad tipo (LT) de forma general para todas las especies, excepto en el caso de las especies descritas para La Paz, pues en ellas se indica el nombre de la localidad, el sustrato y la profundidad a la que fueron encontradas, tan completo como la fuente original así lo indica. Para cada una de las especies se indican las fuentes (s) de los registros (autor, año y páginas donde se reporta la especie). Aunque en algunos estudios los espirórbidos se consideran una familia independiente, se incluyen dentro de Serpulidae de acuerdo con Bastida-Zavala (2009). En algunos casos se indican comentarios particulares y sus respectivas citas fueron incluidas en la sección de referencias.
Resultados
En este estudio se revisaron 1,079 ejemplares asociados a sustratos de origen antropogénico en la bahía de La Paz (muelles, casco de embarcación y compuertas de una granja camaronícola) (Tablas 1, 2). Dichos ejemplares pertenecen a 9 especies de poliquetos agrupadas en 3 familias: Acrocirrus incisaKudenov, 1975 (Fig. 2A), Acromegalomma circumspectum (Moore, 1923) (Fig. 3A-B), Parasabella pallida Moore, 1923 (Fig. 2B), Pseudobranchiomma schizogenicaTovar-Hernández y Dean, 2014 (Fig. 2C), Pseudopotamilla socialisHartman, 1944b (Fig. 3C), Serpula sp. (Fig. 2F, G), Spirobranchus incrassatus Krøyer en Mörch, 1863 (Fig. 2H, J), Hydroides similis (Treadwell, 1929) (Fig. 2E, I) y Pseudovermilia occidentalis (McIntosh, 1885) (Fig. 2D).
Tabla 2 Especies de poliquetos registradas a partir de muestreos recientes en este estudio, para la bahía de La Paz. Nota: las familias y/o especies marcadas con un asterisco constituyen nuevos registros para la zona.
| Especies de poliquetos |
|---|
| *Familia Acrocirridae Banse, 1969 |
| *Acrocirrus incisaKudenov, 1975: sitio 1, embarcación, R1, 2 ej. sitio 3, muelle 6, R1, 1 ej. sitio 3, muelle 6, R2, 5 ej. Familia Sabellidae Latreille, 1825 |
| Acromegalomma circumspectum (Moore, 1923): sitio 3, muelle 3, R1, 1 ej. sitio 3, muelle 6, R1, 1 ej. |
| *Parasabella pallida Moore, 1923: sitio 1, embarcación, R1, 2 ej. sitio 1, embarcación, R2, 1 ej. sitio 2, muelle 3, R1, 1 ej, sitio 4, granja camaronícola, 1 ej. |
| Pseudobranchiomma schizogenicaTovar-Hernández y Dean, 2014: sitio 1, embarcación, R1, 83 ej. sitio 1, embarcación, R2, 106 ej. sitio 2, muelle 2, R1, 16 ej. sitio 2, muelle 2, R2, 43 ej. sitio 3, muelle 3, R2, 126 ej. sitio 3, muelle 6, R1, 628 ej. |
| *Pseudopotamilla socialisHartman, 1944: sitio 1, embarcación, R1, 2 ej. sitio 1, embarcación, R2, 9 ej. sitio 2, muelle 3, R1, ej. Familia Serpulidae Rafinesque, 1815 |
| *Serpula sp. : sitio 3, muelle 6, R1, 25 ej. |
| Spirobranchus incrassatus Krøyer in Mörch, 1863: sitio 1, embarcación, R1, 2 ej. sitio 2, muelle 3, R1, 1 ej. sitio 2, muelle 3, R2, 1 ej. sitio 2, muelle 3, R2, 10 ej. |
| Hydroides similis (Treadwell, 1929): sitio 2, muelle 3, R1, 1 ej. sitio 2, muelle 3, R2, 1 ej. sitio 3, muelle 6, R1, 1 ej. |
| Pseudovermilia occidentalis (McIntosh, 1885): sitio 2, muelle 2, R2, 1 ej. sitio 3, muelle 6, R1, 8 ej. |
De esas especies, 4 constituyen nuevos registros: A. incisa, P. pallida, P. socialis y Serpula sp. Este último serpúlido no pudo identificarse a especie, pues presenta caracteres que no se ajustan del todo a las especies conocidas para el Pacífico oriental y reportadas por Bastida-Zavala (2008): S. columbiana Johnson, 1901, S. cf. hartmanae Reish, 1968 y S. cf. watsoni Willey, 1905. Los ejemplares de La Paz presentan 16-26 radios; 18-21 radios en S. cf. hartmanae; 37-47 radios en S. cf. watsoni; 16-26 en material tipo de S. columbiana reportado por Kupriyanova (1999: 55-160) o 114-145 en ejemplares reportados por Bastida-Zavala (2008). Sin embargo, ya Kupriyanova (1999) y ten Hove y Kupriyanova (2009) han alertado sobre la alta variabilidad del número de radios operculares en Serpula, debida probablemente, a la ontogenia o a las diferencias poblacionales de las especies. Los ejemplares de La Paz se asemejarían más a S. cf. hartmanae Reish, 1968 que a las otras 2 especies con base en el número de radios. No obstante, la profundidad del embudo es mayor en S. cf. hartmanae (tan profundo como 2 veces el diámetro del opérculo), mientras que en los ejemplares de La Paz el embudo es más corto (tan profundo como el diámetro del opérculo). Por lo anterior, no se puede determinar fehacientemente la identidad de la especie, pues podría tratarse de alguna especie no descrita.
Para bahía de La Paz se han registrado 287 especies de gusanos poliquetos pertenecientes a 156 géneros y 37 familias (Tabla 3). Las 6 familias con el mayor número de especies registradas para la bahía de La Paz son: Sabellidae (25), Syllidae (23), Serpulidae (22), Nereididae (22), Polynoidae (18) y Capitellidae (17), que en conjunto constituyen 49.8% de las especies (Tabla 3).
Tabla 3 Familias, géneros y especies registrados en la bahía de La Paz.
| Géneros | Especies | |
|---|---|---|
| Acoetidae | 1 | 2 |
| Acrociriidae | 1 | 1 |
| Amphinomidae | 5 | 7 |
| Aphroditidae | 1 | 1 |
| Capitellidae | 8 | 17 |
| Chaetopteridae | 3 | 3 |
| Chrysopetalidae | 2 | 4 |
| Cirratulidae | 6 | 8 |
| Ctenodrilidae | 1 | 1 |
| Dorvilleidae | 2 | 6 |
| Eunicidae | 5 | 16 |
| Euphrosinidae | 1 | 2 |
| Flabelligeridae | 4 | 9 |
| Glyceridae | 1 | 4 |
| Goniadidae | 1 | 1 |
| Hesionidae | 3 | 7 |
| Lumbrineridae | 3 | 11 |
| Maldanidae | 2 | 2 |
| Nepthyidae | 3 | 8 |
| Nereididae | 11 | 22 |
| Oenonidae | 3 | 5 |
| Onuphidae | 7 | 14 |
| Opheliidae | 3 | 4 |
| Orbiniidae | 3 | 3 |
| Oweniidae | 1 | 1 |
| Paraonidae | 3 | 5 |
| Pectinariidae | 1 | 1 |
| Phyllodocidae | 4 | 4 |
| Pilargidae | 1 | 1 |
| Polynoidae | 10 | 18 |
| Sabellariidae | 1 | 1 |
| Sabellidae | 11 | 25 |
| Serpulidae | 12 | 22 |
| Sigalionidae | 5 | 8 |
| Spionidae | 5 | 5 |
| Syllidae | 9 | 23 |
| Terebellidae | 13 | 15 |
| Totales | 156 | 287 |
La primera especie reportada y descrita para La Paz fue el gusano escamoso Lepidasthenia diguetiGravier, 1905. Después, Berkeley y Berkeley (1939), Hartman (1939, 1940), Steinbeck y Ricketts (1941), Fauvel (1943) y Rioja (1947a, b) reportaron varias especies de poliquetos para la región.
En la segunda mitad del siglo XX se publicaron la mayoría de los registros de especies de poliquetos conocidas para la bahía de La Paz: Rioja (1963) registró varias especies para La Paz y Knight-Jones (1978) 2 espirórbidos. En la década de 1980, los trabajos de SalazarVallejo (1987b) y Salazar-Vallejo et al. (1987) registraron una especie de pilárgido y un neréidido, respectivamente. La década de 1990 cuenta con los trabajos de Bastida-Zavala (1991, 1993, 1994), Hernández-Alcántara y SolísWeiss (1991) y de León-González y Solís-Weiss (1998).
El inicio del siglo XXI se caracterizó por la publicación de revisiones taxonómicas en varias familias o géneros y sus respectivos registros en las islas Espíritu Santo, Partida y San Francisquito (Hernández-Alcántara et al., 2003) y en la bahía de La Paz. Bastida-Zavala y ten Hove (2003) revisaron las especies del género Hydroides (Serpulidae) registradas previamente por Bastida-Zavala (1993); Tovar-Hernández (2007) registró un sabélido cónido; Bastida-Zavala (2008) registró especies de Hydroides, Pomatoceros y Pseudovermilia (Serpulidae). La familia Capitellidae ha sido muy bien estudiada en la región por García-Garza (2011) y García-Garza y de León-González (2009, 2011, 2015), quienes informaron de 12 especies pertenecientes a varios géneros. Góngora-Garza et al. (2011) registraron un sílido Branchiosyllis; Salazar-Vallejo (2011, 2012) informó de 4 especies de flabeligéridos (Flabelligeridae); Tovar-Hernández y Carrera-Parra (2011) registraron 2 especies de Acromegalomma (Sabellidae); Tovar-Hernández y Dean (2014) divulgaron sobre una especie de Pseudobranchiomma (Sabellidae) que se reproduce por esquizogamia; Bastida-Zavala et al. (2016) registraron 3 especies de sabélidos y 11 de serpúlidos en marinas de la bahía de La Paz, y Salazar-Vallejo (2018) en su revisión mundial de Hesione, reporta H. panamena Chamberlin, 1919 (apéndice 1).
En un estudio ecológico sobre poliquetos de la península de Baja California en fondos blandos, Hernández-Alcántara et al. (2017) mencionan que una de las estaciones de muestreo ubicada en la bahía de La Paz presentó el valor más alto de densidad, representado por 22 especies. Aunque en la publicación no se enlistan los nombres de dichas especies por la naturaleza propia del artículo, en el texto indican las más representativas de la zona: el glicérido Glycera lapidum de Quatrefages, 1866, el capitélido Notomastus magnus Hartman, 1947, el néftido Aglaophamus verrilli (McIntosh, 1855), el lumbrinérido Scoletoma zonata (Johnson, 1901) y el paraónido Cirrophorus furcatus (Hartman, 1957).
En un estudio reciente, Cuéllar-Mercado et al. (2019) estudiaron la composición, riqueza y diversidad de poliquetos en la bahía de La Paz recolectados entre los 46 y 208 metros de profundidad. Dicho trabajo reporta la presencia de 26 especies en bahía de la Paz (más 2 especies determinadas solo a nivel de género).
Se describieron 20 especies de poliquetos para la bahía de La Paz (apéndice 1); sin embargo, hoy en día, 3 de ellas no se consideran válidas: 1) Euclymene papillata isocirra Rioja, 1962, descrito para la isla de la Gaviota y en el Mogote, sinonimizado con Isocirrus papillatus (Berkeley y Berkeley, 1939) fideSalazar-Vallejo (1991: 273). 2) Eunoe exoculata Treadwell, 1923, descrito para Pichilingue a 855 m fue sinonimizado con Harmothoe tenebricosa Moore, 1910 fidePettibone (1969: 37). 3) Vermiliopsis cornutaRioja, 1947b: descrito para Coromuel, fue sinonimizado con Pseudovermilia occidentalis (McIntosh, 1855) fideZibrowius (1971: 1374).
De las especies descritas para La Paz, 11 no cuentan con registros posteriores. De ellas, 5 fueron establecidas en la última década (Perinereis bajacalifornicade León-González y Solís-Weiss, 1998; Branchiosyllis sanmartini Góngora-Garza, García-Garza y de León-González, 2011; Semiodera tovaraeSalazar-Vallejo, 2012, Notomastus fauchaldiGarcía-Garza y de León-González, 2015 y Websterinereis pettiboneaede León-González y Balart, 2016), por lo que es probable que la falta de registros obedezca a falta de identificación de muestras acumuladas en los laboratorios y colecciones, lo cual es un fenómeno común en el estudio de los poliquetos y otros invertebrados.
Paleanotus purpureaRioja, 1947a, no ha sido reportada para La Paz después de su establecimiento, pero fue reportada recientemente en Oaxaca y Guerrero (Cruz-Gómez y Bastida-Zavala, 2018). Existen 2 especies de espirórbidos que desde su nominación en 1978 no se han vuelto a reportar (Pileolaria lateralisKnight-Jones, 1978 y Pileolaria spiniferKnight-Jones, 1978). La razón quizá tenga que ver con que en México no hay un taxónomo especialista en esa subfamilia, pues los espirórbidos, aunque muy pequeños, son muy frecuentes en La Paz y de fácil muestreo, pues se encuentran adheridos a diferentes superficies bióticas o abióticas en la zona de intermarea.
Además de esas especies, hay 3 más que fueron descritas para bahía de La Paz en la primera mitad del siglo XX y desde entonces no se han vuelto a reportar. De ellas, el gusano escamoso Lepidasthenia digueti presenta una asociación ecológica interesante, es un comensal de un balanogloso y junto con el camarón mantis Alachosquilla digueti, son inquilinos de las galerías del hemicordado (Coutière, 1905). La relación simbiótica y la falta de registros del polinoido en otras provincias biogeográficas podrían sugerir la presencia de endemismo en el sur del golfo de California. Por su parte, el espiónido Aonides californiensisRioja, 1947b fue encontrado entre fragmentos de coral muerto Porites. Bastida-Zavala (1995) trabajó los poliquetos asociados a coral muerto Pocillopora en Cabo Pulmo-Los Frailes sin reportar la presencia de A. californiensis, por lo que el espiónido podría ser habitante específico de Porites o endémico. Finalmente, el terebélido Polycirrus mexicanusRioja, 1947b hallado sobre conchas de moluscos no ha sido reportado de nuevo, esto obedece a que no ha habido revisiones taxonómicas de Terebellidae para el Pacífico mexicano, pues una buena cantidad de muestras de ejemplares para La Paz, están a la espera de análisis y estudio.
En la bahía de La Paz se encuentran 2 de las principales vías de entrada de especies exóticas en el medio acuático: el tráfico de embarcaciones (agua de lastre y bioincrustantes o “fouling”) y la acuicultura (Tovar-Hernández et al. 2014b). Por su relevancia ecológica, resultan de gran interés los registros de 5 especies de poliquetos introducidos en bahía de La Paz de los que a continuación se informa:
Branchiomma bairdi (McIntosh, 1885). El plumero verde B. bairdi, es un poliqueto sabélido tubícola exótico invasor en varias localidades del golfo de California (Tovar-Hernández et al., 2009a, b, 2012, 2014b). Para la bahía de La Paz se registró en un sitio natural asociado a rocas en la playa Balandra y en sitios perturbados sobre sustratos de origen antropogénico: en la API La Paz la especie se encuentra adherida a boyas de señalización marítima y en cascos de embarcaciones; en Marina La Paz y Club de Yates Palmira se encuentra adherida a los muelles y estructuras sumergidas; en las granjas camaronícolas “Camarón sureño” y “Acuacultores de La Paz” la especie se encuentra adherida a compuertas y pilotes de madera (Tovar-Hernández et al., 2012, 2014b). Las imágenes e información detallada de la especie (generalidades, distribución, ambiente, historia natural, antecedentes de la introducción e impactos), así como un análisis de riesgo, se encuentran en Tovar-Hernández y Yáñez-Rivera (2012a) y Tovar-Hernández et al. (2012). Este sabélido invasor es probablemente el más registrado en los últimos años para varias localidades del mundo, incluyendo el Pacífico mexicano, todas las áreas del mar Mediterráneo, las islas Canarias y Madeira y Australia (Bastida-Zavala et al., 2016; del Pasqua et al., 2018; Keppel et al., 2015). A pesar de su potencial invasor, no fue incluido en el acuerdo por el que se determina la lista de las especies exóticas invasoras para México (DOF-2016), pero al ser éste un instrumento que debe ser actualizado frecuentemente en la medida que se genere nuevo conocimiento, se espera que esta contribución sirva para ello.
Ficopomatus miamiensis (Treadwell, 1934), es un serpúlido exótico invasor en varias localidades de Mazatlán (Salgado-Barragán et al., 2004; Tovar-Hernández et al., 2009b) pero no fue incluido en el acuerdo por el que se determina la lista de las especies exóticas invasoras para México (DOF-2016). Para la bahía de La Paz, se registró en la granja camaronícola “Camarón sureño” en el 2011, pero de acuerdo con información del gerente de producción y del Comité Estatal de Sanidad Acuícola de Baja California Sur, la especie de detectó por primera vez en 2009, observando la mayor densidad de este gusano en abril (Tovar-Hernández et al., 2012, 2014b). Las imágenes e información detallada de la especie, así como un análisis de riesgo se encuentran en Tovar-Hernández y YáñezRivera (2012b) y Tovar-Hernández et al. (2012).
Hydroides diramphus (Mörch, 1863). Es un serpúlido exótico en Guaymas, Sonora (Tovar-Hernández et al., 2014b) y en varias localidades de la bahía de La Paz: en sustratos mixtos de las playas Caimancito (Bastida-Zavala, 1993) y Coromuel (Bastida-Zavala y ten Hove, 2003), y en el Club de Yates Palmira asociado a muelles (Tovar-Hernández et al., 2014b). No cuenta con un análisis de riesgo pero está incluido en el acuerdo por el que se determina la lista de las especies exóticas invasoras para México (DOF-2016). En Tovar-Hernández et al. (2012) se encuentran imágenes e información detallada de la especie.
Hydroides elegans (Haswell, 1883). Es un serpúlido exótico potencialmente invasor en varias localidades del golfo de California: Mazatlán, Topolobampo y Guaymas (Tovar-Hernández et al., 2009b, 2012, 2014b). En la bahía de La Paz fue registrada en una placa de PVC sumergida en Pichilingue (Bastida-Zavala, 2008), durante un mes con una cobertura de 85-90%, +1,000 individuos (Bastida-Zavala, 2008); en la API La Paz (en boyas de señalización marítima, densidad promedio 48 ind/m2) y en muelles del Club de Yates Palmira (152 ind/m2) (Tovar-Hernández et al., 2014b). No cuenta con un análisis de riesgo pero está incluido en el acuerdo por el que se determina la lista de las especies exóticas invasoras para México (DOF-2016). En Tovar-Hernández et al. (2012) se encuentran imágenes e información detallada de la especie.
Hydroides sanctaecrucis Krøyer en Mörch, 1863. Esta especie se registró como exótica en Guaymas y Topolobampo (Tovar-Hernández et al., 2012, 2014b) y en una marina de la bahía de La Paz (Marina La Paz asociado a muelles en una densidad de 4 ind/m2) (Tovar-Hernández et al., 2014b). No cuenta con un análisis de riesgo ni fue incluido en el acuerdo por el que se determina la lista de las especies exóticas invasoras para México (DOF-2016). En Tovar-Hernández et al. (2012) se encuentran imágenes e información detallada de la especie.
Además de esas 5 especies no nativas (NIS), 2 capitélidos (Notomastus hemipodus Hartman, 1945 y N. polyodon Gallardo, 1968), 4 sabélidos [Branchiomma cingulatum (Grube, 1870), B. nigromaculatum (Baird, 1865), Pseudobranchiomma punctata (Treadwell, 1906) y Sabellastarte spectabilis (Grube, 1878)], 1 serpúlido (Pseudovermilia occidentalis [McIntosh, 1885)] y 1 sílido (Myrianida pachycera Augener, 1913) fueron catalogados como NIS? en el apéndice 1.
Discusion
La bahía de La Paz es un destino turístico de gran importancia económica para el estado de Baja California Sur, que cuenta con una amplia diversidad de ambientes marinos idóneos para el establecimiento de diversas poblaciones de invertebrados marinos. De acuerdo con Bastida-Zavala (1993), la bahía de La Paz está relativamente bien estudiada en términos de poliquetos, debido por un lado, al trabajo de investigación sobre estos organismos y por el otro, a la gran variedad de ambientes que existen en ella y que incluyen playas arenosas, rocosas, manglares y formaciones coralinas.
En comparación con otro destino portuario y turístico como lo es Mazatlán, donde 320 especies de gusanos han sido registradas (Villalobos-Guerrero y MolinaAcevedo, 2014), la bahía de La Paz presenta una riqueza de poliquetos de 287 especies. No obstante, de las 287 especies, 132 (46%) son especies cuyos registros se consideran cuestionables (apéndice 1), debido a que en los años en que se registraron, la literatura disponible incorporaba nombres de especies del Ártico, del Índico, del Mediterráneo, o del Polo Sur, y de localidades tan remotas como Groenlandia o el estrecho de Magallanes, por decir solo algunos ejemplos. Esto provocaba que muchas de las especies de poliquetos fueran consideradas “cosmopolitas” o de amplia distribución, sin serlo.
Por ejemplo, el eunícido Marphysa sanguinea Montagu, 1815, descrito para el sur de Inglaterra y registrado en la bahía de La Paz, fue por muchos años considerado una especie cosmopolita. En el 2003, Hutchings y Karageorgopoulus designaron un neotipo de M. sanguinea, proporcionando una descripción completa de la especie, además de información detallada sobre su biología reproductiva. Comprobaron que la especie registrada como M. sanguinea en Australia en realidad se trataba de una nueva especie, sugiriendo que todos los registros de M. sanguinea fuera de su localidad tipo deberían reexaminarse, pues podrían ser incorrectos. Siguiendo este razonamiento y con la finalidad de resolver los problemas taxonómicos en el género, el uso de nuevas estructuras para diferenciar especies, tales como el aparato maxilar, los lóbulos parapodiales, los cirros ventrales y las setas en forma de pectinas, fueron incorporados por Molina-Acevedo y Carrera-Parra (2015), quienes reestablecieron 3 especies del Caribe que habían sido sinonimizadas con M. sanguinea y enfatizaron, también, que los registros de M. sanguinea en el Caribe son dudosos y corresponderían a otras especies, como se comprobó más tarde (Molina-Acevedo y Carrera-Parra, 2017). Bajo este contexto, los registros de M. marphysa para la bahía de la Paz podrían corresponder a una especie no descrita.
Este ejemplo resume la tendencia que hay en el estudio taxonómico de los poliquetos en las últimas 2 décadas en todo el mundo, misma que consiste en hacer revisiones meticulosas de familias o géneros de poliquetos, incorporando además, el uso de herramientas moleculares. Este tipo de estudios en cualquier familia de poliquetos permitirán corregir identificaciones erróneas del pasado e identificando discriminadores morfológicos de mayor validez, lo que resultará en una reidentificación de las especies y actualización de los nombres. Se espera que esa tendencia permita corroborar o corregir los registros de los poliquetos en la bahía de La Paz, pues las herramientas taxonómicas están en constante evolución.
De hecho, algunos nombres específicos han sido corregidos, como el caso de Hydroides brachyacanthus y Pseudovermilia conchata, registradas con estos nombres para la bahía de La Paz por Bastida-Zavala (1993), pero revisados y corregidos como H. similis y P. occidentalis, respectivamente (Bastida-Zavala y ten Hove, 2003; Bastida-Zavala, 2008).
La bahía de La Paz, como todos los destinos portuarios de México, se enfrenta a la problemática de las especies invasoras. La Paz es uno de los puertos más importantes del Pacífico mexicano debido a su actividad comercial, pesquera y turística nacional e internacional, y la probabilidad de que la biota marina exótica ingrese al puerto vía las incrustaciones de embarcaciones, en el agua de lastre o asociada a las prácticas de acuicultura, es sumamente alta. Hasta la fecha, se ha reportado la presencia de por lo menos 20 especies introducidas en la bahía de la Paz: 7 especies de poliquetos (Tovar-Hernández et al., 2014b; Bastida-Zavala et al., 2016), 1 macroalga (Riosmena et al., 2014), 2 briozoos, 1 crustáceo, 4 esponjas y 5 ascidias (Tovar-Hernández et al., 2014b). En contraste, en los puertos de Mazatlán y Topolobampo (Sinaloa) se han reportado en conjunto 30 especies de invertebrados introducidos (Tovar-Hernández et al. 2012). No obstante, para fines de manejo y conservación, no basta con la detección de dichas especies. Es urgente estimar los descriptores ecológicos de las especies introducidas, establecer su monitoreo ecológico y determinar su comportamiento e impactos en la comunidad nativa.
A excepción de los registros de Hernández-Alcántara et al. (2017) y Cuéllar-Mercado et al. (2019) provenientes de dragados, los poliquetos registrados para la bahía de La Paz provienen de las zonas intermareal y sublitoral somera; asimismo, no existen registros de poliquetos pelágicos. La mayoría de las especies fueron recolectadas en fondos arenosos o rocosos, en raíces de mangle, asociados a conchas de moluscos, algas coralinas y recientemente, en sustratos de origen antrópico como muelles, cascos de embarcaciones, boyas de señalamiento marítimo y otro tipo de estructuras sumergidas en la zona portuaria, en marinas y en granjas de producción camaronícola (Tovar-Hernández et al., 2014b; este estudio).
Por todo lo anterior, resulta fundamental fortalecer el trabajo de las instituciones que están dedicadas a descubrir y describir la riqueza y la biodiversidad de la bahía de La Paz, en hábitats como los arrecifes coralinos, pastos marinos y manglares, los cuales son muy vulnerables y presentan menos resiliencia ante el cambio climático, la contaminación, las enfermedades, las especies invasoras y los efectos en cascada producidos por la sobrexplotación de los recursos marinos; asimismo, los estudios futuros deben incluir poliquetos pelágicos y de zonas profundas. De esta manera, se tendrá una mejor representación de la biodiversidad de poliquetos en la bahía de La Paz. Finalmente, se espera que esta información sirva para estimular el estudio detallado de los poliquetos nativos en la región y alertar a ecólogos y tomadores de decisiones sobre la presencia de especies introducidas en la bahía de La Paz, para con ello, contribuir con la generación de conocimiento útil que sirva para el manejo y conservación de su biodiversidad.











 nueva página del texto (beta)
nueva página del texto (beta)