Introducción
Coscinodiscus Ehrenberg, 1839 constituye uno de los géneros más importantes dentro de las diatomeas centrales debido a su gran diversidad y complejidad morfológica (Round et al., 1990). Se han registrado 152 especies aceptadas taxonómicamente (Guiry y Guiry, 2018), de las cuales la mayoría de los representantes se encuentran en hábitats marinos.
La identificación morfológica de estos organismos se basa en características presentes en su estructura externa denominada frústula (Fryxell y Hasle, 1995; Round et al., 1990). La estructura básica de las areolas formadas por un foramen interno y un cribrum externo (Hasle y Syvertsen, 1996; Round et al., 1990) es una característica que define al género, además de la presencia de pórtulas (microrimopórtulas y macrorimopórtulas) sobre la superficie valvar.
Se ha señalado que los caracteres diagnósticos de las especies de Coscinodiscus son las dimensiones (ejes apical y pervalvar), así como la posición y distancia de macrorimopórtulas y microrimopórtulas del anillo marginal, la presencia de microrimopórtulas sobre la valva, y el arreglo y la densidad areolar en diferentes zonas de la superficie valvar (Hasle y Lange, 1992; Hasle y Syvertsen, 1996; Round et al., 1990).
A pesar de que la mayoría de las especies del género pertenecen al microplancton, la identificación de especies no es sencilla dado que ésta se basa en los detalles de la frústula (Hasle y Syvertsen, 1996; Kraberg et al., 2010). Para facilitar la observación de los detalles y clarificar los caracteres morfológicos diagnósticos, se requiere de técnicas para el tratamiento de las frústulas, así como de técnicas de microscopía que permitan observar dichos caracteres (Round et al., 1990). El entendimiento de la estructura de la frústula llevó a la creación de diferentes géneros a partir de Coscinodiscus (Round et al., 1990) e incluso en recientes décadas la clarificación de la morfología ha llevado a la instauración de más géneros como Coscinodiscopsis (Sar y Sunesen, 2008).
Muchas de las especies de Coscinodiscus son indicadoras ambientales de condiciones ricas en nutrientes (Fernandes et al., 2001; Fryxell y Hasle, 1995) y algunas son consideradas especies formadoras de florecimientos algales nocivos como es el caso de Coscinodiscus wailesii Gran et Angst 1931 (Manabe e Ishio, 1991; Sunesen et al., 2009). Por lo que su importancia ecológica queda de manifiesto al participar en procesos importantes dentro de la dinámica del plancton.
En Veracruz se encuentra uno de los complejos arrecifales más importantes del golfo de México: el Sistema Arrecifal Veracruzano. Este sistema de arrecifes constituye un área natural protegida bajo la denominación de Parque y está formada por 23 arrecifes que albergan una gran diversidad de organismos (DOF, 2012). En el Parque Nacional Sistema Arrecifal Veracruzano (PNSAV) se han realizado algunos estudios de fitoplancton marino que han generado conocimiento sobre su diversidad (Rodríguez- Gómez et al., 2015), pero aún existe un desconocimiento de la flora que constituye dicha comunidad. Okolodkov et al. (2011) realizaron un estudio de la comunidad planctónica del PNSAV en donde identificaron 152 diatomeas, de las cuales 5 especies correspondieron al género Coscinodiscus: C. centralis Ehrenberg, 1844, C. granii L. F. Gough 1905, C. cf. marginatus Ehrenberg, 1843, C. radiatus Ehrenberg, 1840 y C. wailesii. Este número de especies representa 15% de las especies de Coscinodiscus registradas para el golfo de México (Krayesky et al., 2009), lo que pone de manifiesto la necesidad de realizar estudios detallados de la composición florística del fitoplancton en el PNSAV.
El propósito de este trabajo fue hacer un estudio detallado de las frústulas de las especies del género Coscinodiscus del PNSAV para la delimitación precisa de las especies, bajo la hipótesis de que habría un incremento en el número de especies conocidas para la región. El estudio se basó en la observación de los Coscinodiscus en 154 muestras fitoplanctónicas que forman parte de la colección de fitoplancton marino del Laboratorio de Ecología Experimental del Instituto de Ciencias Marinas y Pesquerías de la Universidad Veracruzana, que representan espacialmente al PNSAV, así como los cambios estacionales a lo largo de 1 año. Como parte del resultado de la identificación, se elaboraron descripciones morfológicas detalladas con evidencias iconográficas.
Materiales y métodos
El estudio se realizó dentro del polígono del PNSAV, ubicado al suroeste del golfo de México en la zona central de Veracruz, entre las coordenadas 19°01’16” - 19°15’32” N, 95°46’55” - 96°’45” O , el cual abarca 3 localidades: Veracruz, Boca del Río y Alvarado (fig. 1). Esta zona está influenciada por las desembocaduras de los ríos Papaloapan, La Antigua y Jamapa. Este último es un divisor natural en la parte central del parque (DOF, 2012).
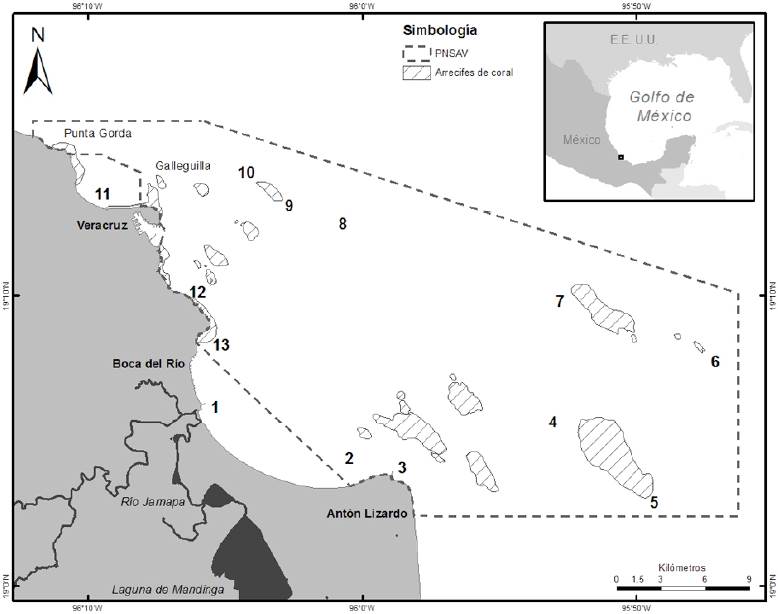
Figura 1 Localización de las estaciones de muestreo de fitoplancton dentro del PNSAV: 1) Jamapa, 2) Antón Lizardo norte, 3) Antón Lizardo sur, 4) norte Cabezo, 5) norte Anegada de Afuera, 6) centro, 7) sur Anegada de Adentro, 8) norte Anegada de Adentro, 9) playa norte, 10) sur plaza de la Soberanía y 11) Mocambo.
El muestreo de fitoplancton se realizó con arrastres horizontales circulares usando una red de 30 µm en 11 sitios a lo largo de la poligonal del PNSAV. Los muestreos se realizaron mensualmente en el período de enero 2011 a febrero 2012. Todas las muestras se fijaron con formaldehído a una concentración final de 4%.
La identificación de especies del género Coscinodiscus se realizó a través de microscopía fotónica utilizando diferentes aumentos. Las observaciones se realizaron con un microscopio de contraste de fase (Motic modelo BA- 300). La identificación del género se realizó observando los ejemplares de diatomeas céntricas con morfotipo de “tambor” o “moneda” a diferentes aumentos; cuando no fue posible discernir si se trataba del género, se seleccionaron las muestras para un tratamiento posterior de limpieza de frústulas.
El estudio de las especies se realizó con observaciones tanto de preparaciones en fresco como permanentes. Para la observación de preparaciones en fresco se tomó una alícuota de la muestra de fitoplancton y se colocaron 3 gotas sobre un portaobjetos limpio. Se hicieron observaciones en campo claro buscando las formas céntricas para la determinación posible del género. La observación para cada muestra se repitió n veces, hasta que 3 observaciones seguidas resultaban en el registro de especies ya observadas o identificadas para garantizar el registro de la mayor diversidad de las especies de interés. Adicionalmente, se contaron los cloroplastos haciendo enfoques en diferentes planos hasta donde la distancia de trabajo lo permitió, por lo que las cuantificaciones son valores aproximados.
Para la limpieza de las frústulas se utilizó el método de limpieza ácida propuesto por Hasle (1978) y se realizó un montaje en laminilla permanente, utilizando resina sintética (Sigma IR = 1.49-1.5) como medio de montaje. Dichas preparaciones se observaron al microscopio fotónico utilizando iluminación de campo claro y contraste de fases.
Se tomaron fotografías con una cámara digital (Leica D-Lux 3) de las células fijadas y frústulas limpias de las diferentes especies. Las imágenes se contrastaron utilizando el programa Photoshop 7.0 versión 2008. Las descripciones de las especies se realizaron de acuerdo con la terminología propuesta por Navarro (2009).
Descripciones
Coscinodiscus asteromphalus Ehrenberg, 1844 (figs. 2-5)
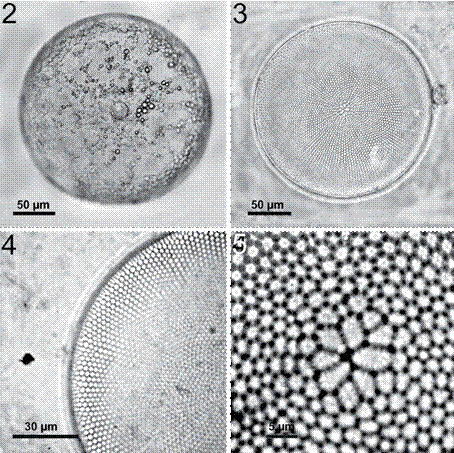
Figura 2-5 Coscinodiscus asteromphalus. 2, Preparación en fresco, mostrando la disposición de los cloroplastos concentrados en la zona marginal; 3, preparación permanente, valva limpia, mostrando el detalle de la roseta central y el patrón radial areolar; 4, detalle de la zona media y marginal de la valva mostrando el patrón areolar radial; 5, detalle de la roseta central conformada por 10 areolas.
Células solitarias con valvas circulares y superficie convexa. El diámetro varía de 180 a 260 μm (figs. 2, 3). Las areolas son de forma hexagonal dispuestas radialmente (fig. 3). La densidad areolar en 10 μm varía debido a la heterogeneidad del tamaño de éstas: 5-6 areolas en el margen, 4-5 areolas en la zona media y 5-6 areolas en la zona central (fig. 4). Presenta 1 o 2 microrimopórtulas en el margen en 10 μm y entre ellas se presentan de 5-6 areolas. No hay microrimopórtulas dispersas sobre la valva. La roseta central es muy evidente incluso a bajos aumentos (objetivo de 10×) y se compone de aproximadamente 10 areolas (figs. 3, 5). En el margen de las areolas son evidentes pequeños puntos. Las células tienen más de 200 cloroplastos localizados en su mayoría hacia el manto y el cíngulo (fig. 2).
Resumen taxonómico
Referencias bibliográficas: Brooks, 1975b, p. 19, Lám. I; Hasle y Syvertsen, 1996, p. 104, Lám. 15; Hernández- Becerril, 2000, p. 8, figs. 2-6; Hilaluddin et al., 2010, p. 33, fig. 3; Moreno et al., 1996, p. 54, Lám. 16, fig. 17.
Comentarios taxonómicos
Puede llegar a confundirse con Coscinodiscus wailesii por la roseta central, pero la principal diferencia entre las 2 especies, es la presencia de microrimopórtulas sobre la valva en C. wailesii. Por otro lado, todas las areolas de C. asteromphalus presentan pequeños puntos en la periferia, mientras que en C. wailesii los puntos solo están presentes en las areolas de la roseta central. Además C. asteromphalus en vista cingular es más delgada en comparación con C. wailesii.
Coscinodiscus centralis Ehrenberg, 1844 (figs. 6-9)
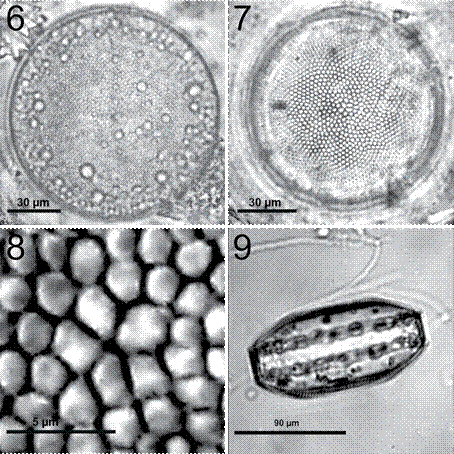
Figura 6-9 Coscinodiscus centralis. 6, Célula completa en preparación en fresco; 7, preparación permanente, frústula limpia mostrando el patrón areolar radial y la roseta central; 8, detalle de la roseta central con 6 areolas ligeramente más grandes; 9, vista cingular mostrando la altura del manto, en preparación en fresco.
Células solitarias con valvas circulares y superficie convexa con el centro ligeramente deprimido. El diámetro de las células es de 70 a 140 μm (figs. 6, 7). Las areolas son muy pequeñas, pero hacia el margen son ligeramente más grandes y se encuentran dispuestas en un patrón excéntrico (fig. 7). La densidad areolar en 10 μm es de 4-5 areolas en el margen y 3-4 areolas en la superficie valvar. Presenta de 1-2 microrimopórtulas en 10 μm, con 4-5 areolas entre ellas. No hay microrimopórtulas dispersas sobre la valva. La roseta central es evidente, la cual se compone por 5 o 6 areolas más grandes en comparación a las demás (figs. 7, 8). En vista cingular es de forma rectangular con el manto muy prolongado por lo que es muy notorio (fig. 9). Las células tienen alrededor de 150 cloroplastos, dispuestas hacia la periferia de la célula (fig. 6).
Resumen taxonómico
Referencias bibliográficas: Hasle y Syvertsen, 1996, p. 105, Lám. 15; Hernández-Becerril, 2000, p. 10, figs. 7-13; Moreno et al., 1996, p. 55, Lám. 17, fig. 1.
Comentarios taxonómicos
Se puede llegar a confundir con Coscinodiscus radiatus, pero las areolas de C. centralis son más pequeñas (mayor densidad areolar en 10 μm) y no presenta microrimopórtulas sobre la valva a diferencia de C. radiatus.
Coscinodiscus concinnus W. Smith, 1856 (figs.10-13)

Figura 10-13 Coscinodiscus concinnus. 10, Célula completa en una preparación en fresco mostrando el patrón areolar radial; 11, vista cingular con manto redondeado; 12, preparación permanente, detalle de la roseta central; 13, vista cingular con manto más pronunciado en preparación en fresco.
Células solitarias con valvas circulares y superficie convexa. El diámetro varía de 50 a 90 μm y eje pervalvar de 50 a 80 μm (figs. 10, 11). Las areolas son pequeñas y están dispuestas en forma excéntrica-radial (fig. 10). La densidad areolar en 10 μm varía en la superficie valvar: 8-9 areolas en el margen, 6-7 areolas en la zona media y 4-5 areolas en la zona central. Tiene 1-2 microrimopórtulas en 10 μm, sin microrimopórtulas en la superficie valvar. Entre las microrimopórtulas marginales hay 8 o 9 areolas. La roseta central está compuesta de 5 areolas de mayor tamaño que las demás (fig. 12). En vista cingular puede ser muy alto, por lo que es de forma rectangular a cuadrangular, con el perfil del manto redondeado y en ocasiones pronunciado (figs. 11, 13). Contiene al menos 200 cloroplastos hacia la periferia de la célula (fig. 10).
Resumen taxonómico
Referencias bibliográficas: Boalch, 1970, Lám. I; Brooks, 1975a, p. 3, Lám. I; Hasle y Syvertsen, 1996, p. 105, Lám. 16; Gran, 1908, p. XIX-37, fig.34; Lebour, 1930, p. 43, fig. 19.
Comentarios taxonómicos
Se puede llegar a confundir con C. marginatus en vista valvar, pero las areolas de C. concinnus son de menor tamaño. Posiblemente el registro de C. cf. marginatus Ehrenberg en el PNSAV, fuera una confusión en la determinación de C. concinnus.
Coscinodiscus gigas Ehrenberg, 1841 (figs. 14-18)
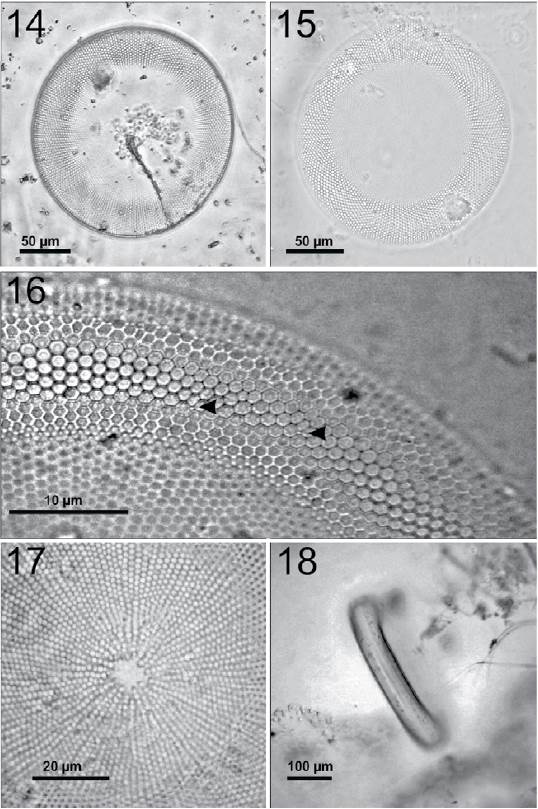
Figura 14-18 Coscinodiscus gigas. 14, Célula completa en una preparación en fresco; 15, preparación permanente, frústula limpia con el margen en foco, el centro se aprecia menos debido a la concavidad de esa parte de la superficie valvar; sin embargo, es posible observar la zona central hialina; 16, margen de la valva mostrando la densidad areolar con algunas de las microrimopórtulas que componen un anillo submarginal (flechas); 17, centro hialino de una frústula limpia y patrón areolar radial; 18, vista cingular de la célula en preparación en fresco.
Células solitarias de forma discoidal con la superficie valvar convexa que conforme se acerca al centro se vuelve cóncava (figs. 14, 15). Es difícil observar a la célula en vista cingular debido a que la posición estable de las células es la vista valvar. El diámetro varía entre 180 a 220 μm; el eje pervalvar mide aproximadamente 46 μm (fig. 18). Las areolas se disponen radialmente y son ligeramente más pequeñas hacia el margen (fig. 16). La densidad areolar en 10 μm: 5-6 areolas en el margen, 4-5 areolas en el resto de la superficie valvar. La zona central es hialina y con forma irregular (fig. 17). Presenta de 1-2 microrimopórtulas marginales en 10 μm. Entre las microrimopórtulas hay 4-5 areolas. Hay microrimopórtulas sobre la valva esparcidas y algunas forman un anillo cerca del margen (fig. 16). Presenta al menos 100 cloroplastos en la parte central de la célula (fig. 14).
Resumen taxonómico
Referencias bibliográficas: Boalch, 1970, Lám. I; Brooks, 1975a, p. 3, Lám. I; Hasle y Syvertsen, 1996, p. 105, Lám. 16; Gran, 1908, p. XIX-37, fig.34; Lebour, 1930, p. 43, fig. 19; Moreno et al., 1996, p. 57, Lám. 17, fig. 8; Navarro, 1981, p. 429, figs. 16-18.
Comentarios taxonómicos
Es una especie que se caracteriza por la forma convexa de su margen y la concavidad del centro. La convexidad y concavidad de la frústula impiden que se logre enfocar toda la superficie valvar en un mismo foco al observarse a través del microscopio fotónico.
Coscinodiscus granii L. F. Gough, 1905 (figs. 19-22)
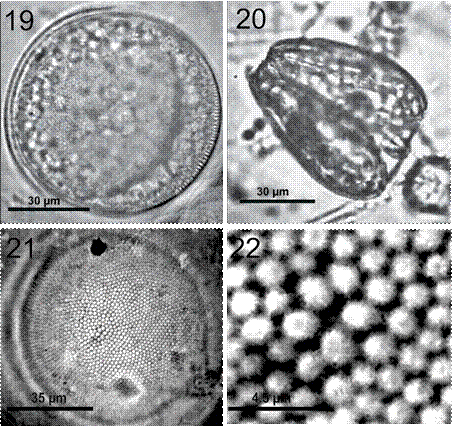
Figura 19-22. Coscinodiscus granii. 19, Célula completa en una preparación en fresco, mostrando los cloroplastos grandes; 20, vista cingular asimétrica (forma de cuña); 21, preparación permanente, frústula limpia mostrando roseta central y patrón areolar radial; 22, detalle de las areolas de la parte media de la valva.
Células solitarias con valvas circulares y superficie valvar plana. En la vista cingular la célula se caracteriza por poseer un lado más ancho que el otro, resultando en una forma de cuña (figs. 19, 20). El diámetro varía de 70-280 μm y el eje pervalvar mide en su parte más ancha aproximadamente 56 μm. Las areolas son pequeñas y dispuestas radialmente. La densidad aerolar en 10 μm varía: 8-9 areolas en el margen y 7-8 areolas en la zona media y centro (fig. 21). Presenta de 1-2 microrimopórtulas en 10 μm localizadas en el margen. Hay 8 o 9 areolas separando las microrimopórtulas. No hay microrimopórtulas en la superficie valvar. Presenta una roseta central apenas visible de 6 areolas ligeramente más grandes que el resto de la valva (fig. 21). Las células tienen por lo menos 150 cloroplastos localizados hacia la periferia.
Resumen taxonómico
Referencias bibliográficas: Boalch, 1970, Lám. II; Brooks, 1975 c, p. 31, Lám. I; Hasle y Syvertsen, 1996, p. 109, Lám. 17; Lebour, 1930, p. 44, fig. 20.
Comentarios taxonómicos
La forma de la frústula en la vista cingular se caracteriza por poseer un extremo ancho y el opuesto más angosto, dando la apariencia de una cuña. Esta característica es diagnóstica de la especie y la vista valvar se caracteriza por no poder apreciarse en un sólo foco, debido a la diferencia de anchura de cada lado de la valva.
Coscinodiscus perforatus Ehrenberg, 1844 (figs. 23-28)

Figuras 23-28 Coscinodiscus perforatus. 23, Célula en preparación en fresco; 24, preparación permanente, frústula limpia mostrando zona hialina central; 25, sección de la valva abarcando desde el centro al margen con microrimopórtulas en la superficie valvar (flechas); 26, detalle de roseta central con 7 areola distintivas y una pequeña zona hialina en el centro; 27, margen con una macrorimopórtula (flecha); 28, vista cingular muy estrecha, en preparación en fresco.
Células solitarias de forma discoidal con las valvas circulares y planas o ligeramente convexas (figs. 23, 24). El diámetro varía de 70 a 100 μm y el eje pervalvar mide menos de 25 μm. Las areolas se disponen sobre la valva en forma radial o formando sectores, con variación en el tamaño (figs. 24-26). La densidad de areolas en 10 μm varía por el tamaño de éstas: 3-4 areolas en el margen, 4-5 areolas en la zona media y 3-4 areolas en la zona central (fig. 25). Posee 2 macrorimopórtulas posicionadas en un ángulo aproximado de 120° que se ven como muescas en el margen de la valva (fig. 27). Presenta microrimopórtulas sobre la valva, con un anillo en la zona intermedia de la valva (fig. 25). En el margen hay 1 o 2 microrimopórtulas en 10 μm separadas por 4-5 areolas. El centro de la valva puede ser hialino irregular o puede presentar una roseta central con 7 areolas que rodean un centro hialino (figs. 25, 26). En la vista cingular es muy delgada por lo que parece una moneda (fig. 28). Presenta alrededor de 150 cloroplastos localizados en la periferia de la célula.
Resumen taxonómico
Referencias bibliográficas: Cupp, 1943, p. 61, fig. 25. A, Lám. 3, fig. 1; Hustedt, 1930, p. 445, figs. 246-247; Sar et al., 2010 p. 516 figs. 1, 9, 10, 20.
Comentarios taxonómicos
La especie ha sido considerada un sinónimo de Coscinodiscus radiatus, pero Sar et al. (2010) validaron la existencia de C. perforatus. La diferencia más evidente es el centro hialino de C. perforatus y su reducido número de rimopórtulas sobre la valva en comparación con C. radiatus. Otro taxón similar es C. centralis, pero éste no tiene rimopórtulas sobre la valva.
Coscinodiscus radiatus Ehrenberg, 1840 (figs. 29-33)
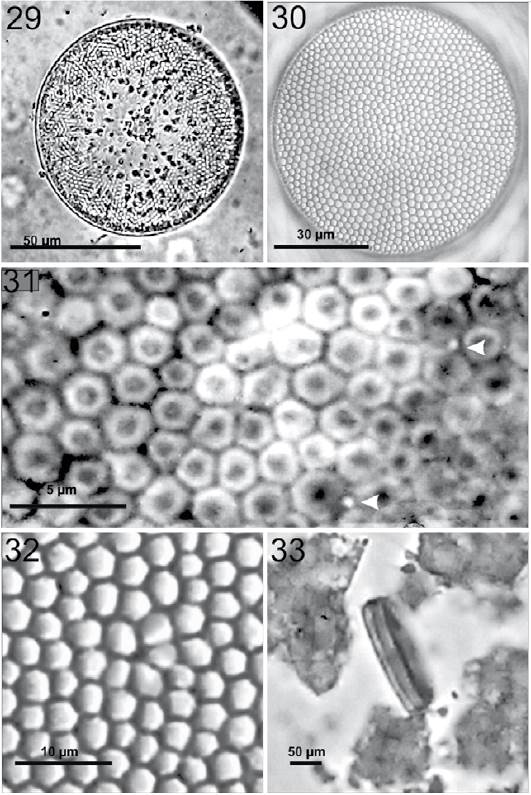
Figura 29-33 Coscinodiscus radiatus. 29, Vista de la frústula completa en preparación en fresco donde se pueden observar los cloroplastos dispersos por toda la célula; 30, vista valvar en preparación permanente, mostrando el patrón areolar y a roseta central formada por 9 areolas; 31, aumento de las areolas en la zona marginal donde se aprecian rimopórtulas sobre la valva (flechas); 32, vista de la roseta central con 4 areolas ligermante más grandes que el resto; 33, vista cingular muy estrecha, en preparación en fresco.
Células solitarias. Valva circular y plana apreciable en un solo foco, en vista cingular parece una moneda (figs. 29, 33). Diámetro de 50 a 80 μm y el eje pervalvar mide aproximadamente 10 μm. Densidades areolares en 10 μm: 6-7areolas en el margen, 4-5 areolas en la zona media y 3-5 areolas en la zona central. Las areolas son visibles en 10×, pero no con detalle, presentan forma hexagonal o circulares dependiendo del foco, se puede observar un pequeño círculo en el interior de cada una. Hay 2 microrimopórtulas en 10 μm en el margen y entre ellas hay 6-7 areolas; presenta varias microrimopórtulas sobre la valva, que son visibles en 100× con mayor nitidez en contraste de fase (fig. 31). Se observa una roseta central que en ocasiones apenas es discernible del resto de las areolas de la valva, y que dependiendo del foco pudiera parecer que existe un centro hialino entre las 5 areolas que la conforman (figs. 30, 32). Los cloroplastos que la componen no son numerosos y se distribuyen radialmente con mayor acumulación en el centro (fig. 29).
Resumen taxonómico
Referencias bibliográficas: Hasle y Syvertsen, 1996, p. 107, Lám. 18; Moreno et al., 1996, p. 58, Lám. 18, figs. 2-4.
Comentarios taxonómicos
Se puede llegar a confundir con Coscinodiscus perforatus, pero la diferencia más evidente es el centro hialino que posee C. perforatus. Además C. radiatus presentar areolas más juntas en comparación con C. perforatus.
Coscinodiscus wailesii Gran et Angst, 1931 (figs. 34-37)

Figura 34-37 Coscinodiscus wailesii. 34, Vista de la frústula completa en una preparación en fresco donde se observan los cloroplastos distribuidos en toda la célula, es posible ver toda la célula en foco; 35, vista valvar en preparación permanente, se observan areolas pequeñas distribuidas en un patrón radial sectorizado y una roseta central con un área central hialina evidente; 36, roseta central con 14 areolas más grandes y un centro hialino circular; 37, vista cingular con forma de tambor, en preparación en fresco, con organismos epífitos en la superficie valvar de la frústula.
Células solitarias. Valva circular y plana, con una pequeña depresión en el centro, se puede observar la valva en un solo foco (figs. 34, 35). Diámetro de 190 a 231 μm y el eje pervalvar mide aproximadamente 163 μm. Densidades areolares en 10 μm: 5-7 areolas en el margen, 5-6 areolas en la zona media y 6-7 areolas en la zona central. Presenta areolas muy finas, las cuales mantienen un tamaño homogéneo en toda la valva (fig. 35). Tiene 1-2 microrimopórtulas en 10 μm en el margen, separadas por 5-6 areolas. Se presentan microrimopórtulas sobre la valva. La roseta central es muy evidente y fácil de observar a 40×. La roseta central puede estar formada por 14-16 areolas alargadas, las cuales poseen puntos en la periferia (fig. 36); algunas rosetas pueden tener un centro circular hialino y las areolas que las componen presentan forma de rectángulo con las puntas curveadas y están pegadas unas con otras. En vista cingular posee una forma rectangular (fig. 37). Se encuentran aproximadamente 150 cloroplastos con mayor concentración en el centro de la célula.
Resumen taxonómico
Referencias bibliográficas: Cupp, 1943, p. 58, Fig. 23; Fernandes et al., 2001, p. 90, figs. 2-4, 5-12; Hasle y Syvertsen, 1996, p. 106, Lám. 16; Moreno et al., 1996, p. 60, Lám. 18, figs. 6-7.
Comentarios taxonómicos
Puede llegar a confundirse con Coscinodiscus asteromphalus, por la roseta central, pero la diferencia característica entre las 2 especies es la presencia de microrimopórtulas sobre la valva de C. wailesii y la ausencia de estas en C. asteromphalus. Otra característica distintiva de C. wailesii es que en vista cingular tiene forma rectangular, por lo que de manera general las células tienen forma de “tambor”.
Coscinodiscopsis jonesiana (Greville) Sar y Sunesen, 2008 (figs. 38-43)
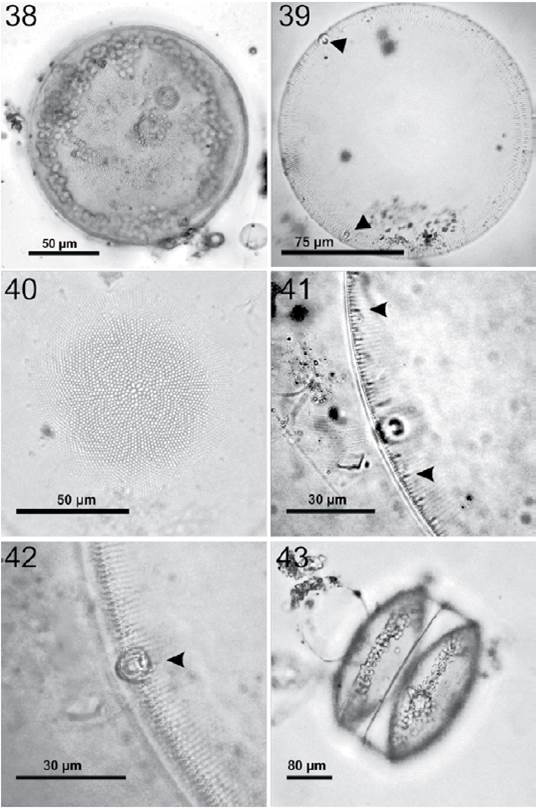
Figura 38-43 Coscinodiscopsis jonesiana. 38, Preparación en fresco, frústula completa donde puede observar los cloroplastos en la periferia; 39, frústula completa en preparación permanente donde se muestra el patrón areolar del margen y las 2 grandes macrorimopórtulas en la periferia (flechas); 40, misma frústula con el centro en foco donde se muestra el patrón areolar de la zona central y la roseta central; 41, rimopórtulas marginales (flechas) y una macrorimopórtula en el margen de la célula; 42, macrorimopórtula en foco (flecha); 43, vista cingular con perfil convexo, en preparación en fresco.
Basiónimo: Eupodiscus jonesianus Greville, 1865 Sinónimo: Coscinodiscus jonesianus (Greville) Ostenfeld, 1915
Células solitarias. Valva en forma circular y convexa con una pequeña depresión en el centro de la célula, en vista cingular se observa de forma rectangular (figs. 38, 43). Diámetro de 80-260 μm. Densidad areolar en 10 μm: 7-11 areolas en el margen, 6-9 areolas en la zona media y 4-6 areolas en la zona central (figs. 39, 40). Las areolas se distribuyen radialmente y aumentan de tamaño de acuerdo con la cercanía al centro, las areolas del margen no son fáciles de observar a 40×. Tiene 1-2 microrimopórtulas en 10 μm separadas entre sí por 9-10 areolas (fig. 41). Presenta microrimopórtulas sobre la valva y 2 macrorimopórtulas marginales que se separan una con la otra alrededor de 110 a 125°. Las macrorimopórtulas poseen un diámetro 10 μm (fig. 42). La frústula posee una roseta central muy evidente formada por 8-10 areolas ovaladas y de mayor tamaño en comparación a la demás (fig. 40). Posee una cantidad mayor de 200 cloroplastos localizados en dirección al manto y al cíngulo, fácilmente observables tanto en la vista cingular como valvar (figs. 38, 43).
Resumen taxonómico
Referencias bibliográficas: Hasle y Syvertsen, 1996, p. 107, fig. 17; Meave-del Castillo y Moreno, 1997, p. 197, fig.3.7; Moreno et al., 1996, p. 57, Lám. 17, figs. 8-9; Sar y Sunesen, 2008, p. 403, figs. 1-3, 4-9.
Comentarios taxonómicos
En el 2008 esta especie fue transferida al género Coscinodiscopsis (Sar y Sunesen, 2008). Taxón fácil de determinar por la presencia de sus 2 enormes macrorimopórtulas en el margen de la valva que son fácilmente visibles aún en el objetivo 10× en microscopia fotónica.
Discusión
En las muestras revisadas se determinaron 8 especies del género Coscinodiscus. Adicionalmente, se identificó una especie del género Coscinodiscopsis, relacionada morfológicamente con el género Coscinodiscus. De los 5 registros previos de Coscinodiscus dentro del PNSAV (Okolodkov et al., 2011), 4 se corroboraron: Coscinodiscus centralis, C. granii, C. radiatus y C. wailesii. La especie que no se encontró dentro de las muestras estudiadas fue C. marginatus. Por otro lado, se obtuvieron 5 nuevos registros: C. asteromphalus, C. concinnus, C. gigas, C. perforatus y Coscinodiscopsis jonesiana. Los estudios detallados de la morfología de especies ponen de manifiesto su importancia para conocer la diversidad biológica de las especies a diferencia de estudios rutinarios de fitoplancton.
La característica que aportó una ayuda importante al realizar la determinación genérica en preparaciones en fresco fue la forma de la vista cingular, debido a que cada una de las especies observadas mostró un tamaño y forma distintiva. Especies como Coscinodiscus concinnus, C. wailesii y C. grani presentan una vista cingular muy ancha, y su posición es estable en vista cingular en preparaciones en fresco, lo que puede facilitar la identificación de las especies sin necesidad de la limpieza de las frústulas. En contraste, en las células de las especies C. asteromphalus, C. gigas y C. radiatus, entre otras, la posición estable es la vista valvar, y el contenido protoplasmático dificulta la observación de las areolas. Por lo que es inevitable la aplicación de la técnica de limpieza de frústulas para una determinación precisa.
Las características más útiles para la determinación taxonómica de las especies fueron la forma general de la frústula (ancho del eje pervalvar y convexidad/concavidad de la superficie valvar), la presencia de una roseta central, presencia de centro hialino, presencia de microrimopórtulas en la superficie valvar, y el patrón y densidad de las areolas. Una característica que se ha utilizado para la caracterización de las especies es la posición y tamaño de macrorimopórtulas (Hasle y Syvertsen, 1996) pero esta característica es más útil para la discriminación del género más que de las especies. En particular, para diferenciar al género Coscinodiscopsis el tamaño de las macrorimopórtulas resultó muy importante.
La riqueza de especies de Coscinodiscus en el PNSAV se puede considerar media en comparación con otras regiones más extensas como el golfo de California en la cual Moreno et al. (1996) reportaron 16 especies, o en el Pacífico mexicano donde Hernández-Becerril (2000) reportó 6 especies. A pesar de que las muestras revisadas representan el área del PNSAV y los cambios de comunidades planctónicas a lo largo del año, no se descarta el aumento futuro de las especies del género, ya que la existencia de especies consideradas raras, podrían ser recolectadas con otros tipos de instrumentos como el uso de botellas u otras redes de diferente luz de malla. Sin embargo, este estudio muestra las especies características del género Coscinodiscus que pueden encontrase en el área. Los estudios detallados con técnicas apropiadas usando microscopía de luz, son suficientes para detectar la diversidad de especies del género Coscinodiscus, por lo que se recomienda su uso en estudios de biodiversidad fitoplanctónica.











 nueva página del texto (beta)
nueva página del texto (beta)


