Introducción
La Bahía Samborombón, sitio RAMSAR desde 1997, es el humedal mixohalino más extenso de Argentina. Es un área protegida y alberga una gran biodiversidad de especies nativas, algunas de ellas en peligro de extinción como el venado de las Pampas Ozotoceros bezoarticus y especies introducidas como perros asilvestrados (Canis familiaris) y cerdos cimarrones (Sus scrofa) (Merino y Carpinetti, 2003; Pérez-Carusi et al., 2009).
En la actualidad, se sabe que la introducción deliberada o accidental de ganado y animales silvestres fuera de su rango original de distribución genera una serie de alteraciones que pueden conducir a la extinción local de especies nativas por efecto de depredación, competencia, transmisión de enfermedades parásitas o transformación del hábitat, entre otros factores (Mack et al., 2000; Pedersen et al., 2007).
La introducción del cerdo silvestre en la región del pastizal pampeano se cree que data del siglo XVI, con individuos traídos en las primeras expediciones españolas que se naturalizaron en la zona. Sin embargo, los registros documentados de la especie en los partidos que conforman la Bahía Samborombón -Magdalena, Punta Indio, Chascomús y Castelli- datan del siglo XIX (Carpinetti et al., 2016). En la mayoría de los lugares donde existen poblaciones naturalizadas de cerdos silvestres se han identificado múltiples impactos negativos de la especie sobre el ambiente, la ganadería y la agricultura (Carpinetti, 1998; Choquenot et al., 1997; Sanguinetti y Pastore, 2016; Singer et al., 1984). Como ejemplo, en la Patagonia Argentina, el jabalí puede alimentarse del 30% de las semillas de Araucaria afectando la regeneración de la conífera y compitiendo con los roedores nativos (Sanguinetti y Kitzberger, 2010). En tanto en la región pampeana, se determinó una tendencia inversa entre la abundancia del venado de las pampas (O. bezoarticus) y el jabalí, por lo cual existiría competencia con este cérvido amenazado (Pérez-Carusi et al., 2009).
Existen numerosas especies de mamíferos introducidos exitosamente en Argentina y sus parásitos pueden representar una amenaza para la biodiversidad (Pedersen y Greives, 2008), ya que por diversos mecanismos tienen la capacidad de ejercer una regulación directa o indirecta en las dinámicas poblacionales de sus hospedadores (Tompkins y Begon, 1999). Las especies introducidas suelen presentar baja riqueza, prevalencia y abundancia de parásitos, además de contar con la ausencia de sus parásitos naturales (Heger y Jeschke, 2014; Torchin et al., 2003). Conocer la parasitofauna de animales introducidos en diferentes ambientes permite comprender si estas especies se liberaron de sus parásitos naturales o si adquirieron parásitos de animales nativos y evaluar las consecuencias que puede tener el ingreso de una nueva especie hospedadora en la comunidad receptora (Dunn y Hatcher, 2015; Dunn et al., 2012; Gozzi, 2015).
El cerdo es una de las especies con mayor relevancia sanitaria para la salud humana y de animales domésticos. Es ampliamente reconocido que las poblaciones de cerdos actúan como reservorios de algunas enfermedades trasmisibles al hombre y a los animales domésticos y silvestres. Entre las enfermedades reportadas, a nivel mundial, se encuentran la fasciolacis, hidatidosis, triquinosis, coccidiosis, brucelosis porcina, tuberculosis, leptospirosis, entre otras (Carpinetti et al., 2014; Kaufmann, 1996; Zimmerman et al., 2012). Existen numerosos estudios que describen la fauna parasitaria de las poblaciones de jabalíes tanto dentro de su rango de distribución natural como en áreas recientemente invadidas (Amayour et al., 2017; De la Muela et al., 2001; García-González et al., 2013; Hampton et al., 2006; Pence et al., 1988; Senlik et al., 2011; Solaymani-Mohammadi et al., 2003). En Argentina se han realizado pocos estudios de endoparásitos (protozoos y helmintos) en poblaciones silvestres de cerdos. Cohen et al. (2010) mencionan una prevalencia de Trichinella spiralis de11% en jabalíes del Parque Nacional El Palmar, Entre Ríos; en tanto que en el Parque Nacional Nahuel Huapi reportaron infestaciones por Fasciola hepatica, Metastrongylus pudendotectus y T. spiralis (Chang-Reissig et al., 2010). En Bahía Samborombón, Carpinetti et al. (2014, 2017) detectaron cerdos asilvestrados con serología positiva para leptospirosis y la enfermedad de Aujeszky.
El objetivo de este trabajo fue reportar las especies parásitas de protozoos y helmintos presentes en una población de cerdos silvestres Sus scrofa en el área protegida Bahía Samborombón y evaluar posibles riesgos zoonóticos ante la presencia de parásitos de importancia para la salud humana, para la producción animal o para la fauna silvestre.
Materiales y métodos
La Bahía Samborombón se localiza a 90 km al sur de la ciudad de La Plata y se extiende desde Punta Piedras (35º27’ S, 56º45’ O) hasta Punta Rasa (36º22’ S, 56º35’ O), Provincia de Buenos Aires, Argentina. La vegetación del área es un mosaico dominado por factores edáficos tales como la duración y extensión de las inundaciones de agua dulce o estuariales y por las características del suelo, con bancos de conchillas donde crecen bosques de “tala” Celtis tala (Cabrera, 1971). El presente trabajo se desarrolló en el Refugio de Vida Silvestre Bahía Samborombón, en las cercanías de la desembocadura del canal 1, estuario del río de la Plata (Fig. 1). En el área, se combinan una variedad de hábitats como marismas intermareales con altas densidades de cangrejales, marismas saladas, arroyos, lagunas y pantanos de agua dulce tanto permanentes como estacionales y pastizales e islas de tierras altas con árboles y arbustos, además de asentamientos humanos basados en la explotación ganadera para su subsistencia (Carpinetti et al., 2014; Merino y Carpinetti, 2003).
Figura 1 Mapa mostrando la Bahía Samborombón, provincia de Buenos Aires y el sitio de muestreo en la desembocadura del canal 1.
En el marco del proyecto “Vigilancia epidemiológica en poblaciones de cerdos silvestres” aprobado por SENASA (Carpinetti et al., 2014), los cerdos cimarrones fueron capturados estacionalmente por guardaparques del Refugio de Vida Silvestre Bahía Samborombón durante un año, desde septiembre de 2015 a septiembre de 2016. Los métodos de captura dependieron de los recursos disponibles y las condiciones ambientales. Se utilizaron armas de fuego y/o trampas de captura con perros entrenados para control y erradicación de esta especie exótica en el área protegida. Para la captura y sacrificio se siguieron los lineamientos establecidos por la “American Society of Mammalogists” para el uso de animales silvestres en investigación (Sikes y The Animal Care and Use Committee of the America Society of Mammalogists, 2016).
Las muestras de materia fecal fueron tomadas del recto de cada animal y conservadas en dicromato de potasio y/o formol 5%. Se revisó la cavidad del cuerpo y se extrajeron las vísceras. In situ se revisaron los órganos. Al observar alguna anormalidad se procedió a tomar una muestra de éste. Para la obtención de muestras del intestino delgado se tomaron 2 porciones de 20 cm cada una, la primera a continuación del estómago y la segunda en el tercio posterior y fueron fijadas en formol 10%. El contenido del ciego fue revisado utilizando bandejas, coladores y abundante agua. Para el análisis de la materia fecal se utilizaron las técnicas de flotación de Sheather y de sedimentación de Ritchie (Vignau et al., 2005) y posteriormente fueron observadas con microscopio óptico (MO) Olympus BX51(Olympus Corporation, Tokio, Japón). Los quistes de protozoos y huevos fueron medidos y fotografiados con una cámara Olympus SC30 (Olympus Corporation, Tokio, Japón) e identificados utilizando bibliografía específica (Kauffmann, 1996; Thienpont et al., 1979). Los helmintos adultos fueron aclarados en lactofenol, observados al MO e identificados utilizando claves (Anderson et al., 2009; Arrabal et al., 2017; D’Alessandro, 2002; Kalhil et al., 1994; Richardson, 2005; Yamaguti, 1963). Los acantocéfalos fueron deshidratados en una serie de alcoholes (70u, 80u, 90u, 95u y 100u), utilizando la técnica de punto crítico y observados usando el microscopio electrónico de barrido (MEB) Jeol 6360 LV y fotografiados.
Se estimó la prevalencia (P) según Bush et al. (1997) y el índice de Fager para estimar la asociación entre especies parásitas. La prueba de “t” determinó si el índice de afinidad era significativo a un nivel de 5%, considerándose que existe afinidad real entre las especies involucradas cuando el valor “t” calculado es superior a 1.645 (Morales y Pino, 1987).
Resultados
Se capturaron un total de 30 individuos, cuyo 90% (27/30) estaba parasitado. En la Tabla 1 se detallan los resultados de las especies parásitas halladas y su prevalencia en el análisis coprológico y en la prospección de vísceras.
Tabla 1 Prevalencia de especies parásitas halladas en el análisis coprológico y en la prospección de vísceras de cerdos asilvestrados en Bahía Samborombón.
| Parásitos | Materia fecal (n = 27) | Prospección de vísceras (n = 30) |
|---|---|---|
| Protozoa | ||
| Iodamoeba sp. | 52 % | - |
| Eimeria sp. | 18.5 % | - |
| Isospora sp. | 22 % | - |
| Cestoda | ||
| Quistes de Echinococcus sp. | - | 20 %* |
| Nematoda | ||
| Ascaris suum | 22 % | 23 % |
| Globocephalus sp. | 7.5% | - |
| Metastrongylus sp. | 7.5% | - |
| Hyostrongylus sp. | 18.5% | - |
| Oesophagostomun dentatum | 4% | 3%† |
| Trichuris sp. | 4% | - |
| Acanthocephala | ||
| Macracanthorhynchus hirudinaceus | 33% | 63% |
* Localización en hígado. † Localización en ciego.
Se hallaron un total de 11 especies parásitas: 3 protozoos, 1 céstodo, 1 acantocéfalo y 6 nemátodos. En el análisis coprológico se encontraron ooquistes de Eimeria sp. e Isospora sp. (Coccidia), quistes de Iodamoeba sp. (Amoebidae), huevos de Macracanthorhynchus hirudinaceus (Acanthocephala, Gygantorhynchidae) y de los nemátodos Ascaris suum (Ascarididae), Oesophagostomum dentatum, Globocephalus sp., Metastrongylus sp. e Hyostrongylus sp. (Strongylida) y de Trichuris sp. (Trichuridae) (Tabla 1; Fig. 2). Las medidas de los quistes y huevos se detallan en la Tabla 2. En la prospección helmintológica se observó el intestino parasitado por juveniles y adultos de M. hirudinaceus y A. suum; en el ciego se encontró O. dentatum y en el hígado, quistes hidatídicos de Echinococcus sp. (Cestoda, Taeniidae) (Fig. 3). El resto de los órganos no estuvieron parasitados. En el intestino de los cerdos parasitados por M. hirudinaceus se observaron las típicas lesiones en la pared externa provocadas por la probóscis y los ganchos del acantocéfalo. Los quistes de Echinococcus sp. midieron de 1 a 6 cm. En su interior se observó líquido conteniendo vesículas poliquísticas de metacéstodos con 3-6 protoescólices. Cada protoescólex lleva una doble corona de ganchos (Fig. 3).
Tabla 2 Medidas de los quistes y huevos hallados en el análisis coprológico de cerdos asilvestrados en Bahía Samborombón.
| Parásitos | Medidas de quistes / huevos |
|---|---|
| Protozoa | |
| Iodamoeba sp. | 12 × 7.2 µm (n = 14) |
| Eimeria sp. | 17 × 12.7 µm (n = 2) |
| Isospora sp. | 18.7 × 15.6 µm (n = 4) |
| Nematoda | |
| Ascaris suum | 73.1 × 60.7 µm (n = 4) |
| Globocephalus sp. | 48.8 × 27.5 µm (n = 2) |
| Metastrongylus sp. | 48.2 × 39.2 µm (n = 2) |
| Hyostrongylus sp. | 80.8 × 44,7 µm (n = 5) |
| Oesophagostomun dentatum | 67.4 × 30.2 µm (n = 1) |
| Trichuris sp. | 68 × 31 µm (n = 1) |
| Acanthocephala | |
| Macracanthorhynchus hirudinaceus | 10.8 × 51.6 µm (n = 9) |
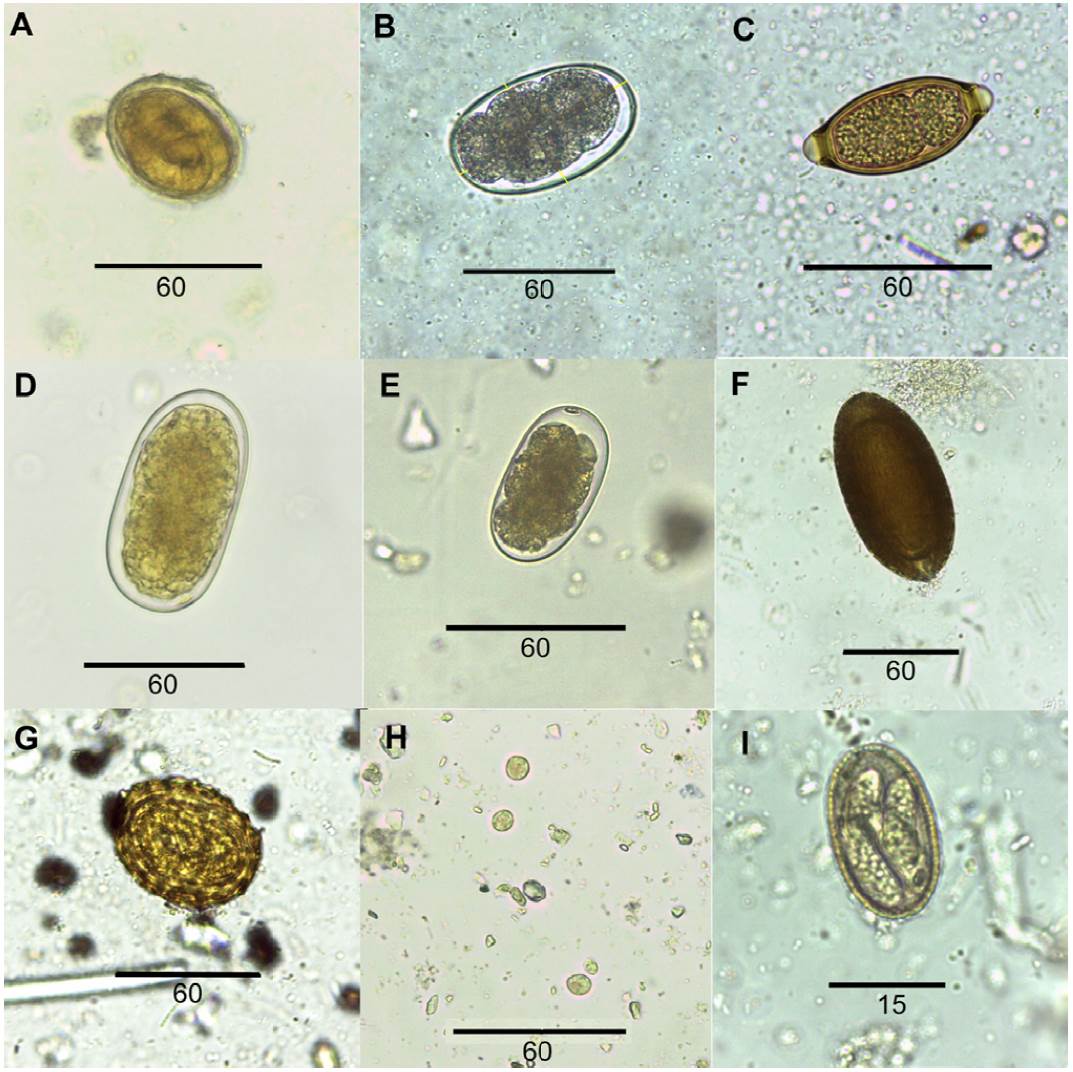
Figura 2 Huevos y quistes de parásitos hallados en el análisis coprológico de cerdos asilvestrados en la Bahía Samborombón: A, Metastrongylus sp.; B, Oesophagostomum dentatum; C, Trichuris sp.; D, Hyostrongylus sp.; E, Globocephalus sp.; F, Macracanthorhynchus hirudinaceus.; G, Ascaris suum.; H, Iodamoeba sp.; I, Eimeria sp.

Figura 3 Helmintos hallados en la prospección parasitológica de cerdos asilvestrados en la Bahía Samborombón. A, Protoescólices de Echinococcus sp.; B, Oesophagostomum dentatum; C, foto al MEB de Macracanthorhynchus hirudinaceus hallado en intestino delgado.
Las especies con mayor prevalencia registradas en las heces fueron Iodamoeba sp. (P = 52%), M. hirudinaceus (P = 33%), A. suum (22%) e Isospora sp. (P = 22%), en tanto que, en la prospección parasitológica, M. hirudinaceus alcanzó una P = 63% (Tabla 1).
La riqueza específica por individuo hospedador fue variable, habiendo cerdos monoparasitados hasta hexaparasitados. El 70% de los cerdos estuvieron parasitados por 1 (18.5%), 2 (22.2%) o 3 (29.6%) especies parásitas y la mayor frecuencia de parasitismo fue de 3 especies. Los valores de asociación del índice de Fager fueron no significativos con excepción del par Isospora sp.-Eimeria sp. (Ind Fager = 0.91; t = 2.05; Tabla 3).
Tabla 3 Índice de Fager y valores de “t” de las especies parásitas halladas en el análisis coprológico y en la prospección de vísceras de cerdos asilvestrados en Bahía Samborombón.
| I Fager | Iod | Mac | Asc | Glob | Met | Hyos | Oes | Eim | Isos | Tric | Echin |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Iod | 1 | 0.61 | 0.36 | 0.25 | 0.12 | 0.21 | 0.25 | 0.31 | 0.30 | 0 | 0.10 |
| Mac | 1 | 0.53 | 0.08 | 0.16 | 0.37 | 0 | 0.29 | 0.35 | 0.08 | 0.42 | |
| Asc | 1 | 0 | 0.20 | 0.30 | 0 | 0.61 | 0.71 | 0.22 | 0.42 | ||
| Glob | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| Met | 1 | 0.28 | 0.50 | 0.28 | 0.25 | 0.66 | 0 | ||||
| Hyos | 1 | 0.28 | 0.20 | 0.18 | 0 | 0.36 | |||||
| Oes | 1 | 0.28 | 0.25 | 0.66 | 0 | ||||||
| Eim | 1 | 0.90 | 0.33 | 0.36 | |||||||
| Isos | 1 | 0.28 | 0.66 | ||||||||
| Tric | 1 | 0 | |||||||||
| Echin | 1 | ||||||||||
| t values | Iod | Mac | Asc | Glob | Met | Hyos | Oes | Eim | Isos | Tric | Echin |
| Iod | 1 | 1.3 | -1.4 | -0.6 | -2.7 | -2.5 | -0.6 | -1.4 | -1.8 | -3.83 | |
| Mac | 1 | 1.5 | -3.5 | -0.9 | 0.5 | -0.7 | -0.2 | -2.2 | 0.42 | ||
| Asc | 1 | -2.1 | -1.8 | 0.5 | 1.1 | -1.2 | 0.48 | ||||
| Glob | 1 | ||||||||||
| Met | 1 | -1.6 | -0.9 | -1.6 | -1.8 | -0.4 | |||||
| Hyos | 1 | -1.6 | -2.4 | -2.6 | -3.6 | -1.42 | |||||
| Oes | 1 | -1.6 | -1.8 | -0.4 | -3.52 | ||||||
| Eim | 1 | 2.1 | -0.9 | -1.42 | |||||||
| Isos | 1 | -1 | 0.55 | ||||||||
| Tric | 1 | ||||||||||
| Echin | 1 |
Discusión
El presente trabajo da a conocer por primera vez 11 especies parásitas (3 protozoos y 8 helmintos) en una población silvestre de S. scrofa en Bahía Samborombón. Hasta el momento, se habían reportado en jabalíes salvajes cazados en el Parque Nacional Nahuel Huapi y sus alrededores, 3 especies de helmintos (F. hepatica, M. pudendotectus y T. spiralis), sarcocistosis en corazón y serología positiva para rotavirus, influenza tipo 3 y leptospirosis (Chang-Reissig et al., 2010) y en el Parque Nacional El Palmar, T. spiralis (Cohen et al., 2010). Otros estudios realizados en animales de criadero en Brasil reportaron las mismas especies halladas en el presente estudio (Mundin et al., 2004).
Entre los protozoos, 8 especies de Eimeria y una de Isospora producen la coccidiosis detectada en cerdos de cautiverio (Kauffmann, 1996; Mundim et al., 2004) y en menor medida en cerdos silvestres (Greiner et al., 1982). La presencia de estos protozoos en los cerdos salvajes tiene importancia para la fauna nativa, ya que se sabe que la prevalencia de estos coccidios es mayor en cerdos juveniles sobre los que depredan los felinos nativos, pudiendo ser transmitidos a éstos y también a otros carnívoros que comparten el ambiente con los cerdos (Pescador et al., 2009). Además, la presencia de estos protozoos en Bahía Samborombón podría ser de importancia sanitaria para los animales de ganadería presentes en la zona, dado que altas prevalencias de estos coccidios generan efectos económicos en la industria ganadera.
Iodamoeba sp. también fue reportada en cerdos en cautiverio y asilvestrados en otros países, aunque ésta no es una especie patógena (Solaymani-Mohammadi et al., 2004; Yaghoobi et al., 2016). En este trabajo se observaron altas cargas parasitarias, lo que indicaría que los cerdos frecuentan ambientes contaminados con materia fecal. El presente trabajo da a conocer el primer reporte de Eimeria sp., Isospora sp. e Iodamoeba sp. en cerdos asilvestrados para Argentina.
Las 4 especies de Strongylida (O. dentatum, Globocephalus sp., Metastrongylus sp. e Hyostrongylus sp.) halladas en el presente estudio son parásitos frecuentes de cerdos en cautiverio (Kaufmann, 1996; Zimmerman et al., 2012). En Bulgaria, Panayotova-Pencheva y Dakova (2018) han reportado la presencia de estas especies en cerdos silvestres con prevalencias que varían entre 7.5% para Hyostrongylus sp. y 28.75% para Metastrongylus sp.; en tanto en Brasil, da Silva y Müller (2013) reportan solo la presencia de O. dentatum en cerdos de granjas. Al presente, para Argentina no hay reportes de estos 4 Strongylida para cerdos en cautiverio, siendo éste el primer registro. Hyostrongylus sp. es un parásito que suele reportarse en cerdos de criadero que frecuentan pastizales (Kaufmann, 1996). La alta prevalencia (18.5%) reportada en este trabajo podría deberse a los pastizales que frecuentan estos cerdos asilvestrados en el área de estudio.
El hallazgo de M. hirudinaceus, Echinococcus sp. y A. suum reviste importancia debido a que son especies zoonóticas y pueden afectar al hombre. Las 2 primeras especies son parásitos con ciclos indirectos, con hospedadores intermediarios como coleópteros y roedores, respectivamente. Para M. hirudinaceus se sabe que diferentes especies de la familia Scarabaeidae actúan como hospedadores intermediarios (Pavlovic et al., 2010); sin embargo, para Argentina aún es desconocido. Durante la prospección de vísceras de los cerdos salvajes, los autores observaron numerosos coleópteros de la especie Diloboderus abderus o escarabajo torito en el contenido estomacal, además de hallarlos en el ambiente. Este coleóptero podría estar involucrado como hospedador intermediario del acantocéfalo.
Actualmente, en Argentina se registran 3 especies de Echinococcus: E. granulosus y E. vogeli que parasitan a cánidos, y E. oligarthrus a felinos, y como hospedadores intermediarios roedores miomorfos (Arrabal et al., 2017; D’Alessandro, 2002; D’Alessandro y Rauch, 2008). Echinococcus granulosus también fue detectado en cerdos de criaderos y en la fauna silvestre; Sciocia et al. (2013) lo mencionan para la provincia de Buenos Aires en el zorro gris pampeano Lycalopex gymnocercus y la liebre introducida Lepus europaeus. Sin embargo, el presente hallazgo resulta novedoso debido a que la morfología de los ganchos de los protoescólices difieren de los de E. granulosus, siendo semejantes a los de E. oligarthrus. Estudios moleculares permitirán confirmar la identidad de esta especie en la población de cerdos asilvestrados de Bahía Samborombón.
Actualmente, algunos autores sostienen que las especies Ascaris suum y Ascaris lumbricoides son sinónimos dado que las diferencias morfológicas y moleculares halladas son escasas de manera que podrían ser asignadas a variaciones geográficas y hospedatorias (Leles et al., 2012). De ser ésto confirmado, el hallazgo de Ascaris en los cerdos debería ser considerado de importancia zoonótica para Bahía Samborombón.
La detección de helmintos intestinales en el análisis coprológico difirió de la detección en la prospección parasitológica. Se observó que algunos hospedadores fueron positivos para Macracanthorhynchus, Ascaris y Oesophagostomum en el análisis de materia fecal, en tanto que los adultos no fueron detectados en la prospección helmintológica; mientras que en otros cerdos sólo se hallaron los adultos y el análisis coprológico dio negativo. Estos resultados apoyan la tesis de que no sólo se deben utilizar técnicas no invasivas, como las técnicas coprológicas, sino también, de ser posible, realizar la prospección de los animales en cuestión.
El presente estudio demostró que la población de cerdos silvestres de Bahía Samborombón presenta una alta riqueza de especies parásitas, muchas de las cuales revisten importancia zoonótica.
Resulta evidente la necesidad de realizar estudios exhaustivos y prolongados en el tiempo en estas poblaciones de cerdos, para conocer la dinámica poblacional de sus parásitos y establecer políticas de control tanto para los cerdos salvajes, como para las parasitosis zoonóticas halladas en ellos.











 nova página do texto(beta)
nova página do texto(beta)


