Introducción
Los bosques tropicales estacionalmente secos (BTES) representan 42% de la superficie de bosques tropicales y subtropicales del mundo, y 22% para Sudamérica (García-Villacorta, 2009). Se encuentran desde el nivel del mar hasta los 1,000 m de altitud, pudiendo llegar incluso hasta los 2,400 m (Espinosa et al., 2012). Los BTES compartidos entre Ecuador y Perú son reconocidos por su alta diversidad y endemismo, y comprenden un núcleo florístico conocido como Pacífico ecuatorial (Linares-Palomino et al., 2010) dominado por el bosque seco ecuatoriano y son considerados como los ecosistemas tropicales más amenazados (Espinoza et al., 2012). Estos aparecen como parches, con altos niveles de aislamiento y de forma esporádica o discontinua, localizados desde el noroeste de México hasta el norte de Argentina y sureste de Brasil (Valdez-Hernández et al., 2014).
En Ecuador, los BTES del Pacífico ecuatorial se ubican en la región costa y son conocidos como bosques secos, los mismos que presentan problemas de conservación asociados a la destrucción y degradación del hábitat por estar ubicados en zonas pobladas, generando pérdida de biodiversidad; además hay poca información, debido a que la mayoría de las investigaciones no han sido publicadas (Aguirre, Kvist et al., 2006; Aguirre, Linares-Palomino et al., 2006). Aunque se han realizado avances importantes en las zonas de Ecuador y Perú a partir del año 2000 (Aguirre y Delgado, 2005; Aguirre, Kvist et al., 2006; Aguirre, Linares-Palomino et al., 2006; García-Villacorta 2009; Leal-Pinedo y Linares-Palomino, 2005; Linares-Palomino et al., 2010; Marcelo-Peña et al., 2007), aun así, en la costa ecuatoriana y en particular en la cordillera Chongón Colonche, se han detectado vacíos de conocimiento ubicados en la transición entre sistemas húmedos del Pacífico con los estacionales y deciduos de la costa central (Cuesta et al., 2013, 2017).
En la Cordillera Chongón Colonche (CCHC) se asienta la comuna Loma Alta, la cual ha sido pionera en temas de conservación comunitaria en la costa ecuatoriana y posee un área protegida conocida como Reserva Ecológica Comunal Loma Alta (RECLA). A pesar de su nivel de protección, aún persisten amenazas como la deforestación y fragmentación de hábitat que han sido anteriormente documentados (Astudillo et al., 2015; Bonifaz y Cornejo, 2004; Fundación Natura y KfW, 1996; Valverde et al., 1991); por ello, el Ministerio de Ambiente del Ecuador (MAE) ha considerado la cuenca del río Ayampe en la CCHC con un alto nivel de prioridad de conservación (MAE, 2006). En ese sentido, el conocimiento de la biodiversidad presente a escala local es urgente, ya que es un indicador del estado de los ecosistemas y su comprensión nos faculta ver los cambios en la estructura del paisaje con fines prácticos en el manejo y conservación ambiental (Moreno, 2001).
El objetivo del estudio es dar a conocer la composición, estructura y diversidad de la vegetación presente en la RECLA con la finalidad de que los resultados permitan promover la investigación, conservación y gestión tanto del área protegida como de la cordillera Chongón Colonche.
Materiales y métodos
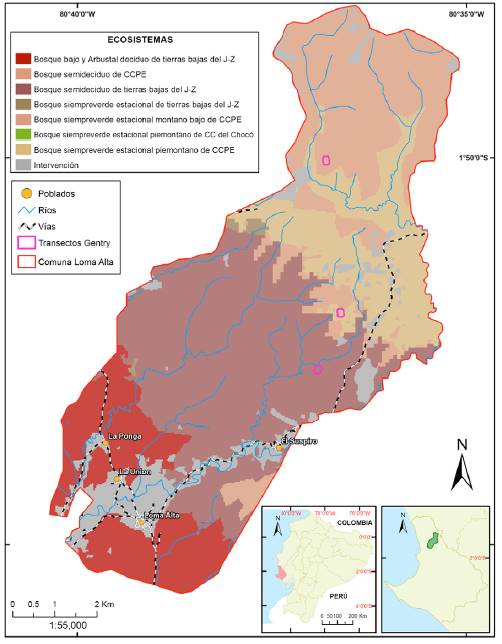
El trabajo de campo se realizó en el año 2015 en la comuna Loma Alta (01º52’ S, 80º 38’ O) ubicada en la provincia de Santa Elena, la cual posee una extensión de 6,842 ha, de las cuales 3,218.19 ha están como Bosque Protector creado en 1987 (Astudillo et al., 2015) (fig. 1).
Los aspectos biogeográficos de la RECLA están determinados por la CCHC que forma parte del corredor Tumbes-Chocó-Magdalena (TCM), llamada también Ecorregión Terrestre del Chocó-Darien-Ecuador Occidental. La ecorregión TCM, geográficamente, se extiende desde Panamá, atraviesa el occidente de Colombia y Ecuador hasta el noroeste de Perú y es reconocida por su diversidad y endemismo albergando bosques húmedos tropicales, húmedos premontanos hasta vegetación seca como matorrales espinosos en las planicies costeras (CEPF, 2005). El endemismo florístico en Loma Alta proviene de los bosques húmedos de la región del Chocó compartida con Colombia y de los bosques secos de la región Tumbesina compartidos con Perú, a lo cual Cornejo (2018) se refiere como región occidental del Ecuador caracterizada por estos 2 grupos disímiles de bosques que difieren en composición florística, diversidad, fitogeografía y condiciones climáticas.
El clima en la CCHC está influenciado por la corriente fría de Humboldt que de junio a septiembre cambia la estacionalidad del área debido al efecto de nubosidad conocido localmente como garúa (MAE, 2013) y que contribuye con precipitación horizontal formando bosques húmedos en las partes altas (Bonifaz y Cornejo, 2004), entretanto mantiene la estructura de bosques secos en las partes bajas. La precipitación horizontal aporta 108 mm de humedad en una estación de garúa, esto es 40% del agua que los bosques interceptan a partir de los 400 m snm, y 10% se retiene como agua subterránea (Becker, 1999; Becker et al., 2005).
En la CCHC, las condiciones climáticas varían acorde a la orografía. Por ejemplo, en las partes altas, la precipitación alcanza los 1,200 mm y una temperatura máxima de 36 ºC en el día durante la estación lluviosa; así como, la precipitación aborda los 1,080 mm y los 18 ºC en las noches durante la estación de garúa (Bonifaz y Cornejo, 2004). En cambio, en las partes bajas del cantón Santa Elena, la precipitación promedio interanual es de 66 mm/ año con una variabilidad que asciende hasta los 200 mm/ mes en la estación lluviosa y se aproxima a 0 en la estación seca, mientras que la temperatura media anual es de 23.4 ºC (GADM Santa Elena, 2014). En Loma Alta, la altitud se inicia desde 64 m hasta los 90 m en las zonas pobladas y en la RECLA la altitud va desde los 200 m en la entrada sur hasta los 830 m en el cerro La Torre. La precipitación fue registrada por Tamariz (2016) con un valor promedio anual de 31.35 mm durante el período 2005 - 2015, con datos históricos proporcionados por el Instituto Nacional de Meteorología e Hidrología (INAMHI) y tomados en la estación Nº M0245 ubicada en el poblado de Loma Alta. La misma autora añadió que el mes de febrero fue el más lluvioso con un promedio de 101.67 mm y mayo fue el mes con menor precipitación con 6.86 mm; cabe resaltar que muchos meses los datos fueron cero.
En la RECLA, las formaciones vegetales identificadas corresponden al bosque deciduo de la cordillera costera del Pacífico ecuatorial (i.e., bosque seco); bosque siempreverde estacional piemontano de la cordillera costera del Pacífico ecuatorial (i.e., bosque de transición) y bosque siempreverde estacional montano bajo de la cordillera costera del Pacífico ecuatorial (i.e., bosque de garúa) (fig. 2) (Astudillo et al., 2015).

Figura 2 Formaciones vegetales presentes en la RECLA. a), Bosque deciduo de la cordillera costera del Pacífico ecuatorial (i.e., bosque seco); b), bosque siempreverde estacional piemontano de la cordillera costera del Pacífico ecuatorial (i.e., bosque de transición), y c), bosque siempreverde estacional montano bajo de la cordillera costera del Pacífico ecuatorial (i.e., bosque de garúa).
Para el muestreo de la vegetación, se utilizó el criterio de gradiente altitudinal recomendado por Whittaker (1960) para establecer subgrupos de formación vegetal a 100 m snm (bosque seco), a 300 m snm (bosque de transición) y a 500 m snm (bosque de garúa), en donde se estableció un transecto lineal de 1,000 m en cada tipo de vegetación y se monitoreó la dinámica vegetal con muestreos mensuales durante 12 meses. En cada transecto lineal, se determinó un área transversal para aplicar el método de Gentry (1995) que consiste en dividir una parcela de 1,000 m2, en 10 transectos de 50 m × 2 m efectuando un censo de plantas leñosas (fanerófitas) de 2.5 cm de diámetro en altura del pecho (DAP) o superior. Los transectos de Gentry se ubicaron a 164 m snm (UTM 0542807 - 9792271), a 300 m snm (UTM 0543375 - 9793627) y a 466 m snm (UTM 0543021 - 9797342) recolectando datos durante la época lluviosa (e.g., enero) y la época seca (e.g., junio).
La identificación de especies botánicas fue basada en el “Catálogo de las plantas vasculares del Ecuador” (Jørgensen y León-Yánez, 1999), así como trabajos efectuados en el área (Astudillo et al., 2015; Bonifaz y Cornejo, 2004) y otras publicaciones de la región costera (Dodson y Gentry 1978, 1991; Dodson et al., 1985; Valverde y Pérez, 2012; Valverde et al., 1979, 1991). El ordenamiento de especies angiospermas se basó en el Sistema de Clasificación del APG III (Bremer et al., 2009) y la base de datos Tropicos (2019; http://www.tropicos.org). La identificación de especies endémicas y su estatus de conservación se basó en el “Libro rojo de las plantas endémicas del Ecuador” (León-Yánez et al., 2011) y los listados de la Unión Internacional para la Conservación de la Naturaleza (UICN, 2019) y Tropicos (2019; http://www.tropicos.org). Adicionalmente, se tomaron fotografías y se recolectaron muestras fértiles de las especies consideradas representativas para estos sitios o de las cuales se tenían duda. Las muestras fueron identificadas en el Laboratorio de Ciencias Ambientales de la Universidad Especialidades Espíritu Santo y llevadas al Herbario Nacional de Loja, donde fueron depositadas.
La estructura vegetal se definió mediante parámetros dasométricos y volumétricos, y con estos datos, se obtuvo el índice de valor de importancia (IVI) que resalta la relevancia ecológica relativa de las especies en las comunidades vegetales acorde al carácter y la estructura de un ecosistema (Cottam y Curtis, 1956; Curtis, 1959; Soler et al., 2012), las clases diamétricas y altimétricas abarcaron una escala de 10 cm y 5 m, respectivamente.
La diversidad alfa (α) se estimó desde el componente de heterogeneidad mediante el índice de Shannon-Wienner (H’), el cual se representó en unidades nats por individuo (nats/ind) y desde el componente de dominancia dado por el índice de Simpson (D) según lo sugiere Moreno (2001) (tabla 1). También, se emplearon estimadores no paramétricos para conocer la riqueza en los 3 tipos de bosques. Estos estimadores consideran las especies pocos abundantes o raras (Colwell y Coddington, 1994), por su enfoque en la extrapolación del número de especies faltantes para conocer si el muestreo realizado fue suficiente (Poulin, 1998). Moreno (2001) sugiere Chao 2 por ser un estimador menos sesgado para muestras pequeñas y como medidas complementarias de los análisis de diversidad.
Tabla 1 Índices de diversidad alfa utilizados en el presente estudio, adaptado de: Moreno (2001); Aguirre (2013); Campo y Duval (2014).
| Tipo de índice | Fórmula | Condición |
| Índice de Shannon (H’) | H = ∑(Pi)(ln Pi) | 0 - 1.35 diversidad baja |
| 1.36 - 3.5 diversidad media | ||
| > 3.6 diversidad alta | ||
| Índice de Simpson (D) | D = ∑(Pi)2 | 0.01 - 0.33 dominancia baja (diversidad alta) |
| 0.34 - 0.66 dominancia media (diversidad media) | ||
| > 0.67 dominancia alta (diversidad baja) |
Donde: Pi = abundancia proporcional de la especie i dividido entre el número total de individuos de la muestra.
Se estimó también la diversidad β desde la propiedad de reemplazo en cada tipo de bosque mediante el índice de Whittaker, que ha sido el más utilizado para diferentes trabajos (Koleff et al., 2003; Magurran, 1988; Wilson y Shmida, 1984) y por ser el más robusto; su fórmula es:
donde S es el número de especies registradas en un conjunto de muestras (diversidad gamma) y α es el número promedio de especies en las muestras (Moreno, 2001).
Para comparar comunidades mediante diferencias, se empleó el índice de Bray-Curtis por considerar valores cuantitativos y ha sido utilizado en otros estudios de comunidades vegetales (Aragón et al., 2010; Moreno, 2001; Yepes et al., 2007; Zacarías et al., 2011). La fórmula es:
donde Na es el total número de individuos en el sitio a, Nb es el total del número de individuos del sitio b, 2jN es la suma de la menor de las dos abundancias para las especies encontradas en ambos sitios (Newton, 2007). El valor 0 indica que no hay especies compartidas y 1 que poseen la misma composición (Moreno, 2001) y sobre la base de esto se realizó un escalamiento multidimensional no métrico (nMDS) mencionado por Clarke y Warwick (2001) por ser métodos robustos para identificar y sugerir patrones en ecología de comunidades (La Torre-Cuadros y Linares- Palomino, 2008; McCune et al., 2002). Con el objetivo de determinar posibles diferencias significativas entre las formaciones vegetales, se utilizó un análisis de similitud (Anosim) y para conocerlasespeciesleñosas representativas de cada bosque, se empleó el análisis de similitudes porcentuales (Simper), según Clarke y Gorley (2006). Siguiendo los patrones elevacionales, se planteó la hipótesis de que la riqueza se incrementa positivamente con la altitud. Para ponerlo a prueba, se determinaron posibles diferencias en la estructura comunitaria vegetal tales como la riqueza, abundancia, equitatividad y diversidad entre bosques utilizando un análisis de varianza no paramétrico de Kuskal-Wallis (KW) al comprobar el no cumplimiento de los supuestos de normalidad (Kolmogorov Smirnov) y homocedasticidad (Zar, 1996). Los datos fueron expresados en cajas y bigotes acorde con las recomendaciones de Boyer et al. (1997).
Los análisis de diversidad fueron realizados con el programa PAST versión 3.16 (Hammer et al., 2001) y para medir la similitud, se elaboró una matriz con las abundancias absolutas. Los análisis estadísticos de la estructura comunitaria, (nMDS-Anosim-Simper) se efectuaron con PRIMER versión 6 (Clarke y Goley, 2006).
Resultados
Se registraron 35 órdenes, 82 familias, 209 géneros y 283 especies. Las familias más representativas fueron Fabaceae (26 spp.), Araceae y Bromeliaceae (19 spp. cada una), Rubiaceae (10 spp.) y Gesneriaceae (11 spp.); por otra parte, los géneros con mayor riqueza fueron Anthurium (9 spp.), Tillandsia (7 spp.), Inga (6 spp.), Philodendron, Guzmania y Cordia (5 spp. cada una); la vegetación leñosa encontrada en los transectos de Gentry fue de 37 familias y 68 especies, destacándose las familias Fabaceae (7 spp.), Euphorbiaceae (5 spp.) y Rubiaceae (4 spp.).
El endemismo incluyó 101 especies (36%) con distribución a nivel local, nacional y regional acorde a las zonas biogeográficas. El endemismo local se dividió en 3 niveles; la región occidental que se circunscribe hasta el oeste de los Andes ecuatorianos con un total de 22 especies (22%), la región natural costa con 11 especies (11%) y la CCHC con 5 especies (5%). Trece especies (13%) son propias del país. El endemismo compartido se enmarcó como las ecorregiones constituidas por TCM, Chocó, Tumbesina y otros, en los cuales se registraron 13 (13%), 16 (16%), 18 (18%) y 3 (3%) especies, respectivamente (Apéndice). También se ubicaron 87 (31%) especies vegetales en alguna categoría de conservación, considerando como en peligro crítico (CR) a Oreanthes ecuadorensis, 16 spp. (18%) en la categoría en peligro (EN), 11 spp. (13%) como vulnerables (VU), 10 spp. (11%) como casi amenazadas (NT), 41 spp. (47%) en preocupación menor (LC), con datos deficientes (DD) y no evaluada (NE) 1 sp. (1%) cada una; así como 6 spp. (7%) fueron registradas como CITES (Apéndice). Las especies más representativas considerando el tipo de endemismo y el grado de amenaza fueron: Annona oligocarpa (anona), Capparidastrum bonifazianum (guineo de monte), Croton rivinifolius (chala), Inga laurina (guaba), Gustavia serrata (membrillo), Inga carinata (guaba), Matisia grandifolia (molinillo), Cedrela odorata (cedro de Castilla), Sorocea sarcocarpa (tillo chino), Phytelephas aequatorialis (tagua) y Randia carlosiana (cañafito).
En el bosque seco, de acuerdo con el IVI, las 3 especies mejor representadas fueron Xylosma benthamii (25%), Gallesia integrifolia (19%) y Casearia aculeata (11%) (tabla 2). La estructura horizontal estuvo conformada por 2 clases diamétricas concentrando 83% la primera clase (fig. 3a) y mostrando una jota invertida no bien definida en la gráfica. La estructura vertical estuvo constituida por 2 clases altimétricas agrupando 79% la primera clase (fig. 3b).
Tabla 2 Estructura del bosque seco. Se muestra la abundancia, frecuencia, dominancia y el Índice de Valor de Importancia (IVI) al 100%. a = absoluta; r = relativa.
| Especie | Abundancia | Frecuencia | Dominancia | IVI al 100% | |||
| a | r | a | r | a | r | ||
| Acalypha cuneata | 1 | 0.66 | 1 | 1.64 | 0.01 | 1.81 | 1.37 |
| Albizia multiflora | 1 | 0.66 | 1 | 1.64 | 0.00 | 0.29 | 0.86 |
| Casearia aculeata | 19 | 12.58 | 9 | 14.75 | 0.06 | 6.86 | 11.40 |
| Cynophalla heterophylla | 13 | 8.61 | 7 | 11.48 | 0.02 | 2.49 | 7.53 |
| Cecropia obtusifolia | 1 | 0.66 | 1 | 1.64 | 0.02 | 1.92 | 1.41 |
| Coccoloba ovata | 2 | 1.32 | 1 | 1.64 | 0.03 | 3.79 | 2.25 |
| Cordia alliodora | 7 | 4.64 | 4 | 6.56 | 0.10 | 12.65 | 7.95 |
| Croton rivinifolius | 4 | 2.65 | 2 | 3.28 | 0.01 | 0.91 | 2.28 |
| Erythroxylum glaucum | 3 | 1.99 | 1 | 1.64 | 0.01 | 0.98 | 1.54 |
| Gallesia integrifolia | 16 | 10.60 | 8 | 13.11 | 0.26 | 32.92 | 18.88 |
| Gouania polygama | 2 | 1.32 | 1 | 1.64 | 0.00 | 0.52 | 1.16 |
| Guazuma ulmifolia | 7 | 4.64 | 5 | 8.20 | 0.04 | 5.05 | 5.96 |
| Leucaena trichodes | 2 | 1.32 | 1 | 1.64 | 0.01 | 1.07 | 1.35 |
| Libidibia glabrata | 1 | 0.66 | 1 | 1.64 | 0.00 | 0.12 | 0.81 |
| Tournefortia glabra | 5 | 3.31 | 2 | 3.28 | 0.01 | 0.81 | 2.47 |
| Xylosma benthamii | 57 | 37.75 | 10 | 16.39 | 0.15 | 19.23 | 24.46 |
| Ziziphus thyrsiflora | 10 | 6.62 | 6 | 9.84 | 0.07 | 8.58 | 8.34 |
| Total | 151 | 100.00 | 61 | 100.00 | 0.80 | 100.00 | 100.00 |
En el bosque de transición, las especies con mayor IVI fueron Gustavia serrata (20%), Urera caracasana (10%) y Cordia alliodora (8%) (table 3). La estructura horizontal estuvo compuesta por 4 clases diamétricas reuniendo 88% la primera clase (fig. 3a) y su gráfica fue una jota invertida bien definida. La estructura vertical estuvo establecida por 3 clases altimétricas congregando 57% la primera clase (fig. 3b).
Tabla 3 Estructura del bosque de transición. Se muestra la abundancia, frecuencia, dominancia y el Índice de Valor de Importancia (IVI) al 100%. a = absoluta; r = relativa.
| Especie | Abundancia | Frecuencia | Dominancia | IVI al 100% | |||
| a | r | a | r | a | r | ||
| Acalypha cuneata | 22 | 6.23 | 8 | 5.88 | 0.10 | 3.97 | 5.36 |
| Annona oligocarpa | 12 | 3.40 | 7 | 5.15 | 0.11 | 4.37 | 4.30 |
| Bactris setulosa | 15 | 4.25 | 8 | 5.88 | 0.02 | 0.79 | 3.64 |
| Bunchosia hookeriana | 1 | 0.28 | 1 | 0.74 | 0.00 | 0.00 | 0.34 |
| Capparidastrum bonifazianum | 14 | 3.97 | 9 | 6.62 | 0.02 | 0.79 | 3.79 |
| Cecropia angustifolia | 4 | 1.13 | 3 | 2.21 | 0.11 | 4.37 | 2.57 |
| Cedrela odorata | 1 | 0.28 | 1 | 0.74 | 0.03 | 1.19 | 0.74 |
| Chrysophyllum argenteum | 1 | 0.28 | 1 | 0.74 | 0.00 | 0.00 | 0.34 |
| Clavija eggersiana | 3 | 0.85 | 3 | 2.21 | 0.01 | 0.40 | 1.15 |
| Cordia alliodora | 16 | 4.53 | 6 | 4.41 | 0.39 | 15.48 | 8.14 |
| Cordia collococca | 10 | 2.83 | 6 | 4.41 | 0.09 | 3.57 | 3.61 |
| Cupania latifolia | 3 | 0.85 | 2 | 1.47 | 0.02 | 0.79 | 1.04 |
| Cynophalla ecuadorica | 1 | 0.28 | 1 | 0.74 | 0.00 | 0.00 | 0.34 |
| Erythroxylum glaucum | 1 | 0.28 | 1 | 0.74 | 0.00 | 0.00 | 0.34 |
| Fridericia candicans | 15 | 4.25 | 6 | 4.41 | 0.03 | 1.19 | 3.28 |
| Gallesia integrifolia | 1 | 0.28 | 1 | 0.74 | 0.02 | 0.79 | 0.60 |
| Garcinia madruno | 6 | 1.70 | 3 | 2.21 | 0.01 | 0.40 | 1.43 |
| Gouania polygama | 2 | 0.57 | 2 | 1.47 | 0.00 | 0.00 | 0.68 |
| Gustavia serrata | 115 | 32.58 | 10 | 7.35 | 0.50 | 19.84 | 19.92 |
| Handroanthus chrysanthus | 1 | 0.28 | 1 | 0.74 | 0.00 | 0.00 | 0.34 |
| Heisteria acuminata | 1 | 0.28 | 1 | 0.74 | 0.00 | 0.00 | 0.34 |
| Inga carinata | 3 | 0.85 | 2 | 1.47 | 0.03 | 1.19 | 1.17 |
| Inga laurina | 9 | 2.55 | 5 | 3.68 | 0.10 | 3.97 | 3.40 |
| Libidibia glabrata | 1 | 0.28 | 1 | 0.74 | 0.00 | 0.00 | 0.34 |
| Maquira guianensis | 2 | 0.57 | 2 | 1.47 | 0.01 | 0.40 | 0.81 |
| Myrcia splendens | 1 | 0.28 | 1 | 0.74 | 0.00 | 0.00 | 0.34 |
| Palicourea guianensis | 3 | 0.85 | 3 | 2.21 | 0.00 | 0.00 | 1.02 |
| Passiflora macrophylla | 1 | 0.28 | 1 | 0.74 | 0.00 | 0.00 | 0.34 |
| Phytelephas aequatorialis | 4 | 1.13 | 4 | 2.94 | 0.26 | 10.32 | 4.80 |
| Randia carlosiana | 1 | 0.28 | 1 | 0.74 | 0.00 | 0.00 | 0.34 |
| Ruagea glabra | 4 | 1.13 | 4 | 2.94 | 0.00 | 0.00 | 1.36 |
| Sapium gladulosum | 3 | 0.85 | 2 | 1.47 | 0.17 | 6.75 | 3.02 |
| Senna oxyphylla | 1 | 0.28 | 1 | 0.74 | 0.00 | 0.00 | 0.34 |
| Sorocea sarcocarpa | 9 | 2.55 | 6 | 4.41 | 0.03 | 1.19 | 2.72 |
| Trichilia pallida | 18 | 5.10 | 7 | 5.15 | 0.08 | 3.17 | 4.47 |
| Triplaris cumingiana | 12 | 3.40 | 5 | 3.68 | 0.04 | 1.59 | 2.89 |
| Urera caracasana | 36 | 10.20 | 10 | 7.35 | 0.34 | 13.49 | 10.35 |
| Total | 353 | 100.00 | 136 | 100.00 | 2.52 | 100.00 | 100.00 |
En el bosque de garúa, las especies representativas acorde al IVI fueron Rhodostemonodaphne kunthiana (18%), Matisia grandifolia (14%) y Randia carlosiana (7%) (tabla 4). La estructura horizontal estuvo formada por 6 clases diamétricas reclutando 73% la primera clase (fig. 3a) y su gráfica fue una jota invertida típica de bosques tropicales. La estructura vertical estuvo distribuida en 7 clases altimétricas concentrando el 49% en la primera clase (fig. 3b).
Tabla 4 Estructura del bosque de garúa. Se muestra la abundancia, frecuencia, dominancia y el índice de valor de importancia (IVI) al 100%. a = Absoluta; r = relativa.
| Especie | Abundancia | Frecuencia | Dominancia | IVI al 100% | |||
| a | r | a | r | a | r | ||
| Acalypha cuneata | 5 | 1.32 | 4 | 2.58 | 0.01 | 0.03 | 1.31 |
| Aegiphila alba | 3 | 0.79 | 2 | 1.29 | 0.06 | 0.32 | 0.80 |
| Alchornea leptogyna | 3 | 0.79 | 3 | 1.94 | 0.01 | 0.04 | 0.92 |
| Annona oligocarpa | 9 | 2.37 | 5 | 3.23 | 0.04 | 0.23 | 1.95 |
| Bactris setulosa | 3 | 0.79 | 3 | 1.94 | 0.03 | 0.16 | 0.96 |
| Beilschmiedia alloiophylla | 12 | 3.17 | 6 | 3.87 | 0.35 | 1.97 | 3.00 |
| Calatola costaricensis | 32 | 8.44 | 10 | 6.45 | 0.53 | 3.02 | 5.97 |
| Capparidastrum bonifazianum | 1 | 0.26 | 1 | 0.65 | 0.00 | 0.02 | 0.31 |
| Cecropia angustifolia | 2 | 0.53 | 2 | 1.29 | 0.14 | 0.80 | 0.87 |
| Cecropia obtusifolia | 6 | 1.58 | 4 | 2.58 | 0.01 | 0.06 | 1.41 |
| Chamaedorea linearis | 17 | 4.49 | 8 | 5.16 | 0.04 | 0.23 | 3.29 |
| Chrysochlamys dependens | 4 | 1.06 | 3 | 1.94 | 0.02 | 0.09 | 1.03 |
| Chrysophyllum venezuelanense | 3 | 0.79 | 3 | 1.94 | 0.07 | 0.40 | 1.04 |
| Cordia collococca | 3 | 0.79 | 2 | 1.29 | 0.00 | 0.02 | 0.70 |
| Cupania latifolia | 12 | 3.17 | 6 | 3.87 | 0.58 | 3.28 | 3.44 |
| Dendropanax macrocarpus | 1 | 0.26 | 1 | 0.65 | 0.01 | 0.05 | 0.32 |
| Dussia lehmannii | 18 | 4.75 | 8 | 5.16 | 0.93 | 5.27 | 5.06 |
| Garcinia madruno | 5 | 1.32 | 5 | 3.23 | 0.06 | 0.37 | 1.64 |
| Gustavia serrata | 9 | 2.37 | 6 | 3.87 | 0.05 | 0.25 | 2.17 |
| Handroanthus chrysanthus | 2 | 0.53 | 2 | 1.29 | 3.00 | 16.95 | 6.26 |
| Inga carinata | 2 | 0.53 | 2 | 1.29 | 0.00 | 0.01 | 0.61 |
| Maquira guianensis | 4 | 1.06 | 4 | 2.58 | 0.16 | 0.93 | 1.52 |
| Matisia grandifolia | 99 | 26.12 | 10 | 6.45 | 1.60 | 9.06 | 13.88 |
| Mollinedia ovata | 3 | 0.79 | 1 | 0.65 | 0.00 | 0.02 | 0.49 |
| Myrcia splendens | 1 | 0.26 | 1 | 0.65 | 0.01 | 0.04 | 0.32 |
| Nectandra subbullata | 19 | 5.01 | 9 | 5.81 | 0.50 | 2.83 | 4.55 |
| Pentagonia grandiflora | 4 | 1.06 | 3 | 1.94 | 0.02 | 0.11 | 1.03 |
| Piper squamulosum | 4 | 1.06 | 4 | 2.58 | 0.00 | 0.03 | 1.22 |
| Psychotria hazenii | 17 | 4.49 | 7 | 4.52 | 0.04 | 0.21 | 3.07 |
| Randia carlosiana | 47 | 12.40 | 10 | 6.45 | 0.40 | 2.29 | 7.05 |
| Rhodostemonodaphne kuntiana | 4 | 1.06 | 3 | 1.94 | 8.86 | 50.08 | 17.69 |
| Tabernaemontana amygdalifolia | 6 | 1.58 | 5 | 3.23 | 0.01 | 0.08 | 1.63 |
| Tetrorchidium andinum | 7 | 1.85 | 4 | 2.58 | 0.11 | 0.62 | 1.68 |
| Urera caracasana | 8 | 2.11 | 5 | 3.23 | 0.00 | 0.01 | 1.78 |
| Vasconcellea microcarpa | 2 | 0.53 | 2 | 1.29 | 0.00 | 0.01 | 0.61 |
| Zanthoxylum riedelianum | 2 | 0.53 | 1 | 0.65 | 0.02 | 0.11 | 0.43 |
| Total | 379 | 100.00 | 155 | 100.00 | 17.69 | 100.00 | 100.00 |
En los transectos realizados en el bosque seco se encontraron 17 especies (13 spp. arbóreas y 4 spp. arbustivas) representadas en un total de 151 individuos pertenecientes a 13 familias. La diversidad, desde el componente de heterogeneidad (H’), registró un valor promedio de 1.56 nats/ind y la dominancia un valor promedio de 0.27 (tabla 5). La diversidad en los transectos fue mayor para el T1 (1.95 nats/ind) y menor para el T2 (0.94 nats/ind); entretanto, la dominancia fue inversa, mayor para el T2 (0.43) y menor en T1 (0.16) (tabla 5).
Tabla 5 Índices de diversidad α de la RECLA.
| Diversidad α | T1 | T2 | T3 | T4 | T5 | T6 | T7 | T8 | T9 | T10 | Promedio | |
| Bosque seco | Riqueza | 8 | 3 | 7 | 4 | 5 | 8 | 7 | 6 | 7 | 6 | 6.1 |
| Individuos | 13 | 9 | 20 | 14 | 13 | 20 | 23 | 11 | 16 | 12 | 15.1 | |
| H’ | 1.95 | 0.94 | 1.85 | 0.99 | 1.52 | 1.79 | 1.48 | 1.64 | 1.72 | 1.71 | 1.56 | |
| Dominancia | 0.16 | 0.43 | 0.18 | 0.47 | 0.24 | 0.22 | 0.32 | 0.22 | 0.22 | 0.19 | 0.27 | |
| Bosque de transición | Riqueza | 14 | 11 | 14 | 13 | 12 | 16 | 15 | 15 | 12 | 13 | 13.50 |
| Individuos | 34 | 44 | 48 | 39 | 27 | 42 | 31 | 27 | 28 | 33 | 35.30 | |
| H’ | 2.27 | 2.11 | 1.96 | 1.95 | 2.08 | 2.39 | 2.37 | 2.46 | 2.19 | 2.00 | 2.18 | |
| Dominancia | 0.14 | 0.15 | 0.22 | 0.22 | 0.19 | 0.13 | 0.13 | 0.11 | 0.15 | 0.24 | 0.17 | |
| Bosque de garúa | Riqueza | 14 | 17 | 12 | 18 | 16 | 16 | 18 | 11 | 15 | 20 | 15.7 |
| Individuos | 40 | 33 | 28 | 38 | 38 | 41 | 42 | 45 | 34 | 40 | 37.9 | |
| H’ | 1.92 | 2.58 | 2.19 | 2.63 | 2.43 | 2.41 | 2.43 | 2.15 | 2.52 | 2.78 | 2.40 | |
| Dominancia | 0.27 | 0.10 | 0.15 | 0.09 | 0.12 | 0.13 | 0.14 | 0.14 | 0.10 | 0.08 | 0.13 | |
T1 - T10: Transectos
H > : Diversidad de Shannon-Wiener (estima la heterogeneidad de la comunidad)
nats/ind: Unidad logarítmica base e de entropía del índice de Shannon-Wiener.
En los transectos realizados en el bosque de transición se reconocieron 37 especies (34 spp. arbóreas y 3 spp. arbustivas) relacionadas a 353 individuos que corresponden a 25 familias. Mediante el índice de Shannon-Wiener, se estimó un valor promedio de 2.18 nats/ind y la dominancia un valor promedio de 0.17 (tabla 5). La diversidad en los transectos fue mayor para el T8 (2.46 nats/ind) y menor para el T4 (1.95 nats/ind); mientras que la dominancia fue mayor para el T10 (0.24) y menor en T8 (0.11) (tabla 5).
En los transectos realizados en el bosque de garúa, se identificaron 36 especies (35 spp. arbóreas y 1 sp. arbustiva) y 379 individuos propios a 28 familias. El índice de Shannon-Wiener mostró una heterogeneidad promedio de 2.40 nats/ind y el índice de Simpson valoró la dominancia promedio de 0.13 (tabla 5). La diversidad en los transectos fue mayor para el T10 (2.78 nats/ind) y menor para el T1 (1.92 nats/ind); mientras que la dominancia inversa a la heterogeneidad, es decir fue mayor para el T1 (0.27) y menor en T10 (0.08) (tabla 5).
En términos generales, la diversidad comparada por tipo de bosque y desde el componente de riqueza específica fue mayor para el bosque de transición; mientras que la heterogeneidad demostró ser mayor en el bosque de garúa y menor para el bosque seco, así como la dominancia fue mayor en el bosque seco y menor en el de garúa (fig. 4).
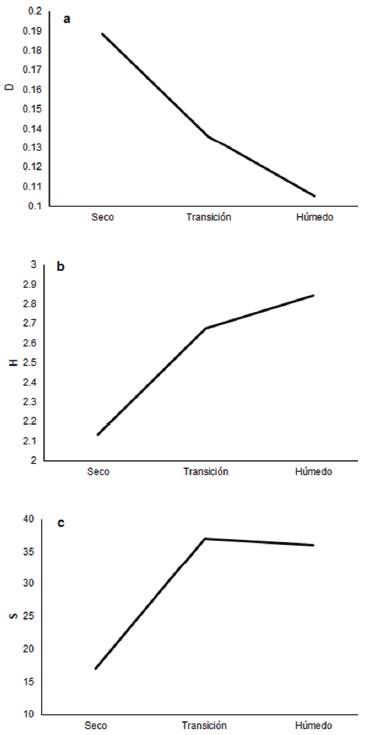
Figura 4 Diversidad α comparada desde los componentes de dominancia (D) -gráfica a; heterogeneidad (H´) -gráfica b, y riqueza (S) -gráfica c, y para cada tipo de vegetación presente en la RECLA.
El estimador Chao 2 indicó que la riqueza para los transectos realizados en el bosque seco, bosque de transición y bosque de garúa fue 18 (18.66 especies; DS = 8.39), 36 (36.45 especies; DS = 6.91) y 35 (35.34 especies; DS = 2.62) especies respectivamente; lo que nos indica que para cada uno de estos bosques hubo una cobertura de la muestra promedio de 98%. Esto último es un indicador de que el esfuerzo de muestreo fue el adecuado y representativo para el área de estudio.
La diversidad beta, desde el componente de reemplazo, fue mayor para el bosque seco (βw = 1.78), seguido por el bosque de transición (βw = 1.74) y del bosque de garúa (βw = 1.29).
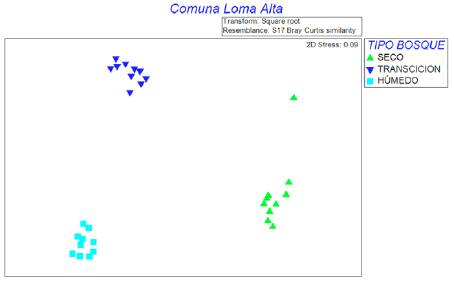
El análisis nMDS basado en el índice de Bray-Curtis detectó diferencias significativas (R = 0.99, p < 0.05) entre los bosques (fig. 5), así también como el Anosim (R = 0.99; p < 0.01). El análisis Simper indicó las especies representativas que contribuyeron a la similitud en cada tipo de vegetación con menos de 60% para cada uno, las mismas que coincidieron con algunas especies del IVI que definió la estructura del bosque (tabla 6). Sin embargo, la disimilitud es mayor a 85% entre bosques, siendo la máxima de 96% entre el bosque seco y de garúa confirmando que cada uno presenta una vegetación particular.
Tabla 6 Análisis SIMPER según el tipo de formación vegetal en la RECLA.
| Tipo de vegetación | Especie | Promedio de similaridad | Abundancia promedio | Contribución (%) | Acumulación (%) |
| Bosque seco (BsPc01) | Xylosma benthamii | 50.55 | 2.29 | 35.66 | 35.66 |
| Casearia aculeata | 1.27 | 18.24 | 53.92 | ||
| Gallesia integrifolia | 1.09 | 13.49 | 67.39 | ||
| Cynophalla heterophulla | 0.94 | 9.98 | 77.37 | ||
| Ziziphus thyrsiflora | 0.76 | 6.85 | 84.22 | ||
| Bosque de transición (BePC02) | Gustavia serrata | 50.58 | 3.34 | 32.48 | 32.48 |
| Capparidastrum bonifazianum | 1.1 | 9.27 | 54.80 | ||
| Acalypha cuneata | 1.22 | 7.43 | 62.20 | ||
| Bactris setulosa | 1.08 | 6.09 | 68.29 | ||
| Urera caracasana | 1.7 | 13.05 | 45.53 | ||
| Bosque de garúa (BeBc01) | Maquira guianensis | 55.94 | 3.07 | 21.25 | 21.25 |
| Psychotria hazenii | 2.12 | 14.6 | 35.85 | ||
| Calatola costaricensis | 1.71 | 11.11 | 46.96 | ||
| Myrcia splendens | 1.29 | 7.99 | 54.95 | ||
| Chamaedorea linearis | 1.16 | 6.70 | 61.65 |
El análisis de KW mostró diferencias significativas en la riqueza (KW: 22.53, p < 0.05), abundancia (KW: 20.33, p < 0.05), diversidad (KW: 22.22, p < 0.05) y equitatividad (KW: 7.98, p < 0.05) por tipo de bosque. La riqueza específica promedio fue de 12 especies con un mínimo de 6 para el bosque seco y un máximo de 16 para el bosque de garúa (fig. 6a). La abundancia promedio fue de 30 individuos/transecto, considerando su valor mínimo de 15.1 en el bosque seco y un valor máximo de 39.8 en el bosque de garúa (fig. 6b). La diversidad promedio fue de 2.99 nats/ind, mientras que la menor fue de 2.24 nats/ ind en el bosque seco y la mayor fue de 3.57 nats /ind en el bosque de garúa (fig. 6c). La equitatividad exhibió un promedio de 0.86 con valor mínimo de 0.83 en el bosque de transición y un valor máximo de 0.88 en el bosque de garúa (fig. 6d).
Discusión
La presente investigación muestra el gran potencial de esta región para albergar especies vegetales. La investigación previa de Bonifaz y Cornejo (2004) a partir de los 400 m snm reportó 218 especies y 58 familias; en el presente estudio se registraron 65 especies más, probablemente debido a que se incluyó sectores más bajos como el bosque seco que se encuentra a 100 m snm. El estudio cualitativo de Astudillo et al. (2015) coincide en su composición vegetal leñosa con el presente trabajo, con la excepción de Alchornea leptogyna, Arrabidaea candicans, Dussia lehmannii, Coccoloba ovata y Xylosma benthamii que se reportaron en esta investigación.
Estudios previos realizados en los bosques secos de Ecuador y Perú (Aguirre, Kvist et al., 2006; Aguirre, Linares-Palomino et al., 2006; Linares-Palomino et al., 2010) indican que las familias leñosas con mayor riqueza fueron las Fabaceae con 70 especies; seguidas por Malvaceae con 19 spp.; Boraginaceae, Cactaceae y Moraceae con 12 spp. cada una, patrón coincidente, con Gentry (1995) y Pennington et al. (2006), quienes señalaron que en estos ecosistemas prevalecen las Fabaceae. El mismo patrón de composición florística fue verificado en este estudio, ya que se destacó la familia Fabaceae como la más rica en especies (18 spp.) en el bosque seco.
Por otra parte, el bosque de garúa también aporta a la diversidad taxonómica y al endemismo local presente en la CCHC ubicado dentro de los BTES del Pacífico ecuatorial (Astudillo et al. en prensa) y este patrón se verifica en este estudio al reportar que el bosque de garúa aporta con 61% al total de la diversidad florística para Loma Alta.
Otros trabajos realizados en los BTES de Ecuador se concentran en el sur (e.g., provincia de Loja) y uno similar al presente fue el realizado por Aguirre et al. (2013) que se refiere a la composición y estructura de los bosques secos de la provincia de Loja ubicados entre 197 y 1,000 m snm. Aguirre et al. (2013) identificaron 58 especies dentro de 29 familias con especies ecológicamente importantes como Ceiba trichistandra, Simira ecuadorensis, Tabebuia chrysantha, Eriotheca ruizii y Terminalia valverdeae. Aunque el presente estudio se realizó en un rango altitudinal menor (desde los 100 a 500 m snm) y en una sola localidad, se obtuvo una mayor riqueza específica (68 spp.) en los transectos, pero además, las especies con mayor IVI difieren entre ambas áreas. Estos resultados están asociados a la existencia de los bosques de garúa en la parte alta en nuestra área de estudio y esto a su vez, coincide con Astudillo et al. (en prensa), en que es en el sector biogeográfico de la cordillera costera del Pacífico ecuatorial donde acontecen condiciones climáticas particulares aunado a la topografía del área.
La estructura diamétrica encontrada en el presente estudio, donde la primera categoría concentra los individuos, exterioriza el problema de la deforestación en esta área protegida que exhibe un bosque joven secundario en crecimiento y es un indicador de la problemática de conservación que enfrentan los BTES del Pacífico ecuatorial, lo cual concuerda con lo publicado en otros tipos de BTES de Ecuador y Perú (Aguirre et al., 2013; Espinosa et al., 2012; García-Villacorta, 2009; Marcelo-Peña et al., 2007). Se debe destacar que en el bosque de garúa aún se localizaron árboles aislados con diámetros cercanos y mayores a 100 cm como remanente del bosque primario.
Con respecto a la diversidad de los BTES del Ecuador, un estudio realizado en el Bosque Protector Chongón Colonche, por Jadán et al. (2014), muestra datos de la diversidad alfa mediante los índices de Shannon-Wiener y Simpson, cuyos valores oscilan entre 2.22 a 2.65 y 0.82 a 0.90, respectivamente; asimismo, el estudio para la provincia de Loja por Aguirre et al. (2013) indicó valores entre 2.45 a 2.75 para el primero y 0.85 a 0.91 para el segundo índice. Los resultados del índice de Shannon- Wiener en ambas investigaciones concuerdan con los rangos de valores medios que van de 1.36 a 3.5 descritos por varios autores (Aguirre, 2013; Campo y Duval, 2014; Moreno, 2001; Ramírez, 2006) y que son semejantes a los de esta investigación. Se debe destacar que el valor más alto de diversidad α observado desde la propiedad de riqueza específica y heterogeneidad corresponde al de esta investigación y para el bosque de garúa, el cual presentó una riqueza específica de 36 spp. y un H’ = 2.84 nats/ind. Contrastando los datos de los BTES de Ecuador con los de Perú, los bosques de la Reserva de Biosfera del Noroeste (Amotape y Tumbes) tienen valores de 1.17 a 3.03 para Shannon-Wiener (Leal-Pinedo y Linares-Palomino, 2005); mientras, en los bosques de Jaén los resultados oscilaron entre 2.9 a 4.1 (Marcelo-Peña et al., 2007). En consecuencia, los datos obtenidos en la RECLA se mantienen como valores medios comparados con los bosques del norte de Perú.
Los porcentajes de completitud (que estuvieron alrededor de 100%) evidencian un muestreo satisfactorio y se pueden haber logrado debido a que los bosques secos son hábitats poco heterogéneos y según López y Williams (2006), los sistemas muy heterogéneos necesitarían un número mayor de muestreo para completar el inventario.
El análisis de ordenación nMDS-Anosim-Simper mostró alta disimilitud entre la composición florística leñosa y determinó 3 grupos diferentes de bosque, coincidiendo con el estudio cualitativo de Astudillo et al. (2015). La caracterización de los ecosistemas para la CCHC fue reportada por el MAE (2013) y en este trabajo se compendian todas las clasificaciones florísticas y bioclimáticas anteriores (Aguirre, Kvist et al., 2006; Josse et al., 2003; Sierra, 1999) para establecer un sistema de clasificación de ecosistemas del Ecuador continental. En Loma Alta se identificaron 3 de los 4 tipos de vegetación descritos para la cordillera costera del Pacífico ecuatorial.
El análisis de la prueba K-W reveló diferencias estadísticas significativas en la riqueza, abundancia, diversidad y equitatividad a lo largo de un gradiente altitudinal destacándose la diversidad α por marcar una tendencia de aumento. Pese a estos resultados, no se podría confirmar que los patrones la diversidad aumentan con la altitud debido a que el rango altitudinal estudiado no fue amplio. Los patrones de diversidad a lo largo de gradientes altitudinales se explican en 2 tendencias: el descenso de la riqueza específica conforme se aumenta la altitud y, la concentración de la riqueza en intervalos de altitudes medias (Colwell y Hurt, 1994; Colwell y Lees, 2000; Grytnes y McCain, 2007; McCain y Grytnes, 2010). Esto se puede notar en el estudio regional de Girardin et al. (2014), en la estructura y diversidad de los bosques andinos de Bolivia, Perú y Ecuador, donde se registró un decremento en la riqueza de especies a medida que la altitud aumentaba; mientras que Medrano-Meraz et al. (2017), describió mayor riqueza arbórea en rangos medios de altitud en la región de El Salto en México. Adicionalmente, se debe considerar que en sistemas montañosos, los factores ambientales influyen en la distribución espacial de la biodiversidad.
La contribución en el conocimiento ecológico y económico que los BTES aportan a la sostenibilidad ambientaly humana, contrastaconelestado de conservación actual que presenta la cordillera Chongón Colonche y que requieren de atención inmediata ya que el conocimiento de estos bosques secos es limitado. Los resultados de esta investigación proporcionan evidencia basados en criterios científicos para fortalecer la gestión ambiental del área protegida a nivel local y regional.
El presente estudio permite incrementarelconocimiento sinecológico vegetal de los BTES del Pacífico ecuatorial ubicados en la RECLA y de la cordillera Chongón Colonche; además de actualizar el listado con un total de 283 especies botánicas. La estructura horizontal y vertical está determinada por 6 clases diamétricas y 7 altimétricas, las cuales concentran 80% y 62% de los individuos en la primera categoría, respectivamente; estos resultados se asocian con la estructura de bosques jóvenes. La diversidad α estimada es similar a la de otros bosques de la región; sin embargo, es importante destacar que en el presente estudio se reporta el valor más alto de diversidad α observado desde la propiedad de riqueza específica y heterogeneidad. El presente estudio evidencia la presencia de 3 tipos de bosque con similitud baja entre ellos y donde la diversidad se incrementa con la altitud.











 nueva página del texto (beta)
nueva página del texto (beta)